4х камерный срез сердца у плода что это такое
4х камерный срез сердца у плода что это такое
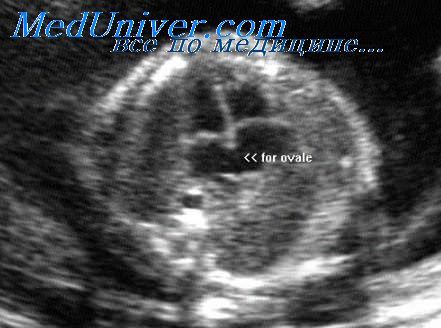
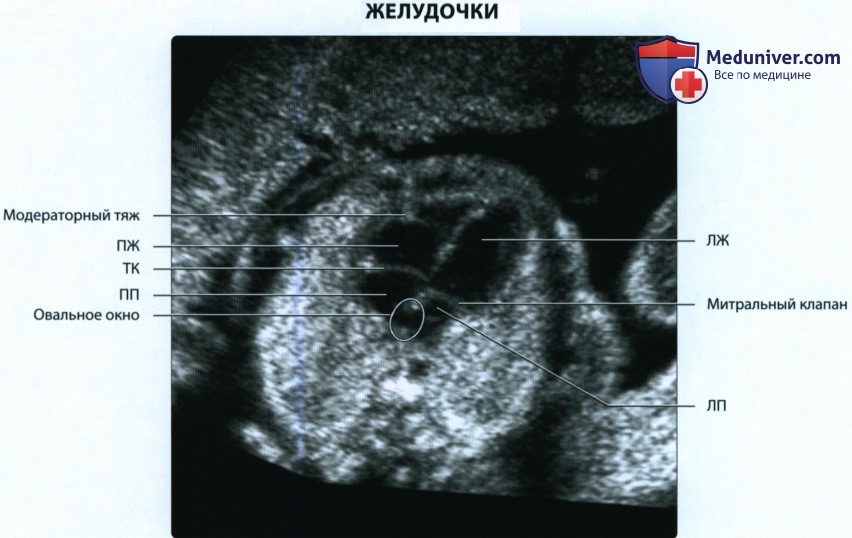
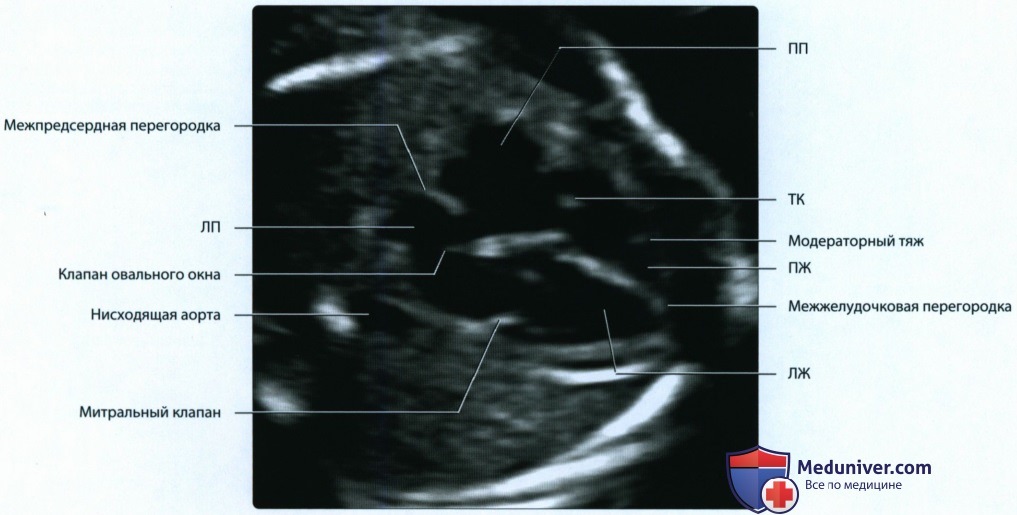
Четырехкамерный срез сердца получается в плоскости, которая проходит практически строго поперечно (аксиально) по отношению к грудной клетке плода. Важными ориентирами для получения этой плоскости являются верхушка сердца, его основание, межжелудочковая перегородка (МЖП), межпредсердная перегородка (МПП), два атриовентри-кулярных клапана (трикуспидальный и митральный), а также четыре камеры, отграниченные этими анатомическими структурами. В норме толщина межжелудочковой перегородки и стенок желудочков одинакова.
Идентификация левого предсердия осуществляется на основании визуализации впадения в него легочных вен. Ротируя датчик таким образом, чтобы левый желудочек и аорта располагались в одной плоскости, можно получить изображение левых отделов сердца. Его правые отделы исследуют, смещая датчик в краниальном направлении и несколько наклоняя его в сторону левого плеча.
На изображениях левой половины сердца определяются структуры, имеющие большое значение для диагностики. Между левым предсердием и левым желудочком визуализируется митральный клапан. Его задняя створка обычно несколько короче передней, которая является как бы продолжением задней стенки аорты. Передняя стенка аорты сливается с межжелудочковой перегородкой. У основания аорты находится аортальный клапан.
У плода имеются две артериальные дуги, которые следует различать при эхографическом обследовании. Дуга аорты дифференцируется с дугой артериального протока согласно следующим критериям. От нее отходят крупные брахиоцефальные сосуды к верхним конечностям и голове, в то время как артериальный проток не имеет ветвей. Ход дуги аорты характеризуется более правильной округлой формой кривизны, по сравнению с ходом протока, который образует легкие угловые изгибы.
Полые вены обнаруживаются при исследовании в продольной плоскости сканирования грудной клетки плода путем визуализации места их впадения в правое предсердие.
Патологии сердца плода, которые можно определить на скрининговом УЗИ
» data-image-caption=»» data-medium-file=»https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2018/05/patologii-serdtsa-ploda.jpg?fit=450%2C300&ssl=1″ data-large-file=»https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2018/05/patologii-serdtsa-ploda.jpg?fit=807%2C537&ssl=1″ />
Основные пороки сердца у плода формируются в 1 триместре беременности на сроке 12-14 недель. Это может быть реакция на внешние факторы либо генетические проблемы. К этому сроку происходит формирование сердечной мышцы плода, поэтому будущей матери необходимо пройти УЗИ обследование на выявление патологий органа.
патологии сердца плода
» data-image-caption=»» data-medium-file=»https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2018/05/patologii-serdtsa-ploda.jpg?fit=450%2C300&ssl=1″ data-large-file=»https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2018/05/patologii-serdtsa-ploda.jpg?fit=807%2C537&ssl=1″ loading=»lazy» src=»https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2018/05/patologii-serdtsa-ploda.jpg?resize=807%2C537″ alt=»патологии сердца плода» width=»807″ height=»537″ srcset=»https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2018/05/patologii-serdtsa-ploda.jpg?w=807&ssl=1 807w, https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2018/05/patologii-serdtsa-ploda.jpg?resize=450%2C300&ssl=1 450w, https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2018/05/patologii-serdtsa-ploda.jpg?resize=768%2C511&ssl=1 768w» sizes=»(max-width: 807px) 100vw, 807px» data-recalc-dims=»1″ />
Во внутриутробном развитии пороки сердца возникают как реакция организма на нарушение плацентарного кровообращения либо воздействие канцерогенных веществ (формальдегиды, никотин, токсические вещества).
Аномалии положения сердца плода
Среди аномалий расположения сердца выделяют эктопию сердца (размещение вне грудной клетки). К таким патологиям относят декстрокардию (смещение сердца в правую сторону относительно нормального положения) и мезокардию (расположение сердца не с левой стороны грудины, а по срединной линии тела).
Эктопия сердца у плода возникает на сроке 14-18 дней с момента зачатия мезадерма начинает развиваться неправильно, что вызывает неправильное срастание брюшной стенки. У плода либо отсутствует диафрагма вообще, либо нет диафрагмального сегмента перикарда.
Из-за отверстия в стенке между правым и левым желудочком слышны интракардиальные шумы. Также у плода эктопия сердца нередко сопровождается другими аномалиями — гидроцефалией, энцефалоцеле и пр.
Надо сказать, что существует высокая вероятность ошибочного диагноза по установки положения сердца. При тазовом предлежании плода на УЗИ сердца визуализируется справа, хотя на самом деле оно располагается в положенном месте.
В 71% случаев эктопия сердца вызывается плевральным выпотом, кистозным аденоматозным пороком развития лёгкого, диафрагмальной грыжей.
Различают четыре вида эктопии:
Грудная эктопия встречается в 55-60% случаев, торакоабдоминальная — в 38%, шейная — почти в 3%. Выживаемость составляет около 10%. В большинстве случаев при эктопии младенец либо рождается мёртвым, либо умирает сразу после рождения.
Патология сопровождается смещением других внутренних органов, которые не защищены от механических повреждений и подвержены инфекциям и вирусам больше обычного.
Врождённые дефекты сердца
Пять наиболее встречаемых дефектов — это тетрада Фалло, дефект межжелудочковой перегородки, транспозиция магистральных сосудов, коарктация аорты, гипоплазия левых камер.
Оптимальным сроком для проведения ультразвуковой диагностики сердца плода считается период 24-26 недель беременности. Именно в это время анатомические структуры сердца максимально визуализируются, а на более ранних сроках можно увидеть только явные и глобальные пороки сердца.
Наиболее информативен ультразвуковой осмотр 4-камерного среза сердца. После которого при любом отклонении от нормы женщина отправляется на более детальное обследование плода с использованием допплеровской эхокардиографии. Также проводится кариотипирование, потому что в 30% случаев аномалии являются результатом хромосомных нарушений.
Что выявляет УЗИ
В нашей клинике используется современное 4D оборудование, имеющее допплеровский режим. С его помощью можно получить изображение 3-х главных сосудов — верхней полой вены, лёгочного ствола и восходящей аорты. Во время обследования выявляется не только расположение сосудов, но и их диаметр и другие параметры.
На экране монитора будут видны следующие патологии плода:
Какие патологии сердца у плода сложно выявить на скрининговом УЗИ
Трудности в диагностике заболеваний сердца на УЗИ вызывают следующие патологии органа:
При подозрении на их наличие, пациентка должна регулярно наблюдаться и соблюдать все рекомендации гинеколога.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter
Возможности эхокардиографии плода в I триместре беременности (11-14 недель)
УЗИ сканер HS50
Доступная эффективность. Универсальный ультразвуковой сканер, компактный дизайн и инновационные возможности.
Введение
Актуальность темы пренатальной диагностики врожденных пороков сердца (ВПС) понятна всем врачам, которые связаны с пренатальной диагностикой, неонатологией, педиатрией, кардиологией, генетикой. ВПС являются одной из ведущих причин перинатальной смертности и регистрируются с частотой 4-13 на 1000 живорожденных [1]. В связи с тем, что профилактические мероприятия по предупреждению ВПС не имеют должного успеха, представляется актуальной и необходимой их пренатальная ультразвуковая диагностика.
Однако параллельно другими учеными эти группы риска отвергались, потому что большинство ВПС встречались у плодов и детей, матери которых не входили ни в одну из предложенных групп риска. Единственными разумными критериями так называемого селективного отбора были признаны беременные, попавшие в группу риска после проведения скрининга I триместра и беременные с подозрением на ВПС при ультразвуковом исследовании (УЗИ) плода [3].
Неоспоримо, что оптимальными сроками беременности для исследования сердца плода являются 20-22 недели, однако большинство летальных и клинически значимых пороков сердца могут быть диагностированы в конце I триместра беременности. Позволим себе процитировать слова главы Fetal Medicine Foundation Кипраса Николаидеса, высказанные им на страницах сайта FMF (www.fetalmedicine.com): «Специалист ультразвуковой диагностики с 12 недели беременности должен заверить большинство родителей, что у их ребенка нет крупных врожденных пороков сердца. В случае крупных врожденных пороков сердца их раннее выявление может привести к постановке правильного диагноза или хотя бы вызвать подозрение для осуществления ультразвукового мониторинга».
На самом знаменитом сайте в мире пренатальной диагностики www.thefetus.net (Philippe Jeanty, USA) опубликовано уже более 30 случаев находок ВПС в I триместре беременности. Однако в отечественной периодике встречаются лишь единичные работы по этой теме. Все они пренадлежат «перу» специалистов пренатальной диагностики Российской ассоциации врачей ультразвуковой диагностики в перинатологии и гинекологии, хотя для многих специалистов как раньше, так и сейчас осмотр сердца плода в сроки 11-14 недель заключается лишь в констатации числа сердечных сокращений.
Цель эхокардиографии в I триместре беременности состоит в выявлении летальных и клинически значимых ВПС. Это исследование не ставит целью выявление стенозов и гипоплазий выносящих трактов, диагностику мелких дефектов перегородок, патологий дуги аорты и артериального протока. Многие из этих пороков не только технически невозможно заподозрить в I триместре, манифестируют они после 30-й недели беременности, т.е. их диагностика является прерогативой исследования III триместра.
Точность пренатальной диагностики ВПС во все сроки беременности варьирует в широком диапазоне. Причинами этого могут быть разный опыт специалистов, ожирение беременной, частота использованных ультразвуковых трансдьюсеров и класс ультразвукового аппарата, перенесенные ранее абдоминальные операции, срок беременности, количество околоплодных вод и положение плода. Однако заметим, что многие из этих факторов теряют свою актуальность именно при проведении трансвагинальной эхокардиографии в I триместре беременности. Своевременная диагностика ВПС позволяет идентифицировать плоды высокого риска по генетическим синдромам, что имеет важное значение при проведении пренатального консультирования и оказывает существенное влияние на акушерскую тактику.
Результаты
С 2006 по 2011 г. пренатально в I триместре беременности были выявлены 125 ВПС. Из них 68 (55%) ВПС сочетались с различными хромосомными аномалиями (ХА) плода, 30 (24%) входили в состав различных множественных врожденных пороков развития (МВПР), 27 (21%) ВПС были изолированными.
Рис. 1. Беременность 12 недель. Четырехкамерный срез сердца плода. Отчетливо видны камеры сердца.
Рис. 1. Изображение сердца плода в мультиплановом режиме и трехмерная поверхностная реконструкция на уровне предсердно-желудочковых клапанов.
Рис. 2. Трехмерная реконструкция сердца плода в «минимальном» режиме.
Преимущества технологии STIC™ при исследовании сердца плода
Стандартными условиями для получения качественного «объема» с помощью STIC™ являются положения позвоночника плода на 5-7 ч изображения, время сбора данных 7,5 с, угол сбора данных 30°, а стартовой плоскостью служит четырехкамерный срез сердца. Клиническое испытание STIC™, в котором врачи общей практики только «собирали объем», а собственно анализ полученных данных выполнялся позднее в режиме offline специалистом по пренатальной эхокардиографии, показало возможность полноценного исследования сердца плода более чем в 94% случаев [2].
Неудача в «извлечении объема», адекватного для последующего анализа, обусловлена «неудобным» положением плода, когда его сердце находится в акустической тени от ребер или позвоночника, а также слишком маленькими или слишком большими размерами сердца соответственно в ранние или поздние сроки беременности [3].
«Объемы», полученные в поперечной плоскости сканирования, используют для получения и анализа двухмерных изображений камер сердца, межпредсердной и межжелудочковой перегородок, атриовентрикулярных клапанов, легочных вен и выносящих трактов. Наилучшая визуализация дуги аорты и аортального протока достигается при «извлечении объема » в сагиттальной плоскости. Вращая «объем» относительно референтной точки в режиме динамической мультиплановой реконструкции, последовательно оценивают интракардиальные структуры в трех ортогональных плоскостях одновременно. Изменяя размер области интереса, можно получить трехмерную поверхностную реконструкцию предсердно-желудочковых клапанов и других отделов сердца. Более того, технология STIC™ позволяет получить нестандартные срезы практически в любой плоскости для того, чтобы, например, увидеть дефект межжелудочковой перегородки в сагиттальной плоскости на всем протяжении [4].
Существенно упрощают и ускоряют анализ объемных трехмерных эхокардиограмм технологии, подобные Multi-Slice View (3D XI™) (рис. 3). Стандартные поперечные плоскости, широко используемые для оценки сердца, автоматически отображались в виде последовательных срезов у большинства плодов, которые были исследованы с помощью STIC™. Качество таких изображений сравнимо с качеством изображений, получаемых при рутинной 2D эхографии [6, 7]. Последовательный и законченный анализ динамических трехмерных эхокардиограмм был возможен во всех случаях, а рекомендуемое авторами публикации расстояние между отображаемыми на экране срезами составило 2,7±0,3 мм в 19-23 нед беременности и 4,0±0,4 мм в 30-33 нед [8].
Рис. 3. Изображение сердца плода в режиме Multi-Slice View (3D XI™).
Функция VOCAL позволяет измерить с высокой степенью воспроизводимости (до 96%) систолический и диастолический объемы желудочков сердца плода и рассчитать соответственно ударный объем и фракцию выброса. Эта процедура проста, она заключается в том, что контуры каждого желудочка обрисовывают вручную на дисплее рабочей станции, а сам объем вычисляют, вращая полученное изображение на 12-30° по оси, проходящей через верхушку сердца и центр атриовентрикулярного клапана (рис. 4) [9]. Процедура еще более упрощается при использовании инверсного 3D режима [10]. Клинические испытания показали, что время, затраченное врачом на измерение ударного объема с помощью 4D STIC™, было существенно меньше по сравнению со стандартной 2D допплерографией (3,1 мин против 7,9 мин) [11].
Рис. 4. Измерение объема желудочка сердца плода с помощью VOCAL™.
Таким образом, исходя из многочисленных публикаций, можно предположить, что по мере накопления клинического опыта и стандартизации применения технология STIC™ позволит каждому заинтересованному врачу приблизить качество и достоверность проводимого ультразвукового исследования сердца плода к экспертному уровню.
4х камерный срез сердца у плода что это такое
3. Формирование сердечной петли:
• Экспрессия генов, ответственных за латерализацию сердца, начинается на стадии кардиогенного поля
• Рост и дифференцировка сердечной трубки приводят к формированию U-образного сердца:
о Типичную форму сердце приобретает к 28-му дню
• Венозный полюс остается фиксированным дорсально
• Предсердия смещаются краниально
• Артериальный конец изгибается вправо и вентрально
4. Формирование перегородок:
• 30-40-й дни беременности
• Предсердия:
о Первичная перегородка растет сверху вниз, достигая эндокардиальных валиков:
— При ее слиянии с эндокардиальными валиками первичное отверстие закрывается
— В результате апоптоза в центре первичной перегородки образуется вторичное отверстие
о Вторичная перегородка растет справа от первичной перегородки
о В результате фенестрации вторичной перегородки образуется овальное окно
• АВ-канал:
о Изначально направлен к зачатку желудочка (развивающемуся ЛЖ)
о К 5-й неделе бульбовентрикулярная складка делит желудочек на две равные части
о Передний, задний и боковой эндокардиальные валики растут кнутри:
— Клетки, произошедшие из эндокарда или нервного гребня
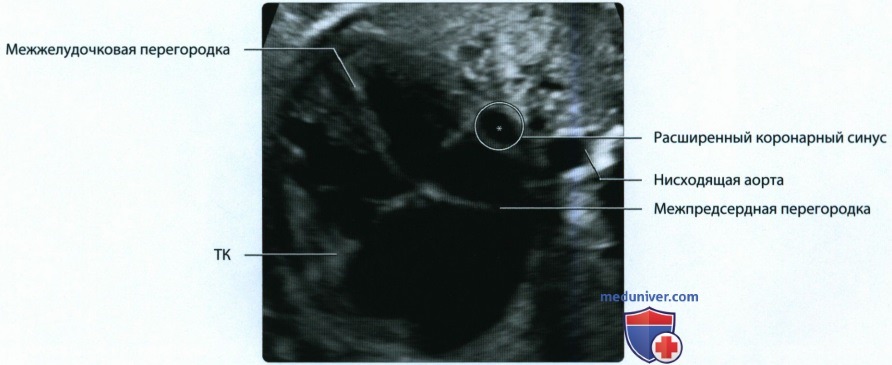
о В результате сращения эндокардиальных валиков образуются митральный и трикуспидальный (ТК) клапаны, отделяющие предсердия от желудочков
• Желудочки:
о Разделены мышечной перегородкой, растущей вниз по мере роста самих желудочков
о От нижних эндокардиальных валиков отходит мембранозная перегородка
о Перегородка выносящего тракта отходит от валиков выносящего тракта в луковице сердца
• Магистральные артерии:
о Выпячивания артериальных конуса и ствола образуют эндокардиальные гребни
о В результате роста эндокардиальных гребней на 7-й неделе происходит разделение магистральных артерий
о Изгиб крупных артерий формируется в результате следующих событий:
— Ориентация трункальных гребней вверху или внизу
— Ориентация конусных гребней слева или справа
— Межтканевое взаимодействие между вторичным сердечным полем и клетками нервного гребня посредством сигнальных путей
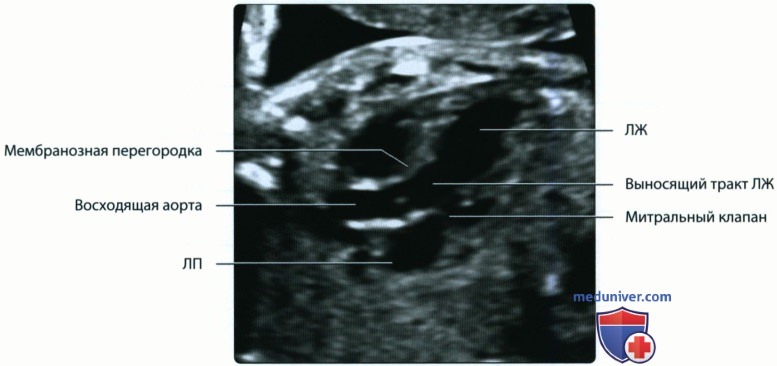
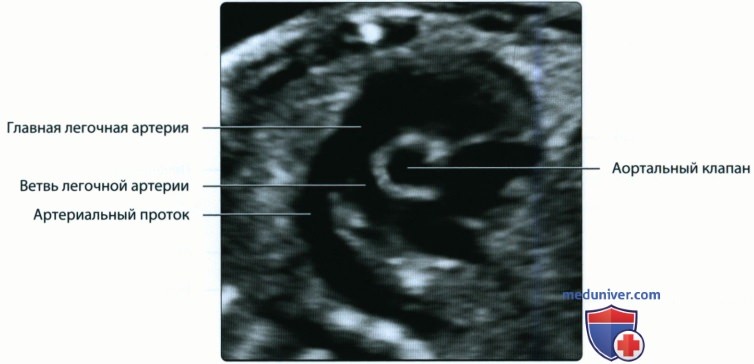
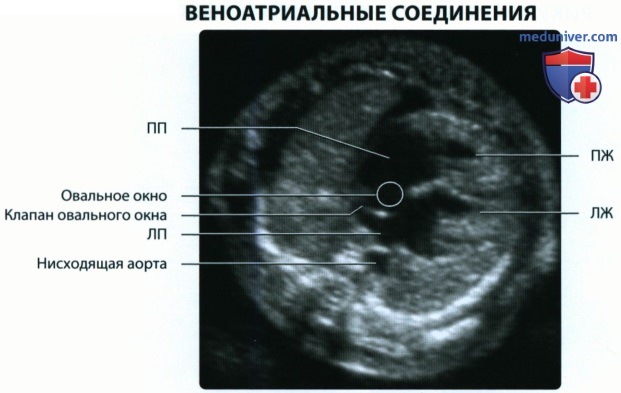
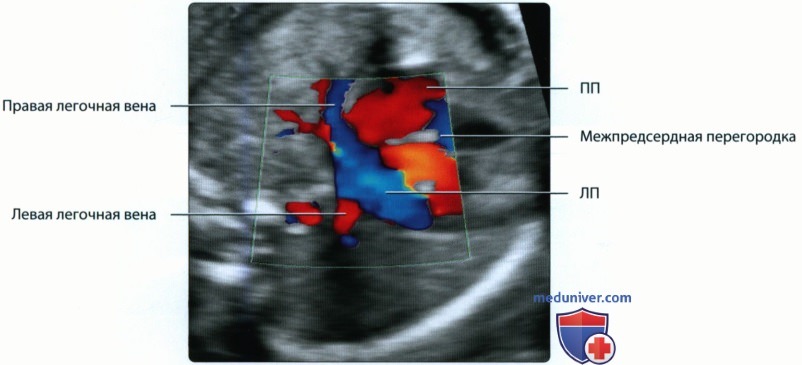
б) Эмбриональное развитие артерий:
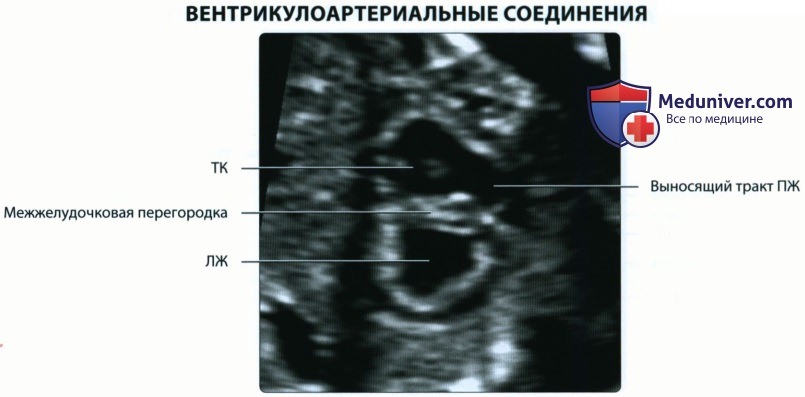
2. Конотрункус:
• Конотрункус является выносящим трактом первичной сердечной трубки
• Рост эндокардиального гребня приводит к разделению артериального ствола на восходящую аорту и легочную артерию
о В результате этого же процесса образуются клапаны аорты и легочной артерии
• Клапан аорты обычно располагается справа и сзади от клапана легочной артерии
• Изначально присутствуют два подартериальных конуса:
о Субпульмональный конус сохраняется
о Субаортальный конус подвергается резорбции:
— Фиброзные компоненты аортального и митрального клапанов непрерывно соединены
— Аорта «заякорена» в ЛЖ:
При разобщении аорты и предсердно-желудочковой перегородки возникает S-образная деформация АВ-канала (в форме гусиной шеи)
3. Легочная артерия:
• Спереди и слева от корня аорты
• У плода главная легочная артерия разделяется на три сосуда: артериальный проток, правую и левую легочные артерии
• У взрослых главная легочная артерия в месте выхода из перикарда разделяется на два сосуда: правую и левую ветви:
о В результате атрофии артериального протока образуется артериальная связка
в) Эмбриональное развитие вен:
1. Венозный синус:
• Имеет в составе правый и левый рога
• В каждый рог впадают желточная, пупочная и кардинальная вены
• По мере роста и дифференцировки входное отверстие синуса смещается вправо, в формирующееся правое предсердие (ПИ)
2. Развитие вен большого круга кровообращения:
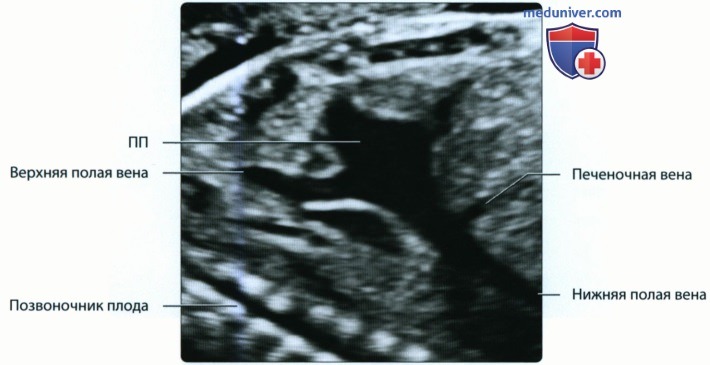
• Правая передняя кардинальная вена → верхняя полая вена
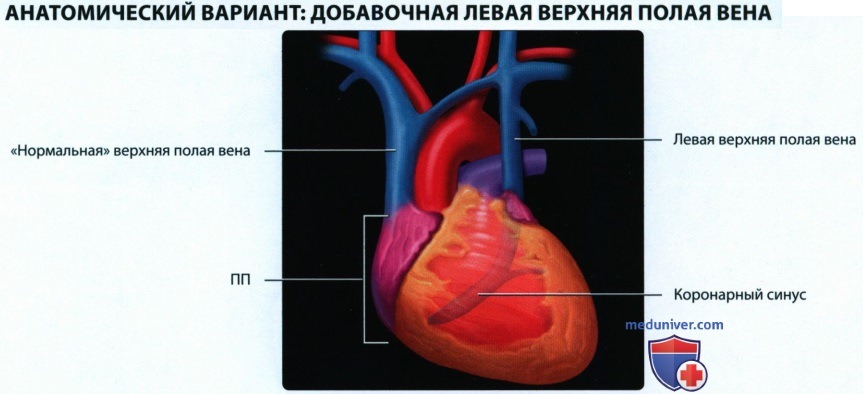
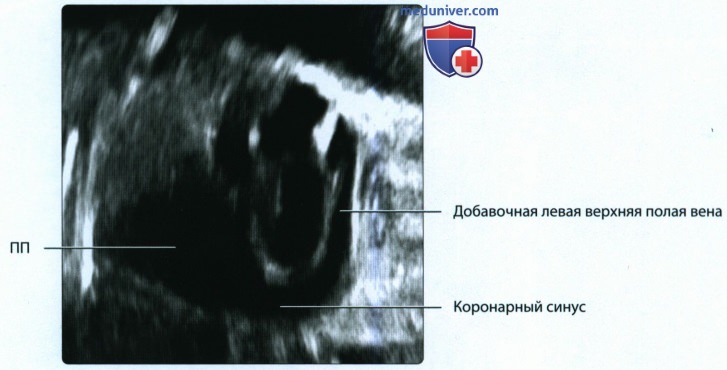
• Левая передняя кардинальная вена подвергается инволюции, левый рог венозного синуса → коронарный синус:
о Персистенция левой передней кардинальной вены становится причиной появления добавочной левой верхней полой вены
• Желточные вены, обеспечивающие отток крови от желточного мешка, становятся печеночной и воротной венами
• Левая пупочная вена (ПВ) впадает в венозный проток, обеспечивая возврат оксигенированной плацентарной крови в сердце плода
• Правая ПВ подвергается инволюции
• ПВ также входит в печень через воротный синус:
о Облитерированная ПВ становится круглой связкой
1. Названия сегментов:
• В основе наименований сегментов сердца лежит его морфология
• В основе анатомического описания сердца лежат наличие сегментов, их взаимное расположение и взаимосвязь
• Кровь по артериям движется от сердца:
о Аорта кровоснабжает головной мозг и тело
о ПА (ветви внутренних подвздошных артерий) несут бедную кислородом кровь от сердца к плаценте:
— У взрослого они становятся медиальными пупочными связками
о Главная легочная артерия несет кровь от ПЖ к туловищу через артериальный проток:
— Небольшой объем крови также попадает к легким плода, поскольку они не участвуют в газообмене
• По венам кровь доставляется к сердцу:
о ПВ несет насыщенную кислородом кровь от плаценты к сердцу:
— Основной объем оксигенированной крови через овальное окно попадает в левые отделы сердца и направляется к мозгу
о Нижняя полая вена несет бедную кислородом кровь от туловища к ПП
о Верхняя полая вена доставляет бедную кислородом кровь от головы к ПП
• Разделение потоков обеспечивает оптимальную доставку оксигенированной крови к голове:
о Насыщенная кислородом кровь из ПВ поступает в ПП через венозный проток и нижнюю полую вену:
— Основная часть потока через овальное окно поступает в ЛП и ЛЖ
— Перфузия сердца и головного мозга осуществляется кровью с наибольшей концентрацией кислорода
о Бедная кислородом венозная кровь из большого круга кровообращения попадает в ПП через верхнюю и нижнюю полые вены:
— Поток крови попадает преимущественно в ПЖ
2. У новорожденного:
• В ответ на увеличение концентрации кислорода в легких с началом дыхания происходит расширение легочной артерии
о Снижение сосудистого сопротивления в легочных артериях:
• После пережатия пуповины артериальное сообщение с плацентой, характеризующееся низким сосудистым сопротивлением, перестает существовать:
о Повышение сосудистого сопротивления в магистральных артериях
• Конечным результатом является снижение кровотока в артериальном протоке и усиление кровотока в главную легочную артерию
о Происходит закрытие артериального протока
• Оксигенированная кровь поступает от легких к ЛП по легочным венам
• Повышение давления в ЛП приводит к закрытию овального окна
Видео анатомия кровообращения плода и плацентарного кровотока
Редактор: Искандер Милевски. Дата обновления публикации: 7.10.2021