acinetobacter ursingii что это такое
Acinetobacter (ацинетобактер)

Acinetobacter — повсеместно встречающаяся бактерия. У здоровых людей, в частности, он обитает на коже, также выделяется из кишечника.
Ацинетобактер — причина внутрибольничных инфекций
Ацинетобактер в анализах кала
Ацинетобактер в систематике бактерий
Род Acinetobacter относится к семейству Moraxellaceae, которое входит в порядок Pseudomonadales, класс гамма-протеобактерии (γ proteobacteria), тип протеобактерии (Proteobacteria), царство бактерии.
В род ацинетобактер включены следующие виды: Acinetobacter albensis, Acinetobacter antiviralis, Acinetobacter apis, Acinetobacter baumannii, Acinetobacter baylyi, Acinetobacter beijerinckii, Acinetobacter bereziniae, Acinetobacter bohemicus, Acinetobacter boissieri, Acinetobacter bouvetii, Acinetobacter brisouii, Acinetobacter calcoaceticus, Acinetobacter endosymbiont of Anopheles claviger, Acinetobacter celticus, Acinetobacter courvalinii, Acinetobacter defluvii, Acinetobacter dispersus, Acinetobacter endosymbiont of Anopheles claviger, Acinetobacter endosymbiont of Culex pipiens, Acinetobacter endosymbiont of Nilaparvata lugens, Acinetobacter equi, Acinetobacter gandensis, Acinetobacter genospecies, Acinetobacter gerneri, Acinetobacter glutaminasificans, Acinetobacter guangdongensis, Acinetobacter guillouiae, Acinetobacter gyllenbergii, Acinetobacter haemolyticus, Acinetobacter halotolerans, Acinetobacter harbinensis, Acinetobacter idrijaensis, Acinetobacter indicus, Acinetobacter johnsonii, Acinetobacter junii, Acinetobacter kookii, Acinetobacter kyonggiensis, Acinetobacter lactucae, Acinetobacter larvae, Acinetobacter lwoffii, Acinetobacter marinus, Acinetobacter modestus, Acinetobacter movanagherensis, Acinetobacter nectaris, Acinetobacter oleivorans, Acinetobacter oryzae, Acinetobacter parvus, Acinetobacter plantarum, Acinetobacter populi, Acinetobacter proteolyticus, Acinetobacter psychrotolerans, Acinetobacter puyangensis, Acinetobacter qingfengensis, Acinetobacter radioresistens, Acinetobacter refrigeratoris, Acinetobacter rhizosphaerae, Acinetobacter rudis, Acinetobacter schindleri, Acinetobacter seohaensis, Acinetobacter septicus, Acinetobacter soli, Acinetobacter tandoii, Acinetobacter tjernbergiae, Acinetobacter towneri, Acinetobacter ursingii, Acinetobacter variabilis, Acinetobacter venetianus, Acinetobacter vivianii, Acinetobacter xiamenensis.
Ряд видов, а именно: Acinetobacter baumannii, Acinetobacter calcoaceticus, Acinetobacter nosocomialis, Acinetobacter pittii объединены в отдельную группу Acinetobacter calcoaceticus/baumannii complex.
Антибиотики, активные и неактивные в отношении ацинетобактера
Необходимо отметить, что ацинетобактер отличаются высокой и поливалентной резистентностью к антибиотикам, что крайне затрудняет эффективное лечение больных (Гельфанд Е.Б. и др.).
A. Противомикробные средства из имеющих описание в данном справочнике
Ацинетобактер устойчив к: рокситромицину.
Б. Иные противомикробные препараты
Ацинетобактер умеренно чувствителен к цефалоспоринам IV поколения: цефепиму, цефпирому и другим (Яковлев С.В.).
Из карбапенемов в отношении ацинетобактера активны меропенем, имипенем, биапенем и панипенем. Эртапенем, наоборот, не активен (Белобородов В.Б.).
Ацинетобактер имеет высокий уровень устойчивости к фторхинолонам. В частности, к ципрофлоксацину на территории России в отделениях реанимации частота устойчивости варьирует от 13 до 53% (Сидоренко С.В.).
По мнению С.В. Яковлева, при выявленном возбудителе, препаратам первого ряда для лечения инфекции (мочевыводящих путей у больных пожилого возраста) ацинетобактера, являются фторхинолоны, в качестве альтернативных средств рекомендуются карбапенемы, амикацин и цефалоспорины IV поколения.
Ацинетобактер чувствителен к сульбактаму и к комбинации амоксициллин + сульбактам (Царапкин Г.Ю. и др.).
Виды ацинетобактера в общем резистентны к азтреонаму (R. de Groot).
Acinetobacter calcoaceticus и рассеянный склероз
E. Cekanaviciute и др. из США в своём исследовании* установили связь микробиоты толстой кишки человека и рассеянного склероза. Они определили, что у больных рассеянным склерозом количество Acinetobacter calcoaceticus и Akkermansia muciniphila повышено, а Parabacteroides distasonis снижено. Было высказано предположение, что состав микробиоты кишечника может стимуловать развитие рассеянного склероза. Определенные виды бактерий способны модулировать иммунный ответ в организме, подстегивая или подавляя заболевание.
*Cekanaviciute E et al. Gut bacteria from multiple sclerosis patients modulate human T cells and exacerbate symptoms in mouse models / Proc. Natl. Acad. Sci. USA, vol. 114, no. 40, 10713–10718, doi: 10.1073/pnas.1711235114.
Проклятая дюжина
Опубликован список из 12 бактерий, устойчивых к действию большинства антибиотиков
В конце февраля 2017 г. Всемирная организация здравоохранения впервые опубликовала список бактерий с уже выработанной или растущей устойчивостью к действию большинства антибиотиков. Задача публикации — стимулировать на государственном уровне поиск новых лекарственных препаратов против перечисленных возбудителей, «представляющих наибольшую угрозу для здоровья человека». Включенные в список бактерии разделены на три группы по приоритетности в плане поиска новых антибиотиков.
Критически высокий уровень приоритетности
Рейтинг бактерий, устойчивых к антибиотикам, заслуженно возглавляют грамотрицательные микроорганизмы — возбудители большинства нозокомиальных (внутрибольничных) инфекций в отделениях реанимации и интенсивной терапии, гнойной хирургии и онкологии. Вызывают инфекции кожи и мягких тканей, ЖКТ, мочевыводящих путей, раневые, эндокардит, менингит, остеомиелит. У ослабленных пациентов особое значение имеют инфекции кровотока и ИВЛ-ассоциированная пневмония. Для бактерий этой группы практически не осталось антибиотиков резерва.
Acinetobacter baumannii
«Природное» местообитание A. baumannii не установлено, однако этих бактерий обнаруживают в стационарах по всему миру. Вызывает до 1 % всех нозокомиальных инфекций, с уровнем смертности от 8 до 35 %. A. baumannii резистентна к пенициллинам, цефалоспоринам, аминогликозидам, хинолонам и тетрациклину. Отмечено значительное увеличение резистентности к карбапенемам — более 50 % в отдельных странах. Выявлены случаи резистентности к «последнему резерву» антибактериальной терапии, полимиксинам, ранее широко не использовавшимся из‑за высокой нефротоксичности.
В терапии карбапенем-резистентной A. baumannii относительно эффективны комбинации антибиотиков: полимиксин Е + рифампицин/карбапенемы/хинолоны/цефепим/ампициллин-сульбактам/пиперациллин-тазобактам.
Pseudomonas aeruginosa
Синегнойная палочка распространена повсеместно, встречается в почве и воде, на/в растениях, животных, людях. Вызывает до 20 % нозокомиальных инфекций. Чувствительность к антибактериальной терапии очень сильно варьирует. В тяжелых случаях отмечается развитие резистентности к ранее высокоэффективным цефалоспоринам, фторхинолонам, карбапенемам, аминогликозидам, азтреонаму, пиперациллину-тазобактаму. Сохраняется чувствительность к полимиксину Е, а также комбинациям антибиотиков.
Смертность при развитии инфекций, вызванных мультирезистентной P. aeruginosa, варьирует от 5 до 50 %, в зависимости от состояния пациента и локализации процесса.
Enterobacteriaceae
Из большого семейства энтеробактерий основные проблемы в стационарах доставляют Klebsiella, Escherichia coli, Citrobacter, Salmonella, Enterobacter, Serratia, Proteus. Вызывает опасения растущее повсеместное снижение чувствительности семейства к карбапенемам. Описаны единичные случаи резистентности E. coli ко всем существующим антибиотикам, включая полимиксин Е.
Высокий уровень приоритетности
Бактерии второй группы объединены по признаку повсеместного распространения, высокой социально-экономической значимости вызываемых ими заболеваний и быстрого развития резистентности к основным антибиотикам, используемым для их эрадикации, однако в резерве еще остается один или несколько эффективных препаратов.
Enterococcus faecium
E. faecium входит в состав нормальной микрофлоры кишечника, но в то же время является условно-патогенным микроорганизмом. У ослабленных больных может вызывать инфекции мочевыводящих путей, раневую инфекцию, сепсис и эндокардит. Резистентен к аминогликозидам, пенициллинам и цефалоспоринам. Беспокойство вызывает снижение чувствительности к ванкомицину — до 72 % в отдельных популяциях. Большинство штаммов E. faecium чувствительны к линезолиду, тигециклину, даптомицину.
Staphylococcus aureus
Золотистый стафилококк, колонизирующий кожу и слизистые оболочки, способен вызывать тяжелые инфекции кожи и мягких тканей, респираторные, раневые инфекции, остеомиелит, сепсис, артрит, эндокардит. Недавнее появление и распространение ванкомицин- и гликопептид-резистентных штаммов в дополнение метициллин-резистентному S. aureus значительно сужает выбор антибактериальных препаратов, однако у возбудителя сохраняется чувствительность к аминогликозидам, эритромицину, тетрациклину, ко-тримоксазолу, линезолиду.
Helicobacter pylori
Тревогу ВОЗ вызывает увеличение случаев резистентности всем известной H. pylori к кларитромицину, что сказывается на эффективности традиционных схем эрадикационной терапии, в том числе и в России. Перед эрадикацией ВОЗ рекомендует проверить чувствительность бактерии к этому антибиотику, при выявлении устойчивости — использовать схемы без него — с метронидазолом, тетрациклином или рифаксимином, а также добавлять висмута трикалия дицитрат.
Campylobacter spp.
Бактерии рода Campylobacter удерживают первое место в мире по гастроэнтеритам, которые у большинства населения планеты протекают в легкой форме, но представляют опасность для маленьких детей, беременных, стариков и иммунокомпрометированных больных. В большинстве случаев достаточно регидратации и восстановления электролитного баланса, антибактериальную терапию назначают при тяжелом течении. Проблемой является резистентность Campylobacter к фторхинолонам, основному средству борьбы с кишечной микрофлорой, и макролидам. Устойчивость к этим препаратам, впрочем, сильно варьирует от страны к стране — от менее 5 % в Финляндии до более 90 % в Индии. В Европе и России эритромицин всё еще остается препаратом выбора. По данным микробилогических исследований, в России также еще вполне актуальны фторхинолоны. В запасе для особо тяжелых случаев с осложнениями — гентамицин и карбапенемы.
Salmonellae
Представители рода сальмонелл также вызывают набор кишечных инфекций, от легкого энтерита до брюшного тифа. Большинство этих бактерий уже резистентны к бета-лактамам, аминогликозидам, тетрациклинам, хлорамфениколу и ко-тримоксазолу. Устойчивость к фторхинолонам растет во всем мире, но пока не привела к полной бесполезности этих препаратов, они остаются антибиотиками выбора, наравне с макролидами и цефалоспоринами третьего поколения. Антибактериальной терапии требуют только тяжелые случаи кишечных инфекций и, конечно, брюшной тиф и паратифы.
Neisseria gonorrhoeae
Гонорея из неприятной, но относительно легко излечимой болезни эволюционировала в глобальную медицинскую проблему. Гонококк потерял чувствительность к пенициллинам, тетрациклинам, сульфаниламидам и фторхинолонам.
Особое опасение вызывает появление и постепенное распространение штаммов, резистентных к цефалоспоринам (цефтриаксону), долгое время служивших безотказным средством борьбы с этой инфекцией. При резистентной к стандартным схемам лечения гонорее рекомендовано использовать комбинацию азитромицина с высокими дозами цефтриаксона. В России гонококк также практически резистентен к фторхинолонам, но пока сохраняет 100 %-ную чувствительность к цефтриаксону.
Средний уровень приоритетности
Третью группу также представляют широко распространенные бактерии, чья устойчивость к «обычным» антибиотикам пока не приняла угрожающих масштабов, однако чревата большими проблемами в будущем.
Streptococcus pneumoniae
Пневмококки — одни из основных возбудителей инфекций ЛОР-органов, внебольничной пневмонии, менингита. Резистентны к тетрациклину и ко-тримоксазолу. В мире постепенно снижается чувствительность S. pneumoniae к бета-лактамам и макролидам, однако, как и в других случаях, доля резистентных штаммов сильно варьирует от страны к стране. В России большинство штаммов пневмококков, к счастью, всё еще чувствительны к пенициллинам и макролидам, также эффективны хлорамфеникол, рифампицин, левофлоксацин, ванкомицин.
Haemophilus influenzae
Гемофильная инфекция у детей младшего возраста протекает в виде бактериемии, гнойного менингита, пневмонии, целлюлита и эпиглоттита, у взрослых — в основном в виде пневмонии. Тревогу ВОЗ вызывает развитие полной резистентности гемофильной палочки к ранее эффективному ампициллину, в результате чего от него пришлось повсеместно отказаться. В России эффективны амоксициллин, цефалоспорины и макролиды, однако рекомендуется проводить бактериологический анализ с оценкой резистентности.
Shigella spp.
Возбудители дизентерии практически не чувствительны к ампициллину. Как и прочие энтеробактерии, они также постепенно вырабатывают устойчивость к фторхинолонам, которые тем не менее всё еще остаются препаратами выбора. В качестве альтернативы — цефалоспорины III поколения, ко-тримоксазол.
Итого
Появление устойчивых к антибиотикам бактерий и публикация этого списка в очередной раз привлекают внимание человечества к необходимости создания — в идеале — принципиально новых средств борьбы с микроорганизмами, иначе, по пессимистичным прогнозам, из-за появления бактерий, устойчивых к антибиотикам, через несколько десятилетий одна только послеоперационная летальность может скатиться до уровня начала прошлого века. Разработка таких препаратов — занятие неблагодарное, поэтому фармацевтические компании не стремятся развивать данное направление, и ВОЗ выносит проблему на межгосударственный уровень.
Проблема лекарственной устойчивости среди возбудителей нозокомиальных инфекций — первые пять бактерий списка — актуальна и для российского здравоохранения. Остальные перечисленные микроорганизмы, по данным российских исследований, на территории РФ в целом сохраняют чувствительность к «своим» антибиотикам. Тем не менее, учитывая возросшую мобильность населения, можно ожидать завоза и распространения резистентных штаммов.
Сводная таблица: чувствительность возбудителей к антибактериальной терапии
Acinetobacter ursingii что это такое
В последнее десятилетие наблюдается неуклонный рост числа инфекций, вызванных Acinetobacter spp. [1, 8]. Данные зарубежной статистики свидетельствуют о том, что ацинетобактер входит в число шести самых опасных бактерий для населения развитых стран [5]. Являясь условными патогенами, ацинетобактеры, тем не менее, представляют серьезную угрозу для пациентов отделений, где широко используют инвазивные методы диагностики и лечения (длительное лечение, катетеризация сосудов, искусственная вентиляция легких, многочисленные наркозы и перевязки) [9]. Ацинетобактерии вызывают инфекционный процесс только на фоне иммуносупрессии. Факторами риска являются тяжелые травмы, длительные операции, тяжелые термические травмы. Раневая ожоговая инфекция нередко обусловлена наличием ацинетобактерий, которые занимают второе место после стафилококков в общей структуре возбудителей [2]. Факторы патогенности, определяющие повреждение тканей и выживание ацинетобактерий в организме, активно действуют на всех этапах инфекционного процесса – адгезии, инвазии, в случае диссеминации и персистенции вызывают интоксикацию и обеспечивают неэффективность иммунного ответа. Бактерии рода Acinetobacter отличаются высокой природной резистентностью к антимикробным препаратам. Выживаемость ацинетобактерий в условиях антибиотикотерапии может быть связана с существованием персистирующих штаммов. Среди Acinetobacter baumanii обнаружено пять наборов токсин-антитоксин, ответственных за трансформацию метаболически активных форм в персистирующие [7]. Клиническая значимость Acinetobacter spp. с одной стороны вызвана их распространенностью, они колонизируют кожу рук персонала, клавиатуры компьютеров, поверхности оборудования, а с другой стороны – способностью приобретать устойчивость к антимикробным препаратам. Если в 2002–2004 гг. в России выявляли всего 6 % имипенемрезистентных Acinetobacter baumanii, то в 2011–1012 гг. их доля выросла до 96 % [4]. Одной из главных причин резистентности ацинетобактерий является продукция β-лактамаз. Ацинетобактерии продуцируют все три класса сериновы β-лактамазы А, С и D классов, а также метало-β-лактамазы (класс В). Большое число штаммов Acinetobacter baumanii продуцируют оксацилиназы – лактамазы, обуславливают резистентность не только к пенициллинам, но и к карбапенемам [10]. Карбапенемрезистентные A. baumanii могут служить источником для переноса карбапенемаз другим видам грамотрицательных бактерий. Это осложняет выбор адекватного антимикробного препарата, результатом чего является неэффективность терапии, увеличение продолжительности и стоимости лечения, а нередко и исход ожоговой болезни [6].
Цель работы: анализ распространенности карбапенемрезистентных штаммов A. baumanii в детском и взрослом ожоговом стационаре ФГБУ «ПФМИЦ» Минздрава России г. Нижнего Новгорода для составления рациональных протоколов стартовой антимикробной терапии.
Материалы и методы исследования
В работе проанализировано 942 раневых штамма Acinetobacter spp., выделенных у взрослых пациентов и детей с термической травмой за период 2012–2015 гг.
Идентификация микроорганизмов проводилась на анализаторе iEMS Reader FM (Labsystems, Финляндия) с помощью набора тест-систем (Lachema, Чехия), в 2015 году – масс-спектрометрически на приборе Autoflex (Bruker). Статистический анализ видового состава выделенной микрофлоры проводили с помощью компьютерной программы «Микроб-2». Антибиотикорезистентность микробных изолятов оценивалась диско-диффузионным методом с использованием агара Мюллера-Хинтон и сенси-дисков Oxoid (Англия) в соответствии с методическими указаниями, минимальные подавляющие концентрации рассчитывали на анализаторе «ADAGIO» (BioRad, США) [3].
Выявление карбапенем-гидролизующих β-лактамаз (ОХА-карбапенемаз группы ОХА-23, ОХА-58 и ОХА-40 подобных и метало-β-лактамаз (MBL группы IMP, VIM и NDM), а также видоспецифических β-лактамаз Acinetobacter baumanii (ген ОХА-51) осуществляли методом мультиплексной полимеразноцепной реакции (ПЦР) с гибридизационно-флюоресцентной детекцией продукции амплификации в режиме «реального времени». В качестве контрольного использовали штамм Acinetobacter baumanii 19606 коллекции АТСС.
Выделение ДНК и выявление наличия генов MBL и ОХА-карбапенемаз проводили с помощью коммерческих наборов «Рибо-преп», «АмплиСенс MDR MBL-FL» и «АмплиСенс MDR Acinetobacter ОХА-FL» проводили с помощью коммерческого набора «Рибо-преп» производства ФГУН ЦНИИЭМ. Амплификация проводилась в термоциклере «Rotor Gene 6000» (Corbett Research, Австралия) по инструкции к наборам. Статистическую обработку полученных данных проводили с помощью компьютерной программы Statistica.
Результаты исследования и их обсуждение
Анализ раневой микрофлоры показал, что в детском ожоговом отделении Acinetobacter spp. составляют в среднем 10 % всей раневой микрофлоры, во взрослом ожоговом – 15 % (табл. 1).
За период наблюдения в разные годы выявлены определенные колебания численности раневых ацинетобактерий, однако достоверных изменений в обоих отделениях не произошло. Следует подчеркнуть, что в структуре возбудителей раневой ожоговой инфекции у взрослых и детей с термической травмой в настоящее время Acinetobacter spp. занимают второе место после стафилококков и первое место среди грамотрицательных микроорганизмов.
Клинически значимыми представителями рода Acinetobacter являются виды Acinetobacter baumanii и Acinetobacter Lwoffii, которые могут вызывать пневмонии, инфекции мочевого тракта, раневые и катетерассоциированные инфекции. Молекулярные исследования видоспецифичности бактерий Acinetobacter spp. по наличию гена ОХА-51 подтвердили принадлежность 97 % анализируемых штаммов к виду Acinetobacter baumanii, 2 % по данным масс-спектрометрии относились к Acinetobacter Lwoffii и 1 % – к Acinetobacter calcoaceticus.
Частота выделения Acinetobacter spp. в ожоговых отделениях ( %)
Журнал «Медико-социальные проблемы семьи» 1 (том 19) 2014
Вернуться к номеру
Роль ацинетобактерий в возникновении проблемных инфекций
Версия для печати
Ацинетобактер является типичным примером так называемых проблемных инфекций ввиду высокого уровня приобретенной резистентности к антибиотикам. Acinetobacter spp. — род
грамотрицательных бактерий, относящийся к семейству Moraxellaceae. Обычно очень короткие и округлые грамотрицательные бактерии, размеры их в логарифмической фазе роста составляют
1,0–1,5 × 1,5–2,5 мкм. Эти микроорганизмы плеоморфны, и их легко спутать с микроорганизмами рода Neisseria. Они хорошо растут на простых питательных средах, образуя белые, выпуклые, гладкие колонии. Ацинетобактер синтезирует липополисахарид и капсульный полисахарид, которые ответственны за высокую токсичность. Это свободно живущие сапрофиты, которые распространены повсеместно. Естественной средой их обитания являются вода и почва. Они могут выживать на влажных и сухих поверхностях, в том числе в условиях больничных учреждений. У 25 % здоровых людей Acinetobacter spp. колонизируется на коже. У ослабленных лиц некоторые представители Acinetobacter spp. могут вызвать опасные для жизни инфекции. Клинически наиболее значимыми микроорганизмами рода Acinetobacter spp. считаются виды A.baumannii, гораздо реже являются возбудителями заболеваний A.lwoffii. У тяжелых больных (палаты интенсивной терапии, реанимация) A.baumannii может вызывать пневмонии, трахеобронхиты, инфекции кровяного русла, мочевого тракта, катетер-ассоциированные и раневые инфекции. Смертность при ацинетобактерной инфекции обычно очень высокая и составляет 20–60 %. Частота возникновения ацинетобактерной инфекции возрастает. Предлагается схема идентификации Acinetobacter spp. для практического врача-бактериолога.
Ацинетобактер є типовим прикладом так званих проблемних інфекцій з огляду на високий рівень набутої резистентності до антибіотиків. Acinetobacter spp. — рід грамнегативних бактерій, що належать до сімейства Moraxellaceae. Зазвичай це дуже короткі й округлі грамнегативні бактерії, розміри їх в логарифмічній фазі росту становлять 1,0–1,5 × 1,5–2,5 мкм. Ці мікроорганізми плеоморфні, і їх легко сплутати з мікроорганізмами роду Neisseriа. Вони добре ростуть на простих поживних середовищах, утворюючи білі, випуклі, гладкі колонії. Ацинетобактер синтезує ліпополісахарид і капсульний полісахарид, що відповідальні за його високу токсичність. Це сапрофіти, що вільно живуть і поширені повсюди. Природним середовищем їх проживання є вода та ґрунт. Вони можуть виживати на вологих і сухих поверхнях, у тому числі в умовах лікарняних установ. У 25 % здорових людей Acinetobacter spp. колонізується на шкірі. У ослаблених осіб деякі представники Acinetobacter spp. можуть викликати небезпечні для життя інфекції. Клінічно найбільш значущими мікроорганізмами роду Acinetobacter spp. вважається вид A.baumannii, набагато рідше збудником захворювань є A.lwoffii. У тяжких хворих (палати інтенсивної терапії, реанімація) A.baumannii може викликати пневмонії, трахеобронхіти, інфекції кров’яного русла, сечового тракту, катетер-асоційовані та ранові інфекції. Смертність при ацинетобактерній інфекції зазвичай дуже висока та становить 20–60 %. Частота виникнення ацинетобактерної інфекції зростає. Пропонується схема ідентифікації Acinetobacter spp. для практичного лікаря-бактеріолога.
Acinetobacter is a typical example of so-called problematic infections due to the high level of acquired resistance to antibiotics. Acinetobacter spp. — genus of Gram-negative bacteria belonging to the family Moraxellaceae. Usually a very short and rounded Gram-negative bacteria, their sizes in the logarithmic growth phase are 1.0–1.5 × 1.5–2.5 micron. These microorganisms are pleomorphic and are easily confused with the microorganisms of the genus Neisseria. They grow well on ordinary nutrient media, forming a white, convex, smooth colonies. Acinetobacter synthesizes lipopolysaccharide and capsular polysaccharide which are responsible for high toxicity. This is free-living saprophytes, which are ubiquitous. Their habitats are water and soil. They can survive on dry and wet surfaces, including in hospital establishments. In 25 % of healthy people Acinetobacter spp. colonises the skin. In immunocompromised individuals, some representatives of Acinetobacter spp. can cause life-threatening infections. Clinically, the most important microorganisms of the genus Acinetobacter spp. considered A.baumannii, and much rarer pathogens are A.lwoffii. In critically ill patients (intensive care, resuscitation units) A.baumannii can cause pneumonia, tracheobronchitis, bloodstream, urinary tract infections, catheter-associated and wound infections. Mortality in Acinetobacter infection is usually very high, and is 20–60 %. The incidence of Acinetobacter increases. A scheme for the identification of Acinetobacter spp. for practitioner-bacteriologist is offered.
ацинетобактер, резистентность, клиника, диагностика.
ацинетобактер, резистентність, клініка, діагностика.
Acinetobacter, resistance, clinical picture, diagnosis.
Статья опубликована на с. 122-127
Актуальность
Имеется ряд микроорганизмов (МО), которые ввиду высокого уровня приобретенной резистентности к антибиотикам принято называть проблемными. К таковым среди возбудителей заболеваний органов дыхания относятся метициллинрезистентные золотистые стафилококки (MRSA) и некоторые представители грамотрицательной флоры — синегнойная палочка (P.aeruginosa), бактерии рода ацинетобактер (Acinetobacter spp.) и в ряде случаев отдельные МО семейства Enterobacteriaceae (E.coli, K.pneumoniae) [1]. В данной работе будут рассмотрены представители рода Acinetobacter spp.
Acinetobacter (ah-see-netto-BAK-ter) является сложным словом, которое произошло от научного греческого [α + κίνητο + βακτηρ (ία)], что означает «неподвижные стержни».
Представители этого рода являются свободно живущими сапрофитами, распространены повсеместно. Естественной средой их обитания являются вода и почва. Они часто выделяются из сточных вод, являются важными почвенными организмами, где они способствуют минерализации (например, ароматических соединений). Они могут выживать на влажных и сухих поверхностях, в том числе в условиях больничных учреждений. Некоторые штаммы были изолированы из продуктов питания, питьевой воды. Эти МО входят в состав микрофлоры кожи здоровых лиц и чаще колонизируют участки между пальцами ног и в паховой области (особенно у проживающих в жарком и влажном климате), могут находиться в желудочно-кишечном и урогенитальном трактах и относятся к малопатогенным микроорганизмам. Однако наличие определенных свойств способствует повышению вирулентности Acinetobacter spp. [2, 3]. У здоровых людей Acinetobacter spp. вегетируют на коже и коррелируют с низким уровнем заболеваемости аллергией [4].
Acinetobacter spp. являются ключевым источником инфекции у ослабленных пациентов в больнице. Клинически наиболее значимыми МО рода Acinetobacter spp. считаются виды A.baumannii, гораздо реже являются возбудителями заболеваний A.lwoffii. Поэтому при упоминании ацинетобактерной инфекции в первую очередь подразумевается A.baumannii. У ослабленных лиц некоторые представители Acinetobacter spp. могут вызвать опасные для жизни инфекции. Такие виды также обладают относительно широким спектром устойчивости к антибиотикам.
Acinetobacter spp. часто выделяют при внутрибольничных инфекциях, и особенно характерно их распространение в отделении интенсивной терапии, где возможно возникновение спорадических случаев, а также эпидемическое распространение является обыденным явлением. У тяжелых больных (палаты интенсивной терапии, реанимация) A.baumannii может вызывать пневмонии, трахеобронхиты, инфекции кровяного русла, мочевого тракта, катетер-ассоциированные и раневые инфекции. В отделениях интенсивной терапии (ОИТ) США в 2003 г. Acinetobacter spp. стал причиной 6,9 % всего количества пневмоний, 2,4 % инфекций кровяного русла, 2,1 % инфекций области хирургического вмешательства и 1,6 % инфекций мочевыделительной системы. В условиях тропического климата Acinetobacter spp. может обусловливать тяжелые внебольничные пневмонии. Кроме того, ацинетобактерии способны вызывать вспышки заболеваний во время стихийных бедствий [5].
К тяжелым инфекциям, вызванных Acinetobacter spp., относятся менингиты, подострые и острые бактериальные эндокардиты, пневмонии, инфекции мочевых путей и бактериемия. Обычно клинические проявления и симптомы этой инфекции не отличаются от таковых при аналогичных заболеваниях, вызванных другими возбудителями. Иногда Acinetobacter spp. может обусловливать молниеносную бактериемию с выраженной лихорадкой, сосудистым коллапсом, петехиями, массивными подкожными кровоизлияниями, которые неотличимы от менингококцемии. Гораздо чаще, однако, бактериемия ассоциируется с очевидным внедрением инфекции через венозную систему, в частности через венозные катетеры, хирургические раны или ожоговые поверхности. Она может также развиваться после инструментальных вмешательств на мочеиспускательном канале или в других областях. В клинических проявлениях таких заболеваний доминирует эндотоксемия, и прогноз их неблагоприятный.
Смертность при ацинетобактерной инфекции обычно очень высокая и составляет 20–60 %, атрибутивная летальность — около 10–20 % [6].
Морфология
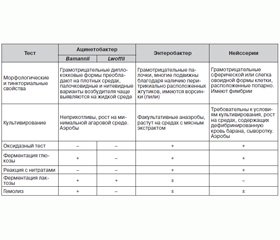
Род Acinetobacter включает 27 названных и 11 неназванных (геномных) видов. Однако, поскольку процедура идентификации в клинической микробиологической лаборатории пока невозможна, они разделены и сгруппированы в три основных комплекса:
1. Acinetobacter calcoaceticus-baumanii комплекс: глюкозоокислительные, негемолитические (A.baumannii могут быть идентифицированы по OXA-51-типированию).
2. Acinetobacter lwoffii: глюкозоотрицательные, негемолитические.
3. Acinetobacter haemolyticus: гемолитические.
Насчитывается 38 видов Acinetobacter spp., из которых значение в клинической диагностике имеют 17 видов: Acinetobacter baumannii, Acinetobacter baylyi, Acinetobacter bouvetii, Acinetobacter calcoaceticus, Acinetobacter gerneri, Acinetobacter grimontii, Acinetobacter haemolyticus, Acinetobacter johnsonii, Acinetobacter junii, Acinetobacter lwoffii, Acinetobacter parvus, Acinetobacter radioresistens, Acinetobacter schindleri, Acinetobacter tandoii, Acinetobacter tjernbergiae, Acinetobacter towneri, Acinetobacter ursingii.
Acinetobacter spp. — род грамотрицательных бактерий, относящийся к семейству Moraxellaceae. Обычно очень короткие и округлые грамотрицательные бактерии, размеры их в логарифмической фазе роста составляют 1,0–1,5 × 1,5–2,5 мкм.
В стационарной фазе роста они приобретают преимущественно форму кокков, располагающихся парами или в виде коротких цепочек. Большие непостоянной формы клетки и нити обнаруживаются в небольшом количестве во всех культурах, а иногда и преобладают. Спор не образуют, жгутиков не имеют, однако некоторые штаммы на плотной питательной поверхности демонстрируют «дергающуюся» подвижность. Капсулы и фимбрии могут быть, но могут и отсутствовать.
Культивирование
Бактерии рода Acinetobacter spp. являются хемоорганотрофами с окислительным метаболизмом. Способность использовать органические соединения в качестве источников энергии и углерода непостоянна. Оксидазы не образуют, каталазопозитивны. Ацетона, индола и сероводорода не образуют. Строгие аэробы, оптимальная температура для роста 30–32 °С, pH около 7,0.
Эти микроорганизмы плеоморфны, и их легко спутать с микроорганизмами рода Neisseria. Они хорошо растут на простых питательных средах, образуя белые, выпуклые, гладкие колонии. Среди микробов, выросших на плотных средах, преобладают диплококковые формы; палочковидные и нитевидные варианты возбудителя чаще выявляются на жидкой среде. Видовая идентификация от энтеробактерий основывается на их отрицательной реакции с нитратами, а от представителей рода Neisseria, которых они могут напоминать по морфологии, отличают по их неприхотливости к питательным средам, по палочковидной форме на жидких средах и по свойственной им отрицательной оксидазной реакции.
Большинство штаммов Acinetobacter spp., за исключением некоторых штаммов А.lwoffii, хорошо растут на бессолевом агаре. Официально классифицируются как ферментирующие лактозу. Бактерии рода Acinetobacter spp., как известно, образуют внутриклеточные полигидроксиалкалоидные включения при определенных условиях окружающей среды (например, отсутствие таких элементов, как фосфор, азот или кислород, в сочетании с избыточным предложением источников углерода) [7, 8].
Резистентность
Acinetobacter spp. могут выживать на влажных и сухих поверхностях до 20 дней. A.baumannii сохраняется на коже человека или сухих поверхностях в течение нескольких недель.
В настоящее время наибольшее беспокойство вызывает рост полирезистентности данных микроорганизмов, встречаются штаммы, резистентные ко всем основным антимикробным препаратам. Из-за этого МО образно окрестили «грамотрицательные MRSA».
Это бактерии, способные к трансформации [9, 10]. Бактериальная трансформация предполагает передачу ДНК от бактерии-донора к бактерии-реципиенту через промежуточную жидкую среду и может быть использована для восстановления повреждений ДНК или как средство для обмена генетической информацией. Маркеры устойчивости к антибиотикам часто плазмидного происхождения, и плазмиды, присутствующие в штаммах Acinetobacter spp,. могут быть переданы другим патогенным бактериям через горизонтальный перенос генов. Способность видов Acinetobacter spp. прилипать к поверхностям, чтобы сформировать биопленки, устойчивость к антибиотикам (перенос гена), стимулируют исследование факторов, ответственных за их распространение [11].
Факторы патогенности и вирулентности
В прошлом представители рода Acinetobacter spp. считались микроорганизмами с низкой вирулентностью или авирулентными. Возникновение молниеносной внебольничной пневмонии, вызванной Acinetobacter spp., указывает на то, что эти бактерии могут иногда быть высоковирулентными и вызвать тяжелые заболевания. Исследования по факторам вирулентности Acinetobacter spp. все еще находятся на начальной стадии. Неспецифические факторы, такие как фимбрии, были описаны у Acinetobacter spp., и известно, что в условиях дефицита железа бактериальный рост может сопровождаться производством рецепторов катехин сидерофоров, которые, в свою очередь, способствуют росту бактерий и экспрессируют факторы вирулентности. Acinetobacter spp. имеет липополисахарид, как и другие грамотрицательные бактерии, который ответственен за высокую токсичность для мышей, приводящей к смерти, и положительный лизат-тест (обнаружение эндотоксина) при ацинетобактерной септицемии. Липополисахариды действуют синхронно с капсульным экзополисахаридом. Капсульный полисахарид, как известно, дополнительно блокирует доступ к микробной клеточной стенке и предотвращает срабатывание альтернативного пути активации комплемента. Экзополисахарид, продуцируемый бактериями, является основным фактором вирулентности и, как полагают, защищает бактерии от протективных антител организма. Экзополисахарид цитотоксичен для фагоцитов и приводит к летальности мышей. Примерно 30 % штаммов Acinetobacter spp. производят экзополисахарид. Этот процесс был изучен для штамма Acinetobacter spp. BD4, который в толстой капсуле имеет экзополисахарид, состоящий из рамнозы, маннозы, глюкозы и глюкуроновой кислоты. В экспериментальных исследованиях была доказана более высокая вирулентность экзополисахарид-продуцирующих штаммов Acinetobacter spp., чем у неэкзополисахарид-продуцирующих штаммов, особенно при полимикробной инфекции. С учетом того, что Acinetobacter spp. часто мультирезистентны к антибиотикам, выявление факторов, влияющих на вирулентность, может решить проблему разделения выделенных штаммов на потенциально высоко- и низковирулентные. Антибактериальной терапии можно было бы избежать для штаммов с потенциально низкой вирулентностью, тогда как выявление высоковирулентных штаммов, колонизирующих дыхательные пути, должно привести к усилению профилактических мер и раннего лечения антибиотиками для пациентов с высоким риском. Всегда поощряется тщательное мытье рук с мылом и водой, использование гелей на спиртовой основе [6].
Эпидемиология и патогенез
Микроорганизмы рода Acinetobacter spp. распространены повсеместно. Они являются нормальными обитателями кожных покровов у 25 % здоровых людей. В случае возможного участия Acinetobacter spp. при бактериемии, которая развивается во время использования у больного внутривенных катетеров, основными входными воротами инфекции считаются кожные покровы. Возросшая частота вызванной Acinetobacter spp. пневмонии, как первичной, так и развившейся в результате суперинфекции, также свидетельствует в пользу того, что дыхательные пути могут служить важными воротами инфекции. По всей вероятности, эти микроорганизмы являются обычными комменсалами, обладающими относительно низкой вирулентностью, которая гораздо чаще обусловливает бактерионосительство, чем вызывает развитие инфекции. Создается впечатление, что болезни, вызываемые Acinetobacter spp., развиваются у лиц, неожиданно встречающихся с внутрибольничной грамотрицательной инфекцией. Частота возникновения ацинетобактерной инфекции возрастает. В Великобритании количество бактериемий, обусловленных Acinetobacter spp., с 2002 по 2003 г. увеличилось на 6 % и составило 1087 случаев. Серьезной проблемой для этой страны является значительное повышение частоты бактериемий, вызванных мультирезистентными штаммами Acinetobacter spp., — более чем на 300 % с 2002 по 2003 г. (7 и 22 случая соответственно). В ОИТ США уровень Acinetobacter-пневмоний повысился с 4 % в 1986 г. до 7 % в 2003 г. [12].
Эпидемиологические данные свидетельствуют, что биопленки Acinetobacter spp. на слизистых оболочках играют определенную роль в таких инфекционных заболеваниях, как пародонтит, инфекции кровотока и инфекции мочевыводящих путей, из-за способности бактерий колонизировать постоянное медицинское оборудование (например, катетеры).
В некоторых регионах проблема нозокомиальной ацинетобактерной инфекции выходит на основные позиции. Так, в Израиле, по данным сайта antibiotic.ru, в последнее десятилетие Acinetobacter spp. стал ведущей причиной вентилятор-ассоциированной пневмонии и бактериемии. Распространение данного возбудителя происходило быстрыми темпами. Еще 7–8 лет назад в Израиле не было случаев инфекций, вызванных Acinetobacter spp., а сегодня только в Тель-Авиве ежегодно регистрируют около 500 случаев, 50 из которых заканчиваются летальным исходом. В результате ретроспективного когортного исследования, включавшего 236 пациентов, установлено, что инфекции, вызванные полирезистентными штаммами А.baumannii, сопровождались менее благоприятным исходом. В группе пациентов, у которых выделялись полирезистентные штаммы, летальность составляла 36 %, тогда как при инфицировании неполирезистентным штаммом — 21 %. Ацинетобактерии очень трудно поддаются идентификации. В то время как меры по эрадикации MRSA и Clostridium difficile в медицинских учреждениях Тель-Авива были успешными, справиться с Acinetobacter spp. не удалось. С начала войны в Ираке более 700 американских солдат были инфицированы А.baumannii. Четыре гражданских лица, проходящих лечение в медицинском центре армии в Вашингтоне, округ Колумбия, инфицировались A.baumannii и умерли. В другом региональном медицинском центре, военном госпитале США в Германии, 63-летняя немка, работающая по контракту, заразилась тем же штаммом А.baumannii на военном объекте и также умерла. На основании генотипирования А.baumannii, культивируемых от пациентов до начала войны в Ираке, можно предположить, что, скорее всего, эти солдаты заразились во время госпитализации и лечении в Европе. Э. Харрис (США) в своем докладе заявил, что сегодня крайне необходимо вести поиск мер профилактики и новых препаратов для лечения. Необходимы новые антибиотики, активные в отношении грамотрицательных возбудителей, хотя в настоящее время подобные препараты не разрабатываются [13].
Диагностика
Диагностика инфекции, вызванной Acinetobacter, может быть затруднена тем, что персонал лабораторий клинической бактериологии мало осведомлен об этих микроорганизмах, что приводит к неправильной интерпретации результатов исследования. Путаница, наблюдающаяся при таксономической классификации этих микроорганизмов, также не облегчает задачу. В практической медицине выделение представителей Acinetobacter spp. из крови, спинномозговой жидкости, мокроты, мочи или гноя должно расцениваться как имеющее клиническое значение, если нет доказательств одновременного наличия какого-либо другого возбудителя. Обязательной является дифференциация Acinetobacter и Neisseria, так как первые устойчивы к пенициллину, а вторые — чувствительны.
Различные виды бактерий в этом роду могут быть идентифицированы с помощью флуоресценции денитрификации лактозы-ФДЛ (Fluorescence-Lactose-Denitrification — FLN) по количеству образующейся кислоты при метаболизме глюкозы. Другой надежный идентификационный тест на уровне рода является хромосомный ДНК-преобразующий анализ (chromosomal DNA transformation assay — CTA). В этом анализе природный триптофан, ауксотрофномодифицированная часть Acinetobacter Lyi (BD4 trpE27), преобразуется с общей ДНК предполагаемого изолированного штамма ацинетобактерии, и преобразованная смесь помещается в агар с добавлением экстракта сердца, мозговой ткани (brain heart infusion agar — BHI). Растет в течение 24 ч при 30 ° С, затем после инкубации культуру собирают и переносят для выращивания на минимальный агар для Acinetobacter (Acinetobacter minimal agar — АММ) и инкубируют при 30 °С в течение 108 ч. Рост на минимальной агаризованной среде указывает на положительный анализ трансформации и подтверждает изолят в качестве члена рода Acinetobacter. Кишечную палочку E.coli HB101 и A.calcoaceticus MTCC1921T можно использовать в качестве отрицательного и положительного контролей соответственно.
Мы предлагаем краткую схему идентификации представителей рода Acinetobacter spp. для практических бактериологов, работающих в больничных учреждениях (табл. 1).
Выводы
1. В клинической практике все большее значение приобретают представители рода Acinetobacter spp., такие как A.baumannii и A.lwoffii.
2. Чаще инфицируются люди, находящиеся на длительном лечении в хирургических стационарах, отделениях реанимации и интенсивной терапии, ожоговых отделениях; представители этого рода способны вызывать вспышки заболеваний во время стихийных бедствий.
3. Заболевание чаще развивается у лиц с ослабленным иммунитетом, снижением резистентности организма.
4. Предлагается схема идентификации Acinetobacter spp. для практического врача-бактериолога, которая поможет установить наличие этих бактерий в клиническом материале.
1. Перцева Т.А. Клинически значимые возбудители инфекций дыхательных путей. Конспект врача–клинициста и микробиолога. Часть 4 «Проблемные» грамнегативные микроорганизмы: синегнойная палочка и ацинетобактер / Т.А. Перцева, Р.А. Бонцевич // Клиническая иммунология. Аллергология. Инфектология. — 2007. — № 7. — С. 32–35.
2. Коротяев А.И. Энтеробактерии // Медицинская микробиология, иммунология и вирусология / А.И. Коротяев, С.А. Бабичев. — СПб.: Специальная литература, 2008. — С. 347–348.
3. Environmental biodiversity, human microbiota, and allergy are interrelated / I. Hanski., L. von Hertzen, N. Fyhrquist [et al.] // Proc. Natl Acad. Sci. USA. — 2012. — Vol. 109. — № 21. — P. 8334–8339.
4. The allergy–protective properties of Acinetobacter lwoffii F78 are imparted by its lipopolysaccharide / J. Debarry, A. Hanuszkiewicz, K. Stein [et al.] // Allergy. — 2010. — Vol. 65, № 6. — P. 690–697.
5. Visca P. Acinetobacter infection — an emerging threat to human health / P. Visca, H. Seifert, K.J. Towner // IUBMB Life. — 2011. — Vol. 63, № 12. — P. 1048–1054.
6. Joly-Guillou M.L. Clinical impact and pathogenicity of Acinetobacter / M.L. Joly-Guillou // Clin. Microbiol. Infect. — 2005. — Vol. 11, № 11. — P. 868–873.
7. Characterization of plant growth promoting traits of Acinetobacter species isolated from rhizosphere of Pennisetum glaucum / F. Rokhbakhsh-Zamin, D. Sachdev, N. Kazemi–Pour [et al.] // J. Microbiol. Biotechnol. — 2011. — Vol. 21, № 6. — P. 556–566.
8. Gene-Silencing Antisense Oligomers Inhibit Acinetobacter Growth In Vitro and In Vivo / B.L. Geller, K. Marshall-Batty, F.J. Schnell [et al.] // J. Infect. Dis. — 2013. — Vol. 208, № 10. — P. 1553–1560.
9. Physiological characterization of natural transformation in Acinetobacter calcoaceticus / R. Palmen, B. Vosman, P. Buijsman [et al.] // J. Gen. Microbiol. — 1993. — Vol. 139, № 2. — P. 295–305.
11. Rahal J. Novel antibiotic combinations against infections with almost completely resistant Pseudomonas aeruginosa and Acinetobacter species / J. Rahal // Clin. Infect. Dis. — 2006. — Vol. 43, Suppl. 2. — P. 95–99.

/125/125.jpg)