алюминий сернокислый что это такое
Сульфат алюминия
Сульфат алюминия растворим в воде и, в основном, используется в качестве флокулянта для очистки питьевой и технической воды станциями очистки сточных вод, а также в производстве бумаги.
Сульфат алюминия иногда упоминается как серная кислота, квасцы алюмоаммиачные или пищевая добавка Е 523. Безводная форма встречается в природе как редкий минерал Миллозевичит, содержащийся в вулканических средах, а также получается при сжигании угольных отходов. Сульфат алюминия образует множество различных гидратов, в числе которых кристаллогидрат Al2(SO4)3*16H2O и октадекагидрат Al2(SO4)3*18H2O.
Сульфат алюминия обладает способностью поглощать и удерживать молекулы воды из окружающей атмосферы.
Получение сульфата алюминия технического возможно путем добавления гидроксида алюминия Al(OH)3 в серную кислоту H2SO 4.
Также возможно получение сульфата алюминия из тетрагидроксоалюмината натрия.
Сульфат алюминия – это белое или почти белое кристаллической формы или в виде порошка соединение без запаха. Он растворим в воде, не летуч и легковоспламеняем. Сульфат алюминия обладает чрезвычайно кислым вкусом.
Применение сульфата алюминия
Раствор сульфата алюминия используется для очистки воды и как краситель в обработке текстиля. В процессе очистки воды раствор сульфата алюминия приводит к коагулированию, нежелательные примеси и загрязненные частицы оседают на дно сосуда и легко отфильтровываются.
При растворении в большом количестве нейтральной или слегка щелочной воды, раствор сульфата алюминия образует студенистый осадок гидроксида алюминия Al(OH)3, который используется при печати и окрашивании тканей, так как является нерастворимым пигментом.
Сульфат алюминия иногда используется для снижения pH почвы сада, что в свою очередь приводит при выращивании некоторых видов цветов (Гортензии) к их повторному цветению.
Сульфат алюминия является активным ингредиентом некоторых антиперспирантов.
В строительстве он используется в качестве гидроизолятора и ускорителя в производстве бетона.
Сульфат алюминия может быть использован в борьбе с моллюсками, насекомыми и слизняками.

В медицине сульфат алюминия входит в состав лекарств, облегчающих боль и дискомфорт, вызванные укусами насекомых. Он помогает разрушить токсичные химические вещества, содержащиеся в укусах, и помогает уменьшить их воздействие на кожу. Эти препараты выпускается в виде спреев, которые наносятся непосредственно на пораженные участки кожи и эффективнее помогают, если будут использованы сразу же после укуса.
Вред сульфата алюминия
Сульфат алюминия вреден при проглатывании или вдыхании. Вдыхание паров сульфата алюминия вызывает кашель и, возможно, одышку.
При контакте с кожей или глазами сульфат алюминия вызывает раздражение, покраснение, зуд и боль. Употребление сульфата алюминия внутрь приводит к сильному раздражению кишечника и желудка, сопровождаемое рвотой, тошнотой и диареей.
Это соединение может вызывать сильные ожоги, если контактирует с открытыми участками кожи.
Первая помощь при отравлении сульфатом алюминия
При попадании сульфата алюминия на кожу или в глаза необходимо промыть пораженный участок водой. В случае вдыхания паров необходимо выйти из токсичной области и медленно отдышаться. Если сульфат алюминия был применен внутрь, необходимо выпить стакан молока, а затем спровоцировать рвоту.
При отравлении сульфатом алюминия ни в коем случае нельзя использовать бикарбонаты, так как такое сочетание в буквальном смысле является взрывным.
Хранение сульфата алюминия
Сульфат алюминия необходимо хранить в прохладном, сухом месте в плотно закрытой таре, не смешивая с другими веществами.
Нашли ошибку в тексте? Выделите ее и нажмите Ctrl + Enter.
Сульфат алюминия: применение
Большая часть поверхностных и треть подземных вод, использующихся предприятиями, требуют очистки от примесей перед подачей в производственный цикл. Отработанная вода перед сбросом также нуждается в обработке. Это многоуровневый процесс. На первом этапе удаляют грубодисперсные примеси. Для этого разработан метод коагуляции, позволяющий связывать лишние частицы путем введения в воду определенных реагентов. Сульфат алюминия – один из них.
Состав сульфата алюминия
Вещество с формулой Al₂(SO₄)₃ – распространенный коагулянт на территории России. Сульфат алюминия выглядит как кристаллы – прозрачные или белого цвета с едва видимым сероватым, розоватым или голубоватым оттенком. Реагент хорошо растворяется в воде в температурном диапазоне 30-40° С и показывает прекрасные результаты при первичной водоочистке.
Область применения сульфата алюминия
Вещество активно потребляют кожевенная, бумажная, текстильная и пищевая промышленность, включая его в производственный цикл. Однако, большая доля приходится на промышленные комплексы, глобальные системы водообеспечения, ТЭЦ и ГЭС, где сульфат алюминия используют для водоподготовки и очистки отработанных вод.
Отвечая на вопрос, вреден ли для здоровья сульфат алюминия, однозначно можно сказать – нет. Препарат не представляет опасности для человека и природы – не ядовит, не образует токсичных соединений. Это одна из причин того, что реагент часто используют в промышленных и бытовых водоочистительных комплексах.
Сульфат алюминия: применение на водоканалах
Водоканалы России – основные потребители крупных объемов сульфата алюминия. Препарат задействуют в качестве коагулирующего компонента для удаления из воды легковесных взвесей механического характера и солей жесткости. Также средство эффективно в отношении ряда бактерий.
Для чего нужен сульфат алюминия на ТЭЦ и ГЭС
После ужесточения норм в отношении очистки сточных вод химические свойства сульфата алюминия сделали его незаменимым там, где нужно очистить воду от солей металлов. В результате обработки увеличиваются скорость прохождения потока через фильтрующий комплекс, а сами фильтры служат дольше.
В условиях ТЭЦ использование коагулянта снижает образование накипи на внутренних элементах нагревательных установок, поэтому снижается количество отключений оборудования с целью профилактической чистки.
Турбины ГЭС также нуждаются в воде с нормированными показателями жесткости. Чем она меньше, тем дольше срок службы агрегатов и ниже вероятность их преждевременного выхода из строя.
Где еще используется сульфат алюминия
На предприятиях химической, металлургической, косметической, фармакологической и прочих отраслей, а также в животноводстве остро стоит проблема нейтрализации стоков и отработанных жидкостей перед сбросом в открытые водоемы. Использование сульфата алюминия для первичной водоочистки дает возможность недорого и эффективно удалять мелкофракционные взвеси, облегчая последующую работу фильтровальных комплексов. В зависимости от потребностей того или иного производства обработанную воду можно либо безопасно «утилизировать», либо повторно включать в один из этапов технологического цикла.
Как работает сульфат алюминия
Сульфат алюминия активирует процесс сжимания двойной оболочки, нейтрализуя электростатический заряд. В результате частицы концентрируются вокруг коагулянта, образуя крупные и достаточно «тяжелые» для оседания фракции.
При этом есть у сульфата алюминия физические свойства, требующие определенных знаний от оператора коагулирующей установки. Так, сразу после внесения потребуется интенсивное перемешивание раствора на протяжении нескольких минут. В это время образуется дисперсия. И от ее однородности зависит сила притяжения между частицами.
Гипотетическая опасность сульфата алюминия может состоять в остаточном содержании коагулянта в очищенной жидкости. Однако в составе жесткой воды присутствуют гидроксид натрия и карбонат кальция, которые связывают алюминий и вместе образуют осадок в виде студенистой массы. Соответственно, данное свойство можно не учитывать.
Если после анализа исходной воды выясняется, что она мягкая, совместно с коагулянтом используют гидрокарбонат кальция либо известковую воду.
Когда сульфат алюминия приносит максимальный эффект
Для понимания, где сульфат алюминия применяется с наибольшей эффективностью, следует исходить из его свойств. Реагент проявляет активность в воде с уровнем рН 4.4-6. Однако на практике пороговое значение рН – 8, хотя при значении этого показателя 7-8 активность будет наименьшей. В ряде случаев, чтобы привести рН к рабочим значениям в воду перед внедрением коагулирующего вещества вносят серную кислоту.
Алюминия сульфат: норма расхода
Расход реагента высчитывают на основании полученных в лаборатории данных о составе воды. Визуально превышение нормы введения коагулянта можно определить по внешнему виду и размеру хлопьев. В норме это флоккулы, по размеру не превышающие булавочную головку. Осадок в виде перистых хлопьев говорит о неверных расчетах. Также нужно учесть:
Достоинство сульфата алюминия – упаковка. Препарат хранится в виде кристаллов, не требует специфических условий, не слеживается. Это позволяет закупать значительные объемы по фиксированной цене. Для приготовления и внесения раствора используются автоматические или ручные дозаторы.
Сульфат алюминия
| Сульфат алюминия | |
|---|---|
 | |
| Традиционные названия | сернокислый алюминий |
| Хим. формула | Al2O12S3 |
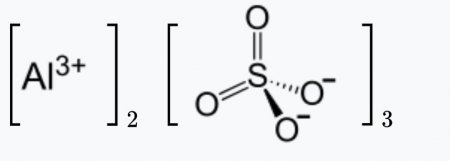
| Рац. формула | Al2(SO4)3 |
| Состояние | твердое |
| Молярная масса | 342,15 г/моль |
| Плотность | |
| Температура | |
| • плавления | 700 °C |
| • кипения | 1600 °C |
| • разложения | 580 °C |
| ГОСТ | ГОСТ 3758-75 |
| Рег. номер CAS | 10043-01-3 |
| PubChem | 24850 |
| Рег. номер EINECS | 233-135-0 |
| SMILES | |
| Кодекс Алиментариус | E520 |
| RTECS | BD1700000 |
| ChEBI | 74768 |
| ChemSpider | 23233 |
| Токсичность | малотоксично |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Сульфат алюминия — сложное неорганическое соединение, соль алюминия и серной кислоты с химической формулой Al2(SO4)3. Выглядит как бесцветные кристаллы, может образовывать кристаллогидраты с различным содержанием воды. Применяется при очистке воды, крашении тканей, дублении кож, как реактив в фотографии, для получения квасцов.
Содержание
Физические свойства
Химические свойства
Сульфат алюминия разлагается при температуре выше 580 °C на γ-модификацию окиси алюминия и серный ангидрид:
Задубливает желатиновые фотослои, что используется в производстве фотографических материалов для повышения механической прочности слоев фотоэмульсии, а в цветной фотографии также для предохранения красителей от гидролитического распада. Механизм дубления обусловлен связыванием ионами алюминия ионизированных карбоксильных групп желатины.
Получение
Сульфат алюминия получают взаимодействием гидроксида алюминия с серной кислотой:
Также сульфат алюминия получают взаимодействием алюминия с серной кислотой:
2 Al + 3 H2SO4 ⟶ Al2(SO4)3 + 3 H2
Применение
Сульфат алюминия применяется как коагулянт для очистки воды хозяйственно-питьевого и промышленного назначения и используется в бумажной, текстильной, кожевенной и других отраслях промышленности.
Используется в качестве пищевой добавки E520.
В фотографии входит в составы стабилизирующих растворов и дубящих фиксажей.
Сульфат алюминия, характеристика, свойства и получение, химические реакции
Сульфат алюминия, характеристика, свойства и получение, химические реакции.
Сульфат алюминия – неорганическое вещество, имеет химическую формулу Al2(SO4)3.
Краткая характеристика сульфата алюминия:
Сульфат алюминия – неорганическое вещество белого цвета.
Химическая формула сульфата алюминия Al2(SO4)3.
Хорошо растворяется в воде, этиленгликоле. Плохо растворим в этаноле.
С водой сульфат алюминия образует кристаллогидраты с различным содержанием воды Al2(SO4)3·nH2O, где n может быть вплоть до 18. Наиболее распространенными являются гексадекагидрат Al2(SO4)3·16H2O и октадекагидрат Al2(SO4)3·18H2O.
Устойчив при обычной температуре.
Сульфат алюминия пожаро- и взрывобезопасен. По степени воздействия на организм продукт относится к веществам 3-го класса опасности в соответствии с ГОСТ 12.1.005.
В земной коре сульфат алюминия находится как в свободном чистом состоянии, в форме кристаллогидратов, а также в составе двойных солей.
Сульфат алюминия в чистом состоянии распространён в природе в виде минерала миллозевичита. В форме кристаллогидратов сульфат алюминия встречается в природе в виде минерала алуногена Al2(SO4)3·17H2O.
Двойные соли сульфат алюминия образует с сульфатами ряда металлов, к которым, к примеру, относится и природный минерал алунит K2SO4·Al2(SO4)3·Al(OH)3.
В пищевой промышленности сульфат алюминия используется в виде добавки Е520.
Физические свойства сульфата алюминия:
| Наименование параметра: | Значение: |
| Химическая формула | Al2(SO4)3 |
| Синонимы и названия иностранном языке | aluminium sulphate (aluminum sulfate (англ.) |
алюминий сернокислый (рус.)
Получение сульфата алюминия:
В промышленности сульфат алюминия получается взаимодействием гидроксида алюминия с серной кислотой.
В лаборатории сульфат алюминия получают в результате следующих химических реакций:
Химические свойства сульфата алюминия. Химические реакции сульфата алюминия:
1. реакция взаимодействия сульфата алюминия и гидроксида натрия :
В результате реакции образуются гидроксид алюминия и сульфат натрия.
2. реакция взаимодействия сульфата алюминия и гидроксида калия :
В результате реакции образуются гидроксид алюминия и сульфат калия.
3. реакция взаимодействия сульфата алюминия и гидроксида лития :
В результате реакции образуются гидроксид алюминия и сульфат лития.
4. реакция взаимодействия сульфата алюминия и нитрата бария:
5. реакция взаимодействия сульфата алюминия и нитрата свинца:
В результате реакции образуются сульфат свинца и нитрат алюминия.
6. реакция взаимодействия сульфата алюминия и фосфата натрия :
В результате реакции образуются фосфат алюминия и сульфат натрия.
7. реакция взаимодействия сульфата алюминия и фосфата калия :
В результате реакции образуются фосфат алюминия и сульфат калия.
8. реакция взаимодействия сульфата алюминия и гидрокарбоната натрия:
Al2(SO4)3 + 6NaHCO3 → 3Na2SO4 + 2Al(OH)3 + 6CO2.
В результате реакции образуются сульфат натрия, гидроксид алюминия и оксид углерода (IV).
9. реакция взаимодействия сульфата алюминия и гидрокарбоната кальция:
В результате реакции образуются сульфат кальция, гидроксид алюминия и оксид углерода (IV). Данная реакция используется для очистки воды. Гидроксид алюминия выпадает в осадок и его хлопья увлекают за собой различные примеси.
10. реакция взаимодействия сульфата алюминия и карбоната натрия и воды:
11. реакция термического разложения сульфата алюминия:
12. реакция термического разложения октадекагидрата сульфата алюминия:
Октодекагидрат сульфата алюминия разлагается на сульфат алюминия и воду.
Применение и использование сульфата алюминия:
Сульфат алюминия используется во множестве отраслей промышленности и для бытовых нужд:
– как коагулянт для очистки воды хозяйственно-питьевого и промышленного назначения;
– в фотографии входит в составы стабилизирующих растворов и дубящих фиксажей;
– как пищевая добавка Е520;
– в качестве морилки при крашении и печати текстильных изделий;
– в бумажной, текстильной, кожевенной и других отраслях промышленности.
Сульфат алюминия
| Сульфат алюминия | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Сульфат алюминия |
| Химическая формула | Al2(SO4)3 |
| Физические свойства | |
| Молярная масса | 342,15 г/моль |
| Плотность | 1,62—2,672 г/см³ |
| Термические свойства | |
| Температура плавления | 770 °C |
| Классификация | |
| Рег. номер CAS | 10043-01-3 |
| Регистрационный номер EC | 233-135-0 |
Содержание
Описание
Сульфат алюминия — это соль белого цвета с серым, голубым или розовым оттенком, при обычных условиях существует в виде кристаллогидрата Al2(SO4)3·18H2O — бесцветных кристаллов. При нагревании теряет воду не плавясь, при прокаливании распадается на Al2O3 и SO3. Хорошо растворяется в воде. Технический сульфат алюминия можно получить, обрабатывая серной кислотой боксит или глину, а чистый продукт, — растворяя Al(OH)3 в горячей концентрированной H2SO4.
Сульфат алюминия применяется для очистки воды хозяйственно-питьевого и промышленного назначения и для использования в бумажной, текстильной, кожевенной и других отраслях промышленности.
Используется в качестве пищевой добавки E-520. [1]
Химические свойства
Сульфат алюминия разлагается при температурах от 770 до 860 °C:
Получение
Сульфат алюминия получают взаимодействием гидроксида алюминия с серной кислотой:
Также сульфат алюминия получают при соединении алюминия с серной кислотой:















