амилаза 180 что делать
Когда желудку и кишечнику не хватает ферментов
Основным инструментом пищеварения являются ферменты, именно они выполняют всю основную работу. Логично, что при их недостатке процесс пищеварения нарушается, и организм начинает нам сообщать о проблемах, сигнализируя различными симптомами. Такие привычные всем симптомы как изжога, тяжесть в животе, боль, метеоризм, диарея или запор – являются прямым указанием на проблемы с пищеварением.
Ферменты поджелудочной железы – виды и функции
Пора узнать, что представляют собой ферменты, и как они влияют на пищеварение. Ферменты поджелудочной железы – это белковые комплексы или катализаторы, основной задачей которых является расщепление питательных веществ на простые, легкоусвояемые соединения. Таким образом, организм легко усваивает все необходимые элементы и витамины.
Какие ферменты вырабатывает поджелудочная железа и какие у них функции?
Особо интересно то, что организм может регулировать выработку тех или иных ферментов в зависимости от характера потребляемой пищи. То есть, если вы потребляете много хлебобулочных изделий, то упор в выработке будет сделан на амилазе, если потребляется жирная пища, то поджелудочная железа отправит в кишечник больше липазы.
Кажется, что работа полностью налажена, и сбоев быть не может. Но сбои случаются и достаточно часто: слишком тонкий механизм работы, который легко нарушить. Даже большой приём пищи с преобладанием жиров может сломать систему, и поджелудочная железа не сможет обеспечить нужное количество ферментов.
Появление проблем с пищеварением
Мы выяснили, что проблемы с пищеварением могут возникать из-за недостатка ферментов. Существует два основных механизма, при которых организму не хватает ферментов поджелудочной железы. В первом варианте проблема с выработкой ферментов кроется в самой поджелудочной железе, т.е. сам орган функционирует неправильно.
Во втором варианте нарушаются условия, при которых ферменты могут правильно работать. Подобное возможно в результате изменения кислотности среды кишечника, например, при воспалении или при изменении стандартной температуры окружения (36-37° С). Воспалительный процесс в кишечнике может возникать при различных состояниях: кишечные инфекции, аллергические реакции (пищевая аллергия, атопический дерматит).
Основные признаки нехватки ферментов поджелудочной железы
Выявить недостаток ферментов достаточно просто. Ключевыми симптомами являются тяжесть после еды, чувство распирания в животе и дискомфорт в животе. Нередко эти симптомы сопровождаются вздутием, урчанием, метеоризмом, диареей. Чаще всего такие симптомы могут возникать в рядовых ситуациях: при употреблении тяжелой, жирной пищи или при переедании, когда удержаться от множества вкусных блюд попросту не удалось. В этом случае не стоит бояться неполадок с поджелудочной железой или других заболеваний ЖКТ. Поджелудочная железа просто не справляется с большим объемом работы, и ей может потребоваться помощь.
Если нехватка ферментов и проблемы с пищеварением сохраняются длительное время, то это не остается незаметным для организма. Симптомы могут усугубляться и носить уже не эпизодический, а регулярный характер. Постоянная диарея дает старт авитаминозу, могут развиваться: белково-энергетическая недостаточность и обезвоживание во всем организме. Может наблюдаться значительное снижение массы тела. Помимо этого при тяжелых стадиях могут наблюдаться следующие симптомы недостатка ферментов поджелудочной железы 8 :
Поддержание пищеварения и лечение ферментной недостаточности
При проблемах с пищеварением могут помочь ферментные препараты (чаще они называются препаратами для улучшения пищеварения), основная задача которых компенсировать нехватку собственных ферментов в организме. Не зря такая терапия называется «ферментозаместительная». Критически важно, чтобы ферментный препарат максимально точно «имитировал» физиологический процесс.
На сегодняшний момент существуют различные препараты для улучшения пищеварения. Как же ориентироваться в многообразии средств и сделать правильный выбор?
Эффективный ферментный препарат должен соответствовать следующим критериям 5,6 :
Амилаза 180 что делать
К.А. Никольская (1), Д.С. Бордин (1, 2), Л.В. Винокурова (1), М.В. Малых (1), Е.А. Дубцова (1)
1) Московский клинический научный центр им. А.С. Логинова ДЗМ, Москва, Россия; 2) Тверской государственный медицинский университет, Тверь, Россия
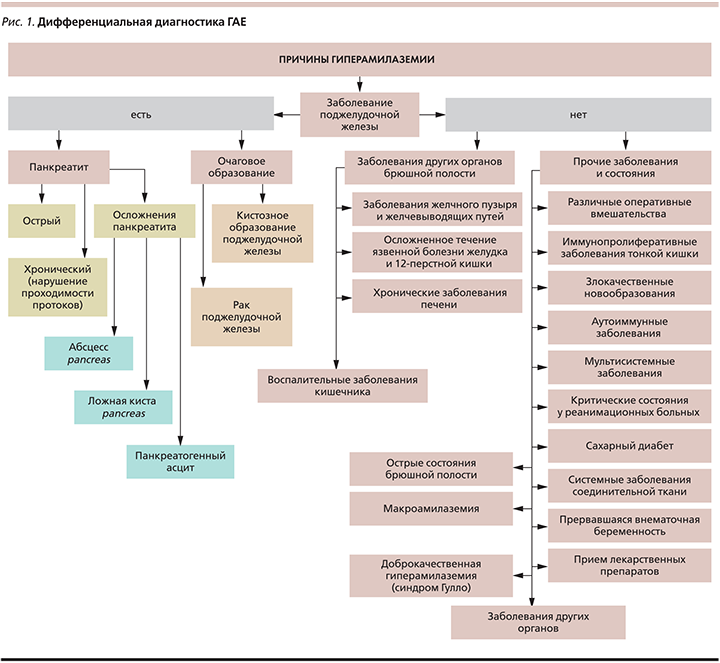
Дифференциальная диагностика заболеваний, приводящих к гиперамилаземии, обширна и разнообразна, и первое заболевание, которое необходимо исключить, – это панкреатит. Чаще всего острый панкреатит и/или обострение хронического панкреатита приводят к гиперамилаземии, которая сопровождается гиперамилазурией (повышением уровня диастазы мочи) и целым симптомокомплексом, главенствующую роль в котором играет боль. Именно поэтому многие врачи при сочетании болей в животе и гиперамилаземии чаще всего ставят диагноз «панкреатит». Всегда ли этот диагноз правомерен? Представленный клинический случай гиперамилаземии у больной целиакией демонстрирует вариабельность заболеваний, сопровождающихся гиперамилаземией, и показывает, насколько важно вовремя и точно установить ее причину.
Для цитирования: Никольская К.А., Бордин Д.С., Винокурова Л.В., Малых М.В., Дубцова Е.А. Гиперамилаземия – всегда ли это панкреатит? Фарматека. 2019;26(2):130–35. DOI: https://dx.doi.org/10.18565/pharmateca.2019.2.130-135
Чаще всего гиперамилаземия (ГАЕ) служит маркером заболеваний поджелудочной железы (ПЖ) – острого панкреатита (ОП), хронического панкреатита (ХП), рака ПЖ. Однако в 8% случаев ГАЕ сочетается с нормальным содержанием амилазы в моче и не сопровождается другими симптомами [1].
Нередко появление ГАЕ врачи расценивают как проявление панкреатита, не обращая внимания на отсутствие каких-либо других проявлений этого заболевания. В настоящее время исследование уровня амилазы в крови входит в рутинный скрининг биохимических анализов, в связи с чем бессимптомная ГАЕ выявляется все чаще, причем стандартные диагностические методы (сбор анамнеза, физикальное обследование, трансабдоминальное ультразвуковое исследование (УЗИ) органов брюшной полости) не всегда выявляют какую-либо патологию, объясняющую лабораторные отклонения. Общепринятого алгоритма диагностического поиска в таких случаях на сегодняшний день не существует [2].
Чтобы не ошибиться в диагнозе при наличии гиперамилаземии, важно помнить, что не всегда ее причиной служат заболевания ПЖ [3–5]. Если при проведении банального УЗИ органов брюшной полости есть изменения, характерные для панкреатита, то необходимо провести более тщательное обследование пациента с применением таких инструментальных исследований, как мультиспиральная компьютерная томография с внутривенным контрастированием, магнитно-резонансная томография и как уточняющий метод – эндоскопическая ультрасонография. Кроме ОП и обострения ХП к ГАЕ могут приводить новообразования ПЖ [6] и ее травмы, а также различные осложнения панкреатита, такие как псевдокисты ПЖ.
В 1964 г. P. Wilding, et al. [7] описали пациента с длительной ГАЕ без клинических проявлений панкреатита. Наличие повышения уровня фермента было объяснено его связыванием с сывороточным глобулином. Через 3 года Р. Berk, et al. [8] описали еще троих пациентов с подобными проявлениями, также без панкреатита, и предложили термин «макроамилаземия» (МАЕ) для обозначения отдельной формы ГАЕ.
По мнению данных авторов, МАЕ возникает вследствие образования и циркуляции в крови комплексов нормальной сывороточной амилазы с белками или углеводами [9]. Данные комплексы имеют большую молекулярную массу, вследствие чего плохо фильтруются почками. Вес молекулы макроамилазы может составлять от 150 тыс. до 2 млн Д, тогда как молекулярный вес обычной молекулы амилазы человека составляет 50–55 тыс. Д [10]. Крупные молекулы задерживаются в кровотоке, что подтверждается высоким уровнем амилазы в крови и низким уровнем амилазы в моче [11, 12]. МАЕ встречается у 0,1% всей популяции [13] и описана у 2,9% госпитализированных пациентов [14–16]. Таким образом, МАЕ может быть причиной ГАЕ неуточненной этиологии [17]. По данным многоцентровых исследований, у 6–9,6% пациентов с ГАЕ, выявленной при рутинном обследовании, диагностируется МАЕ [18, 19].
При таких ситуациях клинические проявления могут отсутствовать, а пациенты длительно безрезультативно обследуются с проведением высокотехнологичных, нередко инвазивных методик. При сочетании МАЕ с болями в животе пациентам могут выполнять диагностические оперативные вмешательства [20].
В исследовании Н.Б. Губергриц и соавт. (2007) [12] показано, что МАЕ встречается у 11% больных ХП. У 3–5% пациентов с повышенным уровнем сывороточной амилазы имела место МАЕ. Сочетание ГАЕ и соотношения клиренсов амилазы и креатинина 2 SD выше контрольного). Средние уровни общей амилазы и макроамилазы были значительно повышены в обеих группах больных целиакией. Уровни неосажденной амилазы (фракция амилазы ПЖ и слюны) не отличались от таковых в контрольной группе. У 3 (3,4%) здоровых лиц, 21 (16,8%) пациента с нелеченой целиакией и 7 (7%) пациентов на АГД была значительно повышена активность макроамилазы [31].
В исследовании 2006 г., проведенном в Италии (Палермо) с участием 90 взрослых пациентов и 112 детей с целиакией, были оценены показатели изоамилазы ПЖ и липазы в сыворотке крови до начала АГД и спустя 12 месяцев на фоне ее соблюдения. В подгруппе взрослых были проанализированы уровни эластазы сыворотки и трипсина. Кроме того, выполнено УЗИ поджелудочной железы. Установлено, что на момент постановки диагноза целиакии у 26 (29%) взрослых и 29 (26%) детей выявлено повышение уровня амилазы и/или липазы; уровень трипсина был повышен в 69% случаев, эластазы – в 19%. Частота повышения уровней ферментов ПЖ была сходной для пациентов с «типичными» и «атипичными» симптомами целиакии, а также в случаях ее бессимптомного течения. В основном выявлялось повышение уровня ферментов до двух нормальных значений. Данные изменения не были связаны с употреблением алкоголя, наркотических препаратов, а также с наличием болевого синдрома и сахарного диабета. УЗИ органов брюшной полости показало отсутствие патологических изменений со стороны ПЖ во всех случаях. Через 12 месяцев соблюдения АГД повышение уровня амилазы ПЖ выявлено в 3 случаях, а липазы – в 2; следует отметить, что эти пациенты не в полной мере придерживались АГД [32].
Таким образом, ГАЕ может сопровождаться не только ОП и ХП, но и ряд других состояний (рис. 1).
Клинический случай
Больная С. 55 лет в августе 2018 г. была госпитализирована в отделение патологии поджелудочной железы и желчевыводящих путей МКНЦ им. А.С. Логинова с диагнозом ХП.
При поступлении пациентка предъявляла жалобы на периодически возникающий дискомфорт в правом подреберье, сухость во рту, вздутие и урчание в животе, склонность к задержке стула.
Анамнез заболевания
Из анамнеза известно, что в 1981 г. больной был поставлен диагноз «первичное бесплодие». Однако в 1990 г. она родила в срок здорового ребенка. Беременность протекала с анемией (гемоглобин – 90 г/л на фоне приема препаратов железа). В 2016 г. пациентка отметила появление дискомфорта в животе и обратилась в поликлинику по месту жительства, где при обследовании выявлена ГАЕ до 3–4 норм. При УЗИ – умеренные диффузные изменения ПЖ, при эзофагогастродуоденоскопии (ЭГДС) – хронический гастрит. На основании полученных данных был установлен диагноз «хронический панкреатит, обострение». Пациентке предложено стационарное лечение, от которого она отказалась. В течение последующих 2 лет проводилась терапия полиферментными препаратами в минимикросферах в суточной дозе 125 тыс. ЕД липазы, спазмолитиками, 1 раз в 3–4 месяца проводился контроль уровня амилазы крови, увеличение которого 3–4 раза выше нормального сохранялось. Кроме того, за последние полтора года вес пациентки снизился на 8 кг.
Данные физикального обследования
Общее состояние удовлетворительное. Кожные покровы и видимые слизистые оболочки обычной окраски и влажности, тургор кожи снижен, пониженного питания (индекс массы тела 18,3 кг/м2). В легких дыхание везикулярное, хрипов нет, частота дыханий 16 в минуту. Частота сердечных сокращений 68 в минуту. Артериальное давление – 130/90 мм рт. ст. Живот не вздут, при пальпации мягкий, безболезненный. Печень у края реберной дуги. Селезенка не пальпируется.
Диагностика
По данным лабораторных исследований, отмечено повышение уровня амилазы крови до 411 ЕД/л (норма до 100 ЕД/л) с сохранением нормального уровня амилазы мочи, незначительно выраженный цитолиз и снижение уровня сывороточного железа до 4,7 мкмоль/л (табл. 1).
Остальные показатели клинического и биохимического анализов крови в пределах референсных значений.
УЗИ. Размеры печени не увеличены – косой внутренний размер правой доли 133 мм (норма до 150 мм), толщина левой доли 58 мм (норма до 60 мм), контур ровный. Эхоструктура паренхимы печени неоднородная, эхогенность незначительно повышена, сосудистый рисунок не изменен.
Воротная вена не расширена – 11 мм, просвет однороден. Объемных образований не выявлено. Внутрипеченочные желчные протоки не расширены. Общий желчный проток 4 мм в диаметре, на доступном осмотру участке его просвет однороден. Желчный пузырь с перетяжками в теле и дне, в размерах не увеличен – 98×18 мм, стенки не утолщены. Содержимое пузыря однородное, конкременты не определяюттся. Паравезикальная область не изменена.
ПЖ обычной формы, контуры четкие, ровные. Размеры: головка 27 мм (норма до 30 мм), тело 14 мм (норма до 20 мм), хвост 23 мм (норма до 35 мм). Эхоструктура ткани ПЖ неоднородная, эхогенность незначительно повышена. Главный панкреатический проток не расширен.
Селезенка не увеличена – 83×32 мм, контур ровный, ткань однородная. Селезеночная вена не расширена.
В желудке неоднородное жидкостное содержимое. Свободной жидкости в брюшной полости не выявлено.
Заключение: ультразвуковые признаки незначительных диффузных изменений печени, ПЖы, деформации желчного пузыря.
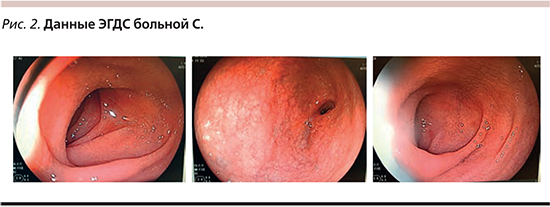
ЭГДС. Слизистая оболочка бульбодуоденального перехода отечная, имеет «мозаичный» рисунок, далее в вертикальной части 12-перстной кишки слизистая оболочка истончена, складки не визуализируются, в нисходящей части 12-перстной кишки слизистая оболочка отечная, складки местами сглажены, перистальтика активная (рис. 2).
Заключение: дуоденит – эндоскопическая картина наиболее соответствует целиакии.
Пациентке была выполнена биопсия залуковичного отдела 12-перстной кишки. В биоптате фрагменты слизистой оболочки тонкой кишки. Кишечные ворсины сглажены. Поверхность слизистой оболочки, сохранившаяся на небольшом протяжении, выстлана клетками эпителия кубической формы. Количество бокаловидных клеток снижено. Число межэпителиальных лимфоцитов увеличено (до 35 на 100 эпителиоцитов). Глубина крипт увеличена. Соотношение ворсина/крипта не превышает 1:1, часть – разрушены и деэпителизированы с поверхностными эрозиями. Строма сильно инфильтрирована лимфоцитами, плазмоцитами с примесью нейтрофилов и эозинофилов. Собственная пластинка отечна и умеренно инфильтрирована лимфоцитами и плазмоцитами. Умеренная гиперплазия бруннеровых желез.
Заключение: морфологическая картина более соответствует глютеновой энтеропатии, MARSH IIIа. Хронический активный эрозивный дуоденит.
Также было выполнено иммунологическое исследование, которое обнаружило повышение титра антител к тканевой трансглутаминазе IgA в 10 раз, к деамидированным пептидам глиадина IgG – более чем в 6 раз, к деамидированным пептидам глиадина IgA – в 8 раз (табл. 2).
Заключительный диагноз
На основании вышепредставленных данных пациентке был выставлен заключительный клинический диагноз «целиакия, латентная форма» и назначена АГД.
Через 3 месяца уровень амилазы крови у пациентки нормализовался, прибавка в весе составила 8 кг.
Заключение
Особенностью представленного клинического случая явилась гипердиагностика ХП. Диагноз был установлен только на основании повышения уровня амилазы крови без каких-либо клинических проявлений и инструментального подтверждения. В течение двух лет больная безуспешно лечилась полиферментными препаратами: ГАЕ сохранялась и продолжалось снижение массы тела. После установления диагноза «целиакия, латентная форма» и назначения АГТ уровень амилазы крови нормализовался и восстановилась масса тела.
Подобные наблюдения представили А. Carroccio, et al. [32], также отметившие нормализацию уровня амилазы крови на фоне соблюдения АГД у больных целиакией.
Литература
1. Тихонова Т.А. Гиперамилаземия – угрожающий симптом или безопасная находка? Бюллетень медицинских интернет-конференций. 2016;6(6).
2. Красновский А.Л., Григорьев С.П., Золкина И.В. и др. Бессимптомная панкреатическая гиперферментемия. Российский медицинский журнал. 2014;5:52–56.
3. Logie J.J., Cox M., Sharkey J. A multidisciplinary approach to an unusual cause of hyperamylasaemia. BMJ CaseRep. 2015;6:2015209780. Doi: 10.1136/bcr-2015-209780.
4. Shah K.S., Shelat V.G., Jogai S., Trompetas V. Primary gallbladder lymphoma presenting with perforated cholecystitis and hyperamylasaemia. Ann R CollSurg Engl. 2016;98(2):13–5. Doi: 10.1308/rcsann.2016.0001.
5. Sinha S., Khan H., Timms P.M., Olagbaiye O.A. Pancreatic-type hyperamylasemia and hyperlipasemia secondary to ruptured ovarian cyst: a case report and review of the literature. J Emerg Med. 2010;38(4):463–66. Doi: 10.1016/j.jemermed.2008.04.042.
6. Matsuura H., et al. Four cases of macroamylasemia malignant tumor. Bull Hygo Cancer Hosp. 1981;12:59.
7. Wilding P., Cooke W.T., Nicholson G.I. Globulin-bound amylase. Ann. Intern. Med. 1964;64:1053–56.
8. Berk J.E., Kizu H., Wilding P., Searcy R.L. Macroamylasemia: a newly recognized cause for elevated serum amylase activity. N Engl J Med. 1967;277:941–46.
9. Губергриц Н.Б., Лукашевич Г.М., Загоренко Ю.А.Макроамилаземия – безобидное заблуждение или опасное незнание? Российский журнал гастроэнтерологии, гепатологии и колопроктологии. 2007;5:64–70.
10. Levitt M.D. Study of macroamylase complexes. J Lab Clin Med. 1972;80:414–22.
11. Haubrich W.S., Schaffner F., Berk J.E. Macroamylasemia. Bockus gastroenterology.5th ed. Philadelphia: WB Saunders, 1995.P. 2851–60.
12. Губергиц Н.Б., Голубова О.А. Макроамилаземия у больных с хроническим панкреатитом. Вопросы реконструктивной и пластической хирургии. 2014;1(48):75–80.
13. Imrie C.W., King J., Henderson A.R. Macroamylasemiae survey of prevalence in a mixed population. N Engl J Med. 1972;287–931.
14. Barrows D., Berk J.E., Fridhandler L. Macroamylasemiae survey of prevalence in a mixed population. N Engl J Med. 1972;286:1352.
15. Berk J.E., Fridhandler L. The prevalence of macroamylasemia. Further study. Am J Gastroenterol 1974;62:54–8.
16. Boyle C.E.L., Fraser C.G. Macroamylasaemia: how common is it? Br Med J. 1985;291;1389.
17. Gubergrits N., Golubova O., Lukashevich G., Fomenko P. Elevated serum amylase in patients with chronic pancreatitis: Acute attack or macroamylasemia? Pancreatology. 2014;14:114–16. Doi: 10.1016/j.pan.2013.12.004.
19. Warshaw A.L., Hawboldt M.M. Puzzling persistent hyperamylasemia, probably neither pancreatic nor pathologic. Am J Surg. 1988;155:453–56.
20. Губергриц Н.Б., Лукашевич Г.М., Загоренко Ю.А.Макроамилаземия – безобидное заблуждение или опасное незнание? Сучасна гастроентерологія. 2006;6(32):93.
21. Mifflin T.E., Benjamin D.C., Bruns D.E. Rapid quantitative, specific measurement of pancreatic amylase in serum with use of a monoclonal antibody. Clin Chem. 1985;31(8):1283–88.
22. Mifflin T.E., Forsman R.W., Bruns D.E. Interaction of immobilized anti-salivary amylase antibody with human macroamylases: implications for use in a pancreatic amylase assay to distinguish macroamylasemia from acute pancreatitis. Clin Chem. 1989;35:1651–54.
23. LottJ A., Ellison E.C. Amylase assay and diagnosis of pancreatic disease
24. Anunann R.W., Berk J.E., Fridhandler L., et al. Hyperamylasemia with carcinoma of the lung. Ann Intern Med. 1973;78:521–25.
25. Warshaw A.L., Lee K.H. Characteristic alterations of serum isoenzymesofamylase in diseasesofliver, pancreas,salivarygland,lung, and genitals. J Surg Res. 1977;22:362–69.
26. Gao T., Eto K., Nakayama J., et al. Abnormalamylasein a patient with malignant tumor. Med Biol (Tokyo). 1971;82:53–6.
27. Ishizuka T., Yasuda K., Kajita K., et al. Macroamylasemiaassociated with thyroid cancer, elevated serum thyroxine-binding globulin(TBG),chronic pancreatitis, and gastrointestinal polyposis. Gastroenterol Jpn. 1986;21:385–90.
28. Blumstein M., Bank S., Greenberg R.E., et al. Immunoproliferative small intestinal disease in an American patient with lymphoma and macroamylasemia. Gastroenterology. 1992;103(3):1071–74.
29. Katsanos K.Н., Kolios G., Tsianos G.V., Tsianos E.V.Hyperamylasemia in inflammatory bowel disease: report of a case with literature review. Ann Gastroenterol. 2004;17(3):306–12.
30. Katz S., Bank S., Greenberg R.E., et al. Hyperamy lasemia in inflammatory bowel disease. J Clin Gastroenterol. 1988;10(6):627–30.
31. Rabsztyn A., Green P.H.R., Berti I., et al. Macroamylasemia in patients with coeliac disease. Am J Gastroenterol. 2001;96:1096–100.
32. Carroccio A., Di Prima L., Scalici C., et al. Unexplained elevated serum pancreatic enzymes: a reason to suspect celiac disease. Clin Gastroenterol Hepatol. 2006;4(4):455–59.
Амилаза в крови: норма, причины повышенной амилазы
Амилаза — пищеварительный фермент, имеющий немаловажное значение для полноценной жизнедеятельности. Изменение уровня этого вещества нередко указывает на серьезные нарушения, требующие обязательного медицинского вмешательства. Если амилаза сильно повышена, пациент нуждается в тщательном обследовании и прохождении лечебного курса под контролем врача.
Функции амилазы в организме
Амилаза была открыта в XIX столетии. Этот пищеварительный фермент участвует в процессе расщепления углеводов, которые становятся в дальнейшем одним из основных источников энергии для живого организма. Амилаза входит в состав панкреатического сока, наполненного всеми соединениями, необходимыми для переработки органических составляющих пищевой массы.
Синтез фермента осуществляется несколькими органами:
Выработка амилазы начинается после употребления крахмалистой пищи. В число таких продуктов входят картофель, рис, выпечка и другие виды питания. Произведенный организмом фермент поступает в полость рта и просвет 12-перстной кишки, где активно участвует в процессе переваривания.
Амилаза обнаруживается не только в крови, но и в моче. Небольшое количество фермента свидетельствует о беспроблемной работе органов и систем. Превышение допустимого показателя чревато развитием различных патологий (панкреатита, сахарного диабета).
Существуют нормальные показатели уровня амилазы для разных жизненных периодов:
Новорожденные (до 30 дней)
Более 18 лет (взрослые)
Стандартная концентрация амилазы является одинаковой для мужчин и женщин. Умеренное повышение ее уровня не становится поводом для особого беспокойства. О наличии проблем свидетельствует возрастание амилазы в несколько раз.
Причины роста амилазы
Подъем уровня фермента у представителей обоих полов характерен для разнообразных нарушений:
Другие факторы, приводящие к подъему амилазы — непроходимость кишечника, острый аппендицит, послеоперационные осложнения, травмы брюшины, отравления. Спровоцировать такое явление способны некоторые лекарственные средства.
У женщин амилаза может повышаться при внематочной беременности, в результате приема оральных гормональных контрацептивов. Нередко норма нарушается после абортов, на фоне раковых заболеваний репродуктивных органов. В детском возрасте рост концентрации фермента вызывают желудочно-кишечные заболевания, наследственные патологии, связанные с некорректной выработкой пищеварительных ферментов.
Также существуют причины высокой амилазы, которые не рассматриваются в качестве патологических. К ним относят подверженность стрессам, нестабильный эмоциональный фон, алкогольную зависимость, несбалансированный рацион, в котором преобладают жирные, соленые, копченые, консервированные продукты.
Превышение допустимой концентрации амилазы сопровождается характерной симптоматикой:
В некоторых случаях возросший уровень амилазы не приводит к развитию неприятных симптомов или же они остаются слабовыраженными. Несмотря на это, пациент с подобным нарушением обязательно нуждается в качественной диагностике и врачебной консультации.
Диагностика и лечение
При подозрении на высокую концентрацию амилазы необходимо, в первую очередь, обратиться к терапевту или гастроэнтерологу. Специалист ознакомится с имеющимися жалобами, проведет визуальный и физикальный осмотр посетителя. Чтобы точно определить содержание фермента в организме, выполняется биохимический анализ крови. При обнаруженном нарушении пациенту часто назначается комплексное обследование, включающее:
Дополнительно могут потребоваться консультации хирурга, нефролога, гинеколога, онколога.
Необходимость в проведении лечебного курса возникает в тех ситуациях, когда уровень амилазы превышает допустимые показатели вдвое, втрое или больше. Пациентам назначается медикаментозная терапия, основанная на применении:
Подъем уровня амилазы, обусловленный протеканием острого или хронического панкреатита, предусматривает соблюдение больным специальной голодной диеты. При наличии выраженных симптомов пациента госпитализируют, назначают лечебный курс с медикаментами, блокирующими активность ферментов, капельницами с солевыми растворами. В дальнейшем предусмотрена продолжительная диетотерапия, предусматривающая неуклонное соблюдение особого режима питания.
Поддерживать амилазу в норме помогают профилактические мероприятия. Чтобы снизить вероятность повышения этого фермента в организме, рекомендуется свести к минимуму употребление тяжелой пищи, контролировать количество поступающего в организм белка, включить в рацион достаточное количество свежих фруктов, овощей, разнообразных круп, отказаться от вредных привычек. При возникновении проблем со стороны пищеварительной системы необходимо избегать самолечения и своевременно обращаться в медицинское учреждение.