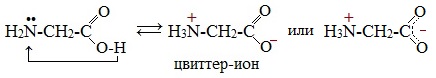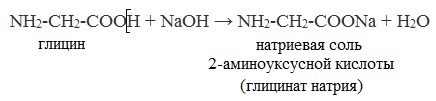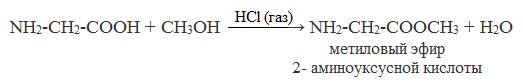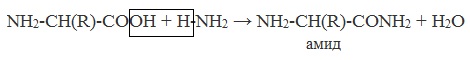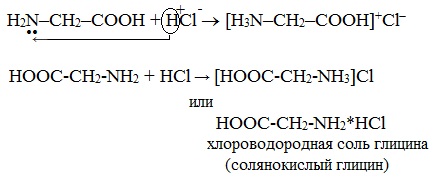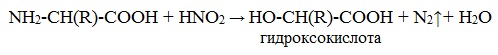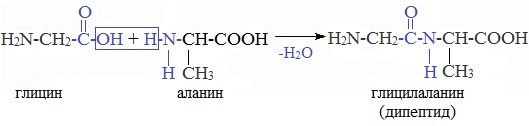аминокислоты амфотерные соединения так как
Конспект лекции по теме «Аминокислоты как амфотерные бифункциональные соединения»
Тема: Аминокислоты как амфотерные бифункциональные
Аминокислоты — это органические соединения, содержащие две функциональные группы — аминогруппу (— NH 2 ) и карбоксилъную группу (- СООН).
Их можно рассматривать как производное карбоновых кислот, в радикале которых атом водорода замещен на аминогруппу рис.
уксусная кислота аминоуксусная кислота
Количество функциональных групп, которые могут входить в состав аминокислот, различно.
Простейшими аминокислотами являются одноосновные моноаминокислоты, состав которых выражают общей формулой
Номенклатура. Названия аминокислот образуют от названий соответствующих карбоновых кислот с добавлением слова «амино-» и указанием места расположения аминогруппы:
по рациональной номенклатуре атом углерода, расположенный рядом (соседний) с карбоксильной группой, обозначают буквой а;
по систематической номенклатуре нумеруют углеродную цепь, начиная с атома углерода карбоксильной группы. Многие аминокислоты имеют тривиальное название. На практике чаще используют тривиальную номенклатуру. Наибольшее значение имеют а-аминокислоты, так как они участвуют в построении белковых молекул.
Состав а-аминокислот можно выразить общей формулой:
Физические свойства. Аминокислоты представляют собой бесцветные кристаллические вещества, хорошо растворимые в воде и малорастворимые в органических растворителях. Многие кислоты имеют сладкий вкус. При температуре 250—300 °С они разлагаются.
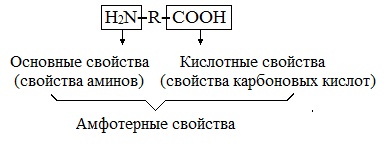
Химические свойства. Аминокислоты содержат в своем составе две функциональные группы противоположного характера. Аминогруппа обуславливает основные свойства аминокислот, а карбоксильная группа — кислотные. Следовательно, по аналогии с неорганическими веществами (гидроксиды алюминия, цинка), аминокислоты — это органические амфотерные соединения.
основные свойства кислотные свойства
(свойства аминов) (свойства карбоновых кислот)
Как кислоты они взаимодействуют с активными металлами, оксидами и гидроксидами металлов, солями слабых летучих кислот, а также со спиртами (реакция этерификации):
Реакции с участием аминогруппы
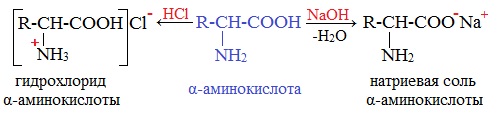
Как основания аминокислоты реагируют с кислотами
гидрохлорид (хлороводородная соль)
Особые свойства аминокислот. Наличие в молекуле аминокислоты двух функциональных групп приводит к появлению новых свойств.
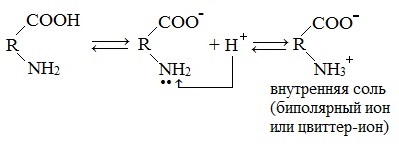
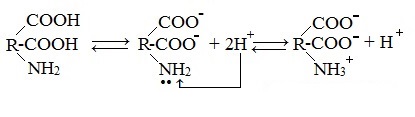
Взаимодействие внутри молекулы. Водные растворы аминокислот могут иметь нейтральную, щелочную или кислую среду в зависимости от того, сколько они содержат амино- и карбоксильных групп. Это объясняется тем, что при растворении в воде карбоксильная группа отщепляет ион водорода, который присоединяется к аминогруппе, т. е. протекает внутримолекулярная нейтрализация (кислота + основание). Это приводит к образованию внутренней соли, молекула которой представляет собой биполярный ион:
внутренняя соль (биполярный ион)
Взаимодействие аминокислот друг с другом (реакции конденсации). Молекулы аминокислот могут реагировать друг с другом. При этом происходит взаимодействие карбоксильной группы одной молекулы и аминогруппы другой молекулы. Реакция конденсации сопровождается отщеплением молекулы воды и образованием пептида. При конденсации двух молекул аминокислоты образуется дипептид:
Пептиды — это органические соединения, состоящие из остатков а-аминокислот, соединенных между собой пептидными (амидными) связями — CO — NH — и имеющие невысокие значения относительных молекулярных масс (до 10000).
Например, природный пептид окситоцин (стимулирует выделение молока молочными железами) имеет относительную молекулярную массу 1007, а инсулин (регулирует содержание сахара в крови) — 5734.
Пептиды являются продуктами частичного гидролиза белков, т. е. это простейшие полипептиды. Они, в кислой или щелочной среде, а также под действием ферментов, подвергаются дальнейшему гидролизу с образованием пептидов с меньшей относительной молекулярной массой или а-аминокислот.
Пептиды, как и белки, играют важную роль в процессах жизнедеятельности. Пептидами являются многие гормоны, некоторые антибиотики и токсины, ферменты. Многие пептиды применяют в медицине и сельском хозяйстве.
Получение аминокислот. Биологически важные (природные) а-аминокислоты получают гидролизом белков.
Значение аминокислот. Биологическое значение а-аминокислот определяется тем, что они являются структурными единицами («кирпичиками»), из которых построены все растительные и животные белки. Поступая вместе с пищей в организм, белки расщепляются на составные а-аминокислоты, которые используются организмом для синтеза белков, свойственных данному организму.
В связи с этим аминокислоты делят на заменимые и незаменимые.
Заменимые — это аминокислоты, которые синтезируются в организме . К ним относятся: глицин, аланин, глутаминовая кислота, серин, аспарагиновая кислота и др.
Незаменимые — это аминокислоты, которые не синтезируются в организме и поступают только с пищей . Это лизин, валин, фенилаланин, триптофан, лейцин и др. Их недостаток в пище приводит к нарушению многих функций организма и может быть причиной прекращения роста организма, истощения, несмотря на достаточную калорийность питания.
Например, белок кукурузы зеин не содержит лизина. В опытах с животными, которые получали с пищей один только этот белок, наблюдалась, несмотря на обильное кормление, потер веса. Отсутствие в пище триптофана может быть причиной тяжелого заболевания глаз — катаракты.
Поэтому эти аминокислоты нужно добавлять в пищу, так как организм может усваивать их в свободном виде. Необходимо добавлять недостающие аминокислоты и в корм животным. Даже малые их дозы позволяют ускорить рост животных и снизит расход кормов.
Аминокислоты находят применение и в пищевой промышленности. Например, глутаминовую кислоту добавляют в консервы и пищевые концентраты для улучшения вкуса.
Напишите уравнение реакции поликонденсации этой кислоты.
Отличие этих полимеров от белков (полипептидов) заключается в том, что здесь цепь образована не а-аминокислотами.
1. Составьте структурные формулы изомерных аминокислот состава C 4 H 9 О 2 N назовите их.
2. Докажите амфотерность а-аминопропионовой кислоты (напишите не мене трех уравнений).
4. Напишите уравнения реакций получения:
а) хлороводородной соли а-аминомасляной кислоты;
б) аминоуксусной кислоты из ацетилена.
5. При взаимодействии четырех молекул аминокислот выделяется молекул воды:
а) три; б) две; в) четыре; г) одна.
6. Определите формулу одноосновной моноаминокарбоновой кислоты, входящей в состав белков, для полной нейтрализации которой потребовался раствор, содержащий 16,2 г бромоводородной кислоты.
7. Для полной нейтрализации смеси уксусной и аминоуксусной кислот требуется 150 мл 2М раствора гидроксида натрия. Исходная смесь может прореагировать с 73 г 10%-ного раствора соляной кислоты. Определите массовые доли (%) веществ в исходной смеси.
Аминокислоты амфотерные соединения так как
Аминокислоты являются амфотерными соединениями, для них характерны кислотно-основные свойства. Это обусловлено наличием в их молекулах функциональных групп кислотного (-СООН) и основного (-NH2) характера.
Кислотно-основное равновесие в водных растворах
В водных растворах и твердом состоянии аминокислоты существуют в виде внутренних солей.
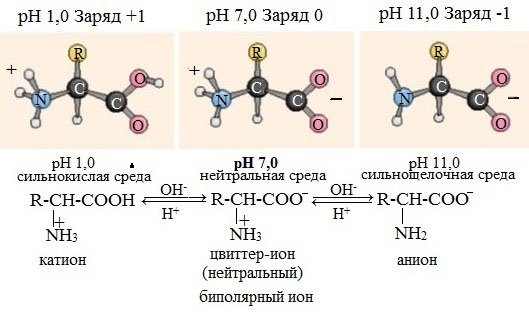
Ионизация молекул аминокислот в водных растворах зависит от кислотного или щелочного характера среды:
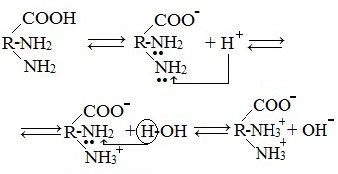
В кислой среде молекулы аминокислот представляю собой катион. В щелочной среде молекулы аминокислот представляют собой анион. В нейтральной среде аминокислоты представляют собой цвиттер-ион или биполярный ион.
Аминокислоты в твердом состоянии всегда существуют в виде биполярного, двухзарядного иона — цвиттер-иона.
Водные растворы аминокислот в кислой и щелочной среде проводят электрический ток.
1. Взаимодействие внутри молекулы – образование внутренних солей (биполярных ионов)
Молекулы аминокислот существуют в виде внутренних солей, которые образуются за счет переноса протона от карбоксила к аминогруппе.
Карбоксильная группа аминокислоты отщепляет ион водорода, который затем присоединяется к аминогруппе той же молекулы по месту неподеленной электронной пары азота. В результате действие функциональных групп нейтрализуется, образуется так называемая внутренняя соль.
Водные растворы аминокислот в зависимости от количества функциональных групп имеют нейтральную, кислую или щелочную среду.
Аминокислоты с одной карбоксильной группой и одной аминогруппой имеют нейтральную реакцию.
Видеоопыт «Свойства аминоуксусной кислоты»
а) моноаминомонокарбоновые кислоты (нейтральные кислоты)
Внутримолекулярная нейтрализация — образуется биполярный цвиттер-ион.
Водные растворы моноаминомонокарбоновых кислот нейтральны (рН≈7).
б) моноаминодикарбоновые кислоты (кислые аминокислоты)
в) диаминомонокарбоновые кислоты (основные аминокислоты)
2. Взаимодействие с основаниями и кислотами
Аминокислоты как амфотерные соединения образуют соли как с кислотами (по группе NH2), так и со щелочами (по группе СООН).
Как кислота (участвует карбоксильная группа)
Как карбоновые кислоты α-аминокислоты образуют функциональные производные: соли, сложные эфиры, амиды.
а) взаимодействие с основаниями
б) взаимодействие со спиртами (р. этерификации)
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир. Сложные эфиры аминокислот не имеют биполярной структуры и являются летучими соединениями.
в) взаимодействие с аммиаком
Как основание (участвует аминогруппа)
а) взаимодействие с сильными кислотами
Подобно аминам, аминокислоты реагируют с сильными кислотами с образованием солей аммония:
б) взаимодействие с азотистой кислотой (р. дезаминирования)
Подобно первичным аминам, аминокислоты реагируют с азотистой кислотой, при этом аминогруппа превращается в гидроксогруппу, а аминокислота – в гидроксикислоту:
Измерение объёма выделившегося азота позволяет определить количество аминокислоты (метод Ван-Слайка).
3. Внутримолекулярное взаимодействие функциональных групп ε-аминокапроновой кислоты, в результате которого образуется ε-капролактам (полупродукт для получения капрона).
4. Межмолекулярное взаимодействие α-аминокислот – образование пептидов (р. поликонденсации)
При взаимодействии карбоксильной группы одной молекулы аминокислоты и аминогруппы другой молекулы аминокислоты образуются пептиды. При взаимодействии двух α-аминокислот образуется дипептид.
Межмолекулярная реакция с участием трех α-аминокислот приводит к образованию трипептида и т.д.
Важнейшие природные полимеры – белки (протеины) – относятся к полипептидам, т.е представляют собой продукт поликонденсации a-аминокислот.
5. Качественные реакции!
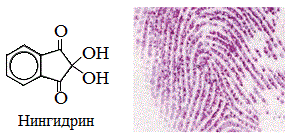
а) нингидриновая реакция
Все аминокислоты окисляются нингидрином с образованием продуктов сине-фиолетового цвета:
Иминокислота пролин дает с нингидрином желтое окрашивание.
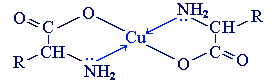
б) с ионами тяжелых металлов α-аминокислоты образуют внутрикомплексные соли. Комплексы меди (II), имеющие глубокую синюю окраску, используются для обнаружения α-аминокислот.
Видеоопыт «Образование медной соли аминоуксусной кислоты»
Почему аминокислоты амфотерные органические соединения?
Для начала давайте выясним, что собой представляют аминокислоты. Это органические соединения, молекулярная структура которых представлена карбоксильной и аминной группами. В состав аминокислот входят такие элементы, как: водород, углерод, кислород, азот. Некоторые их виды представлены в генетическом коде человека.
Аминокислоты являются вторичным продуктом карбоновых кислот, в которых атомы водорода заменены аминогруппами. В итоге мы имеем соединение, которое содержит две группы — карбоксильную и аминогруппу. Аминогруппа определяет основные свойства аминокислот, а карбоксильная отвечает за их кислотные характеристики. Получается, что аминокислоты обладают как основными, так и кислотными свойствами, что характерно для амфотерных соединений. По этой причине они и называются амфотерными.
Кислотные свойства аминокислот обусловлены наличием в них карбоксильных групп. Основные же свойства определяются входящими в их состав аминогруппами, которые могут соединяться с ионами водорода, что приводит к образованию групп замещенного аммония. В данном случае амфотерные свойства аминокислот будут обусловлены взаимодействием карбоксильных групп с аминогруппами.
Примером амфотерных соединений являются белки, в состав которых входят аминокислоты, обладающие, одновременно, свойствами кислот и оснований. По этой причине они способны образовывать соли двух разных видов. Если говорить проще, то при соединении со щелочами аминокислоты будут проявлять свойства кислот, а при взаимодействии с кислотами, будут вести себя как основания. В этом и выражаются их амфотерные свойства.
Белки являются основным строительным материалом живых организмов, будь то человек, животное, или растение. Они несут ответственность за все его основные функции. В свою очередь, в состав белков входят аминокислоты, представленные карбоновыми кислотами, органическими соединениями, карбоксильными группами. По этой причине белки также обладают амфотерными свойствами.
Аминокислоты. Свойства аминокислот.
Аминокислоты, белки и пептиды являются примерами соединений, описанных далее. Многие биологически активные молекулы включают несколько химически различных функциональных групп, которые могут взаимодействовать между собой и с функциональными группа друг друга.
Аминокислоты.
В природе встречаются в основном α-кислоты. В состав белков входят 19 аминокислот и ода иминокислота (С5Н9NO2):
Самая простая аминокислота – глицин. Остальные аминокислоты можно разделить на следующие основные группы:
1) гомологи глицина – аланин, валин, лейцин, изолейцин.
2) серосодержащие аминокислоты – цистеин, метионин.
3) ароматические аминокислоты – фенилаланин, тирозин, триптофан.
4) аминокислоты с кислотным радикалом – аспарагиовая и глутаминовая кислота.
5) аминокислоты с алифатической гидрокси-группой – серин, треонин.
6) аминокислоты с амидной группой – аспарагин, глутамин.
7) аминокислоты с основным радикалом – гистидин, лизин, аргинин.
Во всех аминокислотах (кроме глицина) атом углерода связан с 4-мя разными заместителями, поэтому все аминокислоты могут существовать в виде 2-х изомеров (энантиомеров). Если L и D – энантиомеры.
Физические свойства аминокислот.
Аминокислоты представляют собой твердые кристаллические вещества, хорошо растворимые в воде и мало растворимые в неполярных растворителях.
Получение аминокислот.
1. Замещение атома галогена на аминогруппу в галогензамещеных кислотах:
Химические свойства аминокислот.
Аминокислоты – это амфотерные соединения, т.к. содержат в своём составе 2 противоположные функциональные группы – аминогруппу и гидроксильную группу. Поэтому реагируют и с кислотами и с щелочами:
Кислотно-основные превращение можно представить в виде:
Реагирует с азотистой кислотой:
Реагируют со спиртами в присутствие газообразного HCl:
Качественные реакции аминокислот.
Окисление нингидрином с образованием продуктов, окрашенных в сине-фиолетовый цвет. Иминокислота пролин дает с нингидрином желтый цвет.
2. При нагревании с концентрированной азотной кислотой протекает нитрование бензольного кольца и образуются соединения желтого цвета.
Аминокислоты амфотерные соединения так как
Среди азотсодержащих органических веществ имеются соединения с двойственной функцией. Особенно важными из них являются аминокислоты.
В клетках и тканях живых организмов встречается около 300 различных аминокислот, но только 20 ( α-аминокислоты) из них служат звеньями (мономерами), из которых построены пептиды и белки всех организмов (поэтому их называют белковыми аминокислотами). Последовательность расположения этих аминокислот в белках закодирована в последовательности нуклеотидов соответствующих генов. Остальные аминокислоты встречаются как в виде свободных молекул, так и в связанном виде. Многие из аминокислот встречаются лишь в определенных организмах, а есть и такие, которые обнаруживаются только в одном из великого множества описанных организмов. Большинство микроорганизмов и растения синтезируют необходимые им аминокислоты; животные и человек не способны к образованию так называемых незаменимых аминокислот, получаемых с пищей. Аминокислоты участвуют в обмене белков и углеводов, в образовании важных для организмов соединений (например, пуриновых и пиримидиновых оснований, являющихся неотъемлемой частью нуклеиновых кислот), входят в состав гормонов, витаминов, алкалоидов, пигментов, токсинов, антибиотиков и т. д.; некоторые аминокислоты служат посредниками при передаче нервных импульсов.
Аминокислоты можно рассматривать как карбоновые кислоты, в молекулах которых атом водорода в радикале замещен аминогруппой.
1. В зависимости от взаимного расположения амино- и карбоксильной групп аминокислоты подразделяют на α-, β-, γ-, δ-, ε- и т. д.
2. В зависимости от количества функциональных групп различают кислые, нейтральные и основные.
3. По характеру углеводородного радикала различают алифатические (жирные), ароматические, серосодержащие и гетероциклические аминокислоты. Приведенные выше аминокислоты относятся к жирному ряду.
Примером ароматической аминокислоты может служить пара-аминобензойная кислота:

Примером гетероциклической аминокислоты может служить триптофан – незаменимая α- аминокислота
По систематической номенклатуре названия аминокислот образуются из названий соответствующих кислот прибавлением приставки амино- и указанием места расположения аминогруппы по отношению к карбоксильной группе. Нумерация углеродной цепи с атома углерода карбоксильной группы.
Часто используется также другой способ построения названий аминокислот, согласно которому к тривиальному названию карбоновой кислоты добавляется приставка амино- с указанием положения аминогруппы буквой греческого алфавита.
Некоторые важнейшие α-аминокислоты
Наличие двух или трех карбоксильных групп отражается в названии суффиксом –диовая или -триовая кислота:
1. Изомерия углеродного скелета
2. Изомерия положения функциональных групп
3. Оптическая изомерия
Аминокислоты представляют собой кристаллические вещества с высокими (выше 250°С) температурами плавления, которые мало отличаются у индивидуальных аминокислот и поэтому нехарактерны. Плавление сопровождается разложением вещества. Аминокислоты хорошо растворимы в воде и нерастворимы в органических растворителях, чем они похожи на неорганические соединения. Многие аминокислоты обладают сладким вкусом.
Аминокислоты амфотерные органические соединения, для них характерны кислотно-основные свойства.
1. Внутримолекулярная нейтрализация → образуется биполярный цвиттер-ион:
Водные растворы электропроводны. Эти свойства объясняются тем, что молекулы аминокислот существуют в виде внутренних солей, которые образуются за счет переноса протона от карбоксила к аминогруппе:
Водные растворы аминокислот имеют нейтральную, кислую или щелочную среду в зависимости от количества функциональных групп.
Отношение аминокислот к индикаторам.mp4
2. Поликонденсация → образуются полипептиды (белки):
При взаимодействии двух α-аминокислот образуется дипептид.
3. Разложение → Амин + Углекислый газ:
II . Свойства карбоксильной группы (кислотность)
3. С аммиаком → образуются амиды:
4. Практическое значение имеет внутримолекулярное взаимодействие функциональных групп ε-аминокапроновой кислоты, в результате которого образуется ε-капролактам (полупродукт для получения капрона):
III . Свойства аминогруппы (основность)
1. С сильными кислотами → соли:
2. С азотистой кислотой (подобно первичным аминам):
Измерение объёма выделившегося азота позволяет определить количество аминокислоты (метод Ван-Слайка)
1. Все аминокислоты окисляются нингидрином с образованием продуктов сине-фиолетового цвета!
2. С ионами тяжелых металлов α-аминокислоты образуют внутрикомплексные соли. Комплексы меди (II), имеющие глубокую синюю окраску, используются для обнаружения α-аминокислот.
Образование медной соли аминоуксусной кислоты.mp4
1) аминокислоты широко распространены в природе;
2) молекулы аминокислот – это те кирпичики, из которых построены все растительные и животные белки; аминокислоты, необходимые для построения белков организма, человек и животные получают в составе белков пищи;
3) аминокислоты прописываются при сильном истощении, после тяжелых операций;
4) их используют для питания больных;
5) аминокислоты необходимы в качестве лечебного средства при некоторых болезнях (например, глутаминовая кислота используется при нервных заболеваниях, гистидин – при язве желудка);
6) некоторые аминокислоты применяются в сельском хозяйстве для подкормки животных, что положительно влияет на их рост;
7) имеют техническое значение: аминокапроновая и аминоэнантовая кислоты образуют синтетические волокна – капрон и энант.