амогус что это такое в медицине
Восстановление легких после коронавируса
Восстанавливаются ли легкие после COVID-19? Да. Но нужно не пропустить сроки реабилитации и серьёзно отнестись к рекомендациям врача.
Новая коронавирусная инфекция, вызванная SARS-CoV-2, недостаточно изучена, однако ясно, что она наносит вред всем органам и тканям человека. Вирус проникает в организм через слизистые оболочки носа, глаз, глотки. Первые симптомы появляются на 2-14 день. Обычно это повышение температуры выше 37.5 градусов Цельсия, насморк, потеря обоняния, сухой кашель, послабление стула, слабость и головная боль. На 6–10 сутки от момента появления первых симптомов могут начать беспокоить одышка, боль в груди, усиление кашля. Это тревожные симптомы, говорящие о поражении легких и требующие проведения дополнительного обследования: компьютерной томографии легких, измерения насыщения крови кислородом (сатурации).
Легкие после COVID-19
Попадая в организм человека через слизистые оболочки дыхательных путей SARS-CoV-2 вызывает мощнейшую воспалительную реакцию. Активируются иммунные клетки, вырабатывается колоссальное количество воспалительных веществ (воспалительных цитокинов). Интенсивность этой реакции скорее всего обусловлена генетически. Именно интенсивностью воспалительной реакции и определяется тяжесть поражения легочной ткани по данным исследований. В легочной ткани поражение при COVID-19 обусловлено как поражением самих альвеол (в которых происходит газообмен и кровь насыщается кислородом из воздуха) нашими собственными иммунными клетками так и поражением легочных сосудов, оплетающих альвеолы. Степень поражения легких можно определить при помощи КТ (компьютерной томографии).
Таблица 1. Поражение лёгких при COVID-19
Процент поражения легочной ткани
Поражена часть лёгкого. Небольшое затруднение дыхания.
Гемолитико-уремический синдром
МКБ-10
Общие сведения
Причины
У детей частыми причинами гемолитико-уремического синдрома являются острая кишечная инфекция (90%) и инфекции верхних дыхательных путей (10 %).
Основное значение в развитии Д+ гемолитико-уремического синдрома имеет энтерогеморрагическая Е. coli, продуцирующая специфический шига-подобный веротоксин, способный избирательно повреждать эндотелиальные клетки сосудов почек и головного мозга. Наибольшее сродство веротоксина с эндотелием капилляров почек наблюдается у детей первых 3 лет жизни. Веротоксин вызывает эндотелиальный апоптоз и лейкоцитозависимое воспаление, а также запускает цепь патологических реакций, приводящих к гемолизу эритроцитов, агрегации и деструкции тромбоцитов, локальной активации процесса коагуляции и внутрисосудистого отложения фибрина, развитию ДВС-синдрома.
Такими же свойствами обладает шигатоксин S. dysenteriae I типа. Развивающиеся микроциркуляторные нарушения (микроангиопатическая гемолитическая анемия, тромбоцитопения и микротромбозы) приводят к ишемическим изменениям в органах мишенях. При гемолитико-уремическом синдроме на фоне ОКИ наиболее часто поражаются капилляры клубочков почек, что может приводить к снижению скорости гломерулярной фильтрации, ишемии или некрозу клубочков, вторичной дисфункции или некрозу почечных канальцев, при массивном поражении – к ОПН.
Д- гемолитико-уремический синдром может быть постинфекционным, лекарственным, поствакцинальным, наследственным, связанным с системными заболеваниями соединительной ткани, идиопатическим. В 40% случаев развитие Д- гемолитико-уремического синдрома обусловлено респираторной инфекцией, возбудителем которой является S. pneumoniae, разрушающий мембраны эритроцитов, тромбоцитов и эндотелиоцитов с помощью фермента нейраминидазы. Вирусы ветряной оспы, ВИЧ, гриппа, Эпштейна-Барра, Коксаки также могут быть причиной гемолитико-уремического синдрома.
В основе гемолитико-уремического синдрома может лежать активация тромбоцитов иммунными комплексами (например, комплексом антиген – антитело после прививок живыми вакцинами против полиомиелита, против ветряной оспы, против кори, АКДС).
Классификация
По тяжести течения выделяют легкую и тяжелую формы гемолитико-уремического синдрома.
Симптомы гемолитико-уремического синдрома
В клинической картине гемолитико-уремического синдрома различают продромальный период, разгар заболевания и восстановительный период. Продолжительность продромального периода составляет от 2 до 7 суток. Для него характерно появление признаков поражения ЖКТ или дыхательных путей.
Гемолитико-уремический синдром на фоне ОКИ, вызванной энтеропатогенной Е. coli, имеет ярко выраженную симптоматику. Развиваются симптомы гастроэнтерита или колита (часто кровавая диарея), тошнота, рвота, абдоминальные боли, лихорадка. Постепенно общее состояния ребенка ухудшается, повышенная возбудимость сменяется вялостью.
Гемолитико-уремический синдром может проявляться полиорганной патологией: поражением ЦНС, печени, поджелудочной железы, сердца, артериальной гипертензией. В 50% случаев гемолитико-уремического синдрома наблюдаются неврологические нарушения: подергивания мышц, гиперрефлексия, децеребрационная ригидность, гемипарезы, судороги, ступор, кома (особенно выраженные у детей первых лет жизни). Выявляются гепатоспленомегалия, кардиомиопатия, тахикардия, аритмия.
Диагностика
Диагноз гемолитико-уремического синдрома основан на выявлении характерных клинических признаков, осложняющих течение ОКИ или ОРВИ: гемолитической анемии, тромбоцитопении, ДВС-синдрома, азотемии.
При гемолитико-уремическом синдроме в крови обнаруживаются анемия, анизоцитоз и полихроматофилия эритроцитов (наличие фрагментированных форм), присутствие свободного гемоглобина, снижение количества тромбоцитов, лейкоцитоз, умеренная непрямая гипербилирубинемия, возрастание уровня мочевины и креатинина, гипонатриемия, гиперкалиемия, ацидоз (в олигоанурической стадии ОПН), гипоальбуминемия.
Моча приобретает коричневато-ржавый цвет, в ней могут появиться фибриновые комки, отмечается гематурия, протеинурия, гемоглобинурия. У детей с ОКИ выполняют бактериологическое исследование кала на выявление штаммов энтеропатогенной Е. coli. При тяжелых неврологических нарушениях возможно проведение КТ головного мозга и люмбальной пункции для исключения кровотечения и менингита.
Дифференциальная диагностика гемолитико-уремического синдрома проводится с неотложными хирургическими состояниями (аппендицитом, кишечной непроходимостью, окклюзией мезентериальных сосудов, перфорацией кишечника, дивертикулом подвздошной кишки), ишемическим колитом, септицемией с ДВС-синдромом, вирусным или бактериальным гастроэнтеритом, тяжелой степенью дегидратации при кишечных токсикозах, тромботической тромбоцитопенией.
Лечение гемолитико-уремического синдрома
Лечение гемолитико-уремического синдрома определяется периодом развития заболевания и тяжестью поражения почечной ткани. Чем раньше ребенок с гемолитико-уремическим синдромом поступает в стационар, тем выше вероятность его успешного и полного излечения. Патогенетическая терапия включает нормализацию агрегатного состояния крови с использованием антиагрегантов, гепаринотерапии; улучшение микроциркуляции (трентал, эуфиллин); коррекцию антиоксидантного статуса (витамины А и Е).
При бактериальной этиологии гемолитико-уремического синдрома назначаются антибиотики широкого спектра действия; при инфекции, вызванной энтеропатогенной Е. coli, прием антибиотиков и препаратов, замедляющих моторику кишечника, не рекомендуется. При олигоанурии показана коррекция водно-электролитных расстройств, подавление реакций метаболического распада и инфекционного процесса. Для коррекции тяжелой анемии используется инфузия эритроцитарной массы.
В половине случаев типичного гемолитико-уремического синдрома необходимо раннее проведение заместительной терапии: обменного плазмафереза, перитонеального диализа или гемодиализа. Гемодиализ проводится ежедневно в течение всего олигоуремического периода. В случае развития терминальной стадии ХПН показана трансплантация почки.
Прогноз
Гемолитико-уремический синдром имеет серьезный прогноз, летальность у маленьких детей во время острой фазы заболевания составляет 3-5%, у 12% развивается терминальная ХПН, у 25% происходит снижение клубочковой фильтрации. Плохой прогноз имеют атипичные наследственные, аутоиммунные и связанные с беременностью формы гемолитико-уремического синдрома.
Классическая форма гемолитико-уремического синдрома у детей раннего возраста с преимущественным поражением почечных клубочков протекает более благоприятно. В случае Д+ гемолитико-уремического синдрома наблюдается лучший исход по сравнению с недиарейным синдромом, сопровождающимся частыми рецидивами и высокой летальностью.
Атипичный гемолитико-уремический синдром (аГУС)
Атипичный гемолитико-уремический синдром (аГУС)
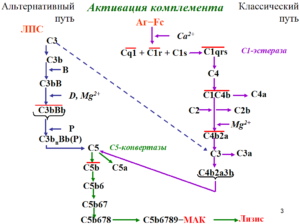
Атипичный гемолитико-уремический синдром (аГУС) – это чрезвычайно редкое (орфанное) заболевание, связанное с недостаточностью альтернативного пути активации комплемента. По системе МКБ-10 кодируется, как D 59.3
Атипичный гемолитико-уремический синдром (аГУС). Прогноз. Причины.
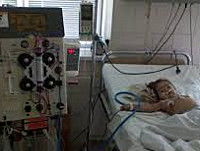
К сожалению, прогноз заболевания, чаще всего, неблагоприятный. Атипичный гемолитико-уремический синдром (аГУС) – это угрожающая жизни хроническая болезнь, характеризующаяся мультисистемным поражением органов и тканей. Заболевание примерно одинаково встречается как у детей, так и у взрослых. В основе заболевания лежит тромботическая микроангиопатия (TMA), при которой в маленьких кровеносных сосудах возникают тромбы. Из-за этого нарушается кровоснабжение, и органы страдают.
Чем дольше длится токсическое агрессивное воздействие на организм, тем более пагубными становятся последствия: отказывают почки, развивается инсульт или инфаркт.
Соответственно, при ранней диагностике, при выявлении заболевания на начальных стадиях, можно снизить пагубное воздействие атипичного гемолитико-уремического синдрома (аГУС), и тем самым дать шанс человеку на нормальную полноценную жизнь.
Атипичный гемолитико-уремический синдром (аГУС). Наследование.
Атипичный гемолитико-уремический синдром (аГУС) считается наследственным заболеванием только в 20% случаев, с аутосомно-рецессивным или доминантным типом передачи. Примерно в половине случаев выявить генетическую мутацию не получается. Поэтому ДНК – анализ при атипичном гемолитико-уремическом синдроме (аГУС) не является важнейшим диагностическим методом, на его основании не может даваться заключение о начале или отмене терапии.
Атипичный гемолитико-уремический синдром (аГУС) одинаково распространен по всей планете, не выявлено зависимости от пола или расы пациентов. Из-за редкости заболевания сложно говорить о точном количестве пациентов, есть предположения о том, что болезнь встречается примерно от 1 до 9 случаев на миллион человек.
Атипичный гемолитико-уремический синдром (аГУС). Клинические проявления.
Симптомы атипичного гемолитико-уремического синдрома (аГУС) встречаются как все вместе, так и по отдельности. Насторожить должно любое из клинических проявлений болезни.
Итак, симптомами атипичного гемолитико-уремического синдрома (аГУС) являются:
Вызывать проявления атипичного гемолитико-уремического синдрома (аГУС) могут несколько причин, зачастую они становятся спусковым крючком для начала заболевания. Вот они:
Все они усиливают нарушение в системе комплемента. Иногда для манифестации заболевания бывает достаточно одного фактора, но они могут действовать и в совокупности.
Атипичный гемолитико-уремический синдром (аГУС). Диагностика.
Во-первых, атипичный гемолитико-уремический синдром (аГУС) не имеет в самом начале возникновения заболевания проявлений гемоколита, во-вторых диарея может сама по себе вызвать заболевание, а не быть его симптомом. На этом этапе нужно исключить STEC и Streptococcus pneumoniae – инфекции.
Дальше методом исключения проверяем пациента на системную красную волчанку, СПИД, злокачественную гипертонию, тромботическую тромбоцитопеническую пурпуру, HELLP – синдром у рожающих женщин и ряд других заболеваний.
Напоминаем, что генетический анализ не имеет 100% достоверности, у части пациентов с подтвержденным атипичным гемолитико-уремическим синдромом (аГУС), нарушения в соответствующем гене не выявлены.
Атипичный гемолитико-уремический синдром (аГУС). Лечение.
Лечение инфузиями плазмы, пламообменом. В настоящий момент метод считается недостаточно эффективным, у одних пациентов он вызывает незначительное улучшение показателей, а у других оказывается практически бесполезным.
Гемодиализ. Процедура искусственной очистки организма лишь устраняет последствия сбоя в системе комплемента, но при этом никак не влияет на процесс избыточного образования белка. Она способна на несколько лет увеличить продолжительность жизни пациента. Сохраняется возможность развития внепочечной тромботической микроангиопатии.
Трансплантация. Почка, потерявшая свою функцию, может быть заменена на новую, но прогрессирующее заболевание может вновь начать разрушать органы и ткани. 90% пациентов опять чувствуют симптомы атипичного гемолитико-уремического синдрома (аГУС). Есть большой риск рецидива после трансплантации. Иногда можно осуществить двойную трансплантацию, и печени, и почки, но при этом возникает огромная сложность в поиске идеально подходящих двух донорских органов. Кроме того, и такая сложнейшая манипуляция может не дать гарантированного положительного результата. Тромботическая микроангиопатия развивается и в других органах.
Гемолитико-уремический синдром как осложнение острой кишечной инфекции у детей
Гемолитико-уремический синдром (ГУС) хорошо известен многим педиатрам и в типичном случае проявляется остро развившейся диареей (гемоколит наблюдается у 75% больных), на фоне которой остро возникает состояние, сопровождающееся.
Гемолитико-уремический синдром (ГУС) хорошо известен многим педиатрам и в типичном случае проявляется остро развившейся диареей (гемоколит наблюдается у 75% больных), на фоне которой остро возникает состояние, сопровождающееся:
Восстановление почечной функции в периоде выздоровления отмечается лишь у 70% больных, и связано это, прежде всего, с глубиной повреждения почечной ткани вследствие разнообразия причинно-значимых, провоцирующих факторов. Так, плохой прогноз имеют атипичные семейные (наследственные) и спорадические случаи ГУС, не ассоциированные с диареей, 25% этих больных погибают в острой фазе заболевания, у 50% прогрессирует отек-набухание головного мозга.
Этиология
Типичный ГУС вызывается шигаподобным токсином Stx1 Shigella disenteria и шигаподобным токсином Stx2 Escherichia coli O157:Н7. Цитопатический эффект шигаподобного токсина обнаружен на вероклетках почек африканских зеленых мартышек. У серотипа E. coli O157 имеются уникальные биохимические свойства — отсутствие ферментации сорбитола. Однако некоторые другие серотипы эшерихий способны вызывать диарею, ассоциированную с ГУС, у детей — О26, О145, О121, О103, О111, О113 и др. Они продуцируют другие токсины, отличные от шигаподобных токсинов своими субъединицами, аминокислотными последовательностями и молекулярным весом.
Классификация тромботических микроангиопатий (представлена Европейской педиатрической группой, 2006 г.).
С учетом этиологии:
Нарушения обмена веществ:
Не полностью установленная этиология:
Установлено, что в основе не ассоциированного с диареей ГУС (non-Stx-HUS) имеет место генетическое нарушение — низкий уровень третьего компонента комплемента в сыворотке и нарушение его регуляции. Выявлены генетические маркеры, которые приводят к атипичному ГУС у больных с наследственной предрасположенностью. В настоящее время обнаружено более 50 мутаций в гене фактора НF1, кодирующих систему активации комплемента. В развитых странах такие больные проходят генетическое тестирование, а также определение уровня аутоантител. Так как атипичный ГУС протекает неблагоприятно с формированием в 50% случаев хронической почечной недостаточности (ХПН) или необратимого повреждения головного мозга, генетическое тестирование важно для решения вопроса о возможности успешной трансплантации почек таким пациентам [2].
Заболеваемость и факторы передачи
В Африке, Азии при бактериологическом исследовании кала от больных ГУС чаще высеваются серотипы шигелл, выделяющие Stx1, после его воздействия у 38–60% детей развивается гемоколит. В США ежегодно регистрируется до 70 тыс. заболевших эшерихиозом и примерно 60 летальных исходов. В Аргентине, Уругвае эшерихиоз эндемичен. Заболеваемость диареей, ассоциированной с ГУС, составляет 10 на 100 тыс. детей в год. Частое возникновение эшерихиоза связывают с традиционным употреблением мясных продуктов из телятины: до 40% молодых животных длительно выделяют в стуле Stx2 E. coli O157:Н7.
В России не ведется анализ заболеваемости диареей, ассоциированной с ГУС, у детей. Публикации скудны, осуществляются в основном реаниматологами. Диарея, ассоциированная с ГУС, этиологически редко расшифровывается. Врачи не диагностируют признаков тяжелого бактериального токсикоза в начальном периоде заболевания. Происходит недооценка степени тяжести состояния больных, соответственно, запоздалая адекватная терапия и неблагоприятные исходы.
Патогенез
Таким образом, в детском возрасте у большинства детей встречается типичный или постдиарейный ГУС, который вторичен по отношению к острым кишечным инфекциям (ОКИ), а центральную роль в патогенезе почечных поражений, гемолиза и тромбоцитопении играет повреждение эндотелиальных клеток. В основе повреждения почек при ГУС лежит гломерулярная тромботическая микроангиопатия — утолщение стенки сосудов с отеком эндотелия и накоплением белков и клеточного детрита в субэндотелиальном слое в результате воздействия одного или нескольких повреждающих факторов. Кроме этого гистопатологические варианты ГУС включают в себя ишемию клубочков, которая в сочетании с тромбозом в последующем может приводить к многоочаговому или диффузному некрозу клубочков (коркового вещества), окклюзии клубочков фибриновыми тромбами.
Нормальный эндотелий обеспечивает эукоагуляционную ситуацию. Это поддерживается продукцией антитромбина III, простациклина, оксида азота, эндотелийзависимого релаксирующего фактора и т. д. При повреждении эндотелия его поверхность приобретает прокоагулянтные свойства, что в свою очередь способствует локальной активации свертывающей системы крови с внутрисосудистой коагуляцией, отложению фибрина в стенках и просвете капилляров. Это приводит к сужению или облитерации просвета капилляров клубочков, снижению скорости клубочковой фильтрации и уменьшению перфузии почечных канальцев с их вторичной дисфункцией или некрозом [5]. При ОКИ, осложненных ГУС, наиболее часто страдают внутриклубочковые сосуды, поражение которых возникает на ранних стадиях заболевания.
Генез тромбоцитопении при ГУС связан с усилением внутрипочечной агрегации тромбоцитов, при этом повышается уровень 3-тромбоглобулина и тромбофактора-4 — специфических тромбоцитарных белков, количество которых в плазме нарастает при активации тромбоцитов и снижении гломерулярной фильтрации [6]. Тромбоцитопении также способствует повышенное их потребление в тромбы. Кроме того, экспериментально показано, что после проведенной двусторонней нефрэктомии уровень тромбоцитов достаточно быстро восстанавливается. Это подтверждает причастность почек к данному лабораторному симптому.
Другим удивительным фактом является значимое снижение продукции эндотелиальными клетками простациклина (PGJ2) у некоторых больных с ГУС и членов их семей. Это предполагает наличие генетического дефекта, который может привести к развитию семейных случаев ГУС, при условии воздействия этиологического фактора на эндотелий сосудов.
Таким образом, при ГУС, обусловленным шигаподобным токсином, изменения наблюдаются непосредственно в клубочках и канальцах почек. Однако нефробиопсия, проведенная через несколько месяцев после заболевания, показывает, что большая часть клубочков сохраняет нормальное строение и только 15–20% склерозированы. Поэтому исходы ОКИ, осложненных ГУС, как правило, благоприятны, если своевременно купируется ОПН.
Основные клинические признаки (ОКИ + ГУС):
Дополнительные симптомы ОКИ + ГУС:
Лечение больных с ГУС проводится исключительно симптоматическое, поддерживающее, поскольку патогенетической терапии с доказанной эффективностью в настоящее время не существует.
Ниже представлены рекомендации по ведению пациентов с ГУС, опубликованные Европейской педиатрической исследовательской группой [3] и в Консенсусе исследовательской группы по печеночно-почечной трансплантации при ГУС.
Лечение:
Нами проводилось изучение клинического профиля, спектра функциональных нарушений, прогностических факторов и исходов у 25 детей с ОКИ, осложненными гемолитико-уремическим синдромом, которые находились на лечении в МУЗ ДГКБ № 3 Новосибирска в период с 1991 по 2010 гг.
Наибольшее количество случаев (16 из 25 больных) ГУС наблюдалось у детей в возрасте до трех лет, что согласуется с данными литературы [1, 3]. В 1,3 раза чаще заболевание развивалось у девочек, такое соотношение встречается не везде, например, в Непале мальчики болеют в 3 раза чаще, чем девочки [4].
В первые трое суток от начала ОКИ ГУС развился у 13 больных, что составило 52% больных, до 5 дней — у 7 (28%) больных, и от 6 до 8 дней — у 5 (20%) детей. Таким образом, острое начало ГУС отмечалось только у половины, а у остальных больных проходило некоторое время от начала диареи, болезнь манифестировала клиникой гастроэнтероколита, поэтому терапия продолжалась на участке и была неадекватной степени тяжести. При этом длительно использовались сорбенты, не назначались антибактериальные препараты, либо использовался фуразолидон без эффекта, и терапия не менялась до появления клинических симптомов ГУС.
Результаты бактериологических исследований кала были положительны лишь у 8 больных. Так, в периоде диареи у двух пациентов в копрокультуре отмечался высев шигелл Флекснера; у одного — Salmonella typhy murium; у двух — E. coli O26; у трех — E. coli O157. Сложность верификации E. coli O157, выделяющей Stx2, обусловлена уникальным свойством ферментации бактерий данного серотипа на средах, содержащих сорбитол.
Развернутая клиническая картина в начале заболевания включала лихорадку, рвоту, абдоминальные боли, одышку, при этом колит отмечался у всех 100% заболевших, а гемоколит — только у пяти больных. Мочевой синдром в виде макрогематурии в острой фазе болезни имел место у двух детей.
Поражение центральной нервной системы (ЦНС) диагностировано у 14 детей (оглушение, сопор, судороги, кома), что было расценено нами как проявление токсикоза, гипергидратации, метаболических изменений (ацидоза), электролитных нарушений — гиперкальциемии, гипокалиемии (гиперкалиемия выявлялась редко), гипонатриемии, нарушение осмолярности плазмы. Гипонатриемия была связана как с потерей этого электролита с кишечником, так и почками. На фоне олигурии экскреция натрия усиливается за счет торможения реабсорбции в канальцах. Начальные признаки поражения ЦНС — повышенная возбудимость, беспокойство, затем прогрессирующая вялость, затем больные впадали в кому. Нарушение сознания проявлялось в основном у детей первых лет жизни.
Анемия — основной симптом ГУС, который во многом предопределяет степень тяжести ГУС, но не коррелирует с глубиной поражения почек. Анемия характеризуется как гиперрегенераторная, поэтому в общем анализе крови много ретикулоцитов за счет активной пролиферации в костном мозге. Бледность кожи — важнейший признак бактериального токсикоза, развивающийся уже в начале болезни, в динамике нарастала за счет гемолиза эритроцитов, падения уровня гемоглобина. В результате гемоглобинурии у некоторых больных отмечался темно-коричневый или черный цвет мочи. Родители указывали на данный симптом участковому педиатру, но ему не уделяли должного внимания. Так, больная Б., 1,5 лет жизни, после появления гемоглобинурии еще на сутки была оставлена дома и поступила с ошибочным диагнозом «вирусный гепатит», когда появилась желтуха на фоне восковидной бледности кожи. Массивный острый гемолиз характеризовался критическими цифрами гемоглобина ( 3 ) выявлялась у всех детей, в трех случаях уровень тромбоцитов снижался до единичных клеток. Количество тромбоцитов в периферической крови, как правило, коррелировало с темпом диуреза, повышение их количества в динамике болезни предшествовало восстановлению диуреза, что является благоприятным лабораторным признаком.
Основные показатели системы гемостаза, за исключением тромбоцитопении, изменялись незначительно. Это свидетельствовало о том, что в патогенезе ГУС отсутствует системное тромбообразование (ДВС-синдром (диссеминированное внутрисосудистое свертывание)), а тромбоз сосудов осуществляется преимущественно на уровне почек. Возможно, у детей и есть период диссеминированного свертывания крови, но факторы, потребляемые в этот период заболевания, быстро восстанавливаются до нормы. Рекомендуется поддерживать нормальный уровень фибриногена, факторов свертывания введением свежезамороженной плазмы, где они содержатся в большом количестве. Так, у наших больных время свертывания, АЧТВ (активированное частичное тромбопластиновое время), уровень фибриногена, количество РФМК (растворимых фибрин-мономерных комплексов), как правило, соответствовало контрольным значениям.
Однако кровотечения отмечались у двух больных. В 1997 г. мы наблюдали случай ГУС у ребенка Р. 3 лет с шигеллезом Флекснера и язвенно-некротическим поражением толстого кишечника. В данном случае отмечался тяжелый гемоколит с периодическими кишечными кровотечениями в течение 12 дней. Предпринимались попытки коррекции гемостаза путем введения большого количества свежезамороженной плазмы, но у больного развился парез кишечника, который определил наступление летального исхода. В 2003 г. у больной К. 6 лет наблюдалось массивное кровотечение из толстого кишечника, использование препарата NovoSeven — рекомбинантного фактора свертывания крови VIIa позволило остановить кровотечение, в последующем наступило выздоровление. Тромбомасса вводилась некоторым больным с критическими цифрами, но только при кровотечениях, поскольку срок жизни тромбоцитов ограничен.
Значения сывороточного уровня мочевины и креатинина в остром периоде болезни значительно превышали контрольные возрастные показатели (в среднем в 1,5–2 раза и более). Тяжесть ГУС обусловливает глубина поражения почек, соответственно, состояние больного и исход зависят от снижения почечных функций. Как известно, длительность анурии предопределяет прогноз — чем дольше она продолжается, тем вероятность восстановления почечной функции меньше и чаще наблюдается переход в ХПН [3]. При сохранении водовыделительной функции почек (так называемая неолигурическая ОПН), даже при высоких цифрах мочевины, прогноз, как правило, благоприятен. Для олигоанурической стадии ГУС не характерны отеки в связи с потерями жидкости со стулом и перспирацией. Протеинурия встречалась у 38% и микрогематурия — у 70% больных.
Варианты заместительной почечной терапии
Плазмообмен — первый уровень терапии, он выполнялся всем 25 больным в объеме 1,5–2 объема циркулирующей плазмы. Это коррекция плазменных факторов, осуществлялась в остром периоде ежедневно, в дальнейшем по необходимости. Острый период ГУС у всех детей протекал по-разному — обычно в течение 2–5 дней наблюдались токсикоз, тромбоцитопенические сыпи, тромбозы катетеров. Если за это время не восстанавливался диурез, больному устанавливали перитонеальный катетер и проводили перитонеальный диализ от 2 до 6 недель.
Перитонеальный диализ выполнялся шести больным (четырем в сочетании с гемодиализом и двум — с гемодиафильтрацией). Есть больные без тяжелого токсикоза и выраженных электролитных нарушений, которым можно проводить только перитонеальный диализ, и они поправляются. Перитонеальный диализ — щадящая заместительная терапия, при которой медленно происходит обмен жидкости через брюшину, он может использоваться длительно, до восстановления функции почек.
С 1991 по 2003 г. плазмообмен в сочетании с гемодиализом был выполнен 14 (56%) больным. С 2008 г. для стабилизации гомеостаза в стационаре осуществляется гемодиафильтрация в сочетании с перитонеальным диализом (использовалась в лечении трем больным). Принцип гемодиафильтрации — замена интерстициальной жидкости на специальные растворы, которые полностью, кроме белков, соответствуют составу плазмы. При гемодиафильтрации плазмообмен осуществляется аппаратным способом, это многочасовая процедура, иногда она длится сутки, при этом диализирующая жидкость вводится со скоростью 70 мл/мин. Этот метод терапии более эффективен при SIRS-синдроме. Гемодиализ показан больным с нарушением азото- и водовыделительных функций почек без симптомов воспаления, снижает уровень азотемии, нормализует гомеостаз за 3–4 часа, поток диализирующего раствора по фильтру составляет 500 мл/мин.
В нашем наблюдении олиго/анурия у трех больных отсутствовала, а в остром периоде болезни доминировали симптомы гемолиза, у трех пациентов олиго/анурия сохранялась до трех суток, у 8 детей — до 8 суток, у шести человек до 15 суток и у двух — до 20 и более. Так, у пациента с длительностью олигурической стадии ОПН 28 дней, которому проводилась почечная заместительная терапия, полностью восстановились функции почек. У другой больной, после 42 дней заместительной почечной терапии, развилась ХПН.
Литература
Е. И. Краснова, доктор медицинских наук, профессор
С. А. Лоскутова, доктор медицинских наук, доцент
О. В. Гайнц
НГМУ, МУЗ ДГКБ № 3, Новосибирск