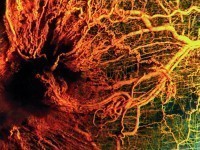
ангиогенез что это такое
Ангиогенез что это такое
В настоящее время не существует единой классификации регуляторов ангиогенеза, однако в соответствии с их природой все факторы, оказывающие влияние на рост кровеносных сосудов, могут быть разделены механические (биомеханические) и химические [5, 10, 31]. Химические факторы, в свою очередь включают широкий спектр биологически активных веществ, которые могут как стимулировать, так и угнетать ангиогенез, и метаболиты [3].
Биомеханические факторы, регулирующие ангиогенез
Эндотелиальные клетки подвергаются различным механическим воздействиям, связанных с током крови: напряжению сдвига, трансэндотелиальному току жидкости, циклической деформации и др. Было показано, что параметры гемодинамики регулируют ангиогенные реакции эндотелиальных клеток [8, 15]. Согласно современным представлениям постоянный ламинарный коровок (постоянное напряжение сдвига) способствует ангиогенной стабилизации сосудов, что обеспечивает как завершение активного ангиогенеза, так и поддержанию ангиогенного покоя. Напротив, турбулентный ток крови, неадекватные параметры напряжения сдвига, повышение трансэндотелиального тока жидкости представляют собой факторы, способствующие активации ангиогенеза. В настоящее время установлено, что биомеханические факторы изменяют экспрессию генов и регулируют не только миграцию, пролиферацию и апоптоз эндотелиальных клеток, но и продукцию ими химических ангиогенных факторов [14, 25, 33].
Биологически активные вещества, стимулирующие ангиогенез
Биологически активные вещества, оказывающие влияние на прорастание сосудов, в зависимости от оказываемого эффекта разделяют на стимуляторы и ингибиторы [3]. Стимулируют рост сосудов семейство факторов роста эндотелия сосудов (VEGF), близкие к нему плацентарные факторы роста (PlGF- 1,2), основной фактор роста фибробластов (FGF-2), ангиопоэтины (ANGPT-1,2), интерлейкин-8 (IL-8), тромбоцитарные факторы роста (PDGF), трансформирующий фактор роста-бета (TGF-бета) и другие [16].
Инсулиноподобный фактор роста (IGF-1) также оказывает стимулирующее влияние на прорастание кровеносных сосудов, через увеличение продукции IL-8. Кроме того, invitro была продемонстрирована способность IGF-1 стабилизировать новообразованные соcуды [21].
IL-8 является независимым VEGF-стимулятор ангиогенеза, который действует через рецепторы CXCR-2, стимулируя пролиферацию, миграцию и выживание эндотелиальных клеток [27].
Тромбоцитарный фактор роста PDGF-BB, малые дозы TGF-бета, гепаринсвязывающий подобный эпидермальному фактор роста (EGF-HB) способствуют стабилизации образованных сосудов [13].
Биологически активные вещества, ингибирующие ангиогенез
На сегодняшний день описан ряд биологически активных веществ, которые ингибируют ангиогенез. Тромбоспондины-1,2 (TSP-1,2), вазогибин-1 (VASH-1), ангиостатины, эндостатин являются примерами медиаторов, которые ингибируют ангиогенез.
Ангиостатины представляют собой протеолитические фрагменты плазминогена, которые обладают способностью подавлять ангиогенез опухоли [26]. Ангиостатины снижают миграцию, пролиферацию и увеличивает апоптоз эндотелиальных клеток, а также снижают продукцию VEGF в клетках опухоли [35]. Ангиостатины образуются в плазме, межклеточном матриксе и на поверхности клеток при участии матриксных металлопротеаз, катепсина, эластазы нейтрофилов [36].
Эндостатин представляет собой С-концевой фрагмент коллагена XVIII, который образуется в результате протезной активности, обусловленной прорастанием кровеносных сосудов. Эндостатин ингибирует пролиферацию эндотелиальных клеток и тубулогенез [9, 37].
Ингибирующее эффекты на ангиогенез были также выявлены у ряда цитокинов, в частности, у IL-4 и гамма-интерферона [19, 20].
Метаболическая регуляция ангиогенеза
Основной функцией сердечно-сосудистой системы является доставка тканям кислорода и питательных веществ, поэтому регуляция состояния сосудистой сети осуществляется рядом метаболических условий.При этом ключевое значение среди метаболитов имеет кислород, а гипоксия тканей является одним из основных индукторов образования новых кровеносных сосудов [23].
Активные формы кислорода также являются значимыми регуляторами ангиогенеза. [38]. Избыточная продукция активных форм кислорода представляет собой универсальный механизм возникновения патологических клеточных реакций, который реализуется при целом ряде заболеваний [1]. АФК стимулируют индукцию VEGF в различных типах клеток, включая гладкомышечные и эндотелиальные клетки, а также способствуют их пролиферации и миграции [38]. Кроме того, АФК являются одним из внутриклеточных сигнальных путей реализации эффектов VEGF, FGF и ANG-1 [11].
Продукты гликолиза также являются посредниками перехода эндотелиальных клеток от фенотипа ангиогенного покоя к активному ангиогенезу [7]. В частности, показано, что лактат является одним из стимуляторов ангиогенеза. Повышенная концентрация лактата потенцирует активацию Tie-2 (рецепторов ANGPT) и VEGFR-2 [29].
Проведенный анализ данных литературы позволяет заключить, что ангиогенез регулируется сложной системой сигнальных механизмов. Смена периодов ангиогенногопокоя и активного ангиогенеза обеспечивается комплексом гемодинамических и метаболических условий, а также балансом про- и антиангиогенных биологически активных веществ. Биомеханимческая и метаболическая регуляция ангиогенеза находится в тесном сопряжении с продукцией биологически активных веществ, влияющих на рост сосудов. Кроме того, биомеханические и метаболические условия способны изменять чувствительность эндотелиальных клеток к про- и антиангиогенным биологически активным веществам. Комплексная регуляция различными факторами обеспечивает четкую координацию ангиогенных процессов, что необходимо для ремоделирования сосудистого русла в соответствии с потребностями тканей в кровоснабжении. Коррекция дисрегуляцииангиогенеза в патологических условиях может выступать в качестве точки приложения терапевтических стратегий при различных заболеваниях, в том числе онкологических.
Рецензенты:
Антипова О.Н., д.м.н., профессор кафедры нормальной физиологии им. И.А. Чуевского, ГБОУ ВПО Саратовский ГМУ им. В.И. Разумовского Минздрава России, г.Саратов;
Пронина Е.А., д.м.н., зав. кафедрой медико-биологических дисциплин Саратовского медицинского института «РЕАВИЗ», г.Саратов.
Ангиогенез что это такое
• Рост опухоли ограничивается доступностью питательных субстратов и механизмом выведения продуктов жизнедеятельности
• Опухоль может стимулировать рост кровеносных сосудов (ангиогенез), которые, в свою очередь обеспечивают увеличение ее массы
Способность клеток растущей опухоли к пролиферации зависит от ряда факторов, наиболее важным из которых является адекватная система кровоснабжения. Известно, что развивающаяся опухоль, т. н. первичная опухоль, может достигнуть размера лишь 0,2 мм, а затем начинает испытывать затруднения с доступом к питательным компонентам и кислороду; в то же время такой опухоли уже необходимо иметь систему выведения отходов жизнедеятельности и двуокиси углерода. Клетки, испытывающие гипоксию, могут вступить в апоптоз.
Проблем не возникает, если в опухоли развилась сосудистая система. Сосуды решают вопросы, связанные со снабжением опухоли кислородом и питательными компонентами, а также с выведением отходов жизнедеятельности. В отличие от здоровых тканей, патологическая ткань опухоли обычно не развивается вместе с артериально-венозной сетью. Вместо этого опухолевые клетки должны обеспечить рост сосудов de novo за счет примыкающих здоровых тканей.
Процесс образования новых кровеносных сосудов называется нео-ангиогенез или просто ангиогенез. Он начинается, когда клетки опухоли секретируют ростовые факторы, называемые ангиогенными, которые взаимодействуют с эндотелиальными клетками, образующими капилляры в соседних здоровых тканях. В ответ на воздействие ангиогенных факторов эти эндотелиальные клетки начинают пролиферировать и проникают в ткань опухоли, начиная формировать сосудистую сеть, которая в дальнейшем поддерживает рост опухоли.
Очевидно, что в небольшой первичной опухоли клетки в течение многих лет делятся с постоянной скоростью. Несмотря на это, на протяжении этого периода масса опухоли не увеличивается. В отсутствие системы кровоснабжения клетки в такой опухоли погибают с той же скоростью, с какой они образуются. Эта гибель вызывается нехваткой кислорода (аноксия) и отравлением отходами своей жизнедеятельности.
Действительно, такой может быть конечная судьба большинства первичных опухолей, образовавшихся в тканях человека. В течение этого периода равновесия процесс диффузии обеспечивает потребность небольшой опухоли в кислороде и питательных компонентах, используя находящиеся рядом хорошо васкуляризованные ткани.
После нескольких лет такого скромного клеточного деления некоторые клетки в небольшой массе опухоли внезапно приобретают способность стимулировать ангиогенез. Когда это происходит, масса опухоли вступает на путь быстрого роста. Такая быстрая смена характера роста опухоли, которая происходит в ходе многоэтапного опухолевого процесса, называется ангиогенное переключение. Этот процесс представляет собой еще один барьер, который здоровые ткани воздвигают на пути неограниченной экспансии опухолевых клеток.
В некоторых опухолях формирование кровеносных сосудов не происходит в ходе одного отдельного события при многоэтапном развитии опухоли (подобно ангиогенному переключению). Вместо этого в опухоли по мере ее роста происходит прогрессивное образование сосудов.
Процесс управления ангиогенезом включает сложные кооперативные взаимодействия между клетками опухоли и соседними здоровыми клетками, которые попадают в опухоль и начинают взаимодействовать с раковыми клетками. Считается, что наряду с ангиогенными факторами, которые непосредственно высвобождаются раковыми клетками, фибробласты и макрофаги высвобождают другие важные факторы.
Вместе они индуцируют образование сосудистой сети, которая отвечает всем потребностям опухоли и начинает обеспечивать ее практически неограниченным запасом питательных компонентов и кислорода. Также через опухоль могут прорасти лимфатические сосуды, которые служат для удаления отходов ее жизнедеятельности и интерстициальной жидкости. Однако по сравнению с системой кровоснабжения лимфатические сосуды в жизни опухоли играют довольно скромную роль.
В зависимости от плотности сети капилляров опухоли, различают несколько стадий ее развития. Про опухоли с плотной сетью капилляров говорят, что они сильно васкуляризованы; это часто служит причиной болей у раковых больных и указывает на агрессивно растущую популяцию раковых клеток. Наличие сосудов в опухоли создает еще более угрожающую ситуацию. Это говорит о том, что опухоль получила доступ к основным сосудам организма, что облегчило миграцию ее клеток и заселение ими отдаленных органов.
Сама опухоль находится слева в виде темной области.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Ангиогенез – on/off
Ангиогенез – это процесс формирования новых кровеносных сосудов в органе или ткани. В норме в организме процессы ангиогенеза протекают с умеренной интенсивностью и активизируются при регенерации поврежденных тканей, рассасывании тромбов, ликвидации очагов воспаления, рубцевании и других процессах восстановления, а также при росте и развитии организма. Нарушения антиогенеза играют важную роль в развитии многих заболеваний.
Исследователи Schepens Eye Research Institute, входящего в состав Гарвардской медицинской школы, впервые идентифицировали в клетках кровеносных сосудов своего рода «переключатель», регулирующий процесс ангиогенеза. Переключатель включается и выключается в зависимости от концентраций в клетке двух ферментов: фосфоинозитид-3-киназы (PI3K) и и фосфолипазы С гамма (PLCγ). Эти ферменты соревнуются за связывание с одним и тем же мембранным липидом, однако стимулируют при этом диаметрально противоположные процессы: рост и регрессию сосудов.
Группа ученых под руководством Андириуса Казлаускаса (Andrius Kazlauskas) обнаружила, что воздействие фермента PI3K на специфический липид приводит к его модификации, что является сигналом к делению клетки. Воздействие же фермента PLCg приводит к распаду молекулы липида на две части, что предотвращает его связывание с PI3K и, соответственно, препятствует росту сосуда. Кроме того, фрагменты липидной молекулы запускают каскад реакций, приводящий к регрессу и отмиранию сосудов.
Понимание этих процессов открывает новые перспективы в разработке методов лечения заболеваний, связанных с нарушением ангиогенеза. Например, препараты, снижающие продукцию фермента PI3K, можно использовать для блокирования роста злокачественных опухолей, а препараты, усиливающие его синтез – для восстановления повреждений сердечной мышцы.
Следующим шагом, который определили для себя исследователи, является идентификация сигнальных механизмов и молекул, непосредственно участвующих в процессах регрессии сосудов.
Статья Eunok Im и Andrius Kazlauskas «Regulating angiogenesis at the level of PtdIns-4,5P2» опубликована в журнале
Код вставки на сайт
Ангиогенез – on/off
Ангиогенез – это процесс формирования новых кровеносных сосудов в органе или ткани. В норме в организме процессы ангиогенеза протекают с умеренной интенсивностью и активизируются при регенерации поврежденных тканей, рассасывании тромбов, ликвидации очагов воспаления, рубцевании и других процессах восстановления, а также при росте и развитии организма. Нарушения антиогенеза играют важную роль в развитии многих заболеваний.
Исследователи Schepens Eye Research Institute, входящего в состав Гарвардской медицинской школы, впервые идентифицировали в клетках кровеносных сосудов своего рода «переключатель», регулирующий процесс ангиогенеза. Переключатель включается и выключается в зависимости от концентраций в клетке двух ферментов: фосфоинозитид-3-киназы (PI3K) и и фосфолипазы С гамма (PLCγ). Эти ферменты соревнуются за связывание с одним и тем же мембранным липидом, однако стимулируют при этом диаметрально противоположные процессы: рост и регрессию сосудов.
Группа ученых под руководством Андириуса Казлаускаса (Andrius Kazlauskas) обнаружила, что воздействие фермента PI3K на специфический липид приводит к его модификации, что является сигналом к делению клетки. Воздействие же фермента PLCg приводит к распаду молекулы липида на две части, что предотвращает его связывание с PI3K и, соответственно, препятствует росту сосуда. Кроме того, фрагменты липидной молекулы запускают каскад реакций, приводящий к регрессу и отмиранию сосудов.
Понимание этих процессов открывает новые перспективы в разработке методов лечения заболеваний, связанных с нарушением ангиогенеза. Например, препараты, снижающие продукцию фермента PI3K, можно использовать для блокирования роста злокачественных опухолей, а препараты, усиливающие его синтез – для восстановления повреждений сердечной мышцы.
Следующим шагом, который определили для себя исследователи, является идентификация сигнальных механизмов и молекул, непосредственно участвующих в процессах регрессии сосудов.
Статья Eunok Im и Andrius Kazlauskas «Regulating angiogenesis at the level of PtdIns-4,5P2» опубликована в журнале
Ангиогенез
М.В. Спринджук 1, 2
Национальная Академия Наук Беларуси
Объединенный Институт Проблем Информатики
1 Объединенный институт проблем информатики Национальной академии наук Беларуси
ул. Сурганова, 6, 220012, г. Минск, Беларусь
2 Автор для связи: Беларусь, 220040, Минск, Ул. Богдановича 112/38.
Электронная почта:
Тема ангиогенеза – образования сосудов из уже существующих – сегодня является наиболее финансируемой и изучаемой медицинской научной темой в мире. Это связано с тем, что приблизительно 500 млн. жителей планеты нуждается в терапевтической коррекции патологических процессов ангиогенеза. В статье – обзоре литературы систематизированы только наиболее яркие источники литературы, намеренно преимущественно отечественных авторов. Работа проиллюстрирована для доступного понимания. В статье рассматриваются вопросы биохимии и патологической физиологии ангиогенеза в непосредственной связи с современной фармакотерапией. Целью литобзора является предоставление читателю возможности ознакомиться с современной медицинской проблемой 21 века: патологическим кровоснабжением и связанными с этим феноменом вопросами.
Ключевые слова: ангиогенез, неоваскуляризация, фактор роста эндотелия сосудов, метастазированиe, рак, злокачественные опухоли, антиангиогенная фармакотерапия.
Angiogenesis in thyroid gland
Review article
M.V. Sprindzuk 1, 2
1 United Institute of Informatics Problems, National Academy of Sciences of Belarus
Surganov str., 6, 220012, Minsk, Belarus
Tel: +375-17-274-21-71
Fax: +375-17-331-84-03
2 Corresponding author: Belarus, 220040, Minsk, Bogdanovicha lane 112/38.
Email:
The research theme of angiogenesis – the development of blood vessels from the already existing, is one of the most financially supported medical scientific activities in the world. This is so, because 500 000000 citizen need the therapeutic correction of the pathologic angiogenesis processes. The review article is an assembly of the brightest research articles written in and translated into Russian. The paper has several figures, prepared in an attempt to provide the understandable educational resource. The biochemical and pathophysiological questions of angiogenesis are discussed in close relation to the modern angiogenic pharmacotherapy. The objective of the article is to present the reader an opportunity to discover the biomedical research challenge of the 21 century: the pathologic blood supply, vascularization and the associated phenomena.
Key words: angiogenesis, neovascularization, vascular endothelial growth factor, metastasis, cancer, malignant tumors, antiangiogenic pharmacotherapy.
Ангиогенез (A.) – процесс образования новых кровеносных сосудов в органе или ткани. В норме в организме процессы ангиогенеза протекают с умеренной интенсивностью и только при регенерации поврежденных тканей, канализации тромбов, ликвидации очагов воспаления, образовании рубца и тому подобных процессах восстановления, а также при росте и развитии организма [1]. Отдельной областью изучения физиологического ангиогенеза является гинекология, так как А. является неотъемлемой частью циклических превращений в яичниках. Ангиогенез необходим для нормального роста эмбриональных и постнатальных тканей, пролиферации эндометрия, созревания в яичнике фолликула и желтого тела, заживления ран, коллатерализации, стимулированной ишемией [2]. Установлено, что эндотелиальные клетки вырабатывают цитокины, которые стимулируют не только пролиферацию и миграцию самих эндотелиальных клеток, но и пролиферацию опухолевых клеток. Иногда эти аутокринные и паракринные факторы секретирует сама опухоль 3.
Особенности физиологического ангиогенеза
Физиологический ангиогенез представляет собой тканевый ответ либо на гормональную стимуляцию (ангиогенез в репродуктивной системе), либо на изменение окружающей среды (ткань способна расширять сосудистую сеть в ответ на ишемию). Учитывая, что фактор роста эндотелия сосудов (endothelial growth factor = VEGF) – это стрессиндуцированный белок, его регуляция сравнивается с другими кислород- и глюкозорегулируемыми белками, поэтому физиологический и ростовой ангиогенез можно рассматривать как адаптационный ответ на дефицит кислорода. Для того чтобы кислород и питательные вещества поступали в достаточном количестве, каждая клетка макроорганизма должна быть близко расположена к капилляру [2].
Особенности патологического и опухолевого ангиогенеза
В последние годы благодаря достижениям в области молекулярной онкологии удалось расшифровать некоторые механизмы канцерогенеза и определить признаки злокачественного фенотипа: самодостаточность в отношении ростовых сигналов, нечувствительность к рост-игибиторным сигналам, уклонение от программированной клеточной смерти (апоптоза), неограниченность репликативного потенциала, ангиогенез, тканевая инвазия и метастазирование.
Злокачественной опухоли требуются питательные вещества. Опухоль объемом более 1-2 мм 3 для продолжения своего роста нуждается в собственной системе кровоснабжения. Эта фраза цитируется во многих сотнях статей и книжных главах. Патологический ангиогенез наблюдается при ангиогенных заболеваниях, к которым, помимо опухолевого роста, метастазирования, атеросклероза, диабетической ретинопатии, эндометриоза, меноррагий, псориаза, относится и плоский лишай [2,6,7, 15-18, 20-22].
Наиболее яркими примерами патологий, связанных с ангиогенезом, являются атеросклероз (Koch et al., 1994), язвенная болезнь (Folkman et al., 1987) и некоторые аутоиммунные заболевания. Существуют косвенные указания на нарушения нормальных процессов А. при ряде патологий развития (Jackson et al., 1995) и при опухолеобразовании [8].
Метастазирование и ангиогенез
Сосуды питают опухоль и позволяют ей метастазировать [8].
Иногда уже на самых ранних стадиях развития опухоли в ней появляются субпопуляции клеток с высокой способностью к метастазированию. Установлено, что рак молочной железы способен метастазировать сразу после разрастания в опухоли сосудов, когда ее размеры еще не превышают 0,125 см2. Полагают, что поздно метастазирующие опухоли недостаточно васкуляризованы [8].
Метастазы опухолей в местные и регионарные лимфоузлы, куда опухолевые клетки попадают по лимфатическим сосудам, представляют собой ранний этап метастазирования (см. рис.2). В ряде исследований было показано, что VEGF индуцирует как лимфангиогенез, так и распространение опухолевых клеток в регионарные лимфатические узлы. Экспрессия ростовых факторов типа VEGF может определять способность опухоли к метастазированию. VEGF оказывает более широкие эффекты на другие клетки, помимо эндотелия сосудов, и на другие процессы, помимо А.:
Рис.2. Ангиогенез и развитие злокачественной опухоли [19].
Фактор роста эндотелия сосудов
Фактор роста эндотелия сосудов (или фактор проницаемости сосудов) является основным регулятором А. Его важнейшая роль подтверждается тем, что мыши, имеющие всего один аллель нормального VEGF-A, погибают внутриутробно. В большинстве опухолей человека концентрация VEGF повышается, что сопровождается усилением инвазивности, склонностью к рецидивам и худшим прогнозом [6].
VEGF – гомодимерный, сильно гликолизированный белок, митогенный только для эндотелиальных клеток, уровень его повышается в тканях, где активно идет А., его рецепторы экспрессируются на эндотелиальных клетках-мишенях в близлежащих кровеносных сосудах. Основными биологически активными формами являются молекулы размером 121 и 165 аминокислотных остатков. В 1989 г. несколько независимых групп ученых получили данные в пользу индукции VEGF гипоксией и гипогликемией. По данным ряда авторов, А. функционирует в динамическом сочетании с цитокинами, их растворимыми рецепторами и антагонистами, протеолитическими ферментами, регулирующими их освобождение из внеклеточного матрикса [2].
Семейство VEGF включает прототипную молекулу VEGF-A, а также VEGF-B, VEGF-C, VEGF-D, вирусный гомолог VEGF-E и плацентарный ростовой фактор (PLGF). VEGF-A повышает сосудистую проницаемость и способствует А., VEGF-B, как полагают, играет роль в регуляции деградации внеклеточного матрикса, клеточной адгезии и миграции, а VEGF-C и VEGF-D участвуют, главным образом, в лимфангиогенезе. PLGF в большом количестве экспрессируется тромбобластом, модулируя развитие сосудистой сети в плаценте (см. рис.3).
Рис.3. Семейство молекул и рецепторов VEGF (более подробные объяснения см. в тексте).
Cвязывание VEGF с рецептором VEGFR-2 ведет к активации каскада различных сигнальных путей. Примеры двух из них изображены на рисунке 3. Такое взаимодействие приводит к включению генов, вовлекаемых в опосредование процессов пролиферации и миграции клеток эндотелия, и обеспечивает клеточное выживание, а также сосудистую проницаемость. Например, связывание VEGF с рецептором VEGFR-2 приводит к димеризации рецептора, за которым следует активация PLC–PKC–Raf киназа–MEK–митоген-активированной протеин киназы (MAPK) и последующая инициация синтеза ДНК и роста клеток, тогда как активация фосфатидилинозитол 3’–киназа (PI3K)–Akt пути приводит к увеличению роста выживания эндотелиальных клеток. Активация гена src может повлечь изменения актина цитоскелета и индуцировать миграцию клеток. Рецепторы VEGF локализованы на поверхности клеток эндотелия, однако могут присутствовать также и внутриклеточные («интракринные») VEGF-сигнальные рецепторы (VEGFR-2). Они вовлекаются в процессы обеспечения выживания эндотелиальных клеток. Детальная структура внутриклеточного VEGFR-2 до сих пор неизвестна, но на рисунке он показан как полноразмерный рецептор, который в норме прикреплен к поверхности клетки. Cвязывание VEGF-C c VEGFR-3 опосредует лимфангиогенез. VEGF может присоединяться к рецепторам нейропилина (NRP), которые могут действовать как корецепторы с VEGFR-2 (горизонтальная стрелка) и осуществлять регуляцию А.
KDR – kinase-insert domain–containing receptor – рецептор, имеющий в составе домен, содержащий киназу.
flk-1 – fetal liver kinase 1 – киназа печени плода.
EGFR – фактор роста эпидермиса, epidermal growth factor receptor.
PLGF – плацентарный фактор роста, placental growth factor.
PTEN – гомолог фосфатазы и тензина, phosphatase and tensin homologue.
S–S – дисульфидная связь, disulfide bond.
VHL – вон Гиппель-Ландау, von Hippel–Lindau.
(рисунок из NEMJ, google images)
У человека выделены 4 изоформы VEGF-A – VEGF121, VEGF165, VEGF189 и VEGF206, которые образуются в результате альтернативного сплайсинга мРНК VEGF.
Изоформы, которые имеют сходную биологическую активность, но сильно различаются по биодоступности, определяющейся размером молекулы и регулирующейся на генетическом уровне при альтернативном сплайсинге мРНК [cплайсинг протеинов – это внутримолекулярная реакция отдельного протеина, при которой внутренний сегмент протеина (называемый интеин) удаляется из протеина-предшественника одновременно с лигацией – отщеплением С-терминальных и Т-терминальных наружных протеинов (называемых экстеинами) с обеих сторон] [10] и протеолитическом расщеплении синтезированных молекул с участием системы активации плазминогена [2].
Более крупные формы VEGF связаны с матриксом через гепаринсвязывающие домены, в то время как VEGF165 (наиболее распространенная и значимая изоформа) и VEGF121 находятся в состоянии, способном к диффузии. Более крупные изоформы находятся в латентном состоянии во внеклеточном матриксе до того момента, как они высвобождаются под действием протеолитических ферментов, таких как плазмин или ММП-9 (матричная металлопротеаза). Этот процесс повышает местные концентрации VEGF-A в процессе роста и перестройки тканей и участвует в активации ангиогенного включения в некоторых опухолях. Как описывалось выше, VEGF-A также играет важную роль в удержании эндотелиальных клеток новообразованных кровеносных сосудов до момента присоединения к ним перицитов. Новообразованные сосуды, у которых еще нет перицитов, зависят от VEGF-A, препятствующего апоптозу эндотелиальных клеток и обратному развитию незрелых сосудов [6].
VEGF – один из членов семейства структурно близких между собой белков, которые являются лигандами для семейства рецепторов VEGF (лиганд – ион, молекула или их группа, которые сывязываются с другой химической структурой, формируя более крупный комплекс) [11]. VEGF влияет на развитие новых кровеносных сосудов (А.) и выживание незрелых кровеносных сосудов (сосудистая поддержка), связываясь с двумя близкими по строению мембранными тирозинкиназными рецепторами (рецептором-1 VEGF и рецептором-2 VEGF) и активируя их (рецептор – молекула белка, которая получает сигнал: нейропередатчик, гормон или другой, и отвечает на него) [12]. Эти рецепторы экспрессируются клетками эндотелия стенки кровеносных сосудов.
VEGF лиганд запускает сигнальный каскад, который в конечном итоге стимулирует рост эндотелиальных клеток сосуда, их выживание и пролиферацию. Эндотелиальные клетки участвуют в таких разнообразных процессах, как вазоконстрикция и вазодилатация, презентация антигенов, а также служат очень важными элементами всех кровеносных сосудов – как капилляров, так и вен или артерий. Таким образом, стимулируя эндотелиальные клетки, VEGF играет центральную роль в процессе А. [7,13].
Таблица 1. Рецепторная специфичность лигандов VEGF и их биологические эффекты [13].
ПлРФ – плацентарный ростовой фактор.
Точка приложения действия бевацизумаба (медикамент, который рассматривается в последней части статьи) – VEGF-A – связывается с соответствующими тирозинкиназными рецепторами VEGF 1 (flt-1) и 2 (flk-1). Гипоксия в сочетании с возросшими местными концентрациями VEGF-A усиливает экспрессию как VEGF рецептора-1, так и VEGF рецептора-2 на эндотелиальных клетках опухоли. Интересно, что рецепторы VEGF также экспрессируются опухолевыми клетками, в том числе VEGF рецептор-1 обнаруживается в раковых клетках. Это позволяет предположить, что анти-VEGF-терапия может оказывать и другие эффекты, помимо подавления А.
Связывание VEGF-A с VEGF рецептором-2 необходимо для нормального А. и гемопоэза, и основные эффекты VEGF-A опосредованы через этот рецептор (рис.1). Связывание VEGF-A ведет к образованию димеров VEGF рецепторов-2, что запускает процесс фосфорилирования тирозинкиназы. Это, в свою очередь, индуцирует фосфорилирование нескольких цитоплазматических сигнальных белков и начало соответствующих сигнальных каскадов, таких как каскад фосфолипазы С, фосфоинозитол-3-киназы, Ras и Src [24,25]. VEGF-C и VEGF-D тоже связываются с VEGF рецептором-2, а также с VEGF рецептором-3 (flt-4). Следовательно, если VEGF-A, доминирующий внутри опухоли, будет нейтрализован действием бевацизумаба, сигнальные пути, опосредованные VEGF рецептором-2, могут быть активными в том случае, если опухоль продуцирует значительное количество VEGF-C и VEGF-D. Действительно, уровни экспрессии VEGF-C и VEGF рецептора-2 в первичных опухолях ободочной кишки и метастазах в лимфатические узлы позволяют предположить наличие сигнального пути VEGF-C [6].
Третий рецептор VEGF – VEGF рецептор-3, не связывается с VEGF-A и обнаруживается, главным образом, в лимфатическом эндотелии. VEGF рецептор-3 связывается с VEGF-C и VEGF-D и участвует в основном в лимфангиогенезе [6].
Значение VEGF для онтогенеза
VEGF чрезвычайно важен для формирования адекватной функционирующей сосудистой системы в ходе эмбриогенеза и в раннем постнатальном периоде, однако у взрослых его физиологическая активность ограничена. Эксперименты на мышах показали следующее:
Ограниченное значение А. у взрослых означает, что подавление активности VEGF представляет собой выполнимую терапевтическую задачу [9].
Воздействие VEGF на незрелые сосуды
Незрелые кровеносные сосуды существуют преимущественно на этапе развития, а у взрослых индивидуумов – лишь в некоторых ситуациях, например, в процессе заживления ран или заболеваний, характеризующихся аномальным А., таких как онкологические. В отсутствие ростовых сигналов эндотелиальные клетки этих незрелых кровеносных сосудов подвергаются программированной клеточной гибели (апоптозу). VEGF препятствует апоптозу эндотелиальных клеток в незрелых кровеносных сосудах, тем самым сохраняя их жизнеспособность. В отличие от этого зрелые кровеносные сосуды, из которых сформирована сосудистая система взрослого, больше не нуждаются в VEGF для своего выживания и поэтому вряд ли будут страдать от подавления активности VEGF [9].
Влияние VEGF на иммунный ответ
Опухоли обладают рядом механизмов, которые позволяют им избежать иммунного ответа организма хозяина. Один из этих механизмов подразумевает ингибирование дендритных клеток – антиген-презентирующих клеток, которые стимулируют В- и Т-лимфоциты. VEGF препятствует функциональному созреванию дендритных клеток из их гемопоэтических клеток-предшественников. Таким образом, секреция VEGF опухолью может иметь важное значение в подавлении иммунного противоопухолевого ответа [9].
Корреляция степени экспрессии VEGF опухолью с неблагоприятным прогнозом
При целом ряде онкологических заболеваний у человека экспрессия VEGF усиливается (табл.2). Несколько исследований также продемонстрировали усиление экспрессии VEGF в стромальных клетках, ассоциированных с опухолью; возможно, в них экспрессия усиливается под влиянием факторов окружающей микросреды, созданных самой опухолью.
Таблица 2. В опухолях усиливается экспрессия VEGF, что коррелирует с прогнозом.
| Тип опухоли | % опухолей с избыточной экспрессией | Корреляция |
|---|---|---|
| Немелкоклеточный рак легкого | 45-90 | Рецидивы, выживаемость |
| Колоректальный рак | 40-60 | Рецидивы/выживаемость |
| Рак молочной железы | 30-60 | Плотность сосудов, выживаемость |
| Почечноклеточная карцинома | 30-100 | Плотность сосудов, стадия опухоли, степень, злокачественности |
| Рак поджелудочной железы | 75-90 | Выживаемость |
| Мультиформная глиобластома | 65-85 | Выживаемость |
| Рак предстательной железы | 30-80 | Плотность сосудов, безрецидивная выживаемость |
При многих видах опухолей усиление экспрессии VEGF коррелирует с неблагоприятным прогнозом, в том числе с агрессивным ростом опухоли, рецидивами, метастазированием и уменьшением выживаемости. Кроме того, экспрессия VEGF коррелирует с повышением плотности микрососудистой сети в опухоли, что само по себе служит индикатором прогноза при различных онкологических заболеваниях [9,13].
А. был впервые описан Hunter в конце 18 века [24], является комплексным процессом, включающим четыре стадии: протеолитическое разрушение базальной мембраны сосудов и межклеточного матрикса, миграцию и прикрепление эндотелиальных клеток, их пролиферацию и, наконец, формирование тубулярных структур [2].
Недостаточное кровоснабжение ведет к гипоксии вследствие уменьшения диффузии кислорода. Гипоксия – главный стимул А. Происходит активация метаболических путей, регулируемых такими белками, как индуцируемый гипоксией фактор 1, что ведет к увеличению экспрессии проангиогенных факторов, включая VEGF и факторы роста фибробластов. Опухоли также снижают экспрессию антиангиогенных факторов, таких как тромбоспондин-1. В тот момент, когда действие проангиогенных факторов превышает действие антиангиогенных, эндотелиальные клетки переходят из обычного дремлющего состояния в активное. Этот момент называется «включением ангиогенеза».
После включения А. происходит разрыв базальных мембран и внеклеточного матрикса (ВКМ), главным образом, в результате повышения активности матричных металлопротеаз. Эти изменения матрикса способствуют миграции эндотелиальных клеток во внесосудистое пространство, где они начинают размножаться. Затем клетки организуются в трубочки с просветом, образуя новую капиллярную сеть. По ходу этого процесса привлекаются перициты, которые прикрепляются к новым сосудам и стабилизируют их. До этой точки созревания целостность и выживание эндотелиальных клеток зависят от VEGF. Несмотря на сходство процессов А., в опухоли образуется сосудистая сеть, которая сильно отличается от сосудов здоровых тканей. Сосудистое русло опухоли с морфологической точки зрения является крайне атипичным и составляет значительную часть опухолевой стромы. Системы артериол, капилляров и венул, присущей большинству здоровых органов, там нет. Макроскопически обнаруживаются два общих типа периферической и центральной сосудистой перфузии. В центре опухолей с периферической сосудистой сетью имеются крупные участки некроза, в опухолях с центральным типом сосудистого русла – наоборот. Однако эти фенотипы внутри опухоли во многом перекрываются, причем в одной части опухоли может быть любой из этих двух типов кровоснабжения. Кроме того, многие сосуды опухоли находятся в спавшемся состоянии из-за недостаточной механической поддержки окружающей их стромы. Микроскопически сосуды выглядят расширенными, извитыми, выявляется наличие слепых петель и выростов, шунтов и немногочисленных анастомозов. Эти структурные различия влияют на внутриопухолевый кровоток; кровь проходит через опухоли непредсказуемым образом, что оказывает неотвратимое отрицательное влияние на доставку лекарственных препаратов [6,14].
Опухолевые кровеносные сосуды не выстланы обычным монослоем эндотелиальных клеток, являются дезорганизованными, рыхлыми и беспорядочно связанными друг с другом. Во многих кровеносных сосудах опухоли также имеются эндотелиальные выросты из просвета, которые проникают глубоко в периваскулярную строму. Поскольку клетки эндотелия не образуют нормального монослоя, они не могут выполнять обычную барьерную функцию эндотелия, что играет роль в аномально высокой проницаемости этой сосудистой сети и ее склонности к кровотечениям. Далее стабилизирующая связь перицитов с эндотелием слабеет, а большие концентрации VEGF являются мощным фактором, повышающим проницаемость [6].
Вопросы контроля баланса регуляции ангиогенеза
Еще совсем недавно основным показателем активности А. в опухолях являлась микроскопическая оценка плотности сосудов в ткани самой опухоли, но за последнее десятилетие в результате исследования молекулярных механизмов опухолевого А. была выявлена группа регуляторных ангиогенных и антиангиогенных факторов, обеспечивающих формирование новых сосудов внутри опухоли [6]. Имеется необходимость отметить, что измерение площади и плотности капилляров опухоли – это морфометрический метод исследования, и равноценно сравнивать его с биохимическими методами, основанными на выявлении РНК и ДНК в тканях и клетках неадекватно. Еще один путь экспрессии А. происходит через вовлечение воспалительных клеток, секретирующих цитокины ФНО-α (альфа фактор некроза опухолей) и ИЛ-1, которые в свою очередь индуцируют продукцию – нормальными клетками. Процесс роста капилляров продолжается, пока не будет достигнута достаточная близость с клеткой. Затем А. вступает в фазу покоя (за исключением ангиогенных циклов в женской репродуктивной системе). Каждое увеличение тканевой массы сопровождается неоваскуляризацией, что поддерживает адекватную сосудистую плотность. Таким образом, А. индуцируется тогда, когда метаболические потребности превышают перфузионную способность существующих сосудов. По-видимому, механизм этого адаптивного ответа в том, что относительный недостаток кислорода приводит к повышению ангиогенных стимулов. Паракринный механизм влияния А. заключается в действии на рост сосудов в тканях с низким уровнем перфузии. Существует ряд клеток, способных повышать уровень VEGF in vitro во время гипоксии, к которым относятся фибробласты, миоциты гладкой и поперечнополосатой мускулатуры, пигментный эпителий сетчатки, астроциты и эндотелиальные клетки, а также некоторые опухолевые клетки. Таким образом, А. VEGF индуцируется гипоксией в большинстве, если не во всех, клеток in vitro. Гипоглиекмия также активирует экспрессию VEGF. Эксперименты, проведенные в клеточных монослоях, показали, что А. может быть независимо индуцирован гипоксией или гипогликемией. Интересен факт, что не происходит индукции VEGF в культивируемых клетках глиомы, лишенных и кислорода, и глюкозы. Повышение экспрессии VEGF требует синтеза белка, который не может идти при двойном стрессе. Способность реагировать на гипоксию и гипогликемию дает преимущество в ситуации, когда существует дефицит только одного из метаболитов. Неясно, однако, проходят ли эти два ответа через два разных пути или они вырабатывают общий медиатор, действующий как проксимальный индуктор VEGF. Исследования разных метаболитов, накапливаемых во время гипоксии и гипогликемии, по отношению к их способности непосредственно индуцировать VEGF не дали убедительных результатов. Показано, что VEGF индуцируется аденозином, а также ионами кобальта. Это свидетельствует о том, что белок гема может быть вовлечен в этот процесс [6].
Рис.4. Cхема факторов развития А. [23].
Роль стромы в патогенезе ангиогенеза
Наряду с факторами роста в процессе А. имеет большое значение состав экстрацеллюлярного матрикса стромы опухоли. Благоприятным является содержание в нем компонентов базальных мембран – ламинина, фибронектина и коллагена IV типа [4].
Формирование сосудов в опухолях происходит на фоне извращенной митогенетической стимуляции и измененного экстрацеллюлярного матрикса. Это приводит к развитию неполноценных сосудов преимущественно капиллярного типа, имеющих нередко прерывистую базальную мембрану и нарушенную эндотелиальную выстилку. Эндотелий может замещаться опухолевыми клетками, а иногда и вовсе отсутствовать [4].
Роль эфринов в патогенезе ангиогенеза
Роль эфринов в А. была впервые продемонстрирована Pandey A. с соавторами (Pandey et al., 1995). Исследователи обнаружили, что эфрин А1 принимает участие в развитии кровеносных сосудов роговицы глаза, он стимулирует А. in vivo и способствует хемотаксису эндотелиальных клеток in vitro. В дальнейшем в экспериментах in vitro было показано, что и другие белки семейства эфринов (эфрин B1, эфрин B2, эфрин B3) способствуют росту капилляров и «сборке» эндотелиальных клеток внутри сосуда, т.е. стимулируют морфо- и А., а также участвуют в процессах ремоделирования сосудов (Adams et al., 1999; Daniel et al., 1996; Stein et al., 1998) [8].
Полученные результаты были подтверждены исследованиями in vivo в экспериментах на животных (Wang et al., 1998). У эмбрионов мыши с «выключением» гена EFNB2 эфрина B2 наблюдается нарушение кровоснабжения формирующихся органов и тканей, вызванное повреждением кровеносных сосудов (Wang et al., 1998). В исследовании Adams R.H. с соавторами была также показана роль эфрина В3 в процессах А. и ремоделирования сосудов (Adams et al., 1999) [8].
Способность индуцировать и поддерживать А. – важнейший этап развития опухоли. А. лежит в основе разработки методов целенаправленного воздействия на этот процесс как средства терапии рака. В плане возможной разработки препаратов идентифицировано несколько молекулярных мишеней и клеточных путей. Одной из таких мишеней является VEGF [6].
Благодаря расшифровке некоторых молекулярных механизмов канцерогенеза лечение онкологических больных переходит на принципиально новый уровень – воздействие на молекулярные мишени, ответственные за процесс пролиферации злокачественной клетки, гиперэкспрессирующиеся преимущественно в опухоли и являющиеся доступными для идентификации рутинными способами. Результаты внедрения в клиническую практику первых таргетных препаратов, блокирующих ростовые факторы, доказало перспективность данного направления, способного значительно повысить эффективность медикаментозного лечения злокачественных опухолей.
Ингибиторы А. имеют два преимущества над другими лекарствами:
С учетом вышеописанных характеристик VEGF становится ясно, что ингибирование VEGF представляет собой новаторский подход к противоопухолевой терапии, который может:
Можно ожидать, что эти эффекты блокады VEGF на сосудистую сеть опухоли не повлияют на нормальные, зрелые сосуды, выживание которых не зависит от VEGF. Кроме того, ингибирование VEGF дополнило бы современные методы лечения, в частности, химиотерапию и противоопухолевую биотерапию, увеличив проникновение препаратов в опухолевые клетки благодаря обратному развитию аномального сосудистого русла опухоли и снижению внутриопухолевого давления. Эти наблюдения позволяют предполагать, что подавление активности VEGF может стать обоснованным принципом терапии целого ряда опухолей [9].
Целенаправленное воздействие на VEGF препаратом бевацизумаб (Авастин, Ф. Хоффманн-Ля Рош Лтд., Базель, Швейцария), гуманизированным моноклональным антителом класса IgG, в комбинации с известными режимами химиотерапии показало эффективность при лечении раков различной локализации.
Как уже упоминалось, А. играет важную роль в процессе заживления ран, поэтому высказываются опасения, что бевацизумаб может вызвать увеличение осложнений у пациентов, требующих оперативного лечения. Хотя в целом препарат хорошо переносится, примерно у 2% больных описаны серьезные проявления токсичности, включая перфорацию желудочно-кишечного тракта и ухудшение заживления ран, несмотря на то, что после операции препарат вводили с отсрочкой не менее 28 дней. Эти осложнения чаще возникают у тех пациентов, которые были оперированы на фоне терапии бевацизумабом, что имеет очевидные последствия для хирургической практики. Тем не менее, значительное улучшение выживаемости, которое можно получить с помощью бевацизумаба, означает высокую вероятность его широкого применения [6].
Тема нуждается в дальнейших исследованиях, так как абсолютно эффективная ангиогенная терапия рака еще не разработана, а количество людей, в ней нуждающихся, не уменьшается.
Работа выполнена в рамках проектов CRDF-4028 и МНТЦ-1682.
Согласен Данный веб-сайт содержит информацию для специалистов в области медицины. В соответствии с действующим законодательством доступ к такой информации может быть предоставлен только медицинским и фармацевтическим работникам. Нажимая «Согласен», вы подтверждаете, что являетесь медицинским или фармацевтическим работником и берете на себя ответственность за последствия, вызванные возможным нарушением указанного ограничения. Информация на данном сайте не должна использоваться пациентами для самостоятельной диагностики и лечения и не может быть заменой очной консультации врача.
Сайт использует файлы cookies для более комфортной работы пользователя. Продолжая просмотр страниц сайта, вы соглашаетесь с использованием файлов cookies, а также с обработкой ваших персональных данных в соответствии с Политикой конфиденциальности.