анизоцитоз микро эритроцитов что это такое
Что такое анизоцитоз тромбоцитов
Анизоцитоз – это патологическое изменение размера эритроцитов и тромбоцитов крови, возникающее на фоне различных заболеваний человека. Чаще в медицинской практике диагностируется анизоцитоз смешанного типа. Кровь является внутренней средой организма, выполняет важную функцию, обеспечивая все органы и системы кислородом и питательными веществами. Изменение формы и размера клеток этой субстанции чаще свидетельствует о развитии серьезных болезней, но для уточнения диагноза требуются дополнительные медицинские исследования.
Понятие заболевания
Значение понятия анизоцитоз и что это такое? Нормальные эритроциты, входящие в состав крови, называют нормацитами. У здорового человека размер этих клеток соответствует значению 7–7,5 мкм. Диаметр микроцитов составляет 6,9 мкм. Размер мегалоцитов – 12 мкм, макроцитов – 8 мкм. В процентном соотношении количество нормацитов занимает около 70% объема крови, соответственно, количество макроцитов и микроцитов должно быть до 15%. Нарушение этого соотношения свидетельствует о развитии анизоцитоза.
Симптоматика заболевания имеет схожий характер с анемией, сердечной недостаточностью. Пациент чувствует слабость, снижение работоспособности, быстро утомляется. Часто возникает нарушение сердцебиения, отдышка и другие симптомы.
Причины нарушения формы и размера кровяных клеток
Анизоцитоз тромбоцитов и лейкоцитов не относится к самостоятельным заболеваниям. Диаметр, окрас и форма кровяных клеток меняется на фоне различных нарушений у человека.
При длительном течении инфекционных заболеваний, сильной интоксикации организма отмечается транзиторный компенсаторный анизоцитоз. Для этого состояния характерно изменение структуры клеток лимфоцитов и лейкоцитов.
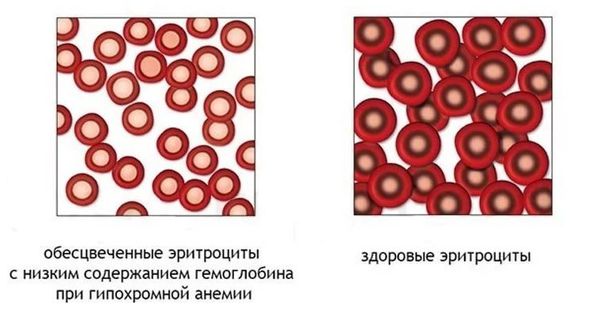
Макроцитоз чаще обнаруживается при анемии, лейкозе, болезнях печени и поджелудочной железы. Нередко в сочетании с этим у пациента диагностируется гипохромия – снижение выработки гемоглобина.
Cимптомы патологии
Анизоцитоз не является самостоятельным заболеванием, состояние характеризуется нарушением состава крови под воздействием той или иной патологии (например, анемии, онкологии, болезни печени). Симптомы этого состояния могут быть самыми разнообразными, что зависит от того, в каком органе происходят патологические изменения.
К общим признакам анизоцитоза относят астению. Понятие подразумевает развитие у человека слабости, быстрой утомляемости, раздражительности. При выполнении нетяжелой физической работы пациент отмечает отдышку, упадок сил. Возникают нарушения со стороны психологического состояния. Нередко нарушается сон, происходят смены настроения, человек становится агрессивным или, наоборот, развивается апатия, нежелание общаться с другими людьми.
У многих больных диагностируется нарушение сердечного ритма. Вследствие этого может возникнуть бледность или покраснение кожных покровов, головокружение, мерцание мушек перед глазами.
Виды и степени анизоцитоза
Анизоцитоз классифицируется в зависимости от того, какие виды кровяных клеток изменены. Патология имеет следующую классификацию:
Кроме этого, различают показатель rdw крови в зависимости от степени:
Учитывая такую классификацию, доктор может дать заключение, например, анизоцитоз смешанного типа умеренный, это означает, что в составе крови присутствуют макро- и микрочастички с измененным размером, а их общее количество составляет не более 50%.
Анизоцитоз у беременных и детей
У новорожденного ребенка часто отмечается физиологический макроцитоз. Объясняется это возрастными особенностями. Как правило, в течение первых 2–3 недель жизни показатели крови самостоятельно нормализуются без дополнительного лечения. Кроме этого, умеренный анизоцитоз у детей может возникать вследствие перенесения инфекционных заболеваний. Норма повышается незначительно, после выздоровления формула крови восстанавливается.
Анизоцитоз при беременности чаще развивается на фоне анемии из-за недостатка в организме железа. Корректируются показатели крови у женщин в положении с помощью правильного питания и приема железосодержащих препаратов.
Диагностика
Анизоцитоз, пойкилоцитоз – это основные показатели развития каких-либо нарушений в организме. Если изменена форма клетки, повышен ее размер или цвет, это свидетельствует о развитии патологического состояния во внутренних органах больного. Диагностика нарушения состава крови проводится исключительно с помощью лабораторного исследования. Для этого человеку назначают общий анализ крови. Дополнительные исследования требуются редко.
Чтобы правильно сдать анализ, больному необходимо придерживаться следующих рекомендаций:
Если пренебрегать данными рекомендациями, анализ будет неточным, что вызовет трудность в постановке диагноза.
Как проводится лечение
Лечение анизоцитоза проводится в зависимости от заболевания, спровоцировавшего нарушение состава крови. Современные технологии, используемые в медицинской практике, позволяют точно определить болезнь, вызвавшую нарушение. При анизоцитозе эритроцитов речь чаще идет о железодефицитной анемии. В этом случае больному назначают специальную диету, включающую продукты с достаточным содержанием железа и медикаментозные средства, восстанавливающие гемоглобин.
При обнаружении в составе крови большого количества клеток с нехарактерным размером и формой на фоне простудных и инфекционных заболеваний проводится дезинтоксикационная терапия, усилия направляются на подавление клеток, вызывающих интоксикацию организма, повышение иммунитета.
При обнаружении онкологии человеку назначают хирургическое лечение, лучевую и химиотерапию. Чем раньше выявлена патология, тем больше шансов справиться с ней, избежать метастаз, смерти больного.
Профилактические мероприятия
Анизоцитоз не является самостоятельной патологией, а лишь сигнализирует о развитии других заболеваний организма, поэтому следует уделить должное внимание профилактике данного состояния. Чтобы избежать изменения состава крови, следует придерживаться таких профилактических мер:
Придерживаясь здорового образа жизни, можно предотвратить серьезные заболевания. Правильное питание, закаливание и занятия спортом позволяют укрепить иммунитет, предотвратить развитие тяжелых патологий.
Еще раз об анемии… Точная дифференциальная диагностика – залог успешного лечения
Куриляк О.А., к.б.н.
Анемией обозначается состояние, которое характеризуется снижением содержания в крови гемоглобина ( 3 4,5-11,0*10 9 /л
Дети до 2 лет: 0,4-1,0 мг/л (7 – 18,0 мкмоль/л)
Итак, на первом этапе в лаборатории следует повести анализ образца на гематологическом анализаторе. При выявлении снижения гемоглобина необходимо прежде всего определить характер анемии: гипо-, нормо- или гиперхромный. Критерием является величина МСН, отражающая, как известно, среднее содержание гемоглобина в эритроците.
Гипохромные анемии характеризуются низким значением МСН ( 95 фл). Значение MCHC тоже не выходит за пределы нормы, а снижение гемоглобина обычно обусловлено резким снижением количества эритроцитов с преобладанием фракции клеток с большим объемом (макроцитов). К данному типу анемий относят В12-дефицитную, фолиеводефицитную и аутоиммунную гемолитическую анемии.
Нормохромные анемии в большинстве случаев являются и нормоцитарными, т.е. все эритроцитарные индексы находятся в пределах нормы (см. Табл. 1). Причиной снижения гемоглобина в этих случаях является снижение общего количества эритроцитов. В группу нормохромно-нормоцитарных анемий входят анемии при острой кровопотере, а также разнообразные гемолитические анемии и анемии при костномозговой недостаточности.
МСН является аналогом цветового показателя (ЦП),который вычисляют в тех случаях, когда в лаборатории нет гематологического анализатора и подсчет эритроцитов осуществляется в камере Горяева. Нормальные значения ЦП находятся в пределах 0,85 – 1,0. Однако, в случае ошибочного подсчета числа эритроцитов, в частности занижения их количества (что при ручном подсчете случается достаточно часто!), цветовой показатель может оказаться близким к единице. Это может служить источником серьезной ошибки на начальном этапе диагностического поиска, которая повлечет за собой назначение необоснованных исследований, и, как следствие, существенно усложнит дифференциальную диагностику.
Алгоритм диагностического поиска при анемии
Гипохромно-микроцитарные анемии
Как было упомянуто выше, при выявлении у пациента гипохромного характера анемии в первую очередь следует заподозрить ЖДА (все ЖДА являются гипохромными!). Однако факт наличия гипохромной анемии сам по себе не исключает других патогенетических вариантов анемии, поскольку не все гипохромные анемии являются железодефицитными. Например, гипохромная анемия может возникать при нарушении синтеза гемоглобина в результате нарушения включения в его молекулу железа при нормальном или даже повышенном уровне железа в сыворотке крови (см. нарушение синтеза порфиринов). Поэтому для дифференциальной диагностики этих состояний следует в первую очередь провести исследование содержания железа в сыворотке. Причем, этот анализ надо выполнять обязательно до назначения больным лекарственных препаратов железа или проведения трансфузий эритроцитов.
Если уровень железа в сыворотке крови находится в пределах нормы или повышен, следует заподозрить у пациента анемию, связанную с нарушением синтеза порфиринов или талассемию и на следующем этапе диагностики целесообразно определить концентрацию ретикулоцитов. Выявление пониженного уровня железа в сыворотке крови однозначно указывает на необходимость определения других показателей обмена железа (ОЖСС и уровень ферритина).
При ЖДА этот показатель снижается (менее 15%), а при перегрузке железом значительно повышается (более 50%).
Еще одним высоко специфичным диагностическим признаком ЖДА является концентрация ферритина в сыворотке крови. Уровень ферритина отражает величину запасов железа в организме. Поскольку истощение запасов железа является обязательным этапом формирования ЖДА, то снижение содержания ферритина (менее 15 мкг/л) – характерный признак не только ЖДА, но и латентного дефицита железа. Однако этот показатель следует оценивать с осторожностью при сопутствующих острых воспалительных процессах, болезнях печени и некоторых опухолях. Дело в том, что ферритин принадлежит к классу острофазных белков и при перечисленных выше состояниях его синтез увеличивается, что при ЖДА может маскировать гипоферритинемию.
снижение содержания ферритина в сыворотке.
Клинический пример №1: У 34-летней женщины выявлена гипохромная микроцитарная анемия с очень низкими MCV (49,0 фл) и МCH (15.0 пг), а также существенно увеличенным значением RDW ( 21.3%).
Т. о., биохимические исследования подтвердили диагноз ЖДА.
После 10-дневного курса терапии пероральными препаратами железа отмечено увеличение RDW, а также появление на гистограмме распределения эритроцитов по объему второго пика в области нормоцитов (отмечен стрелкой).
Полученная кривая свидетельствует об адекватности назначенного лечения.
Таким образом, по данным гемограммы анемия отсутствует. Однако, в картине крови преобладают микроциты с низким содержанием гемоглобина. Наиболее вероятен диагноз – латентный дефицит железа.
2. Анемии при хронических заболеваниях (АХЗ) = железораспределитель-ные анемии
Среди микроцитарно-гипохромных анемий второе место по частоте после ЖДА занимают анемии при различных воспалительных заболеваниях как инфекционного, так и неинфекционного происхождения.
При всем многообразии патогенетических механизмов анемий в данных ситуациях одним из основных при АХЗ считается перераспределение железа в клетки макрофагальной системы, активирующейся при различных воспалительных или опухолевых процессах. Поступающее в организм и высвобождающееся из разрушающихся эритроцитов железо переходит, главным образом, в депо, где и накапливается в макрофагальных клетках в виде железосодержащего белка ферритина. В то же время, перенос железа из клеточного ферритина к трансферрину нарушен, что влечет за собой снижение уровня сывороточного железа. Развивается перераспределительный, или функциональный, дефицит железа вследствие накопления и блокады освобождения железа в тканевых макрофагах, что приводит к снижению доставки железа к эритрокариоцитам костного мозга, нарушению эритропоэза и развитию анемии. Поскольку истинного дефицита железа при этих АХЗ не наблюдается, более оправданно говорить не о железодефицитных, а о железоперераспределительных анемиях. Выделение железоперераспределительных анемий в отдельный патогенетический вариант имеет важное значение, так как при сходстве данного варианта с ЖДА терапевтические подходы при этих анемиях абсолютно различны.
Критерии железоперераспределительных анемий:
3. Анемии, связанные с нарушением синтеза порфиринов = сидероахрести-ческие анемии
Картина гемограммы при данном типе анемий аналогична таковой при ЖДА, поэтому для уточнения диагноза следует обращать пристальное внимание на биохимические показатели обмена железа (Табл.3).
Критериями сидероахрестических анемий являются:
Пациентку лечили препаратами железа. Эффекта не было. После проведения дополнительных исследований получены следующие результаты:
Поскольку при мегалобластном типе кроветворения соотношение лейкопоэз/эритропэз сдвигается в сторону эритропоэза, при анализе гемограммы обычно отмечается лейкопения и тромбоцитопения, которые носят умеренно выраженный характер. Нарушение процессов созревания гранулоцитарного ростка приводит к появлению в крови гигантских гиперсегментированных нейтрофилов.
На этапе синдромной диагностики основным методом является исследование костного мозга, при котором выявляется мегалобластический тип кроветворения с высоким уровнем неэффективного эритропоэза. Данное исследование должно проводиться до назначения витамина В12, т.к. иньекция В12 в течение 1-2 суток изменяет тип кроветворения в костном мозге. Мегалобласты уменьшаются в размерах, меняется структура ядра, клетки становятся макронормобластами. Только по присутствию гиганских форм нейтрофилов можно предположить, что имело место мегалобластическое кроветворение. При невозможности выполнить диагностическое исследование костного мозга допустимо пробное назначение витамина В12 с последующим обязательным исследованием количества ретикулоцитов через 3–5 дней (не позже), приобретающим диагностическое значение. Если анемия связана с дефицитом витамина В12, то под влиянием нескольких инъекций препарата происходит трансформация мегалобластического кроветворения в нормобластическое, что приводит к значительному увеличению в периферической крови количества ретикулоцитов по сравнению с исходным (ретикулоцитарный криз).
Окончательная верификация В12-дефицитного характера анемии может быть осуществлена с помощью исследования концентрации в крови витамина В12 (норма для взрослых: 148-616 пмоль/л, старше 60-ти лет: 81-568 пмоль/л).
Макроцитоз в комбинации с гиперсегментацией нейтрофилов и дефицитом витамина В12 подтверждают диагноз В12-дефицитной анемии.
Фолиево-дефицитные анемии
Фолиево-дефицитные анемии по своим гематологическим признакам (макроцитоз, мегалобластический эритропоэз) аналогичны В12-дефицитным анемиям. Отличительной особенностью является снижение в сыворотке крови уровня фолата (норма 6-20 нг/мл), а также снижение его концентрации в эритроцитах (норма 160-640 нг/мл).
Нормохромно-нормоцитарные анемии
1. Гемолитические анемии ГА
Основным патогенетическим механизмом развития гемолитической анемии (ГА) является укорочение продолжительности жизни эритроцитов (в норме в среднем 120 дней) и их преждевременный распад под воздействием различных причин.
Критерии ГА:
Большинство ГА являются нормохромными, за исключением ГА, связанной с нарушением синтеза глобина (талассемия), которая, как было отмечено выше, является гипохромной. Основным лабораторным признаком, позволяющим заподозрить ГА, является повышение в крови количества ретикулоцитов, в связи с чем данный анализ следует считать обязательным при всех неясных анемиях. Фактически ретикулоцитоз встречается в двух ситуациях, при которых активируется нормальный эритропоэз – при гемолизе и острых кровопотерях. Наряду с ретикулоцитозом при интенсивном гемолизе в крови обнаруживаются ядросодержащие эритроидные клетки (эритрокариоциты), обнаруживаемые в норме только в костном мозге. Наличие или отсутствие гипербилирубинемии определяется, с одной стороны, интенсивностью гемолиза, а с другой – функциональной способностью печени связывать билирубин с глюкуроновой кислотой и экскретировать его в желчь. Поэтому нормальные показатели содержания билирубина в крови не исключают гемолиза. При некоторых ГА, сопровождающихся внутрисосудистым гемолизом (болезнь Маркиафавы, аутоиммунные ГА), в крови увеличивается содержание свободного гемоглобина, выделяющегося с мочой в виде гемосидерина. Последний может быть обнаружен в моче с помощью бензидиновой пробы (аналогичной исследованию скрытой крови в кале) или при окраске осадка мочи на выявление гемосидерина. Эти информативные тесты должны чаще использоваться в лабораторной практике при подозрении на внутрисосудистый гемолиз.
Наследственные ГА связаны с различными генетическими дефектами, в частности с дефектом мембраны эритроцитов (наследственный микросфероцитоз, овалоцитоз), дефицитом некоторых ферментов в эритроцитах (глюкозо-6-фосфат-дегидрогеназа, пируваткиназа и др.), нарушением синтеза цепей глобина (талассемия), наличием нестабильных гемоглобинов.
Среди приобретенных ГА наиболее распространенными являются аутоиммунные ГА (симптоматические и идиопатические). Симптоматические аутоиммунные ГА возникают на фоне лимфопролиферативных заболеваний (хронический лимфолейкоз, лимфогранулематоз и др.), системных васкулитов (системная красная волчанка, ревматоидный артрит), хронического активного гепатита, некоторых инфекций, в частности, вирусных, при приеме ряда медикаментов (альфа-метилдопа). Если причина аутоиммунного гемолиза не выявляется, то говорят об идиопатических ГА. К приобретенным ГА относятся болезнь Маркиафавы (перманентный внутрисосудистый гемолиз), микроангиопатические ГА (гемолиз вследствие ДВС-синдрома на фоне различных заболеваний), механический гемолиз при протезированных сосудах и клапанах сердца, маршевой гемоглобинурии, ГА при воздействии различных токсических веществ (уксусная кислота, мышьяк и др.).
При наличии соответствующих подозрений уточнению причины ГА, т.е. нозологической диагностике, могут способствовать следующие исследования:
2. Анемии при костномозговой недостаточности
В основе данного патогенетического варианта анемий лежит нарушение нормальной продукции эритроидных клеток в костном мозге. При этом часто одновременно с угнетением эритропоэза имеется нарушение продукции клеток гранулоцитарного и тромбоцитарного ростков, что отражается на составе периферической крови (панцитопения) и служит ориентиром в распознавании возможного механизма развития анемии.
Критерии анемии при костномозговой недостаточности:
Ключевой особенностью, позволяющей предположить данный патогенетический вариант анемий, является нарушение со стороны других ростков костного мозга (гранулоцитопения, тромбоцитопения), что может проявляться соответствующей клинической симптоматикой в виде инфекционных осложнений (часто отмечается только лихорадка) или геморрагического синдрома (зависит от выраженности тромбоцитопении). Уместно напомнить, что при В12-дефицитной анемии также может наблюдаться лейко- и тромбоцитопения, однако цитопении при этом выражены умеренно и обычно не сопровождаются описанными симптомами.
Анемия при костномозговой недостаточности может возникать при следующих заболеваниях и патологических процессах: острые и хронические лейкозы; метастазы злокачественных опухолей в костный мозг; замещение костного мозга фиброзной тканью (миелофиброз) вследствие различных причин; замещение костного мозга жировой тканью (апластическая анемия) вследствие различных причин; изолированное угнетение продукции эритроидных клеток костного мозга, чаще иммунной природы (парциальная красноклеточная анемия); миелодиспластический синдром (гетерогенная группа гематологических нарушений, одними из которых являются так называемые рефрактерные анемии).
Фактически с помощью исследования костного мозга (цитологического, гистологического) при данном патогенетическом варианте осуществляется нозологическая диагностика, хотя часто требуется уточнение формы и причины выявленных изменений.
В основе развития анемии может лежать так называемый миелодиспластический синдром (МДС), который является результатом приобретенного дефекта стволовой клетки-предшественницы миелопоэза, что приводит к нарушению нормальной дифференцировки клеток различных ростков костного мозга (эритроидного, гранулоцитарного, тромбоцитарного). В результате этого гемопоэз оказывается неэффективным, что в конечном счете проявляется цитопениями в различных сочетаниях. Неэффективность эритропоэза позволяет трактовать анемию при МДС как следствие костномозговой недостаточности. Основным признаком, позволяющим заподозрить МДС, является бедность клетками периферической крови в сочетании с высокой клеточностью костного мозга и признаками дисплазии всех ростков кроветворения. МДС встречается почти исключительно у больных пожилого и старческого возраста, характеризуется анемией, рефрактерной к лечению препаратами железа, витамином В12, фолиевой кислотой, повышением в костном мозге эритроидных клеток, содержащих железо (рефрактерная анемия с сидеробластами).
3. Анемия при уменьшении массы циркулирующих эритроцитов
Данный патогенетический вариант анемии отличается от остальных и характеризуется уменьшением количества эритроцитов и гемоглобина за счет уменьшения массы циркулирующей крови. Основной причиной развития данного варианта анемий являются острые кровопотери различной локализации.
Основные признаки анемии при уменьшении массы эритроцитов:
Что такое гипохромная анемия? Причины возникновения, диагностику и методы лечения разберем в статье доктора Рубцова Е. В., терапевта со стажем в 21 год.
Определение болезни. Причины заболевания
Гипохромная анемия (Hypochromic anemia) — это вид анемии, при котором уровень цветового показателя крови ниже 0,8 из-за недостатка гемоглобина в эритроцитах. Гипохромия часто сочетается с микроцитозом — уменьшением размера эритроцитов.
Характерными жалобами при гипохромной анемии являются общая слабость, быстрая утомляемость, головокружение, выпадение волос, ломкость ногтей и др.
К гипохромным относятся:
Распространённость гипохромной анемии
Наследственные причины гипохромной анемии
Приобретённые причины гипохромной анемии
1. В организм поступает недостаточно железа из-за полного или частичного отказа от животного белка (мяса). Такие анемии встречаются у вегетарианцев.
2. Железо не всасывается в желудочно-кишечном тракте. Причинами могут быть:
3. Организму требуется больше железа, чем обычно:
4. Железо не поступает в клетки из-за нарушения синтеза трансферрина — главного белка-переносчика железа в плазме крови. Трансферрин связывается с железом, которое поступает с едой или при разрушении эритроцитов, и переносит его к органам и тканям. Производится в печени из аминокислот, образующихся при расщеплении белковой пищи, поэтому его количество в крови зависит от состояния печени, питания человека и от работы кишечника. Уровень трансферрина падает, если в печени разрастается рубцовая ткань (развивается цирроз), если человек ест недостаточно белковой пищи или у него нарушено всасывание аминокислот из-за воспаления в кишечнике.
Симптомы гипохромной анемии
Симптоматика зависит от вида анемии и степени тяжести. Основным общим признаком является бледность кожи.
Симптомы железодефицитной анемии
Для ЖДА характерны два синдрома:
1. Общеанемический синдром. Проявляется общей слабостью, быстрой утомляемостью, беспокойством, головокружением, головными болями, предобморочными состояниями при нормальном уровне артериального давления, повышением температуры тела до 37–37,5 °C и т. д. Чем дольше протекает скрытая фаза анемии, тем менее выражены жалобы пациента. Причина в том, что организм адаптируется к нарушениям при анемии, например приспосабливается к кислородному голоданию.
2. Сидеропенический синдром. Возникает при недостатке железа в клетках, при этом нарушается строение слизистых оболочек и кожи. Основные проявления:
Симптомы талассемии
Есть несколько видов талассемии. Симптомы и время их появления будут зависеть от типа и тяжести заболевания. При самой лёгкой степени тяжести у пациента не будет никаких признаков, самая тяжёлая степень обычно несовместима с жизнью. У некоторых детей симптомы талассемии появляются при рождении, у других развиваются в течение первых двух лет жизни.
Основные проявления талассемии:
Патогенез гипохромной анемии
Основной патогенетический механизм развития гипохромной анемии связан с причиной.
Механизм развития железодефицитной анемии
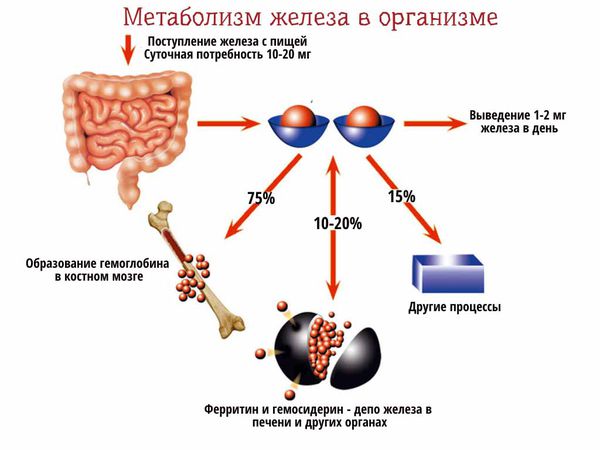
Железо не вырабатывается в организме. Оно поступает вместе с пищей в двух формах: двухвалентной (мясо) и трёхвалентной (растительная пища). Двухвалентная форма всасывается легче, трёхвалентная сначала должна вступить в химическую реакцию с соляной кислотой и перейти в двухвалентную форму. Затем железо всасывается в двенадцатиперстной и тонкой кишке, оттуда попадает в кровь, где соединяется с белком-переносчиком — трансферрином.
Основное количество железа в соединении с трансферрином переносится в костный мозг. Здесь железо включается в состав белка гемоглобина, который является строительным материалом для эритроцитов. Эритроциты переносят кислород от лёгких к органам, а на обратном пути избавляют их от углекислого газа, т. е. отвечают за газовый состав организма. Другая часть железа попадает в печень, почки, селезёнку и другие органы, где откладывается (депонируется) в виде белка ферритина.
Если железо не поступает в организм или его поступает мало, организм сначала расходует его запасы из органов-депо. Этого достаточно, чтобы некоторое время поддерживать адекватный уровень гемоглобина и сывороточного железа. Когда депо опустошается, в работу включается костный мозг. И только когда истощается костный мозг, уровень гемоглобина снижается, что можно увидеть в общем анализе крови (ОАК).
Если уровень гемоглобина в крови падает, органы не получают достаточно кислорода и перестают нормально работать. В первую очередь страдают жизненно важные органы: головной мозг, сердечно-сосудистая система, почки, печень и т. д. Из-за этого развиваются дистрофические процессы, например миокардиодистрофия (невоспалительное поражение сердечной мышцы).
Механизм развития талассемии
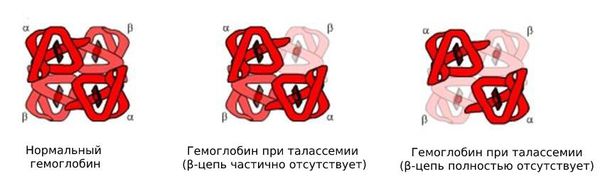
Гемоглобин состоит из четырёх цепей белка глобина: двух α- и двух β-цепей. При талассемии из-за генетической мутации нарушается синтез одной из цепей. Если мутация затронула α-цепи, развивается α-талассемия, если повреждена β-цепь — β-талассемия.
Классификация и стадии развития гипохромной анемии
Классификация анемий по цветовому показателю:
Классификация железодефицитной анемии
Этиологическая классификация ЖДА по Camaschella C. [33]
По степени тяжести:
По клиническим появлениям [16]
Классификация талассемии
По типам:
Степени тяжести α-талассемии:
Степени тяжести β-талассемии:
Осложнения гипохромной анемии
Осложнения железодефицитной анемии
Осложнения анемии связаны с тем, что постепенно нарастает кислородное голодание (гипоксия) жизненно важных органов, в первую очередь сердца, головного мозга и почек. Их работа нарушается.
Сердечно-сосудистая и дыхательная системы. Тяжёлая анемия может стать причиной миокардиодистрофии и сердечной недостаточности, которая проявляется учащённым сердцебиением, перебоями в работе сердца, одышкой при физических напряжениях и др.
Почки и печень. При гипоксии этих органов появляются признаки почечной и печёночной недостаточности. Пациент при этом замечает нарушение оттока мочи и изменение цвета кожи.
Осложнения железодефицитной анемии при беременности
Кроме этого, анемия приводит к кислородному голоданию плода, что негативно сказывается на физическом и умственном развитии ребёнка:
Осложнения талассемии
Диагностика гипохромной анемии
Раньше анемию диагностировали только при снижении уровня гемоглобина, когда у пациента была явная картина гипоксии тканей и органов. Сейчас общепринято, что диагноз «железодефицитная анемия» необходимо ставить до развития явной клинической картины заболевания, так как появление жалоб и снижение уровня гемоглобина — это уже поздняя стадия. Выставлять диагноз и начинать терапию нужно в период латентного течения анемии, т. е. на этапе снижения уровня ферритина в крови.
Талассемия, как правило, диагностируется в детстве. Хотя при малых и промежуточных формах концентрация гемоглобина может быть снижена незначительно, в этом случае нарушений со стороны органов не будет. Таким пациентам диагноз обычно устанавливают во взрослом возрасте, когда видят гипохромию с нормальным обменом железа.
Диагноз «гипохромная анемиия» ставится на основании характерной клинико-гематологической картины и лабораторных доказательств абсолютного дефицита железа.
Сбор жалоб и анамнеза
На приёме пациент может жаловаться на общую слабость, утомляемость, выпадение волос и другие симптомы. При сборе анамнеза врач спросит про хронические заболевания, их осложнения и патологические кровотечения.
Осмотр и физикальное обследование
При осмотре врач оценивает состояние кожи, видимых слизистых оболочек и ногтей, проводит аускультацию (выслушивание) сердца, измеряет пульс, артериальное давление и частоту сердечных сокращений. Также доктор пальпирует (прощупывает) внутренние органы, например печень, селезёнку и лимфатические узлы. При анемии они могут быть увеличены. Полученные данные помогают выбрать тактику ведения пациента.
Лабораторная диагностика
Общий анализ крови:
Биохимический анализ крови:
Опасность в том, что кроме общей слабости пациента часто ничего не беспокоит. Если больной обращается с симптомами анемии, врач должен исключить онкозаболевание до начала терапии. Дело в том, что на фоне приёма препаратов железа показатели крови улучшаются, поэтому пациенты не обследуются дальше. Тем временем опухоль прогрессирует, и при повторном обращении онкологический процесс диагностируется уже в запущенной стадии.
Дополнительные исследования
Чтобы выявить возможный источник кровотечения и сопутствующие патологии, проводятся:
При подозрении на сопутствующие патологии могут потребоваться консультации узких специалистов: гастроэнтеролога, стоматолога, ЛОРа, онколога, нефролога, фтизиатра, пульмонолога, гинеколога, эндокринолога, гематолога, проктолога или инфекциониста.
Лечение гипохромной анемии
Лечение железодефицитной анемии
Терапия ЖДА включает:
Диетотерапия
Яблоки, гранаты, сок красного цвета (свёклы или томатов) не могут компенсировать нехватку железа.
Лечение пероральными препаратами железа
Используются две группы препаратов:
Отличие групп препаратов железа
Препараты железа не задерживаются в организме и быстро выводятся почками, поэтому быстро восполнить дефицит железа не получится. Чтобы восполнить запасы железа, доза должна составлять от 100 до 300 мг двухвалентного железа в сутки в форме таблеток. Повышать дозировку не имеет смысла, так как всасывание железа при этом не увеличивается, избыток будет уходить с калом.
Возможные побочные эффекты. Все препараты, содержащие соли железа, могут вызывать раздражение слизистой оболочки желудка. Поэтому иногда возникают побочные эффекты в виде рвоты, диареи или изжоги. Чтобы от них избавиться, необходимо:
Кальций, йод, магний, цинк, хром и селен, содержащиеся в продуктах питания и в добавках, тоже препятствуют усвоению железа, поэтому не следует принимать их вместе.
Лечение парентеральными препаратами железа
Показания к парентеральному введению препаратов железа:
Препараты для парентерального введения: Феринжект, Феррактин, Феррум Лек, Фербитол, Эктофер. Препараты назначает только лечащий врач после проведённого обследования и уточнения вида анемии. Переизбыток железа в некоторых случаях ещё опаснее, чем его недостаток: портится эмаль, могут развиться тяжёлые токсические гепатиты до трансформации в цирроз и др.
Гемотрансфузия (переливание эритроцитарной массы)
Переливание эритроцитарной массы может потребоваться по индивидуальным показаниям, которые определяет лечащий врач. Показаниями могут быть:
Лечение талассемии
При всех формах талассемии показан приём витаминов группы В. При развитии гиперспленизма, при котором селезёнка увеличивается и активно разрушает клетки крови, необходимо удалить селезёнку.
Прогноз. Профилактика
Прогноз будет хорошим, если выявить анемию на латентной стадии, правильно определить причину и назначить адекватное лечение.
Неблагоприятным прогноз может быть при анемиях на фоне онкозаболевания и генетических нарушений, так как они плохо поддаются лечению. Например, при большой β- талассемии, если болезнь не диагностировать в первые месяцы жизни ребёнка и не начать терапию, средняя продолжительность жизни составит около четырёх лет.
Первичная профилактика ЖДА и латентного дефицита железа — это адекватное, сбалансированное питание.
Профилактические дозы препаратов железа рекомендуется назначать:
Профилактика анемии также включает в себя регулярные обследования у терапевта: если нет хронических заболеваний, то нужно приходить на профилактические осмотры 1 раз в год и делать клинический минимум анализов и обследований (общий и биохимический анализы крови).
Вторичная профилактика проводится пациентам, которые прошли основной курс терапии, у них восстановились показатели крови, но при этом сохраняются причины, которые могут привести к рецидиву гипохромной анемии: обильные менструации, фибромиома матки, рецидивирующий геморрой и др. [3] Необходимость профилактического приёма препаратов железа, а также дозировки определяет лечащий врач.
Все пациенты с гипохромной анемией средней и тяжёлой степени должны стоять на диспансерном учёте у терапевта по месту жительства. Кратность посещения врача и объём обследований определяется индивидуально для каждого пациента, учитывая степень тяжести анемии и наличие сопутствующей патологии. Если пациента ничего не беспокоит, рекомендуется приходить к врачу 2 раза в год.
При выявлении анемии по результатам анализа не следует заниматься самолечением, нужно сразу обратиться к врачу и выяснить основную причину. Во многих случаях требуется лечение первичного заболевания, а не просто приём препаратов железа.