антибиотикограмма что значит резистентно
ОПРЕДЕЛЕНИЕ ЧУВСТВИТЕЛЬНОСТИ К АНТИБИОТИКАМ:
МЕТОДЫ, РЕЗУЛЬТАТЫ, ОЦЕНКА
Решедько Галина Константиновна,
к.м.н., ассистент кафедры клинической фармакологии
Смоленской государственной медицинской академии
214019, г.Смоленск, ул.Крупской, 28, а/я № 5.
Тел.: +7(0812) 61 13 01, 61 13 27, Факс: (0812) 61 12 94,
E-Mail: galina@antibiotic.ru
Содержание
Резюме
В лекции рассмотрены основные методы определения чувствительности in vitro микроорганизмов к антимикробным препаратам (диско-диффузионный, Е-тестов, методы разведения). Отражены подходы к эмпирическому и этиотропному назначению антибиотиков в клинической практике. Обсуждены вопросы интерпретации результатов определения чувствительности с клинической и микробиологической точек зрения.
В настоящее время в клинической практике существуют два принципа назначения антибактериальных препаратов: эмпирическое и этиотропное. Эмпирическое назначение антибиотиков основано на знаниях о природной чувствительности бактерий, эпидемиологических данных о резистентности микроорганизмов в регионе или стационаре, а также результатах контролируемых клинических исследований. Несомненным преимуществом эмпирического назначения химиопрепаратов является возможность быстрого начала терапии. Кроме того, при таком подходе исключаются затраты на проведение дополнительных исследований.
|
Однако при неэффективности проводимой антибактериальной терапии, при нозокомиальных инфекциях, когда затруднительно предположить возбудителя и его чувствительность к антибиотикам стремятся проводить этиотропную терапию. Этиотропное назначение антибиотиков предполагает не только выделение возбудителя инфекции из клинического материала, но и определение его чувствительности к антибиотикам. Получение корректных данных возможно только при грамотном выполнении всех звеньев бактериологического исследования: от взятия клинического материала, транспортировки его в бактериологическую лабораторию, идентификации возбудителя до определения его чувствительности к антибиотикам и интерпретации полученных результатов.
|
Методы определения чувствительности к антибиотикам
Методы определения чувствительности бактерий к антибиотикам делятся на 2 группы: диффузионные и методы разведения.
Рисунок 1. Определение чувствительности микроорганизмов диско-диффузионным методом.
Определение чувствительности микроорганизма с помощью Е-теста проводится аналогично тестированию диско-диффузионным методом. Отличие состоит в том, что вместо диска с антибиотиком используют полоску Е-теста, содержащую градиент концентраций антибиотика от максимальной к минимальной (рис. 2). В месте пересечения эллипсовидной зоны подавления роста с полоской Е-теста получают значение минимальной подавляющей концентрации (МПК).
Рисунок 2. Определение чувствительности микроорганизмов с помощью Е-тестов.
Несомненным достоинством диффузионных методов является простота тестирования и доступность выполнения в любой бактериологической лаборатории. Однако с учетом высокой стоимости Е-тестов для рутинной работы обычно используют диско-диффузионный метод.
Рисунок 3. Определение значения МПК методом разведения в жидкой питательной среде.
Интерпретация результатов определения чувствительности
На основании получаемых количественных данных (диаметра зоны подавления роста антибиотика или значения МПК) микроорганизмы подразделяют на чувствительные, умеренно резистентные и резистентные (рис. 4). Для разграничения этих трех категорий чувствительности (или резистентности) между собой используют так называемые пограничные концентрации (breakpoint) антибиотика (или пограничные значения диаметра зоны подавления роста микроорганизма).
Рисунок 4. Интерпретация результатов определения чувствительности бактерий в соответствии со значениями МПК.
Существуют два подхода к интерпретации результатов определения чувствительности: микробиологический и клинический. Микробиологическая интерпретация основана на анализе распределения значений концентраций антибиотика, подавляющих жизнеспособность бактерий. Клиническая интерпретация основана на оценке эффективности антибактериальной терапии.
Чувствительные микроорганизмы (susceptible)
Клинически к чувствительным относят бактерии (с учетом параметров, полученных in vitro), если при лечении стандартными дозами антибиотика инфекций, вызываемых этими микроорганизмами, наблюдают хороший терапевтический эффект.
При отсутствии достоверной клинической информации подразделение на категории чувствительности базируется на совместном учете данных, полученных in vitro, и фармакокинетики, т.е. на концентрациях антибиотика, достижимых в месте инфекции (или в сыворотке крови).
Резистентные микроорганизмы (resistant)
К резистентным (устойчивым) относят бактерии, когда при лечении инфекции, вызванной этими микроорганизмами, нет эффекта от терапии даже при использовании максимальных доз антибиотика. Такие микроорганизмы имеют механизмы резистентности.
Микроорганизмы c промежуточной резистентностью (intermediate)
Клинически промежуточную резистентность у бактерий подразумевают в случае, если инфекция, вызванные такими штаммами, может иметь различный терапевтический исход. Однако лечение может быть успешным, если антибиотик используется в дозировке, превышающей стандартную, или инфекция локализуется в месте, где антибактериальный препарат накапливается в высоких концентрациях.
С микробиологической точки зрения к бактериям с промежуточной резистентностью относят субпопуляцию, находящуюся в соответствии со значениями МПК или диаметра зон, между чувствительными и резистентными микроорганизмами. Иногда штаммы с промежуточной резистентностью и резистентные бактерии объединяют в одну категорию резистентных микроорганизмов.
Необходимо отметить, что клиническая интерпретация чувствительности бактерий к антибиотикам является условной, поскольку исход терапии не всегда зависит только от активности антибактериального препарата против возбудителя. Клиницистам известны случаи, когда при резистентности микроорганизмов, по данным исследования in vitro, получали хороший клинический эффект. И наоборот, при чувствительности возбудителя может наблюдаться неэффективность терапии.
В определенных клинических ситуациях, когда недостаточно результатов исследования чувствительности обычными методами, определяют минимальную бактерицидную концентрацию.
Значение МБК используют при терапии антибиотиками, обладающими бактериостатическим действием, или при отсутствии эффекта от антибактериальной терапии у особой категории больных. Частными случаями для определения МБК могут быть, например, бактериальный эндокардит, остеомиелит или генерализованные инфекции у пациентов с иммунодефицитными состояниями.
В заключение хотелось бы отметить, что на сегодняшний день не существует методов, которые позволили бы с абсолютной достоверностью прогнозировать клинический эффект антибиотиков при лечении инфекционных болезней. Однако, данные результатов определения чувствительности могут служить хорошим ориентиром клиницистам для выбора и коррекции антибактериальной терапии.
Таблица 1. Критерии интерпретации чувствительности бактерий
Когда «работает» не все: определение чувствительности к антибиотикам
Всемирная организация здравоохранения заявляет: «Устойчивость бактерий к антибиотикам возрастает до угрожающе высоких уровней во всем мире». В таких условиях даже «банальный» отит или тонзиллит может приобретать затяжное, осложненное течение, не говоря о риске в отношении потенциально летальных инфекций. Как выяснить какой препарат эффективен против «своей» патогенной флоры? И какой анализ выбрать?
«Классический» способ
Некоторые представители бактериальной флоры обладают поразительной способностью к мутациям. Бактерии, еще вчера чувствительные к простому пенициллину, сегодня – «не реагируют» на куда более «продвинутые» антибиотики.
Поэтому в современной медицине лечение бактериальных процессов без понимания особенностей возбудителя представляется «занятием» сомнительным и бесперспективным. В лучшем случае, воспаление просто «затихнет» на короткое время, а в худшем – разовьется до угрожающих жизни масштабов.
Особенно опасна такая ситуация в отношении хирургических больных, новорожденных и людей с ослабленным иммунитетом, а также тех, для кого прием антибиотиков стал нормой жизни.
Микробиологические способы идентификации возбудителей уже давно используются медициной всего мира, а современные анализаторы сделали этот процесс быстрее и эффективнее.
Так, посев на флору с определением чувствительности к антибиотикам позволяет не только «узнать» бактерии, но и проверить их чувствительность к стандартному (6-8) или расширенному (до 12) спектру антибиотиков.
В результате будет указан не только вид бактерий, но и их количество и реакция на препарат:
Правда у анализа есть и недостатки:
Новое поколение
Потребность медицины в быстром и качественном микробиологическом исследовании «подтолкнула» науку к созданию метода MALDI-TOF MC, удостоенного Нобелевской премии в 2002 году.
Метод основан на идентификации уникального белкового состава бактерий, представляющего собой своего рода «отпечаток пальца». Его точность достигает 98%. А в анализатор заложена информация более чем о 750 видах клинически значимых микроорганизмах, с возможностью «обновления базы данных».
Кроме того, примененеие идентификации MALDI-TOF MC в составе комплексных исследований позволяет проверить чувствительность микрофлоры к 18-20 препаратам, против максимально-возможных 12 у предыдущих «поколениях» посевов. В результате анализа теперь можно увидеть не только эффективность антибиотика, но и подобрать по протоколу минимальную действующую дозу препарата.
Метод полностью автоматизирован, что исключает влияние человеческого фактора на результат. А готовность исследования составляет максимум 4 дня.
Инфографика: резистентность к антибиотикам
Поделиться:
Революция в медицине
Открытию антибиотиков человечество обязано Александру Флемингу, который первым в мире смог выделить пенициллин. «В тот день, когда я проснулся утром 28 сентября 1928 года, я, конечно, не планировал совершать своим открытием первого в мире антибиотика революцию в медицине… Однако, похоже, именно это я и сделал», — говорил сам ученый.
Труды Флеминга были оценены по заслугам. Вместе с Эрнстом Борисом Чейном и Ховардом Уолтером Флори, которые занимались очисткой пенициллина, он был удостоен Нобелевской премии.
Образцы той самой плесени, которую вырастил Флеминг в 1928 году, были отправлены многим знаменитостям — среди них некоторые ученые-современники, а также Папа Римский Пий XII, Уинстон Черчилль и Марлен Дитрих. Не так давно уцелевший и дошедший до нас фрагмент плесени был продан на одном из лондонских аукционов — стоимость образца составила 14 617 долларов США.
Стремительное развитие
Начиная с 1940-х годов, новые антибиотики стали появляться один за другим: за пенициллином последовали тетрациклин, эритромицин, метициллин, ванкомицин и многие другие. Эти препараты в корне изменили медицину: заболевания, в большинстве случаев считавшиеся смертельными, теперь стало возможно вылечивать. Так, например, до открытия антибиотиков почти в трети случаев пневмония оказывалась смертельной, после начала использования пенициллина и других препаратов смертность сократилась до 5 %.
Однако чем больше появлялось антибиотиков и чем шире они применялись, тем чаще встречались бактериальные штаммы, устойчивые к действию этих препаратов. Микроорганизмы эволюционировали, приобретая резистентность к антибиотикам. Устойчивый к пенициллину пневмококк появился в 1965 году, а резистентный к метициллину золотистый стафилококк, который и по сей день остается одним из возбудителей наиболее опасных внутрибольничных инфекций, был обнаружен в 1962 году, всего через 2 года после открытия метициллина.
Появление и широкое использование антибиотиков действительно ускорило процесс формирования мутаций, отвечающих за резистентность, но не инициировало его. Бактериальная устойчивость (точнее, мутации, отвечающие за нее) появилась задолго до того, как люди начали использовать антибиотики. Так, бактериальный штамм, ставший причиной дизентерии у одного из солдат, умерших во время Первой мировой войны, был устойчив и к пенициллину, и к эритромицину. Эритромицин же был открыт лишь в 1953 году.
При этом количество бактерий, приобретающих устойчивость к антибиотикам, ежегодно увеличивается, а антибиотики новых классов, обладающие принципиально новым механизмом действия, практически не появляются.
Последний бастион
Из-за того, что колистин высокотоксичен для почек, его назначали лишь в безнадежных случаях, когда другие препараты оказывались бессильны. После 2008 года и этот бастион пал — в организме заболевших пациентов стали обнаруживать бактерии, устойчивые к колистину. Микроорганизм был найден у пациентов в Китае, странах Европы и Америки. К 2017 году зарегистрировано несколько смертей от инфекции, вызванной супербактериями, — помочь таким пациентам не смог ни один антибиотик.
Причина в пациентах
В 2015 году Всемирная организация здравоохранения провела опрос среди жителей 12 стран. В нем приняли участие почти 10 тысяч человек. Всем участникам нужно было ответить на вопросы о применении антибиотиков и развитии устойчивости к этим препаратам.
Оказалось, что почти две трети опрошенных лечат с помощью антибиотиков грипп, а около 30 % прекращают принимать антибиотики при первых улучшениях. Респонденты продемонстрировали удивительное невежество не только в правилах приема антибиотиков, но и в вопросах, касающихся антибиотикоустойчивости. Так, 76 % участников опроса были уверены, что устойчивость приобретают не бактерии, а организм самого пациента. 66 % считают, что, если принимать антибиотики, то антибиотикоустойчивая инфекция не страшна.
Все это свидетельствует о том, что люди знают об антибиотиках и резистентности к ним микроорганизмов удручающе мало, а угрозу того, что эти лекарственные препараты перестанут работать, не принимают всерьез.
Соблюдайте правила
Между тем, вероятность того, что уже в этом веке человечество останется без антибиотиков, достаточно высока. Эксперты ВОЗ и другие специалисты в области здравоохранения убеждают общество пользоваться антибиотиками с умом.
Читайте также:
Опасные комбинации препаратов
Прежде всего стоит помнить: лекарство должен назначать врач, а сам антибиотик — продаваться по рецепту. Курс антибиотиков нужно проходить целиком, а не прекращать прием лекарства после первых улучшений. В том случае, если после завершения лечения у вас остаются неиспользованные таблетки, не нужно предлагать их своим друзьям и родным. В каждом конкретном случае назначить лекарство должен врач, и, возможно, ваши препараты не подойдут другим людям.
Фармпроизводителей же ВОЗ стимулирует активнее заниматься разработкой новых антибиотиков, подчеркивая, что сейчас в разработке находится около полусотни антибиотиков, лишь 8 (!) из которых относятся к инновационным препаратам. Эксперты подчеркивают, что этого количества явно недостаточно для обеспечения человечества необходимыми лекарствами — ведь по статистике только 14 % лекарств доходят до потребителя после всех этапов клинических испытаний.
Антибиотикорезистентность: аргументы и факты
Устойчивость к антимикробным препаратам создает угрозу для проведения эффективной профилактики и лечения постоянно возрастающего числа инфекций. Все более необходимым становится рациональное использование имеющихся антимикробных препаратов с учетом спектра их активности и профиля антибиотикорезистентности основных возбудителей. В связи с этим чрезвычайно актуально проведение научных и общественных мероприятий, направленных на обсуждение целого ряда вопросов, касающихся распространенности бактериальных инфекций, трудностей микробиологической диагностики, текущей ситуации с антибиотикорезистентностью и перспектив использования разных классов антимикробных препаратов при лечении инфекций различной локализации.
За последние 100 лет врачам удалось справиться со многими болезнями и значительно увеличить среднюю продолжительность жизни людей. Ряд открытий и изобретений в области медицины по праву можно отнести к числу наиболее значимых в прошлом столетии. Примерами могут служить появление первых кровезаменителей и расшифровка ДНК. Но, по мнению многих экспертов, именно изобретение пенициллина, внедрение его в клиническую практику и последующее бурное развитие антимикробной терапии (АМТ) сыграли наиболее существенную роль в увеличении продолжительности жизни людей в XX веке. Сегодня невозможно представить нашу жизнь без антимикробных препаратов (АМП), помогающих бороться с большинством инфекционных заболеваний [1].
Вместе с тем, в настоящее время во всем мире наблюдается совершенно объективный процесс глобальный рост антибиотикорезистентности микроорганизмов к АМП. Проблема резистентности во многом обусловлена широким и часто нерациональным использованием данных препаратов. Инфекции, вызванные резистентными штаммами микроорганизмов, характеризуются более тяжелым течением, чаще требуют госпитализации больного, увеличивают продолжительность пребывания его в стационаре, предполагают применение комбинированной АМТ с использованием резервных препаратов. Все это приводит к увеличению затрат на лечение, ухудшает прогноз для здоровья и жизни пациентов, а также создает условия для возникновения эпидемий. По данным Центра по контролю и профилактике заболеваний, в США ежегодно не менее 2 миллонов человек инфицируются бактериями, устойчивыми к антибиотикам, из которых примерно 23 тысячи умирают вследствие этих инфекций [2,3].
Несмотря на значительный прогресс в медицине, интенсивность разработки новых АМП за последние 30 лет значительно снизилась. Американское общество по борьбе с инфекционными болезнями в 2004 году сообщило, что за период 1998–2002 гг. количество одобренных Управлением по контролю за пищевыми продуктами и лекарственными средствами (FDA) новых антибиотиков уменьшилось на 56% по сравнению с периодом 1983–1987 г.
Во втором квартале 2014 года Всемирная организация здравоохранения опубликовала отчет об антибиотикорезистентности в мире. Это один из первых детальных докладов за последние 30 лет, касающийся столь актуальной глобальной проблемы. В нем проанализированы данные из 114 стран, в том числе России, на основании которых сделан вывод о том, что резистентность к антибиотикам на сегодняшний день отмечается уже во всех странах независимо от уровня их благосостояния и экономического развития. Российская Федерация в 2014 году со своей стороны стала инициатором подписания документа, в котором закреплено, что оценка ситуации с антибиотикорезистентностью в стране является национальным приоритетом. Сложившаяся ситуация имеет большое социально-экономическое значениеи рассматривается как угроза национальной безопасности. При неэффективности стартовой терапии клиницисты вынуждены использовать альтернативные АМП, которые часто характеризуются более высокой стоимостью и худшим профилем безопасности.
Все более необходимым становится рациональное использование имеющихся АМП с учетом спектра их активности и профиля антибиотикорезистентности основных возбудителей. В связи с этим чрезвычайно актуально проведение научных и общественных мероприятий, направленных на обсуждение целого ряда вопросов, касающихся распространенности бактериальных инфекций, трудностей микробиологической диагностики, текущей ситуации с антибиотикорезистентностью и перспектив использования разных классов АМП при лечении инфекций различной локализации [3,4].
Проблема антибиотикорезистентности
Значение проблемы антибиотикорезистентности подтверждается многими исследованиями. Согласно данным, опубликованным в 2014 году, при сохраняющихся темпах роста антибиотикорезистентности суммарные потери общемирового ВВП к 2050 году составят более 100 триллионов долларов, а количество случаев преждевременной смерти людей в два раза превысит численность населения России [5].
Монорезистентные организмы становятся полирезистентными, а затем и панрезистентными. Появилось понятие так называемых “проблемных” микроорганизмов, среди которых особенно часто, особенно в условиях стационара, где широко применяются АМП и дезинфектанты, встречаются штаммы, резистентные к тем или иным (ко всем известным) АМП. К таким микроорганизмам относятся Staphylococcus spp., Enterococcus spp., Pseudomonas aeruginosa, Acinetobacter spp., ряд штаммов бактерий семейства Enterobacteriaceae.
Одной из наиболее важных причин сложившейся ситуации является доступность АМП населению во многих странах мира и высокая частота самолечения, которое очень часто является неадекватным. Так, по данным Европейского центра по профилактике и контролю заболеваний, около 40% европейцев уверены в том, что антибиотики эффективны при простуде и гриппе.
Свой вклад в усугубление проблемы, к сожалению, вносят и врачи. Недостаточная осведомленность клиницистов относительно правил рациональной АМТ, а иногда и неспособность устоять перед настойчивыми просьбами пациентов и их родителей приводят к неоправданному или неадекватному назначению АМП. Отсутствие просветительской работы с пациентами, в частности о необходимости завершения полного курса АМТ, становится причиной досрочного прекращения лечения. Все это способствует формированию и распространению устойчивых штаммов микроорганизмов.
Многими экспертами не раз уже отмечено, что хотя генерические препараты являются важным инструментом снижения общих затрат здравоохранения, по целому ряду из них отсутствуют адекватные исследования эффективности и безопасности по сравнению с оригинальными препаратами. Несколько исследований, проведенных в Российской Федерации, продемонстрировали наличие более низких концентраций активных субстанций в ряде “псевдогенериков”, что потенциально может приводить не только к снижению эффективности терапииу конкретного пациента, но и более быстрому росту резистентности к целому классу антибиотиков. В настоящее время рассматривается возможность внесения поправок к Федеральному закону №61. Согласно предложенным поправкам для регистрации новых генериков необходимо будет проводить исследование биоэквивалентности регистрируемого генерика по сравнению с оригинальным препаратом, а не любым уже зарегистрированным генериком.
Одной из основных проблем получения достоверных данных в бактериологических лабораториях России является недостаточно хорошее оснащение. Использование нестандартизированных сред и дисков с антибиотиками приводит к получению ложных результатов. В связи с этим значительное количество данных о чувствительности различных микроорганизмов к АМП не может быть использовано для проведения рациональной эмпирической АМТ. Следует также с осторожностью относиться к публикациям в отечественных и зарубежных источниках, в которых отсутствует информация о методах определения чувствительности и критериях интерпретации результатов. Необходимо помнить о том, что данные, полученные в зарубежных странах, могут существенно отличаться от российских, поэтому их нельзя использовать для выбора АМП.
Ситуацию также усугубляет недостаточный контроль за использованием АМП в ветеринарии и сельском хозяйстве. Применение антибиотиков в животноводстве в качестве добавки в корм для скота в малых дозах для стимулирования роста является общепринятой практикой во многих промышленно развитых странах и, как известно, приводит к повышению уровня резистентности микроорганизмов. Сельскохозяйственные животные могут служить резервуаром антибиотикорезистентных бактерий Salmonella spp., Campylobacter spp., Escherichia coli, Clostridium difficile, Staphylococcus aureus (MRSA), Enterococcus faecium (VRE) [7,8].
В настоящее время учитывая потенциальное развитие антибиотикорезистентности, АМП теряют коммерческую привлекательность, что находит подтверждение в отрицательной динамике появления новых системных антибиотиков (рис. 1).
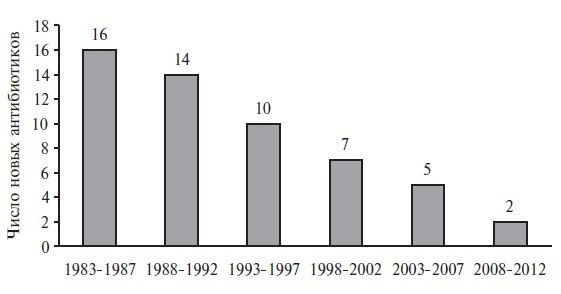
Сдерживание распространения антибиотикорезистентности
Антибиотики на сегодняшний день являются одной из самых часто применяющихся групп лекарственных средств. По данным Ассоциации международных фармацевтических производителей и ГК Ремедиум в 2014 году системные антибиотики в России занимали 4-е место в структуре амбулаторных и 2-е место в структуре госпитальных продаж готовых лекарственных средств.
В настоящее время во всем мире идет поиск альтернативных подходов к терапии инфекционных заболеваний. Одним из перспективных направлений в борьбе с инфекциями является применение бактериофагов и их компонентов. Бактериофаги природных штаммов и искусственно синтезированные генетически модифицированные фаги с новыми свойствами инфицируют и обезвреживают бактериальные клетки. Фаголизины – это ферменты, которые используются бактериофагами для разрушения клеточной стенки бактерий. Ожидается, что препараты на основе бактериофагов и фаголизинов позволят справиться с устойчивыми к АМП микроорганизмами, однако эти препараты появятся не ранее 2022-2023 гг. Параллельно с этим идет разработка препаратов на основе антибактериальных пептидов и вакцин для лечения инфекций, вызванных C. difficile, S. aureus, P. aeruginosa [9].
В последние годы резко возросла поддержка со стороны органов исполнительной и законодательной власти, а также Министерства здравоохранения Российской Федерации исследований, направленных на сдерживание антибиотикорезистентности. Так, например, Межрегиональная ассоциация по клинической микробиологии и антимикробной химиотерапии (МАКМАХ) и Федеральный научно-методический центр мониторинга резистентности к антимикробным препаратам активно занимаются разработкой страте гических направлений по данной проблеме.
На международный уровень обсуждение данной проблемы вышло на рубеже веков. В 2001 году ВОЗ опубликовала Глобальную стратегию по сдерживанию устойчивости к противомикробным препаратам, а в 2016 году вопрос борьбы с растущей угрозой антибиотикорезистентности был вынесен на повестку дня Генеральной Ассамблеи ООН.
Входящие в ООН государства в совместном заявлении обязались разработать национальные планы мер по противодействию устойчивости микроорганизмов к АМП. Это подразумевает усиление мониторинга лекарственноустойчивых инфекций и контроля за применением АМП в медицине, ветеринарии и сельском хозяйстве, а также укрепление международного сотрудничества и финансирования. Также члены организации взяли на себя обязательства ужесточить законодательное регулирование применения АМП, заниматься поиском рационального их использования (улучшение диагностики инфекций с учетом их чувствительности к препаратам) и широко внедрять меры профилактики инфекционных заболеваний (вакцинация, очистка воды, санитария, должный уровень гигиены в стационарах и на фермах) [10].
Еще одним знаменательным событием 2016 года стало подписание ведущими международными фармацевтическими, диагностическими и биотехнологическими компаниями совместной декларации о принятии всеобъемлющих мер против инфекций, устойчивых к лекарственной терапии. Декларация была оглашена на Всемирном экономическом форуме в г. Давосе и подписана на сегодняшний день почти 100 фармацевтическими компаниями. Представители индустрии призывают правительства всех стран мира выйти за рамки заявлений о намерениях и в сотрудничестве с компаниями принять конкретные меры для поддержки инвестиций в разработку антибиотиков, средств диагностики, вакцин и других продуктов, имеющих жизненно важное значение для предотвращения и лечения лекарственно устойчивых инфекций. Одновременно с этим в Декларации устанавливаются обязательства подписавших сторон по дальнейшим действиям в области проблем лекарственной устойчивости. Компании обязуются уменьшить воздействие производства АМП на окружающую среду; содействовать надлежащему применению новых и существующих АМП, в том числе за счет поддержки рекомендаций по применению АМП; продолжать и расширять научноисследовательские разработки по созданию новых АМП; поддерживать инициативы, направленные на обеспечение доступа к АМП во всех частях света при любых уровнях доходов.
Заключение
Современная медицина немыслима без АМТ. Антибиотики во много раз сократили смертность от инфекционных заболеваний, смягчили тяжесть их течения, уменьшили количество постинфекционных осложнений. Однако, несмотря на появление в арсенале врачей значительного перечня лекарственных препаратов, активных в отношении практически всех патогенных микроорганизмов, существует значительное количество проблем и нерешенных вопросов в области АМТ [1].
В течение последних десятилетий АМТ инфекционных заболеваний существенно осложняется резистентностью возбудителей к АМП. Постоянный рост резистентности к АМП отмечен среди возбудителей как нозокомиальных, так и внебольничных инфекций. Возникновение резистентности и распространение ее среди микроорганизмов является естественным процессом, возникшим в ответ на широкое использование АМП в клинической практике, однако имеет большое социально-экономическое значение и в развитых странах рассматривается как угроза национальной безопасности. Инфекции, вызванные резистентными штаммами микроорганизмов, отличаются более тяжелым течением, чаще требуют госпитализации и увеличивают продолжительность пребывания в стационаре, ухудшают прогноз для пациентов.
Специалисты в области АМТ выделяют несколько уровней резистентности к АМП глобальный, региональный и локальный. Прежде всего, необходимо учитывать глобальные тенденции в развитии резистентности. Примерами микроорганизмов, у которых во всем мире стремительно распространяется резистентность к АМП, являются Staphylococcus spp., Enterococcus spp, Streptococcus pneumoniae, Neisseria gonorrhoeae, Pseudomonas aeruginosa, Acinetobacter spp., бактерии семейства Enterobacteriaceae и другие. При этом следует помнить, что резистентность не является тотальной. Так, например, Streptococcus pyogenes сохраняет чувствительность к пенициллину.
При планировании политики АМТ внебольничных инфекций следует более рационально опираться на локальные (региональные) данные, полученные в конкретной стране или регионе страны. В Российской Федерации существуют значительные территориальные вариации частоты резистентности возбудителей вне больничных инфекций к АМП. Вот почему необходимы постоянный мониторинг резистентности и информирование врачей различных специальностей. Наряду с региональными данными по резистентности к АМП внебольничных возбудителей в каждом ЛПУ необходимо иметь данные по резистентности нозокомиальных возбудителей, особенно в отделениях с интенсивным использованием АМП: ОРИТ, отделения хирургической инфекции, травматологии и ортопедии [4].
Хотя от адекватных назначений врачей и отказа пациентов от самолечения во многом зависит успех борьбы с проблемой антибиотикорезистентности, этих шагов, к сожалению, недостаточно. Очень многие решения должны быть приняты на национальном уровне, например, запрет на безрецептурный отпуск антибиотиков, усиление законодательства в отношении предотвращения производства и продажи фальсифицированных АМП, снижение применения антибактериальных средств в продовольственном животноводстве. Следует также отметить, что современные тенденции развития фармацевтической промышленности таковы, что гарантий появления новых групп АМП нет [11,12].
Без сомнения, эра АМП сыграла существенную роль в жизни современного общества. Однако только трезвый подход как к проблеме лечения АМП и ее принципам, так и к роли антибиотикотерапии в современном обществе способен обеспечить правильное планирование выпуска АМП и прогнозирование их эффективности в будущем.






 Читайте также:
Читайте также: