антитела к тиреопероксидазе при беременности сильно повышены что это значит
Антитела к микросомальной тиреопероксидазе, Анти-ТПО
Добавить в корзину
Тиреопероксидаза — это фермент, который синтезируется в щитовидной железе у каждого человека. Антитела к ТПО — это белковые соединения, чье действие направлено против ферментов, отвечающих за формирование активной формы йода, необходимой для синтеза тиреоидных гормонов. Если антитела к тиреопероксидазе повышены — это маркер наличия в организме аутоиммунных заболеваний щитовидной железы.
Когда назначается исследование Анти-ТПО?
Тестирование позволяет обнаружить антитела против ТПО в крови. Также эта проба часто назначается врачами в качестве дополнения к анализам на свободные Т3 и Т4 и анализу на уровень ТТГ.
Если анализ окажется положительным, это означает, что истинными причинами болезненного состояния щитовидной железы являются аутоиммунные заболевания (болезнь Грейвса или Хашимото). Эти болезни провоцируют выработку иммунной системой антител, которые атакуют не больные клетки, а здоровые, тем самым провоцируя общую дисфункцию щитовидной железы.
Когда стоит сдать анализ на определение антител к ТПО:
Стоит отметить, что те люди, чьи анализы на антитела к ТПО были положительными, могут на самом деле не иметь аутоиммунных заболеваний щитовидной железы. Но сам факт их наличия в крови уже сигнализирует о серьезном риске заболеть ими в будущем. Даже если ваша щитовидка, несмотря на наличие антител, функционирует нормально, стоит периодически проходить осмотр у врача, чтобы предотвратить возможные осложнения.
АТ ТПО сильно повышен: значение
Есть целый комплекс причин, по которым АТ ТПО бывает повышен:
Сдать анализ на определение антител к ТПО можно как отдельно, так и вместе с другими пробами в комплексных программах обследования состояния организма.
Нормы АТ к тиреопероксидазе у мужчин и женщин
Антитела к тиреопероксидазе в норме не должны превышать 34 ме/мл как у мужчин, так и у женщин. Нормы анализа у женщин и мужчин меняются лишь в зависимости от возраста — после достижения 50 лет этот показатель не должен превышать 50 ме/мл.
Для своевременного контроля над появлением в крови антител к ТПО, обращайтесь к нам для сдачи анализов и высокоточной диагностики! Каждому пациенту мы гарантируем проведение всех медицинских процедур в максимально комфортных условиях и с соблюдением всех правил техники безопасности по работе с биологическим материалом.
ОБЩИЕ ПРАВИЛА ПОДГОТОВКИ К АНАЛИЗАМ КРОВИ
Кровь берется из вены. Необходимо соблюдать общие рекомендации:
Антитела к тиреопероксидазе при беременности сильно повышены что это значит
Антитела к тиреопероксидазе – специфические иммуноглобулины, направленные против фермента, содержащегося в клетках щитовидной железы и отвечающего за образование активной формы йода для синтеза тиреоидных гормонов. Они являются специфичным маркером аутоиммунных заболеваний щитовидной железы.
Антитела к тиреоидной пероксидазе, микросомальные антитела, антитела к микросомальному антигену, АТТПО, АТПО.
Anti-thyroid Peroxidase Autoantibodies, Antimicrosomal Antibodies, Antithyroid Microsomal Antibodies, Thyroid Peroxidase Autoantibodies, TPO Antibodies, Thyroid Peroxidase Test, Thyroid microsomal antibody, Thyroperoxidase antibody, TPOAb, Anti-TPO.
Диапазон определения: 5.00 ‑ 600.00 МЕ/мл.
МЕ/мл (международная единица в миллилитре).
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Данный анализ предназначен для определения специфических антител к тканям щитовидной железы в сыворотке крови – антиТПО. Они образуются, когда иммунная система человека ошибочно распознает ткани щитовидной железы как чужеродную биологическую субстанцию, что может приводить к тиреоидиту, повреждению тканей железы и различным нарушениям ее функции.
Щитовидная железа синтезирует ряд жизненно важных гормонов: тироксина (T4) и трийодтиронина (T3), которые имеют большое значение в регуляции обмена веществ. В свою очередь, работа щитовидной железы регулируется тиреотропным гормоном гипофиза (ТТГ), который обеспечивает адекватную выработку гормонов щитовидной железы в зависимости от потребностей организма. Повреждающее действие антител на различные биохимические структуры может приводить к нарушению нормальной продукции гормонов щитовидной железы и негативно влиять на регуляцию ее функции, что в итоге вызывает хронические патологии, связанные с гипо- или гипертиреозом. Гипотиреоз проявляется в виде таких симптомов, как повышение массы тела, появление зоба, сухость кожи, выпадение волос, запоры, повышение чувствительности к холоду. Гипертиреоз сопровождается потливостью, учащенным сердцебиением, тревожностью, дрожью в конечностях, слабостью, нарушениями сна, потерей веса, экзофтальмом.
Фермент щитовидной железы тиреопероксидаза играет ключевую роль в образовании гормонов щитовидной железы. Тиреопероксидаза участвует в образовании активной формы йода, без которой невозможен биохимический синтез гормонов щитовидной железы T4 и T3. Появление в крови антител к данному ферменту нарушает его нормальную функцию, вследствие чего снижается производство соответствующих гормонов.
Количественный анализ сыворотки крови на антитела к тиреопероксидазе – наиболее чувствительный метод диагностики аутоиммунных заболеваний щитовидной железы. Отклонение от нормы его результатов – ранний признак тиреоидита Хашимото и диффузного токсического зоба (Базедовой болезни). Современные высокочувствительные методы выявления антител к тиреопероксидазе позволяют правильно поставить диагноз у 95 % больных с тиреоидитом Хашимото и 85 % пациентов с диффузным токсическим зобом. Во время беременности антиТПО могут существенно повлиять на развитие щитовидной железы и здоровье будущего ребенка, так как они способны проникать через плацентарный барьер из крови матери в организм плода. Уровень антиТПО часто повышается и при других заболеваниях щитовидной железы, например при идиопатическом гипотиреозе, аденоме и раке, кроме того, при всех видах аутоиммунных заболеваний, включая ревматоидный артрит, системную красную волчанку, инсулинзависимый сахарный диабет, аутоиммунную недостаточность надпочечников и пернициозную анемию, что в ряде случаев свидетельствует о вовлечении щитовидной железы в этот патологический процесс. Терапия некоторыми лекарственными препаратами (амиодароном, препаратами лития, интерфероном) также может вызывать появление антител к тиреопероксидазе и, как следствие, гипотиреоз.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
Причины повышения уровня антиТПО
В целом выявление антиТПО в сыворотке крови свидетельствует об аутоиммунной агрессии в отношении щитовидной железы, и чем больше результаты анализа отклоняются от нормы, тем выше вероятность наличия данного типа патологии.
Причины понижения уровня антиТПО
Уменьшение концентрации антиТПО до низких или тем более неопределяемых значений свидетельствует о том, что проводимое лечение успешно.
Что может влиять на результат?
Чувствительность и специфичность тестов на антиТПО повышается с развитием медицинских технологий. Методики исследования периодически изменяются. Отчасти по этой причине у данного анализа за все время было несколько названий. Сейчас используется несколько методик его проведения, у каждой из них различные пределы чувствительности и границы нормальных значений. В связи с этим важно делать повторные тесты в той же самой лаборатории, по той же самой методике, как при первичном исследовании, для достижения сопоставимости полученных результатов.
Кто назначает исследование?
Врач общей практики, терапевт, эндокринолог, хирург, ревматолог, кардиолог, акушер-гинеколог, педиатр, неонатолог.
Autoimmune Thyroiditis edited by W.A. Scherbaum, U. Bogner, B. Weinheimer, G.F. Bottazzo: Springer-Verlag, Berlin, 1991.
Diseases of the Thyroid edited by Lewis E. Braverman MD. Humana Press, Totowa, N. J., 2003.
Thyroid Disease in Clinical Practice, I. Ross McDougall, Chapman and Hall, London, 1992.
Surks MI, Ortiz E, Daniels GH and others. Subclinical thyroid disease: scientific review and guidelines for diagnosis and management. JAMA 2004; 291(2): 228-38.
Ladenson PW, Singer PA, Aink B and others. American Thyroid Association Guidelines for Detection of Thyroid Dysfunction. Arch Inten Med 2000; 160: 1573-5.
Molecular Pathology of Endocrine Diseases, Jennifer L., Hunt Springer Science+Business Media, London, 2010 г.
Патология щитовидной железы и беременность
Опубликовано в журнале:
«Врач», 2008, №5, с. 11-16
B. Фадеев, доктор медицинских наук, профессор,
C. Перминова, кандидат медицинских наук,
Т. Назаренко, доктор медицинских наук,
М. Ибрагимова, С. Топалян,
ММА им. И. М. Сеченова, Научный центр акушерства, гинекологии и перинатологии
им. В. И. Кулакова, Москва
Заболевания щитовидной железы (ЩЖ) являются самой частой эндокринной патологией, при этом среди женщин они распространены практически в 10 раз больше и манифестируют в молодом, репродуктивном возрасте.
Важнейшей функцией тиреоидных гормонов является обеспечение развития различных органов и систем на протяжении всего эмбриогенеза, начиная с первых недель беременности. В связи с этим любые изменения функции ЩЖ, даже незначительные, несут повышенный риск нарушений развития нервной и других систем плода. Данные о распространенности тиреоидной патологии в случайной репрезентативной выборке женщин при разных сроках беременности, обратившихся для постановки на учет в женскую консультацию Москвы, представлены в табл. 1, из которой видно, что наиболее часто встречаются различные формы эутиреоидного зоба и носительство антител к тиреоидной пероксидазе (АТ-ТПО). Несколько иной спектр патологии характерен для беременных, обращающихся в специализированные эндокринологические и акушерско-гинекологические учреждения – среди них значительно больше пациенток с гипотиреозом и тиреотоксикозом.
Таблица 1. Распространенность тиреоидной патологии в случайной выборке женщин при разных сроках беременности [5]
| Патология | Количество обследованных | |
| абс. | % | |
| Число обследованных | 215 | 100 |
| Гипотиреоз: | ||
| всего | 4 | 1,86 |
| явный | 2 | 0,93 |
| субклинический | 2 | 0,93 |
| АТ-ТПО: | ||
| >35 мЕд/л | 34 | 15,8 |
| >150 мЕд/л | 21 | 9,8 |
| Тиреотоксикоз | 0 | 0 |
| Диффузный зоб* | 51 | 24,2 |
| Узловой зоб* | 8 | 3,8 |
| Примечание. * Исключая 4 женщин с гипотиреозом. | ||
Современные представления о влиянии патологии ЩЖ на репродуктивное здоровье и о принципах ее диагностики и лечения включают следующие положения:
У женщин заболевания щитовидной железы встречаются в 10 раз чаще, чем у мужчин, и манифестируют в молодом, репродуктивном возрасте
ФУНКЦИОНИРОВАНИЕ ЩЖ ВО ВРЕМЯ БЕРЕМЕННОСТИ
Изменение функционирования ЩЖ у женщины происходит уже с первых недель беременности под воздействием разных факторов, большинство из которых прямо или косвенно стимулируют ЩЖ женщины. Преимущественно это происходит в 1-й половине беременности, т.е. в период, когда у плода еще не функционирует своя ЩЖ, а весь эмбриогенез обеспечивается тиреоидными гормонами матери. В целом продукция тиреоидных гормонов во время беременности в норме увеличивается на 30–50% [8].
К физиологическим изменениям функционирования ЩЖ во время беременности относятся:
1) гиперстимуляция ЩЖ хорионическим гонадотропином (ХГ):
2) увеличение продукции тироксинсвязывающего глобу лина (ТСГ) в печени:
3) усиление экскреции йода с мочой и трансплацентарного переноса йода;
4) дейодирование тиреоидных гормонов в плаценте.
Наиболее мощным стимулятором ЩЖ во время беременности, преимущественно в 1-й ее половине, выступает ХГ, продуцируемый плацентой. По структуре он является гормоном, родственным ТТГ (одинаковые α-субъединицы, разные β-субъединицы), и в больших количествах способен оказывать ТТГ-подобные эффекты, приводя к стимуляции продукции тиреоидных гормонов. В I триместре беременности за счет эффектов ХГ происходит существенное увеличение продукции тиреоидных гормонов, что, в свою очередь, обусловливает подавление продукции ТТГ. При многоплодной беременности, когда содержание ХГ достигает очень высоких значений, уровень ТТГ в 1-й половине беременности у значительной части женщин может быть существенно понижен, а порой полностью подавлен.
Во время беременности происходит увеличение продукции эстрогенов, которые оказывают стимулирующее влияние на продукцию ТСГ в печени. Кроме того, при беременности увеличивается связывание ТСГ с сиаловыми кислотами, что приводит к существенному снижению его клиренса. В результате к 18–20-й неделе беременности уровень ТСГ удваивается. Это, в свою очередь, приводит к связыванию с ТСГ дополнительного количества свободных тиреоидных гормонов. Транзиторное снижение уровня последних вызывает дополнительную стимуляцию ЩЖ со стороны ТТГ, в результате чего свободные фракции Т4 и Т3 сохраняются на нормальном уровне, тогда как уровень общих Т4 и Т3 у всех беременных женщин в норме повышен.
Функционирование щитовидной железы изменяется под воздействием разных факторов уже с первых недель беременности
Уже в начале беременности происходит постепенное увеличение объема почечного кровотока и гломерулярной фильтрации, что приводит к росту экскреции йода с мочой и обусловливает дополнительную косвенную стимуляцию ЩЖ женщины. Кроме того, повышение потребности в йоде развивается в связи с трансплацентарным его переносом, что необходимо для синтеза тиреоидных гормонов ЩЖ плода.
Бурное развитие в последние годы вспомогательных репродуктивных технологий (ВРТ) привело к повышению частоты наступления индуцированной беременности (ИБ), а проблема ее сохранения и рождения здоровых детей приобрела особую актуальность. ИБ – беременность, наступившая в результате применения индукторов овуляции: препаратов для стимуляции функции яичников, широко используемых для восстановления фертильности при ановуляторной форме бесплодия и в программах экстракорпорального оплодотворения (ЭКО) и переноса эмбриона (ПЭ) в матку.
Стимуляция овуляции сопровождается одновременным ростом нескольких, а иногда многих фолликулов (в отличие от спонтанного цикла) и, соответственно, образованием множества желтых тел. Эти гормонально-активные структуры секретируют стероидные гормоны, концентрация которых в десятки раз превышает физиологические. Повышенная секреция половых стероидов сохраняется длительное время после отмены индуктора овуляции, что в ряде случаев приводит к существенному изменению гомеостаза в организме женщины и развитию синдрома гиперстимуляции яичников. В случае наступления беременности повышенные концентрации стероидных гормонов могут сохраняться вплоть до окончательного формирования плаценты с последующим постепенным регрессом.
Известно, что стимулированные беременности относятся к группе риска по развитию осложнений: высокой частоты ранних репродуктивных потерь, многоплодия, раннего гестоза, тяжелого синдрома гиперстимуляции яичников, фетоплацентарной недостаточности, угрозы преждевременных родов [1]. В связи с этим ведение стимулированного цикла и I триместра ИБ требует тщательного динамического наблюдения и гормонального контроля. Высокая стероидная нагрузка вследствие гиперстимуляции яичников, а также прием большого числа гормональных препаратов влияют на метаболизм тиреоидных гормонов, приводят к гиперстимуляции ЩЖ, что, в свою очередь, может усугубить неблагоприятное течение беременности и негативно отразиться на развитии плода.
ЭМБРИОЛОГИЯ И ФИЗИОЛОГИЯ ЩЖ ПЛОДА
Закладка ЩЖ происходит на 3–4-й неделе эмбрионального развития. Примерно в это же время из нервной пластинки происходит закладка центральной нервной системы (ЦНС) – начинаются процессы дендритного и аксонального роста, а также синаптогенез, нейрональная миграция и миелинизация, которые не могут адекватно развиваться без достаточного количества тиреоидных гормонов. ЩЖ плода приобретает способность захватывать йод только с 10–12-й недели беременности, а синтезировать и секретировать тиреоидные гормоны – только с 15-й недели. Таким образом, практически всю 1-ю половину беременности ЩЖ у плода еще не функционирует, а его развитие в полной мере зависит от тиреоидных гормонов беременной.
ДИАГНОСТИКА ЗАБОЛЕВАНИЙ ЩЖ ВО ВРЕМЯ БЕРЕМЕННОСТИ
Как указывалось, принципы диагностики заболеваний ЩЖ во время беременности отличаются от общепринятых:
БЕРЕМЕННОСТЬ И ЙОДОДЕФИЦИТНЫЕ ЗАБОЛЕВАНИЯ
Йододефицитными заболеваниями (ЙДЗ), по определению ВОЗ, обозначаются все патологические состояния, развивающиеся в популяции вследствие йодного дефицита, которые могут быть предотвращены при нормализации потребления йода. Спектр ЙДЗ весьма широк, при этом наиболее тяжелые из них напрямую связаны с нарушениями репродуктивной функции или развиваются перинатально (врожденные аномалии, эндемический кретинизм, неонатальный зоб, гипотиреоз, снижение фертильности).
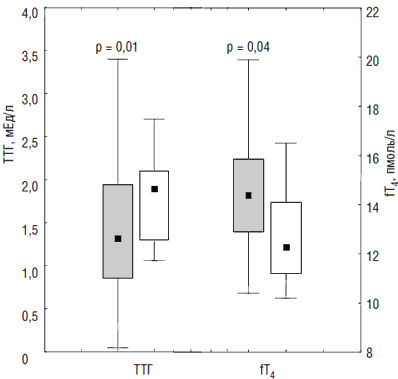
Перечисленные выше механизмы стимуляции ЩЖ беременной носят физиологический характер, обеспечивая адаптацию эндокринной системы женщины к беременности, и при наличии адекватных количеств основного субстрата синтеза тиреоидных гормонов – йода – не будут иметь каких-либо неблагоприятных последствий. Пониженное поступление йода во время беременности приводит к хронической стимуляции ЩЖ, относительной гипотироксинемии и формированию зоба как у матери, так и у плода. В ряде исследований показано, что даже в условиях легкого йодного дефицита уровень fТ4 в I триместре беременности оказывается на 10–15% ниже такового у женщин, получающих йодную профилактику [6]. По данным нашего исследования, при сравнении уровня ТТГ и fT4 в группах женщин без тиреоидной патологии, получавших и не получавших йодную профилактику, выяснилось, что к концу беременности уровень ТТГ был статистически значимо ниже, а fT4 – выше у женщин, получавших 150–200 мкг йодида калия [2] (рис. 1).
Рис. 1. Уровни ТТГ и fT в III триместре беременности у женщин, 4 получавших (темным) и не получавших (светлым) индивидуальную йодную профилактику (Me [25%, 75%], min, max) [2]
Важно отметить, что термин «относительная гестационная гипотироксинемия» сегодня имеет лишь теоретическое обоснование, поскольку конкретные диагностические критерии для него отсутствуют. Другими словами, пока это не диагноз, который может быть поставлен при гормональном обследовании беременной; под этим термином подразумевают феномен, при котором по разным причинам уровень Т4 у беременной женщины не достигает должного для этого физиологического состояния, но сохраняется в пределах нормы для здоровых вне беременности. Как уже указывалось, продукция Т4 в 1-й половине беременности для адекватного развития плода должна увеличиться на 30–50%. В ситуации, когда женщина проживает в условиях йодного дефицита, ее ЩЖ еще до беременности функционирует, в той или иной степени затрачивая свои резервные возможности, и даже использования мощных компенсаторных механизмов в ряде случаев может не хватить для обеспечения столь значительного увеличения продукции тиреоидных гормонов. В результате гиперстимуляция ЩЖ не способствует к должному результату, а приобретает патологическое значение, приводя к формированию у беременной зоба. Именно с этим феноменом и связывается патогенез нарушений психомоторного развития плода в условиях йодного дефицита.
Как уже указывалось, физиологическая гиперстимуляция ЩЖ беременной в условиях йодного дефицита оказывается мощным зобогенным фактором. Как показало проведенное нами исследование случайной выборки беременных, обращающихся для постановки на учет в женскую консультацию, у 24% из них был увеличен объем ЩЖ (см. табл. 1) [5].
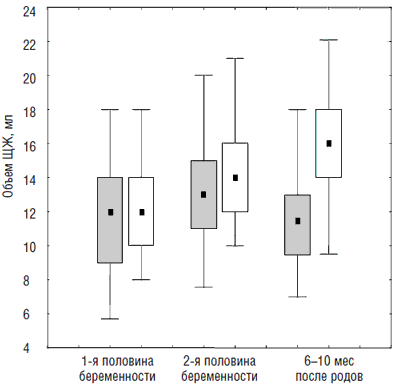
Восполнение дефицита йода с ранних сроков беременности ведет к коррекции указанных изменений. Так, в нашем исследовании, изучавшем динамику объема ЩЖ во время беременности, у женщин, получавших и не получавших йодную профилактику (рис. 2), выяснилось, что в обеих группах ко 2-й половине беременности произошло закономерное и статистически значимое увеличение объема ЩЖ, в большей степени выраженное в группе женщин, не получавших йодную профилактику. После родов в случае отсутствия йодной профилактики происходило дальнейшее увеличение объема ЩЖ, что, видимо, связано с сохранением высокой потребности в йоде в период грудного вскармливания. У женщин, получавших дополнительно 150–200 мкг йода ежедневно, на протяжении 6–10 мес после родов происходило уменьшение объема ЩЖ [2].
Рис. 2. Динамика объема ЩЖ в период беременности и после родов у женщин без патологии ЩЖ, получавших (темным) и не получавших (светлым) индивидуальную йодную профилактику (Me [25%, 75%], min, max) [2]
Для восполнения дефицита йода используются различные варианты йодной профилактики. Наиболее эффективным методом, рекомендуемым ВОЗ и другими международными организациями, является массовая (популяционная) йодная профилактика, которая заключается в йодировании пищевой соли. Поскольку беременность является периодом наибольшего риска формирования самых тяжелых ЙДЗ, уже на этапе планирования беременности женщинам целесообразно назначение индивидуальной йодной профилактики физиологическими дозами йода (200 мкг/сут. – например, одна таблетка препарата «ЙодБаланс-200» ежедневно).
ГИПОТИРЕОЗ И БЕРЕМЕННОСТЬ
Таблица 2. Осложнения некомпенсированного гипотиреоза при беременности (в %) [4]
| Осложнение | Манифестный гипотиреоз | Субклинический гипотиреоз |
| Гипертензия, преэклампсия | 22 | 15 |
| Отслойка плаценты | 5 | 0 |
| Низкая масса тела плода | 16,6 | 8,7 |
| Внутриутробная гибель | 6,6 | 1,7 |
| Пороки развития | 3,3 | 0 |
| Послеродовое кровотечение | 6,6 | 3,5 |
Заместительная терапия гипотиреоза во время беременности требует выполнения ряда условий:
БЕРЕМЕННОСТЬ И АУТОИММУННЫЙ ТИРЕОИДИТ
Аутоиммунный тиреоидит (АИТ) является основной причиной спонтанного гипотиреоза. Если диагностика последнего не вызывает особых сложностей (определение уровня ТТГ), то при отсутствии снижения функции ЩЖ диагноз АИТ зачастую носит лишь вероятностный характер. Тем не менее при АИТ, когда ЩЖ поражена аутоиммунным процессом, ее дополнительная физиологическая стимуляция, происходящая во время беременности, может не достичь своей цели; в этой ситуации, как и при йодном дефиците, у женщины не произойдет повышения продукции тиреоидных гормонов, необходимого для адекватного развития плода в 1-й половине беременности. Таким образом, АИТ во время беременности несет риск манифестации гипотиреоза у женщины и относительной гипотироксинемии у плода.
Основную сложность создает выделение среди женщин с отдельными признаками АИТ группы с максимальным риском развития гипотироксинемии. Так, распространенность носительства АТ-ТПО с уровнем выше 100 мЕд/л, как указывалось, достигает среди беременных 10%, а зоба – порой 20% (см. табл. 1). В связи с этим очевидно, что не всякое повышение уровня АТ-ТПО свидетельствует об АИТ и о существенном риске развития гипотироксинемии. При выявлении повышенного уровня АТ-ТПО без других признаков АИТ необходима динамическая оценка функции ЩЖ во время беременности (в каждом триместре).
Предложено проводить скрининг нарушений функций щитовидной железы у всех женщин на ранних сроках беременности
Как указывалось выше, в ранние сроки беременности в норме характерен низкий или даже подавленный (у 20–30% женщин) уровень ТТГ (2,5 мЕд/л на ранних сроках беременности у женщин – носительниц АТ-ТПО может косвенно свидетельствовать о снижении функциональных резервов ЩЖ и повышенном риске развития относительной гипотироксинемии [3, 7].
Возникает вопрос: каким образом выявить женщин – носительниц АТ-ТПО, а среди них – группу с повышенным риском развития гипотироксинемии, поскольку носительство АТ-ТПО не сопровождается какими-либо симптомами? Специфические клинические симптомы чаще отсутствуют и при гипотиреозе (даже манифестном, не говоря уже о субклиническом). Принимая во внимание высокую распространенность носительства АТ-ТПО и гипотиреоза в популяции, а также в силу ряда других причин, перечисленных ниже, ряд авторов и крупные эндокринологические ассоциации предложили проводить скрининг нарушений функции ЩЖ у всех женщин на ранних сроках беременности.
Аргументами в пользу проведения скрининга на нарушение функции ЩЖ и носительство АТ-ТПО у беременных являются следующие положения:
Предлагаемый скрининг базируется на определении в указанные сроки уровня ТТГ и АТ-ТПО (см. схему). В случае ИБ скрининг на нарушения функции ЩЖ целесообразно проводить в самые ранние сроки (лучше – еще во время определения β-субъединицы ХГ для констатации беременности). Если уровень ТТГ превышает 2,5 мМЕ/л, женщине показана терапия L-T4 (эутирокс).
Диагностика гипотиреоза во время беременности
| ТТГ на ранних сроках беременности (особенно при носительстве АТ-ТПО) | |
| ↓ | ↓ |
| ТТГ 2,5 мЕд/л | |
| ↓ | ↓ |
| 1. Динамическое наблюдение 2. Скрининг на тиреоидит послеродовый | L–Т4 |
АНТИТИРЕОИДНЫЕ АНТИТЕЛА И РИСК САМОПРОИЗВОЛЬНОГО ПРЕРЫВАНИЯ БЕРЕМЕННОСТИ
Многие работы показывают, что у женщин с повышенным уровнем АТ-ТПО даже без нарушений функции ЩЖ повышен риск спонтанного прерывания беременности на ранних сроках [10], патогенез которого пока не выяснен. Вряд ли есть прямая причинно-следственная связь между ним и носительством АТ-ТПО. Возможно, антитиреоидные антитела являются маркером генерализованной аутоиммунной дисфункции, в результате которой и происходит выкидыш. Таким образом, какое-либо воздействие на собственно аутоиммунный процесс в ЩЖ не приводит к снижению риска прерывания беременности и поэтому оно не требуется. Кроме того, несмотря на отсутствие каких-либо мер патогенетического воздействия на аутоиммунные процессы в ЩЖ, следует помнить о том, что носительницы АТ-ТПО входят в группу риска самопроизвольного прерывания беременности, а потому требуют специального наблюдения со стороны акушеров-гинекологов. Особенно большое значение приобретает нормальная функция ЩЖ в программах ВРТ. Результаты недавних исследований, посвященных этой проблеме, показали, что уровень ТТГ значительно выше у женщин с низким качеством ооцитов и при неудачных попытках применения программ ВРТ. Кроме того, отмечена высокая частота носительства АТ-ЩЖ у женщин с неудачными попытками ЭКО [9, 11, 13]. Все это позволяет предположить, что уровень ТТГ является одним из показателей прогноза эффективности программ ВРТ и свидетельствует о важной роли тиреоидных гормонов в физиологии ооцитов. Результаты изучения функции ЩЖ на ранних сроках ИБ после ЭКО продемонстрировали выраженное повышение концентрации ТТГ и снижение концентрации fТ4 у женщин с АТ-ТПО (по сравнению с аналогичным показателем у женщин без антител), что свидетельствует о снижении компенсаторных возможностей ЩЖ на фоне ИБ у женщин с АТ-ЩЖ [12].
Как известно, стимуляция суперовуляции, проводимая в программах ЭКО с целью получения максимального количества ооцитов, сопровождается высокими уровнями эстрогенов в крови. Гиперэстрогения за счет ряда приспособительных механизмов (повышение уровня ТСГ в печени, связывание дополнительного количества свободных тиреоидных гормонов и, как следствие, снижение уровня последних) приводит к повышению уровня ТТГ. Это способствует повышенной стимуляции ЩЖ, которая вынуждена задействовать свои резервные возможности. Поэтому у женщин с АТ-ЩЖ даже при исходно нормальной функции ЩЖ повышается риск развития относительной гипотироксинемии в ранние сроки ИБ.
Таким образом, как стимуляция суперовуляции, так и носительство АТ-ЩЖ являются факторами, снижающими нормальный функциональный ответ ЩЖ, необходимый для адекватного развития ИБ, а АТ-ЩЖ могут быть ранним маркером риска неблагоприятного прогноза беременности после ЭКО и ПЭ.
БЕРЕМЕННОСТЬ И ТИРЕОТОКСИКОЗ
Тиреотоксикоз во время беременности развивается относительно редко (в 1–2 на 1000 беременностей). Практически все случаи тиреотоксикоза у беременных женщин связаны с болезнью Грейвса (БГ). Согласно современным представлениям, выявление БГ не является показанием для прерывания беременности, поскольку в настоящее время разработаны эффективные и безопасные методы консервативного лечения токсического зоба.
Диагностика БГ в период беременности базируется на комплексе клинических данных и результатов лабораторно–инструментального исследования, при этом наибольшее число диагностических ошибок связано с дифференциальной диагностикой БГ и так называемого транзиторного гестационного гипертиреоза. Последний не требует какого-либо лечения и постепенно, с увеличением срока беременности, проходит самостоятельно.
Наибольшее число диагностических ошибок связано с дифференциальной диагностикой болезни Грейвса и транзиторного гестационного гипертиреоза
Основной целью лечения тиреостатиками БГ при беременности является поддержание уровня fT4 на верхней границе нормы или несколько выше нормы с использованием минимальных доз препаратов.
Принципы лечения БГ во время беременности таковы:
Представленный краткий обзор проблемы оставил за рамками обсуждения как большое число частных практических аспектов (например, особенности интерпретации отдельных показателей при оценке функции ЩЖ во время беременности), так и крупных проблем, среди которых – послеродовые аутоиммунные тиреопатии (послеродовый тиреоидит, послеродовая манифестация БГ), вопросы диагностики и лечения различных форм зоба (в том числе узлового) и рака ЩЖ, патология ЩЖ новорожденного, индуцированная заболеванием ЩЖ матери и ее лечением. Нашей задачей было, скорее, обозначить проблему, стоящую на стыке эндокринологии, и гинекологии и приобретающую все большую актуальность по мере развития ВРТ и совершенствования технологий, использующихся в диагностике и лечении заболеваний ЩЖ.
ЛИТЕРАТУРА
1. Назаренко Т. А., Дуринян Э. Р., Чечурова Т. Н. Эндокринное бесплодие у женщин. Диагностика и лечение. – М., 2004; 72.
2. Фадеев В. В., Лесникова С. В., Мельниченко Г. А. Функциональное состояние щитовидной железы у беременных женщин в условиях легкого йодного дефицита // Пробл. эндокринол. – 2003; 6: 23–28.
3. Фадеев В. В., Лесникова С. В., Мельниченко Г. А. Функциональное состояние щитовидной железы у беременных женщин–носительниц антител к тиреоидной пероксидазе // Пробл. эндокринол. – 2003; 5: 23–29.
4. Brent G. A. Maternal hypothyroidism: recognition and management // Thyroid. – 1999; 99: 661–665.
5. Fadeyev V., Lesnikova S., Melnichenko G. Prevalence of thyroid disorders in pregnant women with mild iodine deficiency // Gynecol. Endocrinol. – 2003; 17: 413–418.
6. Glinoer D., De Nayer P., Delange F. et al. A randomized trial for the treatment of mild iodine deficiency during pregnancy: maternal and neonatal effects // J. Clin. Endocrinol. Metab. – 1995; 80: 258–269.
7. Glinoer D., Riahi M., Gruen J. P. et al. Risk of subclinical hypothyroidism in pregnant women with asymptomatic autoimmune thyroid disorders // J. Clin. Endocrinol. Metab. – 1994; 79: 197–204.
8. Glinoer D. The regulation of thyroid function in pregnancy: pathways of endocrine adaptation from physiology to pathology // Endocr. Rev. – 1997; 18: 404–433.
9. Kim C. H., Chae H. D., Kang B. M. et al. Influence of antithyroid antiboies in euthyroid women on in vitro fertilization–embryo transfer outcome // Am. J. Reprod. Immunol. – 1998; 40 (1): 2–8.
10. Matalon S. T., Blank M., Ornoy A. et al. The association between anti– thyroid antibodies and pregnancy loss // Am. J. Reprod. Immunol. – 2001; 45 (2): 72–77.
11. Poppe K. Glinoer D. Thyroid autoimmunity and hypothyroidism before and during pregnancy // Hum. Reprod. Update. – 2003; 9 (2): 149–161.
12. Рoppe K., Glinoer D., Tournaye H. et al. Impact of ovarian hyperstimula-tion on thyroid function in women with and without thyroid autoimmunity // J. Clin. Enocrinol. Metab. – 2004; 89 (8): 3808–3812.
13. Poppe K., Velkeniers B. Female infertility and the thyroid // Best Pract. Res. Clin. Endocrinol. Metab. – 2004; 18 (2): 153–165.