апф рецепторы что это такое простыми словами
«Таблетка от давления»: как это работает
Поделиться:
Наверное, нет ни одной другой группы лекарств, в которой было бы так много препаратов. К тому же большинство средств имеет добрый десяток аналогов, что сеет среди антигипертензивных хаос, здравому уму малоподвластный. Но ум хорошего кардиолога и профессионального фармацевта может постигнуть и не такой лекарственный ералаш.
«Много» — не значит «хорошо»
Разнообразие антигипертензивных препаратов во многом связано с тем, что сегодня наряду с современными продолжают использоваться средства, которыми лечились наши бабушки. К счастью, применяются они достаточно редко, но, тем не менее, смуту в лечение гипертонии вносят. К тому же следует учитывать, что в российских аптеках до сих пор можно запросто купить любой антигипертензивный препарат без рецепта врача. А это значит, что самолечение гипертонической болезни, которое нельзя назвать иначе, чем «самомучение», продолжает процветать и приносить горькие плоды.
Но неужели есть большая разница, как и чем снижать давление: главное же, чтобы тонометр показывал норму или приближенные к ней цифры? Конечно, есть, и вот почему.
Дело в том, что многие антигипертензивные препараты приводят к резкому снижению давления. Это не лучшим образом сказывается на самочувствии больного, однако есть последствия гораздо более серьезные. Если постоянно принимать эти лекарства, эластичность сосудистой стенки, регулярно напрягающейся и расслабляющейся, снижается. В результате развиваются (или быстро прогрессируют) заболевания сердца и сосудов — наиболее опасные осложнения гипертонии.

К препаратам, обладающим резким сосудорасширяющим эффектом, относятся любимые многими поколениями гипертоников адельфан и клонидин. Менее мощное действие на сосуды оказывают дешевые бендазол и его комбинация с папаверином, метамизолом и фенобарбиталом (андипал). Эти средства уменьшают сердечный выброс и при длительном применении ухудшают показатели ЭКГ.
А растительные гипотензивные препараты, например раунатин, и вовсе рассматривать всерьез не приходится: лекарствам, возраст которых уже перевалил за шестой десяток, уже давно найдена более эффективная и безопасная альтернатива.
Шесть групп
Я перечислила далеко не все гипотензивные препараты, которые продолжают выпускаться и применяться, несмотря на серьезные недостатки и побочные эффекты. Их так много, что я боюсь запутать читателя окончательно. Гораздо проще назвать те средства, которые во всем мире признаны препаратами выбора для лечения гипертонии. Они относятся к шести фармакологическим группам:
Механизм действия каждой из этих групп различен и достаточно сложен:
Кстати, разницы в эффективности между ними практически нет. Из ряда препаратов выбиваются нифедипин и каптоприл, которые можно принимать как средства скорой помощи для быстрого снижения давления. Кроме того, диуретики, блокаторы кальциевых каналов и ингибиторы АПФ определенно снижают риск развития сердечно-сосудистых катастроф, вероятность которых значительно возрастает при гипертонии.
Читайте также:
Люди с гипертонией
Как правило, гипотензивный эффект длится 12, а иногда и 24 часов, что позволяет принимать лекарства два или один раз в сутки. Однако далеко не всегда удается справиться с гипертонией с помощью одного препарата.
Когда один в поле не воин
Назначая гипотензивное средство, врач должен стремиться обойтись минимальной дозой. Если приходится повышать дозировку из-за недостаточного антигипертензивного эффекта, следует задуматься о введении второго лекарства — априори безопасней считается принимать два препарата в минимальных дозах, чем один в максимальной. По статистике, больше половины больных не достигают целевых показателей давления с помощью одного средства.
Комбинированная терапия гипертонии может осуществляться как с помощью уже готовых, комплексных препаратов (например, периндоприл + индапамид, лизиноприл + гидрохлортиазид и т. д.), так и за счет сочетания двух разных средств. Однако сочетать тоже нужно с умом — существуют стандартные схемы, доказавшие свою рациональность. Всемирная организация здравоохранения предлагает использовать пять комбинаций:
Правильная терапия
Следует отметить, что даже самый квалифицированный врач вряд ли с первого визита пациента сможет подобрать оптимальную схему лечения гипертонии. Процесс этот подчас длительный и скрупулезный. Больной должен регулярно вести дневник артериального давления и отмечать, как прием препаратов влияет на его показатели. Доктор, анализируя первичные результаты, корректирует дозу или при необходимости вводит еще одно средство. Так продолжается до тех пор, пока эффект не будет достигнут.
Конечная цель гипотензивной терапии — это не быстрое снижение повышенного давления, а недопущение его подъема. У больного гипертонией, получающего адекватное лечение, артериальное давление должно всегда оставаться в норме.
К тому же у тех, кто лечится правильно, снижается риск инфаркта на 20–25 %, инсульта на 35–40 %, а сердечной недостаточности — более чем наполовину. А значит, с современными «таблетками от давления» можно продолжать радоваться жизни, несмотря на гипертонию.
Товары по теме: [product strict=»гидрохлортиазид»](гидрохлортиазид), [product strict=»индапамид»](индапамид), [product strict=»атенолол»](атенолол), [product strict=»бетаксолол»](бетаксолол), [product strict=»метопролол»](метопролол), [product strict=»бисопролол»](бисопролол), [product strict=»небиволол»](небиволол), [product strict=»верапамил»](верапамил), [product strict=»амлодипин»](амлодипин), [product strict=»нифедипин»](нифедипин), [product strict=»фелодипин»](фелодипин), [product strict=»каптоприл»](каптоприл), [product strict=»эналаприл»](эналаприл), [product strict=»лизиноприл»](лизиноприл), [product strict=»рамиприл»](рамиприл), [product strict=»фозиноприл»](фозиноприл), [product strict=»лозартан»](лозартан), [product strict=»валсартан»](валсартан), [product strict=»кандесартан»](кандесартан), [product strict=»ирбесартан»](ирбесартан), [product strict=»телмисартан»](телмисартан), [product strict=»эбрантил»](эбрантил), [product strict=»доксазозин»](доксазозин).
Блокаторы РААС и COVID-19
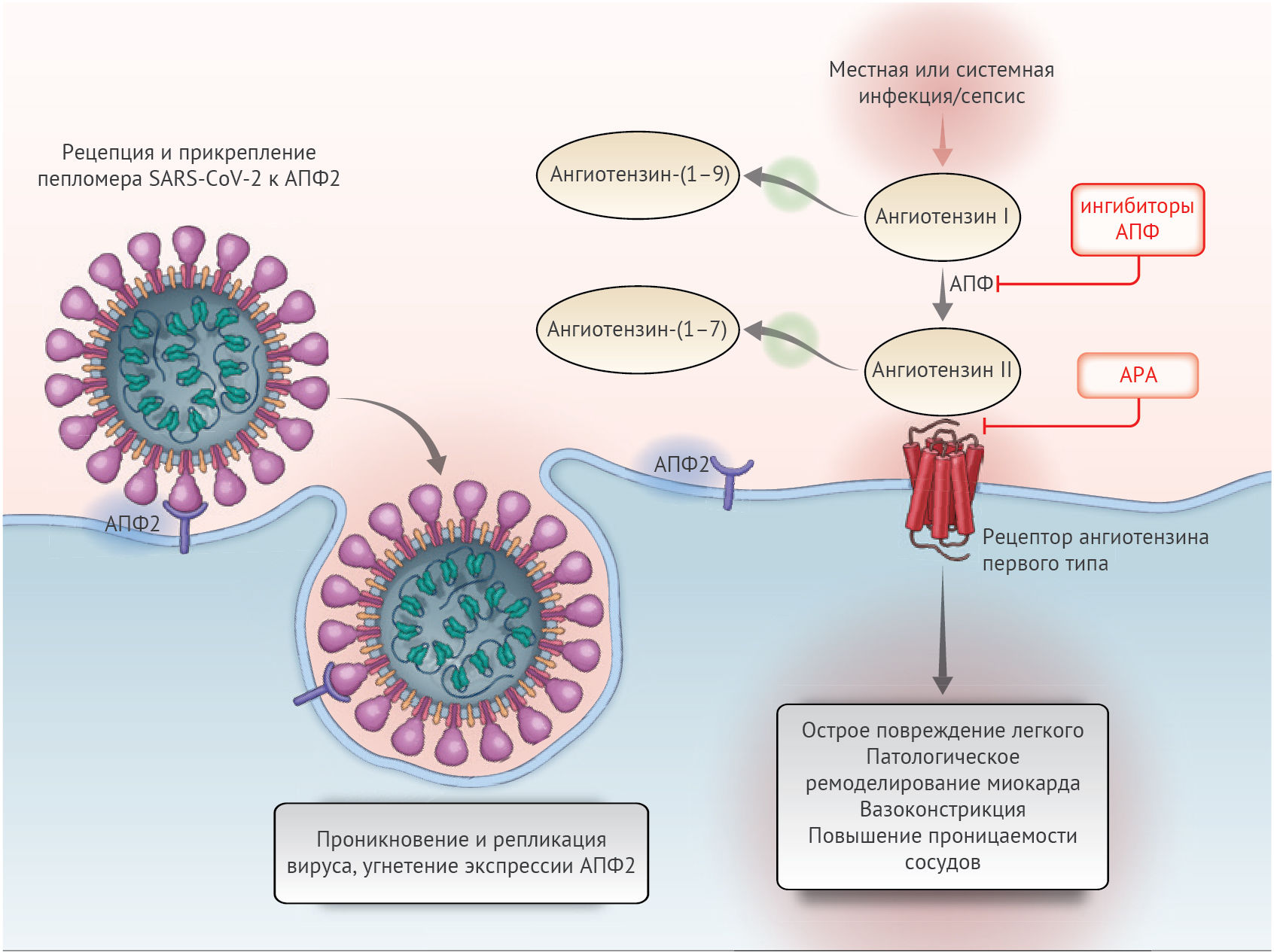
Ренин-ангиотензин-альдостероновая система (РААС) — это элегантный каскад вазоактивных пептидов, организующий ключевые физиологические процессы в теле человека. Коронавирусы тяжелого острого респираторного синдрома SARS-CoV-1 и SARS-CoV-2 стали причиной эпидемии тяжелого острого респираторного синдрома в 2002–2004 годах и текущей пандемии коронавирусной инфекции (COVID-19). Эти вирусы взаимодействуют с РААС через ангиотензин-превращающий фермент 2 (ACE2, АПФ2) — белок, физиологической функцией которого является угнетение активации РААС, но который также служит рецептором для обоих типов вирусов SARS. Эта связь между вирусами SARS и АПФ2 рассматривается как потенциальный фактор инфективности, соответственно, высказываются опасения относительно применения ингибиторов РААС, которые изменяют активность АПФ2, и влияния различий в экспрессии АПФ2 на степень вирулентности вируса в текущей пандемии COVID-19. Действительно, недавно некоторые СМИ и системы здравоохранения призвали к отказу от ингибиторов АПФ и антагонистов рецепторов ангиотензина (АРА) как с профилактической целью, так и в контексте подозрения на COVID-19.
Принимая во внимание обширное применение ингибиторов АПФ и АРА во всем мире, существует срочная потребность в рекомендациях по использованию этих лекарств в терапии пациентов с COVID-19. Здесь мы подчеркиваем, что собранные данные на человеческих выборках весьма скудны и не могут быть применены для подтверждения или опровержения высказываемых гипотез и опасений. В особенности мы обсуждаем неопределенные эффекты блокаторов РААС на уровень и активность АПФ2 у людей и выдвигаем альтернативную гипотезу о том, что изменения АПФ2 могут быть полезны, а не вредны для пациентов с поражениями легких. Также мы недвусмысленно хотим выразить озабоченность касаемо отказа от применения ингибиторов РААС, так как считаем, что это может быть опасным для некоторых пациентов из групп высокого риска с выявленным или подозреваемым COVID-19.
COVID-19 и пожилые пациенты с сопутствующей патологией
Первые доклады обращали внимание на потенциально высокую встречаемость гипертензии среди пациентов с COVID-19 по сравнению с общей популяцией. В самой большой серии случаев из Китая, собранных во время пандемии, гипертензия была самой часто встречаемой сопутствующей патологией у 1099 пациентов, что составляло примерно 15 % от выборки, однако эти значения оказываются ниже, чем встречаемость гипертензии у пациентов с другими вирусными инфекциям, и ниже, чем частота гипертензии в популяции Китая.
По данным докладов, сопутствующие патологии, включая гипертензию, встречались гораздо чаще у пациентов с тяжелым течением COVID-19, требующих перемещения в отделения интенсивной терапии и назначения ИВЛ, или у погибших пациентов в сравнении с пациентами с более мягким течением. Высказываются опасения, что терапия сопутствующих патологий, в том числе применение ингибиторов РААС, могла внести вклад в исход основного заболевания. Однако эти исходы наблюдались также в тесной связи с пожилым возрастом, который в настоящее время считается самым значимым предиктором COVID-19-ассоциированной смерти. К сожалению, на сегодняшний день в докладах недостаточное внимание уделяется возрасту или иным важным факторам, которые могут выступать в качестве потенциальных предикторов риска. Для других инфекционных заболеваний сопутствующие патологии, такие как гипертензия, являются ключевыми прогностическими факторами, что, скорее всего, верно и в отношении COVID-19.
Важно отметить, что, несмотря на заключения о применении ингибиторов РААС, в этих работах отсутствуют конкретные данные. Согласно популяционным исследованиям, доля получающих антигипертензивную терапию от общего числа больных гипертензией в Китае составляет всего от 30 до 40 %. Ингибиторы РААС как базовую терапию или в составе комбинированной терапии получают только 25–30 %пациентов, проходящих лечение. Представленные данные позволяют оценить, что лишь незначительная часть пациентов с COVID-19 получала терапию ингибиторами РААС, по крайней мере в Китае. Необходимо получить информацию о связи терапии ингибиторами РААС и соответствующими исходами основного заболевания со строгим учетом показаний к терапии и тяжести сопутствующего заболевания у пациентов с COVID-19.
Неопределенные эффекты ингибиторов РААС на АПФ2 у людей
Тканеспецифичные и системные компоненты РААС составляют сложную переплетающуюся сеть активирующих и ингибирующих пептидов (рис. 1). АПФ2 — важнейший ингибирующий белок, ответственный за распад ангиотензина II до ангиотензина-(1–7), который таким образом ослабляет его эффекты на вазоконстрикцию, задержку натрия и процессы фиброзирования. Хотя ангиотензин II и является главным субстратом АПФ2, этот фермент также может превращать ангиотензин I в ангиотензин-(1–9) и участвовать в гидролизе иных пептидов. В исследованиях на людях была показана обширная экспрессия АПФ2 в образцах ткани, полученных из 15 органов, в числе которых были сердце и почки, а также в основных клетках-мишенях SARS-CoV-2 (c манифестными признаками поражения) — альвеолярном эпителии легких. Определенный интерес вызывает низкий уровень растворимых форм АПФ2 в системном кровотоке вместе с относительно низкой функциональной ролью АПФ2 в легочной ткани в нормальных условиях. Однако существуют клинические состояния, способствующие активации этого звена.
Можно ожидать, что ингибиторы АПФ и АРА оказывают разное влияние на уровень АПФ2, так как их эффекты на ангиотензин II (основной субстрат АПФ2) различаются. Несмотря на существенную структурную гомологию между АПФ и АПФ2, их активные центры различны. В результате этого ингибиторы АПФ не влияют на активность АПФ2 напрямую. Экспериментальные животные модели позволили обнаружить смешанное воздействие ингибиторов АПФ на уровни АПФ2 и его активность в тканях. Подобные противоречивые результаты в исследованиях на животных моделях наблюдались и в отношении влияния АРА на АПФ2. В одних исследованиях была обнаружена усиленная экспрессия матричной РНК АПФ2 или же увеличенные концентрации самого АПФ2, другие же работы не нашли никаких эффектов.
В отличие от работ на животных моделях, существует мало исследований эффектов ингибиторов РААС на экспрессию АПФ2 на людях. В одной работе описано, что внутривенное введение ингибиторов АПФ пациентам с коронарной недостаточностью никак не повлияло на продукцию ангиотензина-(1–7), что ставит под вопрос влияние ингибиторов АПФ на АПФ2-опосредованный метаболизм ангиотензина II вообще. Аналогично, в другом исследовании среди пациентов с гипертензией уровни ангиотензина-(1–7) остались неизменными после назначения ингибитора АПФ каптоприла. Однако если монотерапия каптоприлом продолжалась 6 месяцев, уровень ангиотензина-(1–7) увеличился. Кроме того, в нескольких исследованиях изучалась активность АПФ2 в плазме или концентрация АПФ2 в моче у пациентов на длительной терапии ингибиторами РААС. В кросс-секционных исследованиях пациентов с сердечной недостаточностью, фибрилляцией предсердий, аортальным стенозом и коронарной недостаточностью, принимающих ингибиторы АПФ или АРА, активность АПФ2 в плазме не отличалась от пациентов с такими же заболеваниями, не получавших терапии. В лонгитюдном когортном исследовании японских пациентов с гипертензией уровень АПФ2 в моче пациентов, получавших длительное лечение АРА олмесартаном, был выше, чем в контрольной группе, не получавшей терапии, но такого эффекта не наблюдалось в отношении ингибитора АПФ эналаприла или других АРА (лозартан, кандесартан, валсартан, и телмисартан). Предшествующая терапия ингибиторами АПФ связывалась с ростом уровня матричной РНК АПФ2 в тканях кишки, но никакой связи между терапией АРА и количеством РНК АПФ2 выявлено не было; влияние ингибиторов РААС на экспрессию АПФ2 в легочной ткани неизвестно.
Эти противоречивые данные указывают на всю сложность устройства ответов РААС на модуляторы и подтверждают предположение о том, что выводы доклинических исследований на модельных организмах нельзя однозначно переносить на человеческую физиологию. Это наводит на мысль, что воздействие ингибиторов РААС на АПФ2 может принимать различные формы в зависимости от конкретного препарата данного класса. Важно отметить, что уровни АПФ2 в плазме могут быть не показательны в отношении полноразмерной мембраносвязанной формы, частично из-за того, что процесс отделения АПФ2 от мембраны отдельно регулируется эндогенным ингибитором. Помимо степени экспрессии, значимость роли АПФ2 может различаться в зависимости от конкретной ткани или клинического состояния. К сожалению, отсутствуют данные о влиянии ингибиторов АПФ, АРА и других ингибиторов РААС на экспрессию АПФ2 в легочной ткани. Более того, даже если ингибиторы РААС и влияют на уровень и/или активность АПФ2 в тканях-мишенях, нет клинических данных о том, что это влияет на процесс связывания и проникновения пепломеров SARS-CoV-2 в клетку. Необходимо дальнейшее изучение взаимного влияния SARS-CoV-2 и РААС на людях.
Потенциальная польза ингибиторов РААС при COVID-19
SARS-CoV-2 не только использует АПФ2 для проникновения в клетку, он также угнетает его дальнейшую экспрессию, что приводит к прекращению его органопротективного действия. В настоящее время предполагается, хоть и без каких-либо доказательств, что непрерывное действие ангиотензина II может частично влиять на степень повреждения органа при COVID-19. Сразу после рецепции и прикрепления пепломера вируса начинается процесс последовательного снижения концентрации АПФ2 на поверхности мембраны. Продолжительно персистирующая вирусная инфекция и репликация вирионов также вносят вклад в снижение экспрессии АПФ2, во всяком случае на клеточных культурах in vitro. Угнетение активности АПФ2 в легких обусловливает первичную инфильтрацию нейтрофилов в ответ на бактериальные эндотоксины и может вести к чрезмерному накоплению освободившегося от ингибирования ангиотензина II и местной активации РААС. Действительно, в экспериментальных моделях на мышах воздействие пепломеров SARS-CoV-1 вызывало острое поражение легких, которое ограничивалось блокадой РААС. В экспериментах с другими мышиными моделями авторы пришли к выводу, что дисрегуляция АПФ2 может способствовать вторичному острому поражению легких при первичном поражении вирулентными штаммами вируса гриппа и респираторно-синцитиального вируса человека. В небольшом исследовании проследили корреляцию между повышенным уровнем плазменного ангиотензина II с общей вирусной нагрузкой и степенью тяжести поражения легких у пациентов с COVID-19. Восстановление уровня АПФ2 посредством введения рекомбинантного препарата АПФ2 позволило обратить разрушительные процессы в легочной ткани на доклинических моделях иных острых вирусных инфекций, а в испытаниях второй фазы у людей с острым респираторным дистресс синдромом безопасно снизить уровень ангиотензина II.
Дисрегуляция АПФ2 при COVID-19 в теории может привести к снижению его кардиопротективного эффекта при вовлечении миокарда и аномальной легочной гемодинамики. Уровни маркеров повреждения миокарда повышались во время развития COVID-19 и продолжали нарастать при ухудшении течения заболевания и перед смертью. Многие вирусы кардиотропны, и многие вирусемии сопровождаются субклиническим вирусным миокардитом. Роль АПФ2 в ответе миокарда на повреждения и его восстановлении хорошо известна. Так, в одном исследовании на животных с нокаутированным геном АПФ2 у них развивались крайне неблагоприятные процессы ремоделирования левого желудочка в ответ на острое повреждение в связи с накоплением ангиотензина II. При аутопсии пациентов, погибших от SARS, в 35 % образов сердец было обнаружено присутствие вирусной РНК, которое, в свою очередь, было ассоциировано со сниженной экспрессией АПФ2. Введение рекомбинантного АПФ2 нормализовало уровень ангиотензина II в изолированных сердцах человека, пораженных дилатационной кардиомиопатией. Данные гипотезы легли в основу испытаний рекомбинантного препарата АПФ2 для восстановления баланса РААС и потенциального предотвращения органного повреждения. В дополнении к этому, на текущий момент проводятся парные исследования лозартана для лечения COVID-19 на пациентах, не получавших ранее терапию блокаторами РААС, которые были госпитализированы, и на пациентах, не имевших госпитализаций в анамнезе.
Продолжение применения блокаторов РААС у пациентов с выявленным или подозреваемым COVID-19
Несмотря на приведенные теоретические противоречия относительно влияния фармакологический регуляции АПФ2 на инфективность SARS-CoV-2, существует явный риск здоровью при отмене терапии блокаторами РААС у пациентов, которые в остальном находятся в стабильном состоянии. COVID-19 протекает особенно тяжело у пациентов с сопутствующими кардиоваскулярными патологиями, что ведет к активному поражению миокарда, миокардиальному стрессу, и кардиомиопатии. Блокаторы РААС показали клиническую эффективность в отношении протективного действия на сердце и почки, их отмена может привести к клинической декомпенсации у пациентов в группах высокого риска.
Несмотря на то, что данные по сердечной недостаточности нечасто встречаются в эпидемиологических докладах из Китая, встречаемость сердечной недостаточности среди пациентов в критическом состоянии в США может быть велика (> 40 %). В клинических испытаниях квинаприла для лечения сердечной недостаточности было продемонстрировано серьезное прогрессирующее ухудшение состояния пациентов с хронической симптоматической сердечной недостаточностью. В исследовании TRED-HF среди пациентов с асимптоматической сердечной недостаточностью и восстановленной фракции выброса левого желудочка был продемонстрирован стремительный рецидив дилатационной кардиомиопатии сразу после прекращения терапии (в том числе терапии блокаторами РААС). Более того, блокаторы РААС являются базисной терапией после инфаркта миокарда: продолжительная терапия на протяжении нескольких дней или недель после указанного события показала снижение ранней смертности. Инфаркт миокарда, ассоциированный с COVID-19, может быть более опасным среди клинически нестабильных пациентов в случае отмены блокаторов РААС.
Отмена блокаторов РААС, назначенных для контроля гипертензии, может нести меньшие риски, нежели их отмена при состояниях, для которых они показаны множеством клинических рекомендаций как базисный метод терапии, однако в этом случае она может быть сопряжена с иными трудностями. Отмена блокаторов РААС для перехода на другую антигипертензивную терапию у стабильных амбулаторных пациентов должна проводиться осторожно во избежание эффекта рикошета. Более того, подбор эквивалентной дозы иной антигипертензивной терапии может быть проблематичным на практике и зависеть от индивидуальных особенностей каждого пациента. Даже малые и непродолжительные скачки АД после смены терапевтической тактики связаны с избыточным кардиоваскулярным риском. Это может быть особенно важно у пациентов с COVID-19 — инфекцией, влекущей за собой активацию РААС, в странах, где не достигнут адекватный контроль артериального давления в популяции (например, в Китае).
Эффекты при отмене блокаторов РААС или при переходе на другие схемы терапии у пациентов с хронической болезнью почек (ХБП) остаются неопределенными. Хотя в Китае частота встречаемости ХБП, госпитализированных по поводу COVID-19, достаточно низка (1–3 %), в других странах и у пациентов в критическом состоянии встречаемость ХБП может быть выше. Многие пациенты испытывают острую почечную недостаточность разной степени в течении болезни. Для этих групп высокого риска рекомендуется принимать индивидуальные решения по терапевтической тактике в отношении блокаторов РААС, руководствуясь гемодинамическим статусом, функцией почек и клинической стабильностью.
На основе доступных данных мы считаем, что несмотря на теоретические опасения и неопределенность в отношении эффектов блокаторов РААС на АПФ2 и потенциального влияния этих препаратов на течение COVID-19, терапия блокаторами РААС должна быть продолжена у пациентов в стабильном состоянии, имеющих риск заражения или уже болеющих COVID-19 (см. сноску). Данную позицию сейчас поддерживает множество профессиональных ассоциаций (Таблица S2). Несмотря на то, что дополнительные данные могут влиять на принятие решений о терапии пациентов с COVID-19 из групп высокого риска, врачи должны осознавать нежелательные последствия преждевременного прекращения доказанной терапии из-за гипотетических опасений, основанных на неполных экспериментальных данных.
Ключевые положения взаимодействия между COVID-19 и ренин-ангиотензин-альдостероновой системой
Ингибиторы АПФ: их безопасность и соотношение польза-риск в клинической практике. Интервью «Лечащего врача».

Мы встретились с С.Ю.Марцевичем, профессором кафедры доказательной медицины ФДПОП Первого МГМУ имени И.М. Сеченова, чтобы выяснить, насколько обоснованно беспокойство по поводу безопасности ингибиторов АПФ и должно ли это повлиять на клиническую практику.
.jpg)
С.Ю.Марцевич: Такие препараты, как бета-блокаторы, статины, иАПФ – огромное достижение современной кардиологии. Они появились где-то в середине-конце 20 века, и они впервые позволили не просто улучшить симптомы болезни, но и повлиять на ее исход, продлить жизнь пациента. Показатели смертности от сердечно-сосудистых заболеваний очень высоки, и эти препараты доказали свое влияние не только в исследованиях, но и в общей популяции. Например, в США был проведен анализ, который показал, что за несколько десятилетий применение таких препаратов внесло существенный вклад в снижение смертности населения. Широкое использование этих препаратов – это стратегическое решение, и принципиально иной подход.
Естественно, как и у любых других препаратов, у них есть побочные эффекты. Вопрос в том, какие они, насколько они полно и грамотно выявлены. Чем больше развивается наука оценки побочных действий лекарств, тем менее вероятным становится их серьезный побочный эффект. Все последние группы лекарств очень тщательно тестируются.
Ингибиторы АПФ имеют огромный опыт применения, он исчисляется десятилетиями. Их безопасность доказана как рандомизированными контролируемыми исследованиями, которые легли в основу их внедрения в практику, так и этой самой практикой. Ожидать от них необычных побочных действий достаточно наивно.
ЛВ: А что касается недавнего исследования, опубликованного в журнале BMJ, согласно которому применение ингибиторов АПФ связано с увеличением риска развития рака легких?
С.Ю.: Эта статья, к сожалению, имеет невысокий уровень доказательности. Это чисто наблюдательное исследование. Самым высоким классом наблюдательного исследования считается исследование, основанное на регистре, но это исследование проводилось с использованием базы данных. В отличие от базы данных, регистр имеет заранее поставленную цель: например, изучить побочное действие ингибиторов АПФ. И если бы мы хотели действительно изучить этот вопрос, надо было бы использовать уже имеющийся или создать новый регистр, способный решить поставленную задачу. А база данных, поскольку не создается под конкретную цель, не дает такой точности данных. Если исследование заранее не планирует что-то оценивать, то оно всегда будет ущербным в плане доказанности сделанных выводов.
Если бы эту базу данных планировали использовать для выявления онкологии, то и способы выявления заболеваний и связи с лекарственными препаратами были бы более адекватными. Там же все решается с помощью сложных статистических методов. Но статистические методы никогда не заменят клинических исследований.
Когда с помощью наблюдательных исследований пытаются решить вопросы, не решенные в рандомизированных контролируемых исследованиях (РКИ), нужно получить две группы больных: те, кто получал препарат и те, кто его не получал. Чтобы снизить вероятность ошибок, эти группы должны быть абсолютно одинаковыми. Авторы утверждают, что им удалось получить сопоставимые группы, но это не так, и это четко видно в таблице 1 из их статьи.
| Параметр | Вся выборка | Пациенты, получавшие антигипертензивную терапию на момент начала исследования | ||
| иАПФ | Блокаторы рецепторов ангиотензина | Другие | ||
| Применение статинов | 164891 (16,6%) | 73510 (35,3%) | 4092 (25,5%) | 87289 (11,4%) |
Табл. 1. (фрагмент). По Hicks Blánaid M, Filion Kristian B, Yin Hui, Sakr Lama, Udell Jacob A, Azoulay Laurent et al. Angiotensin converting enzyme inhibitors and risk of lung cancer: population based cohort study BMJ 2018; 363: k4209.
В группе, получавшей ингибиторы АПФ, статины назначались вдвое чаще. Получается, что в этой группе были более тяжелые больные, получавшие более интенсивное лечение.
Представляется некорректной и сама постановка вопроса. В этой статье показано, что вероятность рака легких увеличивается через 10 лет после начала приема иАПФ. Но ведь речь идет о больных с сердечно-сосудистыми заболеваниями, у которых прогноз жизни очень плохой. Сколько они проживут без лечения?
Полученные данные можно трактовать совершенно по-другому. Те больные, которые получали ингибиторы АПФ, были, возможно, спасены от сердечно-сосудистых осложнений за счет применения ингибиторов АПФ, поэтому они прожили дополнительные 10 лет, а после этого умерли. Каждый человек от чего-то рано или поздно умрет, с этим нельзя спорить.
Почему умирали именно от рака легких? Сами авторы анализа дают подсказку: в основном, в этой группе были курильщики. Тогда все становится еще проще: от рака легких умерли те, кто курил.
Почему-то никто не упоминает о том, что в этом же номере BMJ есть 11 комментариев к этой статье. Большинство комментаторов, в том числе, члены редколлегии, пишут, что побочное действие всегда надо соотносить с пользой препарата. А в этой статье о соотношении пользы и риска нет ни слова, авторы сконцентрировались на раке легких, и больше их ничего не интересовало.
ЛВ: А авторы дают какой-то ответ на эти комментарии?
С.Ю.: Нет, может быть, он появится со временем, но пока что авторы ничего не ответили. Они провели дополнительный анализ, и указали, что вывод о раке легких касается только курящих. Это единственное, в чем они сделали какую-то уступку, но сути дела это не меняет.
ЛВ: Вы считаете, что эта информация недостаточно достоверна, чтобы принимать решения о терапевтической стратегии на ее основании?
С.Ю.: Да, именно так. Неграмотность постановки вопроса и дефекты анализа этому мешают. Никаких изменений в лечебной практике быть не должно.
На данном этапе из этой статьи можно сделать только один вывод: авторы сформировали гипотезу, но ничего более.
ЛВ: Бывали ли противоположные ситуации, когда новые данные о каких-то классических препаратах заставляли отказаться от их употребления?
С.Ю.: Это сложный вопрос. Случаи отзыва препаратов бывали, и даже тех, которые применялись достаточно долго. Недавно в юбилейном номере журнала NEJM вышла статья, авторы которой анализируют, как оценивался риск применения лекарств на протяжении двух веков. Раньше на побочные действия тоже обращали внимание, но на первый план выходила эффективность лекарств, и еще в начале XX века применялись препараты на основе мышьяка, ртути. Но они сошли на нет, потому что их токсичность была очевидна и безо всяких исследований.
Более свежий пример – один из первых антибиотиков, стрептомицин. Хотя он и спас большое количество жизней, он оказался весьма токсичным, и в некоторых случаях приводил к глухоте. Это стало ясно без проведения каких-то дополнительных исследований.
Есть и другие примеры: церивастатин, который несколько уступал другим статинам по частоте развития побочных эффектов, или антидиабетические препараты из группы глитазонов.
Система обеспечения безопасности лекарств постоянно совершенствуется. При такой постановке вопроса искать какие-то неизведанные побочные эффекты достаточно наивно.
ЛВ: Ингибиторы АПФ – безопасный класс препаратов?
С.Ю.: Да, их побочные эффекты были выявлены еще до того, как они попали в клиническую практику. Единственное серьезное осложнение – ангионевротический отек. Он опасен, не всегда предсказуем, но крайне редок, и не ограничил применения препарата. Врачам были даны рекомендации, у каких больных можно ожидать развития этого побочного эффекта.
Частый побочный эффект – кашель, но он не опасен. Согласно рекомендациям, врач должен поинтересоваться у больного, насколько ему мешает кашель. Как правило, когда пациенты узнают, что средство продлевает жизнь, они соглашаются, что кашель не так уж и страшен.
ЛВ: Есть ли какие-то индивидуальные метаболические или генетические особенности, влияющие на эффективность ингибиторов АПФ?
С.Ю.: Это неизведанный вопрос. Подбор лекарств по генетическим особенностям звучит привлекательно, но реальные успехи в этом деле минимальны. Как правило, за этим не стоит никаких клинических доказательств, а подкреплены доводы лишь формальной логикой.
На метаболизм многих лекарств могут влиять как внутренние, так и внешние факторы. Классический пример – грейпфрутовый сок, который, как считается, теоретически может повлиять на действие лекарств. Но это доказано только in vitro, не в клинических исследованиях.
Когда только был разработан клопидогрел, который позиционировался как замена аспирина, были опубликованы статьи о том, что у некоторых пациентов может быть генетическая невосприимчивость к аспирину. Сейчас, много лет спустя, когда появились более современные, чем клопидогрел, препараты, стали говорить о генетической невосприимчивости уже у этому препарату. А о невосприимчивости к аспирину как-то подзабыли. Возможно, какой-то генетический фактор и есть, но мы не можем его определить при помощи наших методов – и тем более не могли тогда.
ЛВ: Как бы вы сравнили ингибиторы АПФ и блокаторы рецепторов ангиотензина?
С.Ю.: Это близкие группы препаратов, хотя между ними и есть свои различия. Чисто хронологически сложилось так, что иАПФ появились раньше, и все принципиальные вещи в отношении снижения смертности были доказаны именно на них. Сартаны пытались преподнести как более эффективные и безопасные препараты. Эта гипотеза на протяжении какого-то времени работала, но как только начали проводиться рандомизированные клинические исследования, стало ясно, что иАПФ обладают явными преимуществами. Я не знаю ни одного исследования, в котором было бы показано превосходство сартанов над иАПФ, а есть и крупные исследования, которые показывают обратное.
Никто не говорит, что сартаны – плохие препараты, но они уступают ингибиторам АПФ, если речь идет о пациентах высокого риска. Преимущество сартанов только одно – они реже вызывают кашель. Но если перед врачом пациент высокого риска, пациент с плохим прогнозом, то ему показаны ингибиторы АПФ. Назначение сартанов в такой ситуации будет грубейшей ошибкой. Они должны назначаться тогда и только тогда, когда пациент не переносит лечение ингибиторами АПФ.

 Читайте также:
Читайте также: