апластическая анемия что это такое простыми словами
Апластическая анемия у взрослых
Общая информация
Краткое описание
Одобрен
Объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения Республики Казахстан
от «3» октября 2019 года
Протокол №74
Приобретённая (идиопатическая) апластическая анемия – панцитопения с гипоцеллюлярным костным мозгом в отсутствие патологической инфильтрации и повышения количества ретикулиновых волокон.
Апластическая анемия – гетерогенное заболевание. В большинстве случаев (70-80%) этиология остается неясной – идиопатическая апластическая анемия. Примерно в 15-20% наблюдаются конституциональные/врожденные варианты апластической анемии. В некоторых случаях удается установить причину апластической анемии – лекарственное воздействие (таблица 1), инфекцию и др.
Таблица 1. Препараты, использование которых может быть ассоциировано с АА.
| Группа | Препараты |
| Антибиотики | Хлорамфеникол, Сульфаниламиды, Ко-тримоксазол, Линезолид |
| Противовоспалительные препараты | Препараты золота, Пеницилламин, Индометацин, Диклофенак, Напроксен, Пироксикам, Сульфасалазин |
| Противосудоржные препараты | Карбамазепин, Фенитоин |
| Тиростатики | Тиоурацил, Карбимазол |
| Антидепрессанты | Фенотиазины |
| Гипогликемические средства | Хлорпропамид, Толбутамид |
| Противомалярийные препараты | Хлорохин |
| Другие | Аллопуринол, Тиазиды |
Код(ы) МКБ-10:
| МКБ-10 | |
| Код | Название |
| D 61.3 | Идиопатическая апластическая анемия |
Дата разработки/пересмотра протокола: 2015 год (пересмотр 2018 г.)
Сокращения, используемые в протоколе:
| АЛТ | – | аланинаминотрансфераза |
| АСТ | – | аспартатаминотрансфераза |
| БФ | – | бластная фаза |
| ГСК | – | гемопоэтические стволовые клетки |
| ГЦ | – | герменативный центр |
| ЗНО | – | злокачественное новообразование |
| ИГХ | – | иммунногистохимия |
| ИП | – | истинная полицитемия |
| ИФα | – | интерферлн-альфа |
| ИФА | – | иммунноферментный анализ |
| ИФТ | – | иммуннофенотипирование |
| КП | – | клинический протокол |
| КТ | – | компьютерная томография |
| ЛДГ | – | лактатдегидрогеназа |
| МПЗ | – | миелопролиферативные заболевания |
| МФ | – | миелофиброз |
| МДС | – | миелодиспластический синдром. |
| МКБ | – | международная классификация болезней |
| МОБ | – | минимальная остаточная болезнь |
| ОАК | – | общий анализ крови |
| ОБП | – | органы брюшной полости |
| ПХТ | – | полихимиотерапия |
| ПЦР | – | |
| РКИ | – | рандомизированное клиническое исследование |
| ТКМ | – | трансплантация костного мозга |
| УД | – | уровень доказательности |
| УЗДГ | – | ультразвуковая доплерография |
| УЗИ | – | ультразвуковое исследование |
| ЭКГ | – | электрокардиограмма |
| ЭТ | – | эссенциальная тромбоцитемия. |
| FISH | – | Fluorescence in situ hybridization |
Пользователи протокола: врачи общей практики, терапевты, гематологи, гинекологи.
Категория пациентов: взрослые, беременные.
Шкала уровня доказательности [1]:
Апластическая анемия
Апластическая анемия (АА) — это заболевание, характеризующееся панцитопенией, гипоклеточностью костного мозга при отсутствии аномальных клеток или фиброза костного мозга. Первое описание апластической анемии было получено в 1888 году Паулем Эрлихом — это была молодая беременная женщина, умершая от тяжелой анемии и нейтропении, на аутопсии было выявлено замещение межтрабекулярных пространств костного мозга жировой тканью, т. е. отсутствие гемопоэза. Термин «апластическая анемия» был введен французским гематологом А. М. Шоффаром в 1904 году и применен стохастически. Хоть АА и не является распространенным заболеванием, трагичность каждого отдельного случая и фатальные последствия вызывают к ней значительный интерес [1, 3, 4].
АА может носить как наследственный, так и приобретенный характер. Несколько редких врожденных заболеваний, включая анемию Фанкони, синдром Швахмана-Даймонда, врожденный дискератоз, первично характеризуются апластическим типом гемопоэза [2].
В большом количестве литературных источников начиная с XX века описаны различные химические и лекарственные соединения, вызывающие это заболевание; широко известно влияние на показатели крови бензола, а также случаи апластической анемии после введения хлорамфеникола. Хлорамфеникол является широко известным лекарством, документально зарегистрированным как фактор развития апластической анемии. Хотя этот препарат при очень высокой дозе оказывает непосредственно миелосупрессивное действие из-за его влияния на митохондриальную ДНК, возникновение апластической анемии носит идиосинкразический характер, предположительно связанный с унаследованной чувствительностью к нитрозосодержащим токсичным промежуточным продуктам. Риск развития апластической анемии у пациентов, получавших хлорамфеникол, составляет примерно 1 на 20 000, то есть в 25 раз больше, чем в общей популяции. Хотя в индустриальных странах его использование в качестве антибиотика прекращено, до сих пор появляются сообщения о фатальной апластической анемии при его топическом или системном использовании.
Известно, что некоторые препараты также могут вызывать селективные цитопении и агранулоцитоз, которые обычно обратимы и проходят после прекращения воздействия агента. Эти обратимые реакции не коррелируют с риском апластической анемии, ставя под сомнение эффективность рутинного мониторинга клинического анализа крови в качестве метода диагностики апластической анемии [1].
Исследования in vitro и данные клинических наблюдений привели к выводу, что основой для большинства случаев приобретенной апластической анемии служит атака цитотоксическими Т-лимфоцитами CD34+ клеток и стволовых клеток крови (СКК). Иммунное повреждение клеток костного мозга после лекарственной, вирусной или токсической аплазии костного мозга может быть результатом индукции неоантигенов, провоцирующих вторичную Т-опосредованную атаку на кроветворные клетки. Спонтанное или митоген-индуцированное увеличение продукции мононуклеарами интерферона-γ, IL-2 и фактора некроза опухолей-α (TNF-α) ингибирует дифференцировку гемопоэтических клеток [1]. Секреция интерферона-γ является результатом повышения регуляции транскрипционного фактора T-bet и апоптоза CD34+ клеток, частично опосредованного FAS-зависимым путем [3].
В ранних лабораторных экспериментах удаление лимфоцитов из апластического костного мозга увеличивало число колоний клеток в культуре тканей, а их внедрение в нормальный костный мозг подавляло гематопоэз in vitro. Эффекторные клетки были идентифицированы при помощи иммунофенотипирования активированных цитотоксических CD8+ Т-клеток, экспрессирующих Th1-цитокины, в частности γ-интерферон. CD8 клетки могут определяться непосредственно в крови при помощи:
Также снижение количества регуляторных Т-клеток (CD4+, CD25+, FoxP3+) способствует увеличению аутореактивной популяции CD8+ CD28– Т-клеток, которая индуцирует апоптоз аутологичных гемопоэтических клеток. Т-регуляторные клетки являются компонентами иммунной системы, подавляющими иммунные реакции других клеток, а также играющими роль в предотвращении аутоиммунных реакций [2].
АА может возникать из-за метаболической или иммунологической предрасположенности (полиморфизма генов) у восприимчивых лиц. В случае фенилбутазон-ассоциированной аплазии костного мозга происходит замедление процессов окисления и клиренса соответствующего соединения, ацетанилида, по сравнению с нормальной контрольной группой, что предполагает избыточное накопление лекарственного средства как потенциального пускового механизма развития аплазии.
Для пациентов как с приобретенной, так и с наследственной апластической анемией (Фанкони, врожденный дискератоз) характерно наличие дефекта теломераз и восстановления теломер. Одной из характерных черт лейкоцитов при апластической анемии является укорочение теломер, причиной чему предполагали деплеции стволовых клеток. Однако анализ наследования в больших родословных продемонстрировал, что X-связанная форма врожденного дискератоза была вызвана мутациями в DKC1 (dyskeratosis congenita 1), идентификация мутаций в TERC (Telomerase RNA Component) у пациентов с аутосомно-доминантным наследованием помогла выявить генетическую основу укорочения теломер [3].
Центральную роль в восстановлении структуры РНК играет шаблон РНК, кодируемый TERC, при этом теломераза, представляющая собой обратную транскриптазу, кодируемую TERT (Telomerase Reverse Transcriptase), удлиняет нуклеотидную последовательность; другие белки, включая дискерин, кодируемый DKC1, связаны с восстановлением теломер. Систематические исследования ДНК выявили мутации TERC и TERT у некоторых пациентов с приобретенной апластической анемией. У членов семей, имеющих данную мутацию, несмотря на нормальные или почти нормальные показатели крови, выявили уменьшенное количество CD34-клеток, плохую скорость образования гемопоэтических колоний, повышенный уровень гемопоэтического фактора роста, гипоцеллюлярные участки в костном мозге, и, конечно, короткие теломеры. Клиническое проявление этих аномалий проявлялось позже, чем при типичном дискератозе, и не вызывало характерных физических отклонений. Некоторые из пациентов с синдромом Швахмана-Даймонда (Shwachman-Bodian-Diamond) также имеют мутации гена SBDS.
АА может сосуществовать или, по-видимому, эволюционировать вместе с другими гематологическими заболеваниями, характеризующимися пролиферацией специфических клонов клеток, такими как пароксизмальная ночная гемоглобинурия (ПНГ) или миелодиспластический синдром (МДС). Наличие небольшого количества клонов также создает проблемы при постановке диагноза апластической анемии даже при использовании таких высокочувствительных методов диагностики, как фенотипический (проточная цитометрия для ПНГ) или цитогенетический (флуоресцентная гибридизация in situ (FISH) для MDS) анализ [1, 2].
Более пятидесяти процентов пациентов с АА имеют клон ПНГ-клеток, которые обнаруживаются проточной цитометрией по отсутствию мембранных белков, связанных с якорным гликозилфосфатидилинозитолом. Мутация в гене PIG-A в стволовой клетке нарушает синтез гликозилфосфоинозитола (GPI) и, следовательно, вызывает отсутствие экспрессии GPI-связанных белков на поверхности эритроцитов потомства, лейкоцитов и тромбоцитов (CD14, CD16 и CD24 для лейкоцитов, CD55 и CD59 для эритроцитов). Большинство колоний клонов этих клеток небольшие и не приводят к клиническим проявлениям гемолиза или тромбоза, но при ПНГ может преобладать разрушение костного мозга («апластическая анемия/синдром ПНГ»). Было высказано предположение о том, что при ПНГ значительное уменьшение количества белков на клеточной поверхности позволяет «избежать» атаки и выжить существующему мутантному клону. Ассоциация клона ПНГ с HLA-DR29, по-видимому, также позволяет им избежать иммунной атаки и служит предиктором отсутствия реакции на иммуносупрессивную терапию. Тем не менее существует мало конкретных экспериментальных доказательств различия в дифференцировке типов иммунных реакций или восприимчивости клонов ПНГ по сравнению с фенотипически нормальными популяциями клеток-мишеней.
Конечным результатом иммуноопосредованного повреждения костного мозга является уменьшение образования клеток крови в костном мозге. Количество CD34+ клеток и их производных у пациентов с апластической анемией заметно снижено [2].
Клинически AA не сопровождается увеличением лимфатических узлов, печени или селезенки. Основным проявлением заболевания является панцитопения: для клинического анализа крови характерно уменьшение содержания всех форменных элементов. На ранних стадиях можно наблюдать изолированную цитопению, чаще тромбоцитопению. Может присутствовать моноцитопения, что требует дифференциального диагноза с волосатоклеточным лейкозом. АА сопровождается снижением ретикулоцитарного индекса, относительное число ретикулоцитов обычно меньше 1 % и может быть равно нулю, абсолютное число ретикулоцитов — менее 40 000 в мкл (40×10 9 /л), несмотря на высокие уровни эритропоэтина; анизоцитоз и пойкилоцитоз отсутствуют. Эти изменения в периферической крови сопровождаются гипоклеточностью костного мозга без аномальных или злокачественных клеток или фиброза. Необходимо тщательное исследование мазков крови для исключения наличия диспластических клеток. При АА может быть увеличено содержание фетального Hb: у детей это требует проведения дифференциального диагноза с миелопролиферативными миелодиспластическими синдромами, такими как ювенильный миеломоноцитарный лейкоз или другие подтипы МДС [3, 4].
Критерии диагностики АА:
АА подразделяется на:
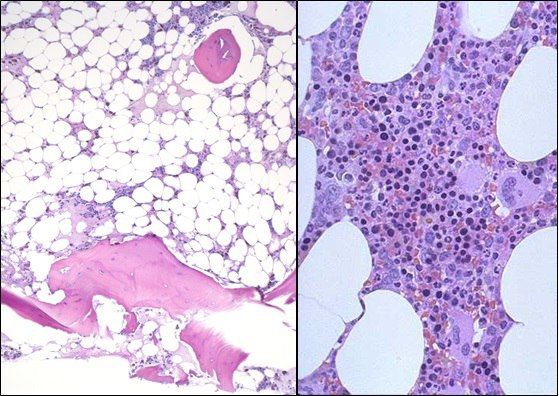
Основным методом диагностики является проведение трепанобиопсии. Аспират костного мозга при АА обычно содержит трабекулы с пустыми, заполненными жиром межтрабекулярными пространствами и малым количеством гемопоэтических клеток. Могут присутствовать единичные лимфоциты, плазматические клетки, макрофаги и тучные клетки [1].
Слева — апластическая анемия, справа — норма
При выполнении цитогенетического анализа могут возникнуть трудности из-за низкой клеточности материала: для получения достаточного количества клеток может потребоваться несколько аспираций. Обнаружение клональных цитогенетических аномалий при апластической анемии является признаком наличия миелоидного заболевания. Переход к более новым методам, таким как сравнительная геномная гибридизация (CGH), позволяет обнаруживать анеуплоидии, делеции, дублирование и/или амплификации любого локуса.
Лучшим доказательством ключевой роли иммуноопосредованного механизма в патофизиологии АА является положительный ответ на иммуносупрессивную терапию у больных с апластической анемией: большинство пациентов демонстрируют гематологическое улучшение после транзиторного разрушения Т-клеток антитимоцитарным глобулином (ATGs), в случае рецидива ответ на ATG также сохраняется. По мере усиления иммуносупрессивной терапии, начиная с ранних попыток лечения при помощи кортикостероидов до использования агрессивных препаратов, таких как циклофосфамид в высоких дозах, увеличилось число сообщений о благоприятных результатах лечения, и иммунный механизм стал рассматриваться как ведущий. Влияние различных генетических факторов, микроокружения и индивидуальных характеристик иммунного статуса больного, вероятно, объясняет вариабельность клинической картины и реакций на проводимое лечение [1].
Терапия проводится при помощи следующих препаратов и методов:
Также необходима поддерживающая терапия при помощи гемотрансфузии. Единого целевого значения концентрации гемоглобина не существует, и оно должно быть установлен индивидуально. Для снижения риска иммунизации следует учитывать фенотип Rh и Kell. Пациентам с АА, получающим активное лечение и находящимся в стабильном состоянии, следует назначать профилактические переливания тромбоцитов, пороговая концентрация тромбоцитов составляет 10×10 9 /л. У пациентов, имеющих факторы риска кровотечения, число тромбоцитов должно составлять 20×10 9 /л. Регулярные профилактические переливания тромбоцитов не рекомендуются для стабильных пациентов с АА, не находящихся на активном лечении в данный момент. У пациентов с апластической анемией при регулярной поддержке переливания РБК будет развиваться перегрузка тканевого железа. Сывороточный ферритин остается наиболее широко используемым показателем для оценки перегрузки железом. Магнитно-резонансная томография может определять содержание железа количественно и является хорошим дополнением к лабораторным методам мониторинга [4].
Апластическая анемия
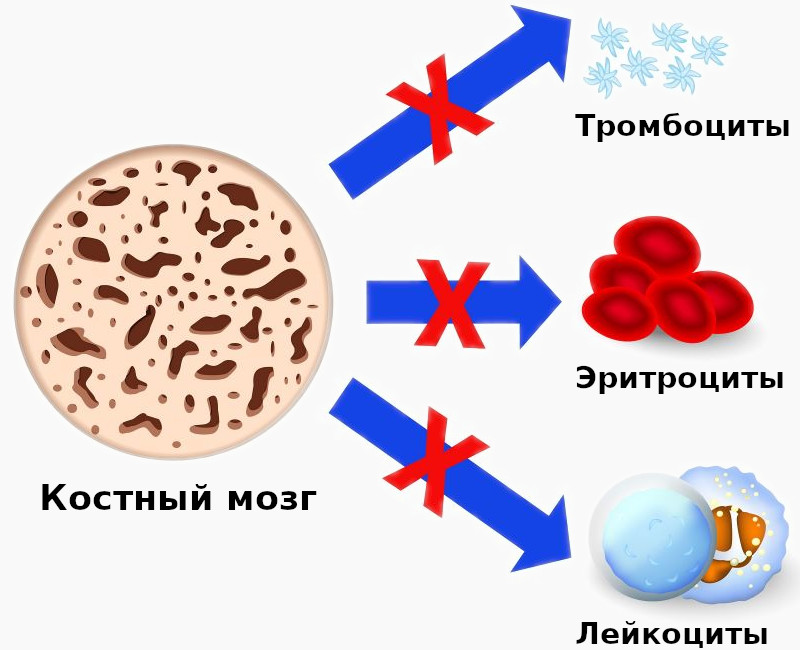
Апластическая анемия – серьёзное нарушение формирования, развития и созревания клеток крови. Оно характеризуется угнетением кроветворной функции костного мозга, что проявляется дефицитом образования белых и красных кровяных клеток, а также тромбоцитов. Иногда наблюдается недостаток формирования только эритроцитов. Заболевание считается одним из самых тяжёлых расстройств гемопоэза и при отсутствии адекватного лечения может стать причиной летального исхода в течение нескольких месяцев. Оно в одинаковой степени поражает пациентов мужского и женского пола в возрасте от десяти до двадцати пяти лет или старше пятидесяти. Согласно медицинской статистике каждый год диагностируют два случая патологии на один миллион человек.
Пройти диагностику и лечение апластической анемии в Москве предлагает отделение гематологии ЦЭЛТ. Наша многопрофильная клиника одна из первых в РФ начала деятельность на рынке платных медицинских услуг и успешно продолжает её уже третье десятилетие. В отделении гематологии ведут приём ведущие отечественные специалисты, в арсенале которых имеется современная лечебно-диагностическая база, позволяющая точно ставить диагноз и проводить лечение в соответствии с международными стандартами. Стоимость услуг доступна в нашем прайс-листе, который мы регулярно обновляем. Во избежание недоразумений просим Вас уточнять цифры у операторов нашей информационной линии: +7 (495) 788 33 88.
Апластичная анемия: этиология
Согласно происхождению, выделяют врождённую и приобретённую анемию. Первая развивается вследствие хромосомных мутаций, вторая – под воздействием химических веществ, излучения, инфекций. Специалисты считают, что угнетение кроветворения костного мозга может быть инициировано появлением в нём и в крови цитотоксических Т-лимфоцитов. Они производят ФНО (внеклеточный белок) и интерферон “y”, которые подавляюще воздействуют на ростки кроветворения. Причина запуска механизма может крыться в:
В 50% случаев причину развития патологии установить не удаётся. Такая форма апластической анемии называется идиопатической.
Классификация апластической анемии
| Форма патологии | Чем отличается? |
| По продолжительности течения | |
| Острая | Не более одного месяца |
| Подострая | От одного месяца до полугода |
| Хроническая | Более полугода |
| По степени тяжести при избирательной аплазии | |
| Умеренная | Гранулоцитов менее 0,0х10 9 /л, тромбоцитов менее 20,0х10 9 /л. |
| Тяжёлая | Гранулоцитов менее 0,5х10 9 /л, тромбоцитов менее 20,0х10 9 /л. согласно результатам диагностики клеточность костного мозга составляет менее трети от нормы. |
| Очень тяжёлая | Гранулоцитов более 0,5х10 9 /л, тромбоцитов более 20,0х10 9 /л. |
Апластическая анемия: симптомы
Заболевание начинается остро, оно сопровождается ощущением сильной слабости и быстрой утомляемостью. Кожные покровы больного и видимые слизистые оболочки выглядят бледными, а сам он страдает от следующих клинических проявлений:
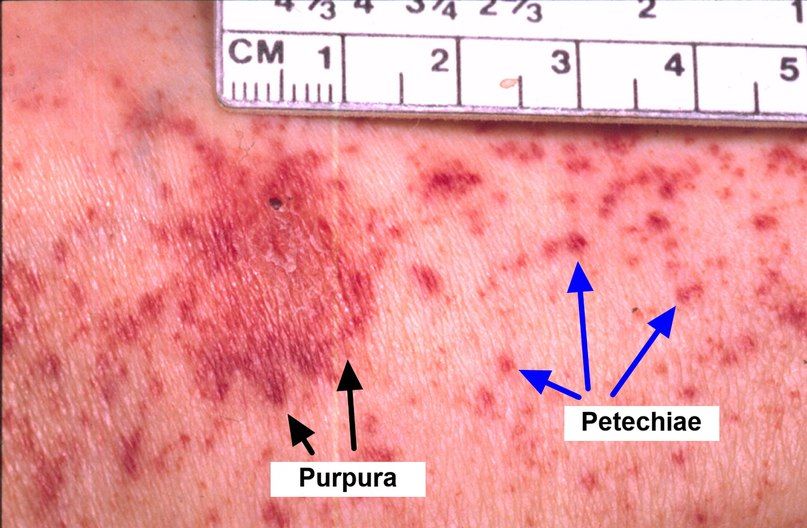
При снижении количества тромбоцитов в единице объёма крови проявляется геморрагический синдром:
Снижение количества лейкоцитов в единице объёма крови характеризуется регулярным частым развитием инфекционных заболеваний кожи и структур мочевыводящей системы, воспалительными процессами слизистой оболочки рта, воспалениями лёгких.
Врождённая форма анемии развивается у детей до десяти лет и сопровождается целым рядом других нарушений:
Апластическая анемия: осложнения
Отсутствие лечения апластической анемии может привести к летальному исходу из-за развития таких осложнений, как:
Апластическая анемия: диагностика
Перед тем, как приступить к лечению заболевания, гематологи ЦЭЛТ проводят комплексную диагностику, направленную на точную постановку диагноза и выявление этиологического фактора. Она включает в себя:
При наличии заболевания у пациента выявляют серьёзное снижение гемоглобина, вплоть до критического уровня – 20-30 г/л, наблюдается агранулоцитоз – снижение зернистых лейкоцитов и моноцитов. Количество лимфоцитов может быть в норме или сниженным, тромбоцитов – всегда снижено, иногда их не обнаруживают вовсе. Скорость оседания эритроцитов – повышается до 4-60 мм/ч. Исследование образца костного мозга выявляет повышенное содержание жировой ткани – 90%, включающее в себя элементы стромы и лимфы, а вот гематогенные клетки имеются в очень малом количестве.
Лечение апластической анемии
Лечение идиопатической и других видов апластической анемии – очень сложная задача, требующая комплексного индивидуального подхода. При разработке тактики специалисты ЦЭЛТ учитывают результаты диагностики и показания пациента. Больного помещают в изолятор с асептическими условиями, что позволяет исключить риск развития инфекций и их осложнений. Медикаментозная терапия заключается в приёме:
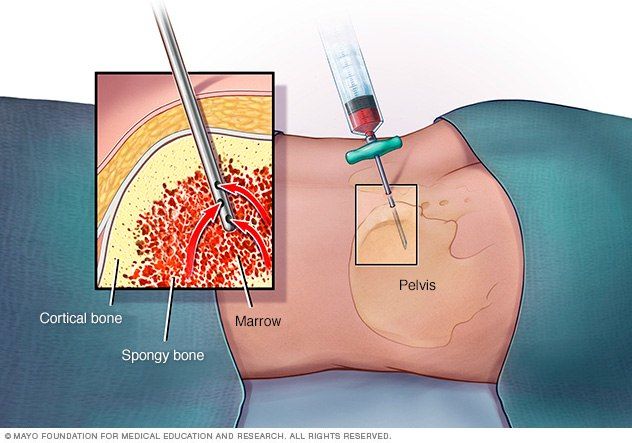
Всем больным апластической анемией проводят переливание эритроцитарной и/или тромбоцитарной массы, в объёмах, определяемых исходя из клинической картины и показателей периферической крови. Кроме того, пациенту могут назначить спленэктомию – хирургическое вмешательство, направленное на удаление селезёнки. Самые благоприятные прогнозы может обеспечить трансплантация костного мозга. Она заключается в пересадке донорских или собственных стволовых кроветворных клеток, предварительно изъятых из подвздошных костей путём пункции. К сожалению, процедура недоступна для широкого применения из-за сложности подбора совместимого донора. В том случае, если это невозможно, пациенту назначают паллиативную терапию с применение циклоспорина А.
В отделении гематологии нашей клиники ведут приём кандидаты, доктора и профессоры медицинских наук с опытом практической и научной работы от двадцати пяти лет. Вы можете записаться к ним на приём онлайн или обратившись к нашим операторам. Специалисты высокой квалификации работают и в отделении урологии. К ним можно записаться на цистоскопию мочевого пузыря.
Записавшись на прием гематолога, вы сможете получить всестороннюю консультацию. В компетенции врача находится лечение различных заболеваний крови, большинство из которых можно выявить на ранних стадиях и назначить своевременное лечение, позволяющее справиться с болезнью быстро и легко.
Публикации в СМИ
Анемии апластические
Апластические анемии — группа патологических состояний, характеризующихся панцитопенией в периферической крови вследствие угнетения кроветворной функции костного мозга.
Классификация • Врождённые (анемия Фанкони, Дайемонда–Блекфэна) • Приобретённые (результат воздействия химических, лекарственных, инфекционных агентов и ионизирующего излучения) • Идиопатические (причина заболевания неясна).
Этиология • Приобретённые анемии •• Инфекции (вирусные гепатиты, инфекционный мононуклеоз, ЦМВ, парвовирусная, грипп) •• Лимфопролиферативные нарушения (тимома, лимфома, хронический лимфобластный лейкоз) •• Ионизирующее излучение •• Токсины и химические вещества (бензол, инсектициды, соединения свинца и пр.) •• ЛС, например цитостатики, препараты золота, НПВС, противосудорожные препараты, антибиотики • Врождённые анемии (анемия Фанкони). Существует 4 группы комплементации, т.е. не менее 4 генов, мутация любого из которых ведёт к развитию апластической панцитопении 4 типов (все r ) •• Группа А (тип 1 анемии Фанкони, *227650, 20q13.2–q13.3, дефекты генов FA1, FA, F, r ) •• Группа В (тип 2, *227660, дефект гена FA2, r ) •• Группа С (тип 3, *227645, 9q22.3, дефект гена FACC, r ) •• Группа D (тип 4, *227646, дефект гена FA4, r ).
Патогенез апластических анемий • Внутренний дефект гемопоэтических стволовых клеток • Иммунная реакция на гемопоэтическую ткань • Нарушение поддерживающей функции стромального окружения в костном мозге
Клиническая картина
• Характерные черты апластических анемий •• Общие признаки (одышка, бледность кожных покровов и слизистых оболочек, тахикардия, слабость, систолический шум на верхушке сердца, снижение массы тела) •• Частое присоединение инфекционно-воспалительных и гнойно-некротических процессов различной локализации вследствие лейкопении (нейтропении) •• Геморрагический синдром: крупные и мелкие кровоизлияния (в т.ч. в сетчатку глаза), кровотечения различной локализации (меноррагия, мелена, носовые кровотечения), обусловленные тромбоцитопенией. Особенности у детей • Преобладающий возраст — 14–16 лет • Анемии обычно предшествует перенесённое инфекционное заболевание (ветряная оспа, краснуха, вирусные гепатиты) • Заболевание развивается очень быстро • В 70% случаев при лечении циклоспорином удаётся достичь полной клинико-гематологической ремиссии.
• Анемия Фанкони. Существует 2 типа •• Классический (тип I) ••• Низкий рост ••• Микроцефалия ••• Деформации скелета (отсутствие или гипоплазия первой пястной или лучевой кости) ••• Аномалии почек и сердца ••• Гипоспадия ••• Гиперпигментация кожи ••• Глухота •• Тип 2 характеризуется наличием малых аномалий развития.
• Врождённая апластическая анемия (синдром Дайемонда–Блекфэна) — аллельный вариант анемии Фанкони (*205900, r ). От анемии Фанкони её отличают раннее появление анемии (как правило, в первые месяцы жизни), отсутствие нейтропении и тромбоцитопении.
По тяжести различают нетяжёлую (гранулоциты меньше 1,5 ´ 10 9 /л, тромбоциты 100 ´ 10 9 /л, мегакариоциты меньше 80 ´ 10 9 /л) и тяжёлую (в периферической крови гранулоциты менее 0,5 ´ 10 9 /л, тромбоциты менее 20 ´ 10 9 /л; в костной ткани преобладание фиброзной ткани более чем на 60%) формы.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
• Приобретённая анемия •• Панцитопения •• Нормохромные эритроциты •• Удлинённое время кровотечения •• Выраженное снижение содержания ретикулоцитов (арегенераторная анемия) •• Повышение концентрации железа в сыворотке крови (вследствие гемотрансфузий) •• Нормальные показатели общей железосвязывающей способности сыворотки (ОЖСС) •• Концентрация эритропоэтина сыворотки обычно увеличена пропорционально степени анемии •• Нарушение показателей функций печени.
• Анемия Фанкони •• Макроцитоз (в отличие от приобретённой апластической анемии) •• Повышение содержания HbF •• Отсутствие выраженной панцитопении до 3–8-летнего возраста •• Характерны ломкость хромосом, дефекты репарации, повышенная чувствительность хромосом к диэпоксибутану, митомицину и УФО.
• Анемия Дайемонда–Блекфэна: макроцитоз, ретикулоцитопения, повышенное содержание HbF.
Пункция костного мозга • Увеличенные запасы железа • Уменьшено количество клеток •• Уменьшение количества мегакариоцитов •• Уменьшение количества миелоцитов •• Уменьшение количества эритроидных предшественников •• Замещение нормальной кроветворной ткани на жировую и фиброзную • Анемия Фанкони — при пункции костного мозга часто не обнаруживают изменений.
Инструментальные исследования • КТ области тимуса при подозрении на тимому • Рентгенологическое исследование костей предплечья (возможно обнаружение аномалий развития лучевой кости) и больших пальцев кистей (конституциональная анемия) • УЗИ почек.
Дифференциальная диагностика • Транзиторная эритробластопения у детей • Миелодиспластический синдром • Пароксизмальная ночная гемоглобинурия • Острый лейкоз • Волосатоклеточный лейкоз • СКВ • Диссеминированная инфекция • Гиперспленизм • Анемии при гипотиреозе, гипопитуитаризме и заболеваниях печени.
ЛЕЧЕНИЕ
Тактика ведения • Стационарное лечение в гематологическом отделении. При нейтропении показана изоляция для предупреждения возможного инфицирования • Исключение причинных факторов • Исследование Аг системы HLA больных и членов их семей.
Трансплантация костного мозга пациентам с выраженной апластической анемией, особенно в возрасте до 30 лет — метод выбора (при наличии HLA-идентичного донора) • Трансплантация от неродственных доноров в случае неэффективности проводимого лечения.
Консервативное лечение
• Проводят при отсутствии донора для трансплантации костного мозга •• Глобулин антитимоцитарный. Для выявления повышенной чувствительности сначала необходимо проведение кожной пробы ••• Препарат выбора для лечения пациентов пожилого возраста или при отсутствии донора для трансплантации костного мозга ••• Курсовая доза 160 мг/кг, разделённая на 4 дозы, в течение первых 4 дней лечения ••• Необходимую дозу препарата растворяют в 500 мл 0,9% р-ра натрия хлорида и вводят в/в капельно в течение 4–6 ч ••• Развитие анафилактической реакции — абсолютное противопоказание к дальнейшему введению препарата •• Циклоспорин ••• Начальная доза — 5 мг/кг/сут внутрь или 3 мг/кг в/в. Далее дозы подбирают, исходя из концентрации циклоспорина в крови, определяемой ежедневно ••• При отсутствии эффекта в течение 120 дней препарат отменяют •• Метилпреднизолон — по 2 мг/кг/сут в/в с 1 по 14 день лечения, по 1 мг/кг — с 15 по 21 день •• Гранулоцитарный колониестимулирующий фактор (например, молграмостим) — при неэффективности тимоглобулина или циклоспорина ••• Начальная доза — 5 мкг/кг/сут п/к до увеличения количества гранулоцитов более 1 000/мкл ••• При отсутствии эффекта в течение 14 дней дозу удваивают •• Андрогены эффективны при некоторых вариантах анемии Фанкони, приобретённой апластической анемии, хотя случаи успешного лечения крайне редки. При отсутствии эффекта в течение 4–6 мес препарат отменяют постепенно.
• Поддерживающая терапия •• Оксигенотерапия •• Санация полости рта и других слизистых оболочек •• Переливание отмытых эритроцитов через лейкоцитарные фильтры; тромбоцитарной массы •• Антибактериальная терапия •• Гемостатики
• Осложнения терапии • Геморрагический синдром • Инфекционные осложнения • Гемосидероз при переливании крови • Сердечная недостаточность • Почечная недостаточность • Токсический гепатит • Анафилактический шок и сывороточная болезнь (при использовании антитимоцитарного глобулина) • Развитие острого лейкоза.
Оперативное лечение • Тимэктомия при тимоме.
Исходы лечения • Полная клинико-гематологическая ремиссия: концентрация Hb выше 110 г/л, тромбоцитов более 100 ´ 10 9 /л, гранулоцитов более 1,5 ´ 10 9 /л • Частичная клинико-гематологическая ремиссия: концентрация Hb 90–110 г/л, тромбоцитов 30–100 ´ 10 9 /л, гранулоцитов 0,5–1,5 ´ 10 9 /л • Минимальный гематологический ответ: уровень Hb 80–90 г/л, тромбоцитов более 10–30 ´ 10 9 /л (без проведения трансфузий).
Течение и прогноз • Приобретённая анемия. Течение и прогноз прямо пропорциональны возрасту больного. При отсутствии своевременной и адекватной терапии 80% пациентов погибают в течение 3 мес от манифестации заболевания. С внедрением в клиническую практику циклоспорина шансы на продление жизни больного увеличились. При предполагаемой трансплантации костного мозга во избежание сенсибилизации в предоперационный период желательно избегать переливаний препаратов крови (в особенности от родственников) • Анемия Фанкони. Выживаемость не превышает 4 лет при изолированной заместительной терапии. Прогноз значительно благоприятнее при эффективности андрогенов или трансплантации костного мозга.
Синонимы: Для анемии Фанкони — синдром Фанкони.
МКБ-10 • D60 Приобретённая чистая красноклеточная аплазия [эритробластопения] • D61 Другие апластические анемии
Примечания • Аплазия костного мозга — врождённое или приобретённое тяжёлое состояние, проявляющееся панцитопенией. Врождённая форма сочетается с фенотипическими и цитогенетическими аномалиями, что облегчает диагностику • Панцитопения — снижение количества эритроцитов, лейкоцитов и тромбоцитов. Характерны бледность и сонливость, инфекции, обусловленные нейтропенией; геморрагический диатез вследствие тромбоцитопении. Для дифференциальной диагностики необходимо исследование костного мозга (аплазия [чаще гипоплазия] костного мозга, вытеснение ростков костного мозга бластными клетками, аутоиммунное разрушение клеток крови — синдром Эванса) • Конституциональными называют врождённые и иногда идиопатические типы анемий.