аплазия костного мозга это что такое
Аплазия костного мозга это что такое
К концу первых суток после облучения число кроветворных клеток резко уменьшается. При этом обращает на себя внимание сокращения клеток красного ростка. В пунктатах костного мозга обнаруживаются только полихроматофильные и оксифильные нормобласты и отсутствуют проэритробласты, базофильные формы и делящиеся клетки [Cangdon С С, Fliedner Т. М, 1974; Harris E. В., 1974]. Числа миелокариоцитов уменьшается почти вдвое, резко снижается число незрелых клеток нейтрофильного ряда (до 25%) и лимфоцитов (до 60%).
В то же время ретикулярные клетки и другие гистиоцитарные элементы содержатся в большем количестве, чем обычно. Одновременно с распадом кроветворных клеток в костном мозге выявляются макрофаги с признаками фагоцитоза клеточного детрита.
Основной причиной аплазии кроветворной ткани при острой лучевой болезни является гибель полипотентных стволовых клеток вследствие прямого действия ионизирующей радиации. Гибель клеток крови ранних генераций происходит в интерфазе вследствие некробиоза и патологического их деления. При облучении в дозе 100 рад гибнет уже около 63% стволовых клеток, а при облучении в дозе 1000 рад число их уменьшается в 1000 раз [Груздев Г. П., 1970].
В литературе появилось достаточное количество сведений о хромосомных аберрациях клеток костного мозга у людей, случайно подвергшихся внешнему облучению в массивных дозах. Установлено, что наибольшее, число аберраций наблюдается через 22—48 ч после облучения, когда преобладают аберрации хромосомного типа. Количество аберрантных клеток увеличивается в соответствии с увеличением дозы облучения [Пятки» Е. К., Дворецкий Л. И., 1968].
На этом основании предложены критерии биологической дозиметрии [Воробьев А. В. и др, 1973, 1975].
Через 3 сут очаги кроветворения выявляются только в виде отдельных островков, состоящие из немногочисленных зрелых форм гранулоцитов с гиперсегментированными, пикнотичными или распадающимися ядрами, немногих клеток красного ряда и единичных распадающихся мегакариоцитов и большого числа плазматических клеток. В дальнейшем количество миелоидной ткани уменьшается еще больше. На высоте заболевания костный мозг представляет собой отечную жировую ткань, в строме которой видны отдельные клетки или небольшие островки клеточных элементов.
Незначительные участки костномозговой ткани сохраняются вблизи костных балок. Основную массу клеток в этот период составляют плазматические клетки, недифференцированные ретикулярные элементы и отдельные гемоцитобласты. Появляются гигантские уродливой формы нейтрофильные лейкоциты с увеличенным содержанием ДНК в крупных, гиперсегментированных ядрах. По наблюдениям Д.И.Гольдберг с соавт. (1974), после облучения в массивных дозах популяция радиорезистентных ретикулярных клеток может превращаться в гигантские гемогистиобласты, способные дифференцироваться в клетки миелоидного ряда. Это подтверждается наличием в некоторых из таких клеток пероксидазы и фосфолипндов, свойственных, как известно, миелоидным клеткам. Вместе с тем такие гигантские нейтрофилы характеризуются низкой активностью щелочной фосфатазы й пероксидазы, небольшим содержанием гликогена, что свидетельствует о неспособности их обеспечивать свои специфические функции.
Публикации в СМИ
Анемии апластические
Апластические анемии — группа патологических состояний, характеризующихся панцитопенией в периферической крови вследствие угнетения кроветворной функции костного мозга.
Классификация • Врождённые (анемия Фанкони, Дайемонда–Блекфэна) • Приобретённые (результат воздействия химических, лекарственных, инфекционных агентов и ионизирующего излучения) • Идиопатические (причина заболевания неясна).
Этиология • Приобретённые анемии •• Инфекции (вирусные гепатиты, инфекционный мононуклеоз, ЦМВ, парвовирусная, грипп) •• Лимфопролиферативные нарушения (тимома, лимфома, хронический лимфобластный лейкоз) •• Ионизирующее излучение •• Токсины и химические вещества (бензол, инсектициды, соединения свинца и пр.) •• ЛС, например цитостатики, препараты золота, НПВС, противосудорожные препараты, антибиотики • Врождённые анемии (анемия Фанкони). Существует 4 группы комплементации, т.е. не менее 4 генов, мутация любого из которых ведёт к развитию апластической панцитопении 4 типов (все r ) •• Группа А (тип 1 анемии Фанкони, *227650, 20q13.2–q13.3, дефекты генов FA1, FA, F, r ) •• Группа В (тип 2, *227660, дефект гена FA2, r ) •• Группа С (тип 3, *227645, 9q22.3, дефект гена FACC, r ) •• Группа D (тип 4, *227646, дефект гена FA4, r ).
Патогенез апластических анемий • Внутренний дефект гемопоэтических стволовых клеток • Иммунная реакция на гемопоэтическую ткань • Нарушение поддерживающей функции стромального окружения в костном мозге
Клиническая картина
• Характерные черты апластических анемий •• Общие признаки (одышка, бледность кожных покровов и слизистых оболочек, тахикардия, слабость, систолический шум на верхушке сердца, снижение массы тела) •• Частое присоединение инфекционно-воспалительных и гнойно-некротических процессов различной локализации вследствие лейкопении (нейтропении) •• Геморрагический синдром: крупные и мелкие кровоизлияния (в т.ч. в сетчатку глаза), кровотечения различной локализации (меноррагия, мелена, носовые кровотечения), обусловленные тромбоцитопенией. Особенности у детей • Преобладающий возраст — 14–16 лет • Анемии обычно предшествует перенесённое инфекционное заболевание (ветряная оспа, краснуха, вирусные гепатиты) • Заболевание развивается очень быстро • В 70% случаев при лечении циклоспорином удаётся достичь полной клинико-гематологической ремиссии.
• Анемия Фанкони. Существует 2 типа •• Классический (тип I) ••• Низкий рост ••• Микроцефалия ••• Деформации скелета (отсутствие или гипоплазия первой пястной или лучевой кости) ••• Аномалии почек и сердца ••• Гипоспадия ••• Гиперпигментация кожи ••• Глухота •• Тип 2 характеризуется наличием малых аномалий развития.
• Врождённая апластическая анемия (синдром Дайемонда–Блекфэна) — аллельный вариант анемии Фанкони (*205900, r ). От анемии Фанкони её отличают раннее появление анемии (как правило, в первые месяцы жизни), отсутствие нейтропении и тромбоцитопении.
По тяжести различают нетяжёлую (гранулоциты меньше 1,5 ´ 10 9 /л, тромбоциты 100 ´ 10 9 /л, мегакариоциты меньше 80 ´ 10 9 /л) и тяжёлую (в периферической крови гранулоциты менее 0,5 ´ 10 9 /л, тромбоциты менее 20 ´ 10 9 /л; в костной ткани преобладание фиброзной ткани более чем на 60%) формы.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
• Приобретённая анемия •• Панцитопения •• Нормохромные эритроциты •• Удлинённое время кровотечения •• Выраженное снижение содержания ретикулоцитов (арегенераторная анемия) •• Повышение концентрации железа в сыворотке крови (вследствие гемотрансфузий) •• Нормальные показатели общей железосвязывающей способности сыворотки (ОЖСС) •• Концентрация эритропоэтина сыворотки обычно увеличена пропорционально степени анемии •• Нарушение показателей функций печени.
• Анемия Фанкони •• Макроцитоз (в отличие от приобретённой апластической анемии) •• Повышение содержания HbF •• Отсутствие выраженной панцитопении до 3–8-летнего возраста •• Характерны ломкость хромосом, дефекты репарации, повышенная чувствительность хромосом к диэпоксибутану, митомицину и УФО.
• Анемия Дайемонда–Блекфэна: макроцитоз, ретикулоцитопения, повышенное содержание HbF.
Пункция костного мозга • Увеличенные запасы железа • Уменьшено количество клеток •• Уменьшение количества мегакариоцитов •• Уменьшение количества миелоцитов •• Уменьшение количества эритроидных предшественников •• Замещение нормальной кроветворной ткани на жировую и фиброзную • Анемия Фанкони — при пункции костного мозга часто не обнаруживают изменений.
Инструментальные исследования • КТ области тимуса при подозрении на тимому • Рентгенологическое исследование костей предплечья (возможно обнаружение аномалий развития лучевой кости) и больших пальцев кистей (конституциональная анемия) • УЗИ почек.
Дифференциальная диагностика • Транзиторная эритробластопения у детей • Миелодиспластический синдром • Пароксизмальная ночная гемоглобинурия • Острый лейкоз • Волосатоклеточный лейкоз • СКВ • Диссеминированная инфекция • Гиперспленизм • Анемии при гипотиреозе, гипопитуитаризме и заболеваниях печени.
ЛЕЧЕНИЕ
Тактика ведения • Стационарное лечение в гематологическом отделении. При нейтропении показана изоляция для предупреждения возможного инфицирования • Исключение причинных факторов • Исследование Аг системы HLA больных и членов их семей.
Трансплантация костного мозга пациентам с выраженной апластической анемией, особенно в возрасте до 30 лет — метод выбора (при наличии HLA-идентичного донора) • Трансплантация от неродственных доноров в случае неэффективности проводимого лечения.
Консервативное лечение
• Проводят при отсутствии донора для трансплантации костного мозга •• Глобулин антитимоцитарный. Для выявления повышенной чувствительности сначала необходимо проведение кожной пробы ••• Препарат выбора для лечения пациентов пожилого возраста или при отсутствии донора для трансплантации костного мозга ••• Курсовая доза 160 мг/кг, разделённая на 4 дозы, в течение первых 4 дней лечения ••• Необходимую дозу препарата растворяют в 500 мл 0,9% р-ра натрия хлорида и вводят в/в капельно в течение 4–6 ч ••• Развитие анафилактической реакции — абсолютное противопоказание к дальнейшему введению препарата •• Циклоспорин ••• Начальная доза — 5 мг/кг/сут внутрь или 3 мг/кг в/в. Далее дозы подбирают, исходя из концентрации циклоспорина в крови, определяемой ежедневно ••• При отсутствии эффекта в течение 120 дней препарат отменяют •• Метилпреднизолон — по 2 мг/кг/сут в/в с 1 по 14 день лечения, по 1 мг/кг — с 15 по 21 день •• Гранулоцитарный колониестимулирующий фактор (например, молграмостим) — при неэффективности тимоглобулина или циклоспорина ••• Начальная доза — 5 мкг/кг/сут п/к до увеличения количества гранулоцитов более 1 000/мкл ••• При отсутствии эффекта в течение 14 дней дозу удваивают •• Андрогены эффективны при некоторых вариантах анемии Фанкони, приобретённой апластической анемии, хотя случаи успешного лечения крайне редки. При отсутствии эффекта в течение 4–6 мес препарат отменяют постепенно.
• Поддерживающая терапия •• Оксигенотерапия •• Санация полости рта и других слизистых оболочек •• Переливание отмытых эритроцитов через лейкоцитарные фильтры; тромбоцитарной массы •• Антибактериальная терапия •• Гемостатики
• Осложнения терапии • Геморрагический синдром • Инфекционные осложнения • Гемосидероз при переливании крови • Сердечная недостаточность • Почечная недостаточность • Токсический гепатит • Анафилактический шок и сывороточная болезнь (при использовании антитимоцитарного глобулина) • Развитие острого лейкоза.
Оперативное лечение • Тимэктомия при тимоме.
Исходы лечения • Полная клинико-гематологическая ремиссия: концентрация Hb выше 110 г/л, тромбоцитов более 100 ´ 10 9 /л, гранулоцитов более 1,5 ´ 10 9 /л • Частичная клинико-гематологическая ремиссия: концентрация Hb 90–110 г/л, тромбоцитов 30–100 ´ 10 9 /л, гранулоцитов 0,5–1,5 ´ 10 9 /л • Минимальный гематологический ответ: уровень Hb 80–90 г/л, тромбоцитов более 10–30 ´ 10 9 /л (без проведения трансфузий).
Течение и прогноз • Приобретённая анемия. Течение и прогноз прямо пропорциональны возрасту больного. При отсутствии своевременной и адекватной терапии 80% пациентов погибают в течение 3 мес от манифестации заболевания. С внедрением в клиническую практику циклоспорина шансы на продление жизни больного увеличились. При предполагаемой трансплантации костного мозга во избежание сенсибилизации в предоперационный период желательно избегать переливаний препаратов крови (в особенности от родственников) • Анемия Фанкони. Выживаемость не превышает 4 лет при изолированной заместительной терапии. Прогноз значительно благоприятнее при эффективности андрогенов или трансплантации костного мозга.
Синонимы: Для анемии Фанкони — синдром Фанкони.
МКБ-10 • D60 Приобретённая чистая красноклеточная аплазия [эритробластопения] • D61 Другие апластические анемии
Примечания • Аплазия костного мозга — врождённое или приобретённое тяжёлое состояние, проявляющееся панцитопенией. Врождённая форма сочетается с фенотипическими и цитогенетическими аномалиями, что облегчает диагностику • Панцитопения — снижение количества эритроцитов, лейкоцитов и тромбоцитов. Характерны бледность и сонливость, инфекции, обусловленные нейтропенией; геморрагический диатез вследствие тромбоцитопении. Для дифференциальной диагностики необходимо исследование костного мозга (аплазия [чаще гипоплазия] костного мозга, вытеснение ростков костного мозга бластными клетками, аутоиммунное разрушение клеток крови — синдром Эванса) • Конституциональными называют врождённые и иногда идиопатические типы анемий.
Апластическая анемия ( Гипопластическая анемия )
Апластическая анемия – угнетение функции кроветворения красного костного мозга (эритроцитопоэза, лейкопоэза и тромбоцитопоэза), приводящее к пангемоцитопении. К основным клиническим проявлениям гематологического синдрома принадлежат головокружение, слабость, обмороки, одышка, покалывание в груди, кожные геморрагии, кровотечения, склонность к развитию инфекционно-воспалительных и гнойных процессов. Заболевание диагностируется на основании характерных изменений гемограммы, миелограммы и гистологического исследования трепанобиоптата. Лечение патологии включает проведение гемотрансфузий, иммуносупрессивной терапии, миелотрансплантации.
МКБ-10
Общие сведения
Причины
По происхождению апластическая анемия может быть врожденной (связанной с хромосомными аберрациями) и приобретенной (развившейся в течение жизни). Принято считать, что угнетение миелопоэза связано с появлением в красном костном мозге и крови цитотоксических T-лимфоцитов, производящих фактор некроза опухолей и γ-интерферон, которые в свою очередь подавляют ростки кроветворения. Запускать этот механизм могут различные внешнесредовые (химические соединения, физические явления, лекарственные вещества), а также эндогенные факторы (вирусы, аутоиммунные реакции). К числу наиболее значимых причин относят:
Патогенез
В основе апластической анемии может лежать либо первичное повреждение гемопоэтических стволовых клеток, либо нарушение их эффективной дифференцировки. При наследственных анемиях недостаточность гемопоэза опосредована кариотипическими аберрациями, приводящими к нарушению репарации ДНК и невозможности репликации стволовых клеток костного мозга. В случае приобретенной анемии под влиянием этиофакторов наблюдается активация Т-клеток, которые начинают продуцировать цитокины (интерферон-гамма, ФНО), поражающие клетки-предшественники гемопоэза. В стволовых клетках костного мозга повышается экспрессия генов, отвечающих за апоптоз и активизацию клеточной гибели. Основные клинические проявления обусловлены пангемоцитопенией – снижением в составе крови всех ее форменных элементов (эритроцитов, лейкоцитов, тромбоцитов).
Классификация
Кроме различных этиологических вариантов (лекарственного, постгепатитного, идиопатического), различают острую (до 1 мес. течения), подострую (от 1 до 6 мес.) и хроническую (более 6 мес.) форму заболевания. Анемию, протекающую с избирательным угнетением эритропоэза, называют парциальной красноклеточной аплазией. На основании выраженности тромбо- и гранулоцитопении данная форма анемии подразделяется на 3 степени тяжести:
Симптомы апластической анемии
Поражение трех гемопоэтических ростков (эритро-, тромбоцито- и лейкопоэза) обусловливает развитие анемического и геморрагического синдромов, инфекционных осложнений. Дебют апластической анемии обычно происходит остро. Анемический синдром сопровождается общей слабостью и утомляемостью, бледностью кожи и видимых слизистых, шумом в ушах, головокружением, покалыванием в груди, одышкой при нагрузке.
Основным проявлением тромбоцитопении выступает геморрагический синдром. Больные отмечают появление петехий и экхимозов на коже, повышенную кровоточивость десен, спонтанные носовые кровотечения, меноррагии. Возможно возникновение гематурии, маточных и желудочно-кишечных кровотечений. Следствием лейкопении и агранулоцитоза служит частое развитие инфекционных процессов – стоматитов, пневмоний, инфекций кожи и мочевыводящих путей. Для апластической анемий нехарактерны похудание, лимфаденопатия, гепато- и спленомегалия – при этих признаках следует искать другую причину пангемоцитопении.
Врожденная апластическая анемия (синдром Фанкони) обычно развивается у детей в возрасте до 10 лет и кроме аплазии костного мозга характеризуется другими нарушениями: микроцефалией, гипоплазией почек, низкорослостью, аномалиями развития верхних конечностей (гипоплазией первой пястной и лучевой кости), гипоспадией, гиперпигментацией кожи, крайней степенью тугоухости и др. При наследственной анемии Эстрена-Дамешека отмечается тотальное поражение кроветворения и панцитопения при отсутствии врожденных аномалий развития. Для анемии Даймонда-Блекфена или парциальной красноклеточной аплазии характерно только снижение количества эритроцитов.
Осложнения
Летальный исход может быть обусловлен кровоизлияниями во внутренние органы, массивными кровотечениями, инфекционными осложнениями, анемической комой. Наиболее грозное из геморрагических осложнений – кровоизлияние в головной мозг (геморрагический инсульт). Больные склонны к частым и тяжело протекающим вирусным и бактериальным инфекциям респираторного тракта. Значительное или стремительное снижение уровня красных кровяных телец может привести к анемической коме. При молниеносной форме крайне быстро развиваются тяжелейшая анемия, иммунодефицит, коагулопатии, имеющие фатальные последствия.
Диагностика
Оценка гематологического статуса включает внимательный клинический осмотр и проведение тщательной лабораторной диагностики. При физикальном обследовании выявляется выраженная бледность или желтушность кожи, артериальная гипотония, тахикардия. Основу диагностического алгоритма составляет проведение общего и биохимического анализа крови, стернальной пункции, трепанобиопсии:
В рамках диагностического поиска апластическую анемию необходимо дифференцировать с мегабластными (В12-дефицитными, фолиеводефицитными) анемиями, идиопатической тромбоцитопенической пурпурой, пароксизмальной ночной гемоглобинурией, острым лейкозом.
Лечение апластической анемии
Больные с апластической анемией госпитализируются в специализированные отделения. Им обеспечиваются полная изоляция и асептические условия для предупреждения возможных инфекционных осложнений. Проведение эффективного лечения является сложной проблемой практической гематологии. В зависимости от уровня цитопении используются следующие лечебные подходы:
Прогноз и профилактика
Прогноз определяется этиологической формой, тяжестью и остротой течения анемии. Критериями неблагоприятного исхода служат быстрое прогрессирование заболевания, тяжелый геморрагический синдром и инфекционные осложнения. После трансплантации костного мозга ремиссии удается достичь у 75–90% пациентов. Первичная профилактика данной разновидности анемии предполагает исключение влияния неблагоприятных внешнесредовых факторов, необоснованного применения лекарственных препаратов, предупреждение инфекционной заболеваемости и др. Пациентам с уже развившимся заболеванием требуется диспансерное наблюдение гематолога, систематическое обследование и длительная поддерживающая терапия.
Аплазия костного мозга
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Аплазия костного мозга (или аплазия кроветворения) – это синдромы недостаточности костного мозга, которые включают группу расстройств, при которых резко подавляется функция кроветворения, которую выполняет костный мозг. Следствием данного нарушения является развитие панцитопении (наблюдается дефицит всех кровяных клеток: лейкоцитов, эритроцитов, а также тромбоцитов). Глубокая панцитопения является опасным для жизни состоянием.

Код по МКБ-10
Эпидемиология
Аплазия костного мозга встречается у людей с частотой 2,0/1 000 000 людей ежегодно. Данный показатель меняется в зависимости от страны, поэтому может быть разброс в пределах 0,6-3,0+/1 000 000 людей за ежегодно.

Причины аплазии костного мозга
Среди причин аплазии костного мозга выделяют такие:

Факторы риска
Среди факторов риска аплазии костного мозга выделяются описанные ниже.

Патогенез
Патогенез аплазии костного мозга пока не изучен полностью. В наши дни рассматривается несколько различных механизмов его развития:
При данном заболевании содержание компонентов (это витамин B12, железо, а также протопорфирин), которые непосредственно участвуют кроветворении, не уменьшается, но в то же время кроветворная ткань не может их использовать.

Симптомы аплазии костного мозга
Аплазия костного мозга проявляется в зависимости от того, какой клеточный элемент крови был поражён:
При парциальной красноклеточной аплазии костного мозга наблюдаются резкое снижение выработки эритроцитов, глубокая ретикулоцитопения, а также изолированная нормохромная анемия.
Существует врождённая и приобретённая формы данного заболевания. Вторая проявляется под видом приобретённого первичного эритробластофтиза, а также синдрома, возникающего при иных заболеваниях (это может быть рак лёгких, гепатит, лейкоз, инфекционный мононуклеоз или пневмония, а также серповидноклеточная анемия, паротит или язвенный колит и пр.).

Осложнения и последствия
Среди осложнений аплазии костного мозга:

Диагностика аплазии костного мозга
При диагностике аплазии костного мозга проводится изучение анамнеза болезни, а также жалоб пациента: насколько давно появились симптомы заболевания, и с чем больной связывает их появление.
Далее выясняется анамнез жизни:
После этого проводится физикальный осмотр. Определяется цвет кожи (при аплазии костного мозга наблюдается бледность), определяется частота пульса (чаще всего он учащён) и показатели АД (оно пониженное). Обследуются слизистые оболочки и кожные покровы на предмет наличия кровоизлияний и гнойных пузырьков и пр.

Анализы
В процессе диагностики заболевания проводятся и некоторые лабораторные исследования.
Выполняется анализ крови – если у пациента аплазия костного мозга, будет выявлено понижение уровня гемоглобина, а также количества эритроцитов. Цветовой показатель кровипри этом остаётся в норме. Уменьшается число тромбоцитов с лейкоцитами, а помимо этого нарушается правильное соотношение лейкоцитов, потому как уменьшается содержание гранулоцитов.
Проводится также анализ мочи, чтобы определить наличие эритроцитов в моче – это является признаком геморрагического синдрома, либо наличие лейкоцитов и микроорганизмов, что является симптомом развития в организме инфекционных осложнений.
Проводится также и биохимический анализ крови. Благодаря нему выясняются показатели глюкозы, холестерина, мочевой кислоты (чтобы выявить сопутствующее поражение каких-либо органов), креатинина, а также электролитов (натрия, калия и кальция).

Инструментальная диагностика
При инструментальной диагностике проводятся следующие процедуры.
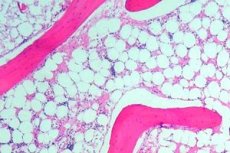
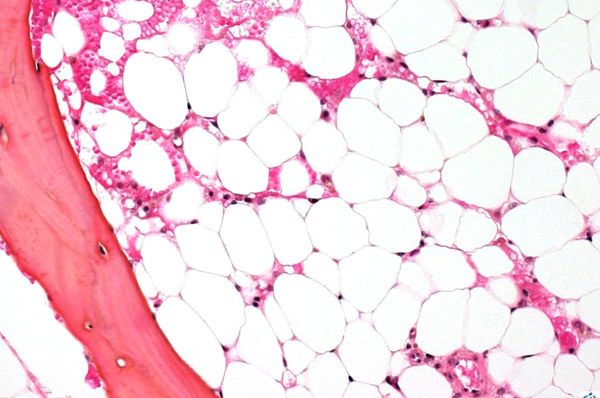
С целью обследования костного мозга выполняется пункция (прокалывание, при котором извлекается внутреннее содержимое) какой-либо кости, обычно таковой является грудина или тазобедренная кость. С помощью микроскопического обследования определяется замещения кроветворной ткани на рубцовую либо жировую.
Трепанобиопсия, при которой обследуется костный мозг, а также его соотношение с находящимися рядом тканями. Во время данной процедуры используется специальный аппарат, который называется трепан – с его помощью из подвздошной кости берётся столбик костного мозга вместе с надкостницей, а также костью.
Электрокардиография, которая позволяет выявить проблемы с питанием сердечной мышцы, сердечным ритмом.
Какие анализы необходимы?
Дифференциальная диагностика
Дифференциальная диагностика проводится с такими заболеваниями:
К кому обратиться?
Профилактика
Первичные профилактические меры относительно аплазии костного мозга заключаются в следующем: нужно предупредить воздействие на организм внешних негативных факторов. Для этого следует соблюдать технику безопасности в процессе работы с красителями или предметами, которые могут являтся источниками ионизурующего излучения, а также контролировать процесс применения лекарств.
Вторичная профилактика, которая необходима для предотвращения возможного ухудшения состояния у человека с уже развившейся болезнью или для предотвращения рецидива, заключается в таких мерах:

Прогноз
Аплазия костного мозга обычно имеет неблагоприятный прогноз – если не проводится своевременное лечение, больной погибает в 90% случаев.
Благодаря трансплантации донорского костного мозга 9 из 10 больных могут прожить больше 5 лет. Поэтому данный метод считается самым эффективным способом лечения.
Иногда выполнить пересадку не представляется возможным, но современная медикаментозная терапия также способна дать результат. Около половины пациентов благодаря ней могут прожить больше 5 лет. Но при этом в большинстве случаев выживают пациенты, заболевшие в возрасте не старше 40 лет.

Лечение аплазии костного мозга
Устранить болезнь при помощи этиотропного лечения (воздействовав на его причину) почти невозможно. Может помочь устранение провоцирующего фактора (например, отмена принимаемого лекарственного препарата, выезд из зоны радиации и пр.), но в этом случае лишь снижается скорость гибели костного мозга, а вот стабильное кроветворение этим способом восстановить не удаётся.
Иммуносупрессивное лечение проводится, если нельзя провести трансплантацию (нет подходящего больному донора). В этом случае используются лекарства из групп циклоспорина А либо антилимфоцитарного глобулина. Иногда их применяют совместно.
Применение ГМ-КСФ (лекарства, которые стимулируют выработку лейкоцитов). Это лечение используют, если количество лейкоцитов падает до уровня менее 2х109 г/л. Также в этом случае могут применяться кортикостероидные лекарственные средства.
Применяются анаболические стероиды, которые стимулируют образование белка.
В процессе лечения аплазии костного мозга применяются такие методы:
Выполняется переливание отмытыми эритроцитами (это донорские эритроциты, которые освобождают от белков) – этот метод уменьшает выраженность и количество негативных реакций на процедуру переливания. Делают такое переливание только, если существует угроза жизни больного. Таковыми являются следующие состояния:
Переливание донорских тромбоцитов осуществляют, если у пациента наблюдаются кровотечения и явно выраженное уменьшение числа тромбоцитов.
Кровоостанавливающую терапию проводят в зависимости от области, в которой началось кровотечение.
При возникновении инфекционных осложнений проводятся таки методы терапии:
Лекарства
При аплазии костного мозга обязательно используется медикаментозное лечение. Чаще всего применяют препараты, относящиеся к 3 лекарственным группам: это цитостатики (6-меркаптопурил, циклофосфан, метотрексат, циклоспорин А, а также имуран), иммунодепрессанты (дексаметазон, а также метилпреднизолон) и антибиотики (макролиды, цефалоспорины, хлорхинолоны, а также азалиды). Иногда могут применяться лекарства, корректирующие нарушения кишечной микрофлоры и проблемы с АД, ферментные лекарства и пр.
Метилпреднизолон прописывают внутрь. При пересадке органов – в дозировке не более 0,007 г/сут.
Побочные эффекты лекарственного препарата: вода, а также натрий могут задерживаться в организме, повышается АД, может наблюдаться потеря калия, остеопороз, мышечная слабость, лекарственный гастрит; может снижаться сопротивляемость разным инфекциям; подавление деятельности надпочечников, некоторые психические расстройства, проблемы с менструальным циклом.
Лекарство противопоказано при тяжёлой стадии гипертонической болезни; при 3 стадии недостаточности кровообращения, а кроме этого при беременности и остром эндокардите, а также нефритах, различных психозах, остеопорозе, язвах 12перстной кишки или желудка; после недавней операции; при активной стадии туберкулёза, сифилисе; людям пожилого возраста, а также детям младше 12 лет.
Метилпреднизолон с осторожностью назначают при наличии сахарного диабета, только если имеются абсолютные показания либо для лечения у пациентов с резистентностью к инсулину, с высокими титрами антиинсулиновых антител. При туберкулёзе или инфекционных болезнях использовать лекарство можно, лишь комбинируя его с антибиотиками либо препаратами, лечащими туберкулёз.
Имуран – в первый день разрешено применять дозу не более 5 мг на 1 кг веса человека в сутки (необходимо употребить в 2-3 приёма), но дозировка в целом зависит от режима иммуносупрессии. Размер поддерживающей дозы – 1-4 мг/кг веса в сутки. Её устанавливают в зависимости от толерантности организма пациента и его клинического состояния. Исследования указывают, что лечение с применением Имурана нужно проводить длительным курсом, даже применяя маленькие дозы.
При передозировке могут появиться язвы в горле, кровотечения и синяки, а также инфекции. Такие признаки более характерны при хронической передозировке.
Побочные эффекты – после пересадки костного мозга при лечении азатиоприном в сочетании с другими иммуносупрессорами у пациентов часто наблюдаются бактериальные, грибковые или вирусные инфекции. Среди прочих побочных реакций – аритмия, признаки менингизма, головные боли, поражение губ и ротовой полости, парестезии и пр.
Циклоспорин А применяют внутривенно – суточная доза разделяется на 2 приёма и вводится за 2-6 ч. Для начальной суточной дозы достаточно 3-5 мг/кг. Внутривенное применение является оптимальным в процессе лечения пациентов, которым была совершена трансплантация костного мозга. Перед пересадкой (4-12 час. однократно перед операцией) пациенту дают внутрь дозу 10-15 мг/кг, и далее такую же суточную дозу применяют последующие 1-2 нед. Позже дозу снижают до обычной поддерживающей (примерно 2-6 мг/кг).
Симптомами передозировки являются сонливость, сильная рвота, тахикардия, головные боли, развитие тяжёлой почечной недостаточности.
При приёме Циклоспорина необходимо следовать следующим мерам предосторожности. Терапию должны проводить в стационаре врачами, которые обладают большим опытом в лечении пациентов иммунодепрессантами. Нужно помнить, что вследствие приёма Циклоспорина предрасположенность к развитию злокачественных лимфопролиферативных опухолей возрастает. Именно поэтому нужно перед началом приёма решить, оправдывает ли положительный эффект от его лечения все сопряжённые с этим риски. При беременности препарат разрешается использовать лишь ввиду строгих показаний. Так как существует риск появления анафилактоидных реакций в результате внутривенного приёма, следует в целях профилактики принимать антигистаминные препараты, а также максимально быстро перевести пациента на пероральный способ введения лекарства.
Витамины
Если у больного наблюдаются кровотечения, помимо гемотерапии следует принимать 10% раствор хлористого кальция (внутрь), а также витамин К (в сутки по 15-20 мг). Кроме того, назначается аскорбиновая кислота в больших количествах (0,5-1 г/сут.) и витамин Р (в дозировке 0,15-0,3 г/сут.). Рекомендовано принимать фолиевую кислоту в больших дозах (максимум 200 мг/сут.), а также витамин В6, желательно в форме инъекций (по 50 мг пиридоксина ежедневно).
Физиотерапевтическое лечение
Чтобы активизировать работу костного мозга, применяется физиотерапевтическое лечение – диатермия трубчатых костей в области голеней либо грудины. Процедуру нужно проводить каждый день в течение 20 мин. Следует отметить, что этот вариант возможен только, если отсутствует выраженная кровоточивость.
Оперативное лечение
Пересадку костного мозга проводят в случае тяжёлой стадии аплазии. Результативность подобной операции повышается, если пациент находится в молодом возрасте, а также ему было выполнено малое количество переливаний элементов донорской крови (не больше 10-ти).
При таком лечении проводится извлечение у донора костного мозга и дальнейшая его пересадка реципиенту. Прежде, чем взвесь стволовых клеток будет введена, их обрабатывают при помощи цитостатиков.
После проведения пересадки пациенту предстоит длительный курс иммуносупрессивного лечения, которое необходимо для предотвращения возможного отторжения трансплантата организмом, а также предотвращения иных негативных иммунных реакций.