армянская болезнь что это такое простыми словами
Армянская болезнь что это такое простыми словами
Периодическая болезнь, или средиземноморская семейная лихорадка, — наследственное заболевание. Для нее характерны кратковременные острые и самопроизвольно исчезающие подъемы температуры тела, периоды полисерозита, возобновляющегося с нерегулярными интервалами, а также амилоидоз, который в отсутствие лечения приводит к тяжелой почечной недостаточности. Тип наследования — аутосомно-рецессивный. Болезнь встречается главным образом у выходцев из Средиземноморья — евреев-сефардов, турок, apмян и арабов, среди которых частота носительство патологического гена достигает 20 %.
Среди греков, испанцев и итальянцев она несколько ниже. У евреев-ашкенази, немцев и англосаксов периодическая болезнь наблюдается редко, а среди других этнических групп встречается лишь спорадически. В 63-68 % случаев первые клинические проявления возникают до 5-летнего возраста, в 90% случаев — до 20-летнего. Самый ранний возраст начала заболевания — 6 мес. Типичные острые периоды продолжаются 1-4 сут, сопровождаясь лихорадкой и симптомами перитонита (90%), артрит, или артралгии (85%) и плеврита (20%). Перикард и влагалищная оболочка яичка поражаются редко.
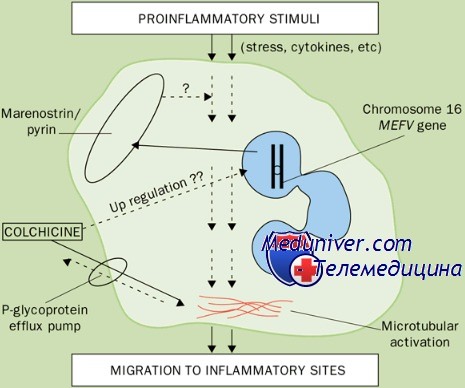
Ген периодической болезни был картирован в небольшом сегменте короткого плеча хромосомы 16 (р13,3) между генами поликистоза почек и синдрома Рубинстайна-Тейби. Затем двум исследовательским группам (международной и французской) удалось выделить и клонировать этот ген, получивший название MEFV. Он принадлежит к семейству генов RoRet, насчитывает примерно 10 тыс. пар оснований и содержит 10 экзонов. Его транскрипт (3,7 тыс. пар нуклеотидов) кодирует состоящий из 761 аминокислот белок пирин (от греч. «огонь»), или маренострин (от лат. «наше море»), который экспрессируется в миелоидных клетках. Обнаружено более 29 мутаций гена MEFV, большинство которых локализуется в последнем экзоне. Все ли они ассоциированы с периодической болезнью, неясно.
Почти у 70 % больных средиземноморского происхождения встречаются те или иные из пяти наиболее частых мутаций (M694V, V726A, M694I, M6801 и E148Q). Анализ гаплотипов и мутаций среди носителей дефектов показывает, что, происходя от общего предка, они в течение столетий разделились. Наиболее частая миссенс-мутация — метионин-694-валин (M694V) — встречается в 30-67% случаев и ассоциируется с тяжелым течением заболевания и высокой частотой амилоидоза. На 2-м месте находится мутация валин-726-аланин (7-35%), ассоциирующаяся с более легким течениям болезни и меньшей частотой амилоидоза. Таким образом, фенотипические различия болезни могут определяться разными мутациями. Клонирование идентификация гена периодической болезни сделали возможной ее диагностику даже там, где она встречается редко и мало знакома врачам. Генетическии скрининг (с помощью ПЦР) теперь проводят в ряде лабораторий.
Однако в таких лабораториях обычно определяют только 5-10 наиболее частых мутаций, пропуская более редкие. Поэтому диагностика периодической болезни все еще основывается на клинической картине, а генетические исследования проводят лишь для подтверждения диагноза. Патогенез обострений болезни остается мало изученным, хотя имеются сообщения о некоторых имунных нарушениях. Особый интерес представляют данные о недостаточности ингибитора (инактивирующего фермента) С5а. Компонент комплемента С5а — анафилатоксин, обладающий высокой хемотаксической активностью. В норме небольшие количества С5а, попадающие в серозные полости, нейтрализуются инактивирующим ферментом еще до того, как вызовут воспаление. Одна из гипотез патогенеза периодической болезни заключается в том, что недостаточность ингибитора С5а (вследствие аномальности пирина) обусловливает накопление его в серозных полостях, что и лежит в основе острых приступов заболевания.
Дальнейшее изучение функции пирина должно пролить свет на его взаимодействие с другими белками, принимающими участие в воспалительной реакции.
Приступы периодической болезни можно предотвратить приемом колхицина в дозе 0,02—0,03 мг/кг (максимум 2 мг) в сутки. Суточную дозу принимают за 1 или 2 раза. Лечение колхицином снижает не только частоту приступов, но и риск амилоидоза, а также уменьшает степень уже имеющегося амилоидоза. Прием колхицина во время беременности, по-видимому, не опасен ни для матери, ни для плода.
В последнее время обнаружено по крайней мере три других синдрома периодической лихорадки, которые следует отличать от периодической болезни. Гипер-IgD периодический лихорадочный синдром (HIDS) — аутосомно-рецессивное заболевание, встречающееся преимущественно в семьях европейского происхождения (голландцев, французов). В его основе лежат мутации гена мевалонаткиназы, локализованного на хромосоме 12 (участок q24). Приступы лихорадки продолжаются более 14 сут и сопровождаются увеличением шейных лимфатических узлов, болью в животе, сыпью, артралгией/артритом и иногда спленомегалией. В крови возрастает уровень белков острой фазы воспаления и IgD (> 100 ЕД/мл).
Специфические методы лечения неизвестны, хотя иногда помогают глюкокортикоиды. Периодический синдром, ассоциированный с рецептором ФНО (TRAPS), ранее носил другие названия: семейная ирландская лихорадка, семейная периодическая лихорадка и аутосомно-доминантная повторяющаяся лихорадка. Описано лишь несколько случаев этого синдрома в семьях ирландского и шотландского происхождения. В основе лежат мутации гена, расположенного на хромосоме 12 (участок р13) и кодирующего рецептор ФНО 1-го типа. У больных возникают кратковременные (4-6 сут) подъемы температуры, сопровождающиеся болью мышц живота. Могут иметь место сыпь, конъюнктивит и односторонний периорбитальный отек.
Иногда возрастает содержание белков острой фазы воспаления, но наиболее специфичный признак — низкий уровень растворимого рецептора ФНО 1-го типа в сыворотке крови. Для лечения применяют глюкокортикоиды. Показана терапевтическая эффективность этанерцепта (рекомбинантного рецептора ФНО). Недавно описано заболевание, названное синдромом периодической лихорадки с афтозным стоматитом, фарингитом и аденитом (PFAPA). У некоторых больных наблюдалась и артралгия. В большинстве случаев симптомы исчезали уже после однократного приема преднизона (1-2 мг/кг). Обычно этот синдром развивается до 5-летнего возраста и через 4-8 лет самопроизвольно исчезает. Неясно, имеет ли он инфекционную природу или связан с иммуногенетическими нарушениями.
Каждый 16-й армянин болен периодической болезнью: в чем польза ранней диагностики
ЕРЕВАН, 24 декабря. Новости-Армения. Периодическая болезнь или семейная средиземноморская лихорадка, которой преимущественно подвержены древние народы, преследует армян по сей день. Это одно из наиболее часто встречающихся генетических (наследственных) заболеваний. Человек может заболеть периодической болезнью в том случае, если его родители являются носителями мутантного гена. В чем причина мутации гена, какие симптомы указывают на необходимость генетического исследования, с какой точностью генетический анализ может обнаружить наличие болезни у пациента, каков риск передачи семейной лихорадки потомству? На эти и другие вопросы в рамках спецпроекта «Периодическая болезнь» агентства «Новости-Армения» отвечает врач-генетик Центра медицинской генетики и первичной охраны здоровья Анна Егиазарян.
Хотя периодическая болезнь является рецессивным заболеванием, т.е болезнь проявляется обычно при наличии двух мутаций, у нас есть много пациентов с клиническими проявлениями ПБ, у которых одна мутация. Также имеется приблизительно 1,8% больных без мутаций.
В Центре медицинской генетики и первичной охраны здоровья проводится молекулярно-генетический анализ 12 наиболее распространенных в армянской популяции мутаций с различной степенью патогенности. Например, мутация М694V считается наиболее патогенной, и при наличии даже одной такой мутации в гетерозиготном состоянии болезнь может проявиться. Наличие 2-х таких мутаций говорит о наиболее тяжелой форме заболевания. Клинические проявления обычно возникают в раннем возрасте и очень часто развивается амилоидоз почек (это грозное осложнение ПБ, приводящее к хронической почечной недостаточности). Мы проводим также анализ гена SAA1, при помощи которого можем спрогнозировать предрасположенность к развитию амилоидоза. Изоформа α/α в сочетании с мутацией M694V в гомозиготном состоянии – это высокий риск развития амилоидоза почек.
Современные представления о периодической болезни и клинические рекомендации по диагностике и лечению
В статье представлены современные сведения о патогенезе, клинических проявлениях, диагностике и лечении периодической болезни. Обсуждаются клинические и лабораторные методы оценки активности заболевания и подходы к лечению больных, резистентных к колхицину, на основе подавления эффектов интерлейкина-1.
Периодическая болезнь (ПБ), более известная в англоязычной литературе под названием Средиземноморская лихорадка, является древнейшим заболеванием. Первые наблюдения ПБ были описаны еще на закате средневековья. Так, H. Reimann указывает, что в 1629 г. Aubrey сообщил о своем страдании, которое проявлялось ознобом, тошнотой, рвотой, болями в животе, длящимися до полусуток и возникающими сначала каждые 2 недели, позже ежемесячно, один раз в 3 месяца, один раз в полгода [1].
Как самостоятельная нозологическая единица ПБ была выделена только в середине ХХ столетия. В 1948 г. H. Reimann на основании 6 наблюдений объединил общим термином “периодическая болезнь” ряд синдромов, включающих периодическую лихорадку, доброкачественный пароксизмальный перитонит, циклическую нейтропению и перемежающуюся артралгию [2]. Основными критериями считали периодичность и доброкачественность течения. По этой причине понятие “периодическая болезнь” стало очень широким. Благодаря работам E. S):1–112. ohar и соавт. (1967) [3], а в нашей стране – О.М. Виноградовой (1964, 1973) [4], В.А. Аствацатрян и соавт. [5] клиническая картина ПБ была очерчена более отчетливо. После открытия гена MEFV, мутации которого приводят к развитию клинических проявлений ПБ, были сформулированы окончательные критерии ПБ.
Тем не менее, сохраняет актуальность выделение особого обобщающего термина для всех периодических синдромов, клинические проявления и принципы диагностики которых сходны. Учитывая их наследственный характер, широко применяется термин семейные периодические лихорадки, которые, помимо ПБ, включают в себя криопиринопатии (семейная холодовая крапивница, синдром Макла-Уэллса, NOMID-CINCA синдром), гипериммуноглобулинемию D (дефицит мевалонаткиназы), TRAPS):1–112. (синдром, обусловленный мутацией гена рецептора к фактору некроза опухоли [ФНО]-α) и некоторые другие. Все эти заболевания характеризуются беспричинно повторяющимися приступами лихорадки в сочетании с воспалением кожи, серозных оболочек и суставов [4]. В основе патогенеза ведущую роль играют генетически детерминированные нарушения врожденного иммунитета, а механизмы специфического иммунитета – гуморального, связанного с синтезом аутоантител, и Т-клеточного, не имеют значения [5].
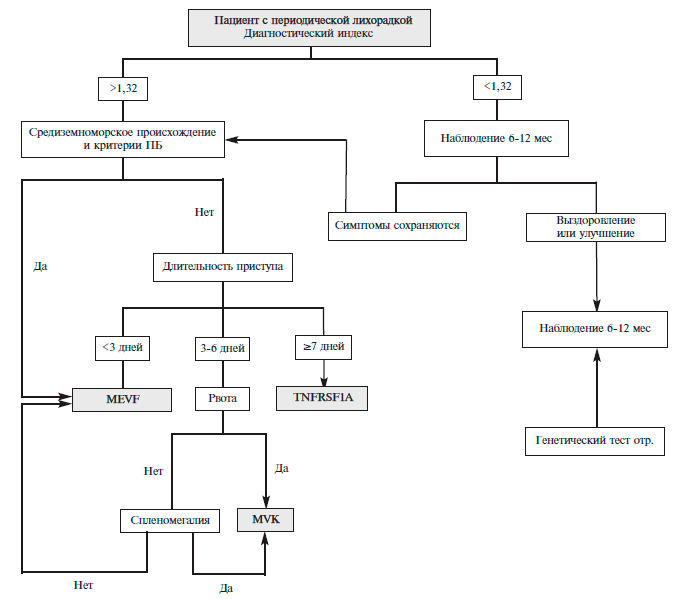
Клиническое предположение о наличии этих синдромов может возникать преимущественно у молодых пациентов с приступами болей в животе, грудной клетке в сочетании с афтозным стоматитом, диареей при наличии подобных признаков у родственников (табл. 1) [8]. Для оценки риска семейных периодических лихорадок предложен специальный индекс [9], автоматизированный расчет которого, предлагается на сайте Eurofever Project (https://www.printo.it/eurofever/index. asp). Паци ен там с высоким риском следует проводить генетическое тестирование для исключения семейных периодических лихорадок. У выходцев из Средиземно морья и Кавказа с непродолжительными приступами (менее 3 дней) в первую очередь следует исключать ПБ, у остальных пациентов с длительностью приступов до недели и эпизодами рвоты следует думать о дефиците мавалонаткиназы с развитием гипериммуноглобулинемии D, приступы длительностью более недели являются основанием для исключения TRAPS):1–112. (рис. 1). У пациентов с низким риском предлагается наблюдение за течением болезни с последующим повторным обсуждением показаний к генетическому исследованию на семейные периодические лихорадки.
Эпидемиология периодической болезни
Одним из признаков наследственной природы ПБ является этноассоциированный характер болезни – ее широкое распространение у народов, проживающих в бассейне Средиземного моря – армян, евреев-сефардов и, реже, арабов, турков, была показана разными авторами на больших группах больных. По данным О.М. Ви но градовой лица других национальностей среди больных ПБ встречались лишь в 2% случаев [4]. Среди 86 носителей гена ПБ, наблюдавшихся J. S):1–112. amuels и соавт. [10], необычно высоким было число итальянцев и евреев-ашкенази. Однако и в этой группе 96% пациентов оказались представителями средиземноморской популяции. В группе из 150 больных ПБ, обследованных О.М. Виноградовой [4], 88,6% составили армяне. В последние годы эту болезнь на территории России широко диагностируют у азербайджанцев, представителей разных народов Северного Кавказа, имеются также отдельные наблюдения ПБ среди русских и украинцев, преимущественно жителей южных регионов России. Болезнь наследуется по аутосомно-рецессивному пути. Это означает, что у родителей симптомы заболевания обычно отсутствуют, однако в больших семьях болезнь может проявиться у родных или двоюродных братьев/ сестер, дяди или дальнего родственника.
Ген, ответственный за ПБ, был клонирован в 1997 году и обозначен аббревиатурой MEFV (MEditerranean FEver) [11,12], в том же году были идентифицированы 8 основных мутаций гена. Ген MEFV располагается на коротком плече 16 хромосомы центромерно к гену гемоглобина- α, рядом с генами, ответственными за аутосомно-доминантный поликистоз почек и туберозный склероз 14. Показано, что среди евреев-сефардов, выходцев из Испании, частота носительства MEFV составляет от 1:16 до 1:8 (при распространенности ПБ в этой популяции от 1:250 до 1:1000) [15]. Частота носительства среди евреев-ашкенази Южной Европы почти на 2 порядка ниже – 1:135 (при распространенности ПБ 1:73000). Частота носительства среди американских армян составляет 1:7 [16].
Причина сохранения в современной средиземноморской популяции высокой частоты носительства MEFV остается неясной, однако сочетание ее с многочисленностью аллелей MEFV может свидетельствовать в пользу благоприятных условий для естественного отбора гетерозигот-носителей этих аллелей, по аналогии с распространенностью гена серповидноклеточной анемии в эндемичных очагах малярии.
Клиническая картина и диагноз
Продуктом MEFV является белок пирин, или маренострин (от латинского Mare Nostrum – Средиземное море) [11,12]. Одним из отличительных свойств пирина является наличие В30.2-домена. Кроме того, в молекуле пирина обнаружены 2 локуса потенциального связывания с ядром, а α-спиральный и В-box-домены могут обеспечивать взаимодействие с другими белками. Все выявленные в настоящее время мутации, ассоциирующиеся с ПБ, касаются изменений в В30.2-зоне пирина.
Экспрессия MEFV происходит почти исключительно в гранулоцитах и не наблюдается в лимфоцитах и моноцитах [11]. Не обнаруживают экспрессию гена и в других тканях. Согласно основной в настоящее время рабочей гипотезе пирин является базовым регулятором воспалительного ответа нейтрофилов. Соответ ственно, структурные изменения в молекуле пирина могут изменить функцию контроля и способствовать постоянному провоспалительному потенциалу нейтрофилов.
Немутантный пирин ингибирует адапторный белок AS):1–112. C, который кроме участия в апоптозе формирует ядро инфламмасомного комплекса путем гомотипического взаимодействия с белком NLRP и каспазой, что ведет к активации интерлейкина (ИЛ)-1 β. Инфламма сома – макромолекулярная платформа в цитоплазме, устойчивая к внутриклеточным механизмам деградации белков и, в силу этого, способная обеспечить реализацию провоспалительной активности клетки. Суще ствует несколько разновидностей инфламмасом. При ПБ и других семейных периодических лихорадках основное значение придают инфламмасоме на основе белка NLRP3 – криопирина. В качестве основной причины развития ПБ рассматривают утрату ингибиторного эффекта мутантного пирина на AS):1–112. C и, как следствие, активацию каспазы-1 [17], либо формирование пирином собственной инфламмасомы [18]. Однако роль мутаций домена B30.2 в развитии ПБ остается спорной; возможно, пирин может проявлять как про-,так и противовоспалительные свойства в зависимости от конкретных условий. Значение мутантного пирина в усилении секреции ИЛ-1 β при ПБ подтверждается купированием приступа ПБ при парентеральном введении ингибиторов ИЛ-1 [19].
Таким образом, в настоящее время несомненным диагностическим критерием ПБ является выявление гомозиготного носительства мутаций пирина. Однако у 20% больных клинические признаки ПБ развиваются при наличии только одной мутации. У таких пациентов сохраняют диагностическое значение клинические критерии болезни, в частности эффективность колхицина. Окончательный диагноз в этом случае может быть установлен только через 6-12 месяцев наблюдения за эффектом колхицина.
Важное значение имеет осмотр пациента во время периодических приступов заболевания, которые проявляются лихорадкой в сочетании с абдоминалгиями, торакалгиями, артралгиями и другими, более редкими, проявлениями. Указанные проявления могут возникать в различных сочетаниях или с разной периодичностью, обычно выделяют абдоминальный, торакальный, лихорадочный, реже суставной варианты ПБ.
Болезнь возникает преимущественно в детском или юношеском возрасте, чаще у мужчин, и характеризуется хроническим течением с обострениями и ремиссиями, возникающими от разнообразных причин и через различные сроки. Между приступами болезненные проявления отсутствуют, а во время приступа болезни многие пациенты сохраняют работоспособность. Приступы продолжаются от 12 ч до 3 суток, а затем самостоятельно разрешаются. Продолжительность межприступного периода у одного и того же пациента составляет от нескольких дней до нескольких месяцев, иногда приступы следуют один за другим с промежутками в 1-3 дня, но возможны и длительные ремиссии до нескольких лет. Характерный признак болезни, имеющий диагностическое значение, – стереотипность приступов. Пациенту, как правило, без труда удается отличить боль и лихорадку, вызванные приступом болезни, от подобных симптомов другого генеза.
Лихорадка, которая у нелеченных больных, как правило, достигает высоких значений и сопровождается потрясающими ознобами, является практически постоянным симптомом приступа. Выделение особой лихорадочной формы болезни обосновывается тем, что другие симптомы, включая абдоминалгии, встречаются реже. Однако В.М. Арутюнян и соавт. полагают, что острый асептический серозит, хотя бы и кратковременный, является облигатным проявлением болезни, в связи с чем нецелесообразно расширять классификацию болезни за счет лихорадочной и суставной форм, а достаточно ограничиться тремя формами – абдоминальной, торакальной и смешанной [20].
Абдоминальный вариант наблюдается у 91% больных [11,12]. В основе абдоминального варианта ПБ лежит рецидивирующее доброкачественное воспаление серозной оболочки брюшной полости с преобладанием экссудативной реакции над пролиферативной, что подтверждается малым количеством спаек, несмотря на частоту приступов. В воспалительный процесс вовлекаются брыжейка, серозная оболочка кишки, печени, селезенки, диафрагмы. Абдоминалгии обычно сопровождаются симптомами раздражения брюшины и вялой перистальтикой, что наряду с лихорадкой и лейкоцитозом периферической крови создает существенные дифференциально-диагностические сложности и ведет к необоснованной лапаротомии.
Торакальный вариант, в основе которого лежит асептический плеврит, наблюдается у 57% пациентов [11, 12]. При рентгеноскопии грудной клетки во время приступа отмечают ограничение подвижности купола диафрагмы, небольшой выпот в синусе над диафрагмой, реже дисковидные ателектазы, все эти явления затем полностью исчезают, но у трети больных возникают спайки.
Артрит и артралгии развиваются у 45% больных [11,12], очень редко как единственное проявление болезни. Суставные проявления имеют характер летучих артралгий, моноартрита, реже полиартрита, чаще вовлекаются коленные и голеностопные суставы. По окончании приступа эти явления полностью исчезают, не оставляя пролиферативных изменений. Ревматоид ный фактор, антистрептококковые антитела не определяются.
Редко (13%) встречается рожеподобная эритема в виде болезненных плотноватых пятен диаметром 10-15 см обычно в области голеностопных суставов [11,12].
Самым тяжелым осложнением является АА-амилоидоз, строящийся из циркулирующего белка-предшественника S):1–112. AA, близкого С-реактивному белку. Частота амилоидоза значительно отличается по данным разных авторов. О.М. Виноградова на примере популяции бывшего СССР указывает частоту амилоидоза 41,3%. Аме риканские авторы, обследовавшие популяцию армян, проживающих в США, сообщают о низкой частоте амилоидоза – 2% [8,21]. В любом случае, прогноз болезни определяется наличием и тяжестью амилоидоза. Клинические проявления амилоидоза характерны для АА-типа, при котором основным органом-мишенью являются почки. В течении амилоидной нефропатии обычно удается выделить три стадии – протеинурическую, нефротическую и стадию почечной недостаточности. Особенностью амилоидоза является сохранение высокой протеинурии на стадии хронической почечной недостаточности [22]. Нелеченный ААамилоидоз в рамках ПБ обычно прогрессирует быстрее, чем при других воспалительных заболеваниях: 5- и 10летняя выживаемость составляет соответственно 48% и 24%, соответственно, а при вторичном АА-амилоидозе другой этиологии – 77% и 44% [23].
Широко распространено мнение о наследственном характере амилоидоза при ПБ. Так, у больных ПБ с отягощенным по амилоидозу семейным анамнезом риск амилоидоза увеличивается в 6 раз [24]. Описан так называемый фенотип II ПБ (некоторые исследователи ставят под сомнение наличие фенотипа II, учитывая его исключительную редкость [25]), при котором клинически выраженных приступов не бывает, однако развивается АА-амилоидоз. При этом у родственников нередко регистрируется клиника несомненной ПБ.
Благодаря обнаружению в последние годы гена ПБ и его продукта – белка пирина показаны различные механизмы наследования ПБ и АА-амилоидоза. Пирин непосредственно не участвует в метаболизме S):1–112. AA, а гены обоих белков располагаются в разных хромосомах (гены S):1–112. AA обнаружены в 11 хромосоме). Таким образом, ПБ в настоящее время, подобно другим хроническим воспалительным процессам, рассматривают в качестве пускового фактора вторичного АА-амилоидоза.
У больных ПБ описаны единичные наблюдения асептического менингита, перикардита, миалгий, узелкового полиартериита, гломерулонефрита, пурпуры Шенлейн-Геноха, клиническое значение которых не вполне ясно [4]. Спленомегалия, как правило, сопутствует амилоидозу [4].
Оценка активности аутовоспалительных заболеваний
Первая попытка создания критериев активности аутовоспалительных заболеваний была предпринята группой ученых из Клиники Шиба (Израиль) в отношении ПБ [26]. В разработанной ими шкале учитываются возраст на момент начала заболевания, частота приступов, наличие артритов, рожеподобной эритемы и доза колхицина, необходимая для достижения ремиссии болезни. В 2005 г. ученые из той же клиники провели дополнительное исследование, в котором показали недостаточность этой шкалы для корректной оценки активности болезни [27]. С использованием статистических методов были разработаны новые критерии тяжести ПБ (модифицированные критерии Тель Хашомер), которые отличаются для больных, принимающих и не принимающих колхицин [27].
Эксперты рабочих групп EUROFEVER и EUROTRAPS):1–112. попытались разработать единые критерии активности семейных периодических лихорадок с использованием дельфийского метода и метода номинальных групп [28]. Для каждого заболевания были выделены симптомы, которые, по мнению экспертов и опрошенных больных, свидетельствуют о его высокой активности. В опроснике для больных содержатся ежедневные сведения о наличии и выраженности симптомов в баллах. По завершении месяца сумма баллов делится на количество дней в месяце (30 или 31): максимальной активности соответствует 13 баллов для криопиринопатий и 16 баллов для ПБ, HIDS):1–112. и TRAPS):1–112.
Традиционными методами подтверждения воспалительной природы заболевания и оценки его активности являются подсчет лейкоцитов крови и измерение показателей острофазового воспаления – СОЭ, уровня С-реактивного белка (СРБ), фибриногена и других.
Нередко при аутовоспалительных заболеваниях развивается анемия, как правило, нормохромная нормоцитарная, которая является следствием хронического воспаления (анемия хронических заболеваний). Веду щую роль в ее патогенезе играют провоспалительные цитокины – ФНО-α, ИЛ-1β, ИЛ-6 и интерферон-g [30,31]. Так, ФНО-α снижает эритропоэз за счет непосредственного блокирующего действия на рост эритроидных клеток-предшественниц и активации их апоптоза в костном мозге [32–34]. ИЛ-6 также подавляет костномозговую пролиферацию эритроидных клеток-предшественниц, снижает синтез эритропоэтина, через стимуляцию печеночной продукции гепсидина блокирует макрофагальное депо железа и его абсорбцию энтероцитами [35].
В последнее время исследователи стали уделять внимание новому показателю активности воспаления – отношению нейтрофилы/лимфоциты – ОНЛ (в норме оно равно 0,78-3,53 с медианой 1,65) [36]. Это надежный маркер, который может быть легко определен по результату клинического анализа крови. В настоящее время показана способность этого показателя отражать активность воспаления при ПБ. А. Ahsen и соавт. определяли ОНЛ и концентрацию СРБ у 62 больных ПБ в стадии ремиссии и 41 здорового человека [37]. Как ОНЛ, так и концентрация СРБ у больных с ремиссией ПБ были выше, чем у здоровых людей. Отмечена умеренная корреляция между этими параметрами (r=0,449, p
Лечение периодической болезни
Несмотря на наследственный характер ПБ в настоящее время существуют эффективные методы ее лечения. С 1970 г. в практику вошел колхицин, который позволил не только предупреждать приступы болезни, но также проводить лечение и профилактику амилоидоза, что существенно улучшило прогноз больных. Механизм противовоспалительного действия колхицина может быть связан с торможением дегрануляции полиморфноядерных лейкоцитов, способностью уменьшать продукцию ИЛ-1, снижать проницаемость сосудистой стенки. Известный цитостатический эффект колхицина в применяемых дозах, по-видимому, незначителен. Ежедневный прием 1-2 мг колхицина позволяет прово дить надежную профилактику приступов ПБ и амилоидоза. Терапевтическая доза при уже развившемся амилоидозе составляет 2 мг/сут. По данным клиники им. Е.М. Тареева колхицин эффективен даже у большинства больных с нефротическим синдромом, однако эффект наступает не сразу, спустя 2-4 года постоянного приема колхицина. Эффективность препарата при амилоидозе почек резко снижается на стадии почечной недостаточности, свидетельствующей о тяжести склеротических изменений.
Указанные дозы обычно хорошо переносятся, в том числе при многолетнем приеме. Нередко развивающаяся в начале лечения диарея носит преходящий характер и, как правило, не требует полной отмены препарата.
Приблизительно у 15-20% больных колхицин оказывается изначально неэффективным. Представление о ПБ как о внешней инфламмасомопатии позволило рекомендовать назначение ингибиторов ИЛ-1 пациентам, резистентным к лечению колхицином. В Рос сийской Федерации зарегистрирован канакинумаб (Иларис®) – человеческие моноклональные IgG1 антитела к ИЛ-1, которые связываются с цитокином и блокируют его взаимодействие с рецепторами. Канакинумаб обладает длительным периодом полувыведения (21-28 дней), что позволяет вводить его подкожно каждые 8 недель. Рекомендуемая стартовая доза у взрослых составляет 150 мг один раз в 4 недели, при необходимости ее можно увеличить до 300 мг.
Эффективность и безопасность канакинумаба изучались у больных с различными аутовоспалитель ными заболеваниями. В двойном слепом, плацебоконтролируемом, рандомизированном исследовании, состоявшем из 3 час тей, 35 пациентов с криопиринассоциированным периодическим синдромом (КАПС; синдром Макла-Уэллса у 33 и синдром NOMID/CINCA у 2) получали канакинумаб в течение 48 недель [52]. Во время части 1 всем пациентам вводили канакинумаб в дозе 150 мг подкожно. Если в течение 15 дней после введения препарата наблюдался полный ответ (отсутствие активности или минимальная активность по оценке исследователя и концентрации СРБ и S):1–112. AA ТАБЛИЦА 1. Эффективность канакинумаба в исследовании CLUSTER
Заключени
Представленная нами проблема ПБ демонстрирует достижения молекулярно-биологических исследований в современной практической медицине, показывает возможности диагностики и лечения на основе знаний о молекулярных механизмах ПБ. Последнее особенно важно с практических позиций, поскольку возможность выделения аутовоспалительных реакций с центральной ролью нейтрофила среди патофизиологических механизмов позволяет определить критерии индивидуального подхода к лечению с выбором патогенетически обоснованного средства подавления активности ПБ. Главным препятствием в диагностике и лечении больных ПБ остается низкая информированность врачей об этом заболевании, хотя в этнических группах высокого риска заболевание встречается с частотой 1-3 на 1000.