аспирация секрета ротоглотки что значит
Аспирационная пневмония
Аспирационная пневмония – это инфекционно-токсическое повреждение легочной паренхимы, развивающееся вследствие попадания в нижние дыхательные пути содержимого ротовой полости, носоглотки, желудка. Аспирационная пневмония проявляется кашлем, тахипноэ, цианозом, тахикардией, болью в груди, лихорадкой, появлением зловонной мокроты. Диагностика аспирационной пневмонии опирается на аускультативные и рентгенологические данные, результаты бронхоскопии, микробиологического исследования содержимого нижних дыхательных путей и плеврального выпота. Лечение аспирационной пневмонии требует проведения оксигенотерапии, антибиотикотерапии, эндоскопической санации трахеобронхиального дерева; при необходимости проводится дренирование развившихся абсцессов или эмпиемы плевры.
МКБ-10
Общие сведения
Под аспирационной пневмонией в пульмонологии понимается воспаление легких, возникшее в результате установленного эпизода случайного попадания в нижние дыхательные пути содержимого ротоносоглотки или желудка. Среди различных форм пневмоний аспирационная пневмония имеет довольно большой удельный вес: на ее долю приходится около 23% случаев тяжелых форм легочной инфекции. Аспирационный синдром нередко встречается у практически здоровых лиц во время сна. Так, при исследованиях с ирригацией носоглотки раствором, меченным радиоактивными изотопами, аспирация была зафиксирована у 45-50% здоровых людей и у 70% пожилых пациентов в возрасте старше 75 лет с нарушением сознания.
Причины
Аспирационные пневмонии развиваются на фоне случайного попадания твердых частиц или жидкости в воздухоносные пути. Тем не менее, одного лишь факта аспирации недостаточно для возникновения аспирационной пневмонии. В механизме развитии пневмонии играет роль количество аспирированного содержимого и его характер, число микроорганизмов, попадающих в терминальные бронхиолы, их вирулентность, состояние защитных факторов организма.
Факторы риска
Чаще всего преморбидным фоном для аспирационных пневмоний служат:
Нарушения сознания, обусловленные различными факторами:
Заболевания периферической и центральной нервной системы:
Заболевания, сопровождающиеся нарушением акта глотания (дисфагией) и регургитацией:
Травмы и ятрогенные повреждения:
В детском возрасте:
Патогенез
Сценарий развертывания событий при аспирации содержимого в трахеобронхиальное дерево может варьировать от полного отсутствия нарушений до развития респираторного дистресс-синдрома, дыхательной недостаточности и гибели пациента. Условиями, приводящими к развитию аспирационной пневмонии, служат нарушения факторов местной защиты в дыхательных путях и патологический характер аспирационных масс (количество, химические свойства и рН, степень инфицированности и пр.). Основными патогенетическими звеньями, приводящими к возникновению аспирационной пневмонии, выступают механическая обструкция дыхательных путей, острый химический пневмонит и бактериальная пневмония.
При вдыхании большого объема аспирата или крупных твердых частиц возникает механическая обструкция трахеобронхиального дерева. Возникающий при этом защитный кашлевой рефлекс способствует еще более глубокому проникновению аспирированного субстрата в бронхи и бронхиолы, что может привести к развитию отека легких. Механическая обструкция сопровождается развитием ателектазов легкого и застоем бронхиального секрета, на фоне которых увеличивается риск инфицирования легочной паренхимы.
В ответ на агрессивное воздействие аспирированного содержимого развивается острый химический пневмонит, характеризующийся выбросом биологически активных веществ, активацией системы комплемента, высвобождением факторов некроза опухолей, цитокинов и т. д. Дальнейшие патологические изменения в легочной паренхиме обусловлены ее повреждением биологически активными веществами, а не прямым действием аспирата. На фоне рефлекторного бронхоспазма, ателектаза части легкого, снижения легочной перфузии и прямого повреждения альвеол быстро развивается гипоксемия. С присоединением бактериального компонента нарастает дыхательная недостаточность, лихорадка, кашель, т. е. появляются все признаки бактериальной пневмонии. В этой стадии аспирационной пневмонии рентгенологически определяются очаги инфильтрации, нередко возникают легочные абсцессы и эмпиема плевры.
Симптомы аспирационной пневмонии
В клиническом течении аспирационная пневмония проходит этапы пневмонита, некротизирующей пневмонии, абсцедирования и эмпиемы плевры. В отличие от бактериальной легочной инфекции, клиника аспирационной пневмонии разворачивается постепенно и стерто. В течение нескольких дней после эпизода аспирации могут иметь место субфебрилитет, слабость, сухой мучительный кашель. В дальнейшем нарастают диспноэ, боли в грудной клетке, лихорадка, тахикардия, цианоз, выделение пенистой мокроты с примесью крови при кашле. Нередко, уже спустя 10-14 суток при аспирационной пневмонии возникает абсцедирование легочной ткани и эмпиема плевры. При этом появляется продуктивный кашель с выделением гнойной мокроты с гнилостным запахом, кровохарканье, ознобы.
Диагностика
Лечение аспирационной пневмонии
При наличии абсцессов в легких выполняется их дренирование, проводится вибрационный массаж, перкуторный массаж грудной клетки. При необходимости осуществляется повторная трахеальная аспирация секрета, санационные бронхоскопии и бронхоальвеолярный лаваж. К хирургическому вмешательству прибегают при организации абсцессов больших размеров (более 6 см), легочном кровотечении, образовании бронхоплевральной фистулы. При аспирационной пневмонии, осложненной эмпиемой плевры, выполняется дренирование плевральной полости, проводятся санационные промывания, введение в полость плевры антибиотиков и фибринолитиков. Возможно проведение открытого дренирования (торакостомии), плеврэктомии с декортикацией легкого.
Прогноз и профилактика
При небольших объемах аспирированного содержимого, стабильном общем фоне и своевременном грамотном лечении, прогноз при аспирационной пневмонии не вызывает опасений. В случае развития массивного пневмонита, легочных абсцессов, эмпиемы плевры, бронхоплевральных свищей, сепсиса – прогноз крайне серьезен. Летальность при осложненном течении аспирационных пневмоний составляет 22%.
Учитывая высокий риск аспирационной пневмонии среди лиц, страдающих заболеваниями нервной и пищеварительной систем, необходимо проводить лечение основного патологического состояния. Пациентам с дисфагией и склонностью к аспирации рекомендуется дробное питание и щадящая диета. Для профилактики рефлюкса у пациентов с дисфагией, тяжелобольных и послеоперационных пациентов необходимо приподнимать головной конец кровати под углом 30-45°. Особое внимание следует уделять пациентам, находящимся на ИВЛ, зондовом питании. Большую роль в предупреждении аспирационных пневмоний играет гигиена и своевременная санация полости рта, регулярное посещение стоматолога.
Аспирационный синдром
В.Е. Волков, проф., С.В. Волков, проф., Н.Н. Чеснокова
Чувашский государственный университет им. И.Н. Ульянова
Аспирационный синдром в большинстве случаев – внезапное попадание в дыхательные пути (аспирация) кислого желудочного содержимого, вызывающего ожог дыхательных путей и часто сопровождающегося развитием у больного критического состояния. Впервые это жизнеопасное осложнение описано С.Л. Мендельсоном в 1946 г. как неотложное состояние вследствие массивной аспирации желудочного содержимого у рожениц, при родах под общим обезболиванием. Хотя с тех пор прошло более 7 десятилетий, многие вопросы, касающиеся профилактики, неотложной диагностики и лечения синдрома остаются нерешенными, что подтверждается высокой летальностью – ≥40–50% [4].
Этиология и патогенез
В основе развития синдрома лежат аспирация желудочного содержимого, что приводит к химическому ожогу дыхательных путей и альвеол в результате воздействия хлористого водорода со свойствами сильной кислоты, а также обструкция дыхательных путей рвотными массами. Развивается обструктивная (асфиксическая) форма острой дыхательной недостаточности с возможностью летального исхода в течение нескольких минут, реже – часов и дней.
Считается, что для развития синдрома Мендельсона достаточно попадания в дыхательные пути 20–30 мл желудочного сока, имеющего низкий рН. Химический ожог слизистой оболочки дыхательных путей сопровождается повреждением эпителия трахеи, бронхов, бронхиол, стенок альвеол и эндотелия легочных капилляров. Степень повреждающего действия находится в прямой зависимости от кислотности и количества аспирированного желудочного сока. Вследствие кислотного ожога происходит экстравазация плазменной части крови в легочный интерстиций, а также в полость альвеол, что приводит к отеку легких и развитию острого респираторного дистресс-синдрома. Нарастание отека слизистой бронхов и бронхиол быстро вызывает бронхолегочную обструкцию, проявляющуюся распространенным бронхиолоспазмом и перенаполнением жидкостью альвеол, что ведет к развитию гипоксии вследствие острой дыхательной недостаточности.
Деструктивные изменения в легких, проявляющиеся повреждением эпителиального и эндотелиального слоев и отека, могут возникать под воздействием желудочного сока при рН 2,5–5,0, а также при попадании в дыхательные пути желчи, желудочных ферментов и других агрессивных компонентов [1]. При массивной аспирации желудочного или пищеводного содержимого у больного может быстро развиться асфиксический синдром, при котором первостепенное значение приобретает механический фактор; одновременно возникает обструкция трахеи, бронхов и бронхиол. Кроме обструкции, указанные легочные макроструктуры подвергаются химическому воздействию, что усугубляет тяжесть повреждения тканевых структур легких. Помимо этого, аспирация инфицированного содержимого из ротоглотки, а при кардиоспазме и кардиостенозе – из резко расширенного атоничного пищевода приводит к развитию пневмонита, при котором поражаются в основном нижние доли легких вплоть до развития абсцессов различной величины.
Аспирация желудочного содержимого или регургитация содержимого пищевода возможны при нарушении сознания (наркоз, опьянение, действие седативных средств, кома, горизонтальное положение больного). У всех больных перед экстренным оперативным вмешательством, при родах предполагается наличие содержимого в желудке, когда нарушена его эвакуация из желудка в кишечник. У больных кардиоспазмом и кардиостенозом, при которых обычно показана плановая операция под наркозом, почти всегда в пищеводе имеется жидкость. Аспирации способствует высокое внутрибрюшное и внутрижелудочное давление, например, при увеличении объема живота, обусловленном острым расширением желудка, различными видами острой кишечной непроходимости, острым панкреатитом, перитонитом и др.
К регургитации и аспирации нередко предрасполагают декомпенсированный стеноз привратника язвенной и раковой этиологии, а также атония кардиального сфинктера у больных, страдающих гастроэзофагеальной рефлюксной болезнью. Если не проведена своевременная декомпрессия желудка и пищевода, во время наркоза, чаще – в период интубации происходит массивная аспирация желудочного содержимого, что нередко сопровождается остановкой сердца.
Клиника и диагностика
Аспирационный синдром характеризуется острой дыхательной недостаточностью, обусловленной ларингоспазмом или бронхоспазмом, астматическим состоянием. Эти нарушения обычно возникают вслед за аспирацией или спустя 1–6 ч, реже – 12 ч, что проявляется возрастающим беспокойством больного, экспираторной одышкой, тахикардией и цианозом. В большинстве случаев аспирационный синдром сопровождается падением артериального давления (АД) и другими нарушениями деятельности сердечно-сосудистой системы вплоть до остановки сердца. Отмечается стойкость цианоза, который не устраняется даже при подаче кислорода 100% концентрации. При аускультации легких выслушиваются свистящие, а в нижних отделах – крепитирующие хрипы. При прогрессировании острой дыхательной недостаточности Ра02 снижается до 35–45 мм рт. ст., возрастает легочное сосудистое сопротивление.
При дальнейшем прогрессировании аспирационного синдрома его клинические проявления со стороны легких соответствуют клинике острого респираторного дистресс-синдрома. При рентгенологическом исследовании у больных с аспирационным синдромом удается выявить так называемое «шоковое легкое»: участки пониженной воздушности, диффузное затемнение легочной ткани.
При аспирации желудочного содержимого, имеющего умеренную кислую или нейтральную реакцию, синдром может протекать относительно благоприятно. При небольшой по объему аспирации она чаще ограничивается повреждением нижней доли правого легкого, проявляясь клинической картиной правосторонней нижнедолевой пневмонии.
Неотложная помощь
При развитии аспирационного синдрома следует быстро опустить головной конец кровати или операционного стола для оттока желудочного содержимого из ротоглотки, после чего очистить ее полость электроотсосом или тампоном, фиксированным с помощью корнцанга. Необходимо срочно произвести интубацию трахеи после предварительного осмотра голосовой щели с помощью ларингоскопа. Приподнимание головы и туловища в этот момент может предотвратить возможность повторной аспирации. После введения в трахею интубационной трубки следует надуть ее манжетку, что позволяет предотвратить повторное попадание в дыхательные пути желудочного содержимого.
Уже в первые минуты аспирации больной нуждается в сердечно-сосудистой реанимации. После интубации необходимо быстро удалить аспират из дыхательных путей с помощью катетера, введенного через интубационную трубку и соединенного с электроотсосом. Необходимо стремиться к полному удалению аспирата из трахеи и бронхов. Срочное отсасывание аспирата из трахеи и бронхов, а также откашливание его больным намного эффективнее восстанавливают проходимость дыхательных путей, чем бронхоскопия, произведенная через 30–60 мин после аспирации. После экстренных лечебных мероприятий необходимо приступить к выполнению бронхиального лаважа, для чего используют небольшое количество 0,9% раствора хлорида натрия (10–15 мл) с добавлением натрия бикарбоната (1 ампула – 44 ммоль). Общее количество раствора доводят до 30–50 мл. Использование большого объема жидкости для лаважа противопоказано, так как это может привести к оттеснению аспирата в более глубокие отделы дыхательных путей вплоть до альвеол [2].
В начальный период бронхолегочной аспирации обычно используют чистый кислород. При отсутствии эффективного спонтанного дыхания проводят искусственную вентиляцию легких, поддерживая насыщение артериальной крови кислородом на уровне 90–95%. С целью устранения шока и бронхоспазма внутривенно вводят гидрокортизон в дозе 150–200 мг или дексаметазон в дозе 4–8 мг, 10 мл 2,4% раствора эуфиллина. Показано также введение антигистаминных препаратов (30 мг димедрола или 20–40 мг супрастина), при низком АД – введение допамина в дозе 10–15 мкг/кг•мин. Выполняют инфузии изотонических электролитных и коллоидных растворов, свежезамороженной плазмы (200–400 мл), 20% раствора глюкозы (10–20 мл) и гепарина в дозе 5000– 10 000 ЕД [4].
При стабилизации состояния больного целесообразна санационная бронхоскопия с помощью фиброскопа, введенного через интубационную трубку. Бронхоскопия должна завершаться промыванием бронхов раствором глюкокортикоидов (гидрокортизон, дексаметазон) и введением антибиотиков (гентамицин и др.). Необходимо сохранение кашлевого толчка, при котором опорожнение бронхов более эффективно. Обязательно выполняют вибромассаж грудной клетки, мониторинг деятельности дыхательной и сердечно-сосудистой систем. После восстановления адекватного спонтанного дыхания осуществляют экстубацию.
Профилактика
Перед экстренной операцией медсестра и врач опорожняют желудок больного с помощью зонда. Больных не следует поить и кормить перед любым оперативным вмешательством, особенно когда требуется наркоз. Обязательно проводят премедикацию, предусматривающую введение атропина в дозе 0,1 мг на 10 кг массы тела.
При выполнении интубации необходимо соблюдение следующих мер: придание голове возвышенного положения, надавливание на перстневидный хрящ, что обеспечивает сдавление пищевода между трахеей и позвоночником (прием Селлика). Этот прием применяют сразу после преоксигенации кислородом 100% концентрации до введения мышечных релаксантов и заканчивают после интубации трахеи и раздувания манжетки. Если в момент интубации отмечается поступление желудочного содержимого в глотку, надо ввести интубационную трубку в пищевод и раздуть манжетку [4]. После санации ротоглотки необходимо выполнить интубацию трахеи запасной интубационной трубкой. Затем необходимо ввести в желудок зонд. Следует помнить, что аспирация небольшого количества желудочного содержимого может оказаться незамеченной, поэтому во время наркоза и после его окончания тщательно высушивают легкие. После экстубации с помощью ларингоскопа осматривают ротоглотку и при необходимости производят санацию. Экстубацию выполняют только при восстановлении мышечного тонуса и сознания.
К сожалению, во всех руководствах по анестезиологии и реанимации первостепенная роль при аспирационном синдроме отводится интубации трахеи. Однако клиническая практика показывает, что в данной критической ситуации выполнить интубацию трахеи в некоторых случаях по разным причинам не удается. Поэтому этот метод не может рассматриваться в качестве метода «последней надежды». К тому же аспирационный синдром может развиться у лиц, которым наркоз не требуется (состояние опьянения, затекание в ротоглотку содержимого пищевода при кардиоспазме, остром расширении желудка и др.). Такие больные при невозможности интубации трахеи или неудачной интубации нуждаются в выполнении крикотиреоидотомии (коникотомии).
Изложенное позволяет заключить, что:
Аспирационная пневмония
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
НИИ пульмонологии МЗ РФ
С овременные классификации, в зависимости от условий возникновения заболевания, подразделяют пневмонии на две большие группы: внебольничные и нозокомиальные (госпитальные) пневмонии [1]. Такой подход обоснован различными причинными факторами пневмоний и различными подходами к выбору антибактериальной терапии. Кроме того, принято отдельно рассматривать пневмонии у больных с тяжелыми дефектами иммунитета и аспирационные пневмонии, так как такая классификация пневмоний имеет большое практическое значение с точки зрения ведения больных [1].
Аспирация из ротовой полости и носоглотки является одним из наиболее частых путей проникновения микроорганизмов в дыхательные пути, другие механизмы (ингаляция, гематогенное распространение, контактное проникновение из очага инфекции) играют гораздо меньшую роль в генезе пневмоний. Несмотря на то, что аспирация является основным механизмом поступления патогена в дыхательные пути как при внебольничных, так и госпитальных пневмониях, аспирационными пневмониями (АП) принято называть только пневмонии у больных после документированного эпизода массивной аспирации или у больных, имеющих факторы риска для развития аспирации.
Аспирация содержимого ротовой полости и носоглотки является частым событием у здоровых людей во время сна. В нескольких исследованиях при ирригации носоглотки раствором с радиоактивной меткой, аспирация была документирована у 45–50% здоровых лиц и у 70% больных с нарушением уровня сознания [2]. Однако не каждая аспирация ведет к развитию пневмонии. Возникновение пневмонии зависит от числа бактерий, достигающих терминальных бронхиол (размер инокулюма), вирулентности бактерий и, с другой стороны, от состояния защиты нижних дыхательных путей. Статус защитной системы хозяина определяет, будет ли микроорганизм размножаться и вызывать пневмонию, или будет уничтожен факторами защиты.
Итак, для развития аспирационной пневмонии необходимо наличие двух условий:
1) нарушение местных факторов защиты дыхательных путей: закрытия глотки, кашлевого рефлекса, активного мукоцилиарного клиренса и др.
2) патологический характер аспирационного материала: высокая кислотность, большое количество микроорганизмов, большой объем материала и др.
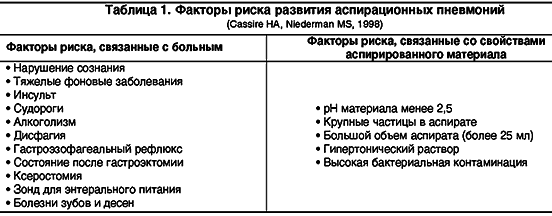
К факторам риска развития аспирационных состояний относятся снижение уровня сознания, нарушение глотания (дисфагия), нарушение функции кардиального сфинктера пищевода, плохое гигиеническое состояние полости рта (табл. 1) [3].
Во время комы практически любой этиологии (инсульты и другие цереброваскулярные события, передозировка снотворных, транквилизаторов и наркотических препаратов), при судорожных состояниях, общей анестезии происходит нарушение нормального глоточного рефлекса и секрет ротоглотки затекает в дыхательные пути, т.е. происходит аспирация.
Длительный прием алкоголя приводит к нарушению факторов иммунной защиты, кашлевого рефлекса и к орофарингеальной колонизации патогенными микроорганизмами, включая, кроме традиционной анаэробной флоры, Staphylococcus aureus и грамотрицательные микроорганизмы (Klebsiella spp, Enterobacter spp, Pseudomonas spp). Высокая частота аспирационных событий у алкоголиков связана с эпизодами бессознательных состояний во время алкогольных эксцессов, нарушениями сна, рвотой и моторными нарушениями пищевода.
Дисфагия является одним из самых сильных предикторов развития АП. В проспективном исследовании J. Croghan et al. было обнаружено, что в течение 12 месяцев АП возникла у 50% лиц с дисфагией и аспирацией, документированными во время видеофлюорографии, в то время как в группе больных без подтвержденной дисфагии в течение того же срока АП была выявлена в 12,5% [4].
Во многих работах показана сильная ассоциация между нарушением моторики пищевода и частотой развития АП: при гастроэзофагеальном рефлюксе и болезнях пищевода, состояниях после гастроэктомии, при зондовом питании.
Плохое состояние полости рта также является фактором риска АП. Нормальная микрофлора ротоглотки содержит анаэробы в концентрации 108 микроорганизмов/мл (Fusobacterium, Bacteroides, Prevotella, анаэробные кокки) и аэробы в концентрации 107 микроорганизмов в 1 мл (в основном, кокки). Число микроорганизмов снижается у людей без зубов и значительно повышается при наличии гингивита и периодонтита – до 1011 в 1 мл [5].
Характеристика аспирированного материала
Характер материала, аспирированного в дыхательные пути, также имеет огромное значение в патогенезе аспирационных пневмоний. Высокая концентрация микроорганизмов в аспирате, а также наличие в нем высоковирулентных патогенов обеспечивают преодоление защитных сил макроорганизма и развитие инфекции [5].
Кроме того, химические свойства аспирата являются фактором, определяющим характер повреждения легких. Очень низкий рН аспирата ( Аспирационные синдромы
Аспирация в трахеобронхиальное дерево может приводить к различным последствиям: от полного отсутствия каких-либо клинических событий до развития острого респираторного дисстресс-синдрома, дыхательной недостаточности и смерти больного. В 1975 г. J. Bartlett и S. Gorbach предложили рассматривать аспирационный синдром, как «тройную угрозу»: 1) механическая обструкция дыхательных путей; 2) химический пневмонит; 3) бактериальная пневмония [6]. Хотя очевидно, что лишь последний аспирационный синдром может быть отнесен к категории «аспирационная пневмония», но и первые два могут быть рассмотрены, как состояния, способные приводить к развитию аспирационной пневмонии примерно в 30% случаев.
Аспирационная пневмония имеет довольно большой удельный вес среди всех форм пневмоний,. Так, по данным мультицентрового исследования O.Leroy et al., около 23% тяжелых форм пневмоний в отделениях интенсивной терапии приходится на АП [7].
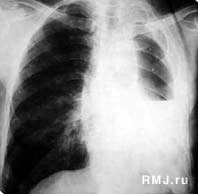
АП вызывается микроорганизмами, в нормальных условиях колонизирующими верхние дыхательные пути, т.е. маловирулентными бактериями, в большинстве случаев, анаэробами. АП может рассматриваться, как плевролегочная инфекция, которая при отсутствии терапии проходит следующие этапы развития: пневмонит (пневмония), некротизирующая пневмония (формирование очагов деструкции размерами менее 1 см, без уровней жидкости), абсцесс легких (одиночные или множественные полости размерами более 2 см), эмпиема плевры [8] (рис. 1–4). Распределение аспирированного материала, а, следовательно, и локализация инфекционных очагов в легких зависят от положения тела больного в момент аспирации. Чаще всего АП развивается в задних сегментах верхних долей и верхних сегментах нижних долей (зависимые сегменты), если аспирация произошла в то время, когда больной находился в горизонтальном положении, и в нижних долях (больше справа), если больной находился в вертикальной позиции.
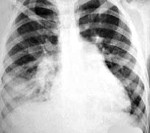
Рис. 1. Рентгенологическая картина АП нижней доли правого легкого у мужчины 18 лет, возникшей после аспирации во время алкогольного опьянения (изменение тени сердца связано с врожденным пороком сердца).
Рис. 2. Некротизирующая пневмония верхней доли правого легкого у мужчины 56 лет, возникшая после массивной аспирации во время судорожного синдрома.
Рис. 3. Абсцесс легкого у мужчины 58 лет, страдающего алкоголизмом.
Рис. 4. Аспирационная пневмония нижней доли левого легкого и левосторонний пио-пневмоторакс у женщины 67 лет, перенесшей инсульт и страдающей дисфагией.
В отличие от пневмонии, вызванной типичными внебольничными штаммами (пневмококк), АП развивается постепенно, без четко очерченного острого начала [9] (табл. 2). У многих больных через 8–14 дней после аспирации развиваются абсцессы легких или эмпиема. При появлении очагов деструкции примерно у половины больных отмечается продукция мокроты со зловонным гнилостным запахом, возможно развитие кровохарканья. Отсутствие гнилостного запаха даже при формировании абсцесса не исключает значения анаэробов в генезе АП, т.к. некоторые анаэробные микроорганизмы (микроаэрофильные стрептококки) не приводят к образованию продуктов метаболизма, обладающих гнилостным запахом. Другие симптомы АП не отличаются от других форм пневмонии: кашель, диспное, плевральные боли, лихорадка, лейкоцитоз. Однако у многих больных их развитию предшествуют несколько дней, а иногда и недель маловыраженных клинических признаков (слабость, субфебрильная лихорадка, кашель, у ряда больных – снижение веса и анемия) [8]. При АП, вызванной анаэробами, у больных практически никогда не наблюдается ознобов. К важным особенностям клинической картины можно отнести фоновые состояния больного: болезни периодонта, нарушение глоточного рефлекса, алкоголизм, эпизоды нарушения сознания.
Характерные клинические особенности аспирационной пневмонии:
• документированная аспирация или факторы, предрасполагающие к развитию аспирации
• зловонный запах мокроты, плевральной жидкости
• локализация пневмонии в зависимых сегментах
• некротизирующая пневмония, абсцесс, эмпиема
• наличие газа над экссудатом в плевральной полости
• красная флюоресценция мокроты или плевральной жидкости в ультрафиолетовом свете (инфекция, вызванная Porphyromonas)
• отсутствие роста микроорганизмов в аэробных условиях.
Летальность при аспирационных пневмониях достигает 22%. Независимыми предикторами плохого прогноза являются неэффективная начальная антибактериальная терапия, бактериемия, госпитальная суперинфекция [7].
Причинными факторами большинства АП являются анаэробы (около 50%), чаще всего комбинация этих микроорганизмов (как минимум, два патогена), реже комбинация анаэробов и аэробов (40%) и еще реже – аэробами (10%) [5]. Роль анаэробов в генезе АП была впервые установлена в 1970–х годах при использовании для забора материала пункции трахеи с аспирацией секрета (метод транстрахеальной аспирации). Структура патогенов, вызывающих АП, за последние годы практически не изменилась, некоторые изменения претерпела таксономическая классификация части микроорганизмов.
Наиболее частыми причинными анаэробными микроорганизмами при АП являются Fusobacterium nucleatum, Prevotella malanogenica (ранее относившаяся к роду Bacteroides), Porphyromonas spp (ранее относившиеся к роду Bacteroides), Streptococcus intermedius (ранее называвшиеся Peptostreptococcus), микроаэрофильные стрептококки. Кроме того, определенное значение также имеют и микроорганизмы рода Bacteroides (B.buccae, B.oris, B.oralis и др), однако подчеркивается, что роль Bacteroides fragilis при аспирационной пневмонии преувеличена [5]. В некоторых исследованиях микроорганизм Veilonella parvula являлся причиной до 12% всех аспирационных пневмоний [10]. Все перечисленные микроорганизмы менее вирулентны по сравнению с аэробными возбудителями внебольничных пневмоний, с чем и связано менее бурное течение воспалительного процесса. Исключение составляет Fusobacterium necrophorum, который обладает исключительно вирулентными свойствами, но в настоящее время пневмония, вызванная этим патогеном, встречается очень редко.
Возбудители аспирационных пневмоний:
• Bacteroides spp (B.buccae, B.oris, B.oralis и др.)
• Haemophilus influenzae (особенно тип b)
Получение культуры анаэробных микроорганизмов является довольно сложной задачей и требует соблюдения, как минимум, трех условий: правильный забор материала, его транспорт и посев на специальные среды.
Следует подчеркнуть, что экспекторированная мокрота не может быть использована для получения культуры анаэробов, так как в норме они в больших количествах присутствуют в верхних дыхательных путях и неизбежно контаминируют мокроту. При наличии эмпиемы плевральная жидкость является хорошим источником для этиологической диагностики. Положительная гемокультура также может приблизить к идентификации причинного патогена, однако аспирационная пневмония нечасто ассоциирована с бактериемией.
Забор материала из нижних дыхательных путей для получения анаэробных культур возможен при использовании методов, позволяющих избежать контаминации образца микрофлорой ротоглотки.
Чаще других используются метод транстрахеальной аспирации (ТТА) и метод защищенной щеточной биопсии (ЗЩБ). Несмотря на хорошую информативность, ТТА в настоящее время используется гораздо реже, чем раньше (хотя по–прежнему широко применяется в некоторых центрах Европы и в Японии). Причина – недостатки метода ТТА: инвазивность, невозможность проведения у интубированных больных, риск кровотечения. Хорошей альтернативой ТТА является метод ЗЩБ – получение материала во время фибробронхоскопии при помощи бронхиальной щетки, защищенной от контаминации внутри двойного телескопического катетера, закрытого биодеградирующей пробкой. Данный метод в настоящее время широко используется для диагностики респиратор–ассоциированных пневмоний. Однако есть данные о применении ЗЩБ при аспирационной пневмонии, причем результаты микробиологических исследований материала нижних дыхательных путей, полученного при помощи ЗЩБ, примерно такие же, как при использовании ТТА: при остром абсцессе легких анаэробы были изолированы в 74% случаев [11]. Полученный материал должен быть немедленно помещен в анаэробную среду (транспортная емкость с анаэробной средой) и как можно быстрее доставлен в микробиологическую лабораторию. Определенное значение может иметь и выбор сред для культивирования анаэробов [12].
Среди аэробных бактерий в генезе АП имеют значение такие микроорганизмы, как Staphylococcus aureus, Streptococcus pyogenes, Streptococcus vitridans, Haemophilus influenzae (особенно тип b), Eikenella corrodens, Klebsiella pneumoniae, Escherichia coli, Enterobacter cloacae, Proteus mirabilis, Pseudomonas aeruginosa [11,13]. Аэробные микроорганизмы выделяют особенно часто при нозокомиальных АП, кроме того, их доля очень высока среди больных с тяжелой АП, требующей госпитализации в отделения интенсивной терапии [13]. Объяснением такого различия микробного пейзажа по сравнению с внебольничной АП является высокая колонизация аэробными микроорганизмами (особенно грамотрицательными) ротоглотки и параназальных синусов у тяжелых больных, находящихся в стационаре.
Роль анаэробов в генезе нозокомиальных АП менее значима по сравнению с аэробами, хотя в ряде исследований было показано, что доля анаэробов в этиологии нозокомиальных АП (в том числе и респиратор–ассоциированных) может достигать 23–35% [8,10].
Антибактериальная терапия является основным компонентом лечения аспирационной пневмонии. Выбор антибиотика зависит от тяжести АП (см. ниже), окружения, в котором возникла пневмония, и наличия или отсутствия факторов риска для колонизации дыхательных путей грамотрицательными микроорганизмами [5].
Критерии тяжелой пневмонии (American Thoracic Society, Am Rev Respir Dis 1993; 148: 1418– 1426):
• Частота дыхания более 30 в 1 мин
• Потребность в искусственной вентиляции легких
• Тяжелая дыхательная недостаточность (PaO2 / FiO2 b –лактамазы, а доля резистентных штаммов среди Bacteroides spp достигает 90% [8,14]. Кроме того, весомая доля аэробных бактерий, участвующих в развитии аспирационных пневмоний в ассоциации с анаэробами или без них, также ставит под вопрос пенициллин G, как препарат выбора при аспирационной пневмонии [13].
В настоящее время предпочтение отдается клиндамицину (внутривенно 600 мг каждые 8 часов с последующим переходом на прием per os 300 мг каждые 6 часов), который обладает большей активностью по сравнению с пенициллином против анаэробов (в т.ч. и Bacteroides spp). В нескольких сравнительных исследованиях эффективности пенициллина G и клиндамицина при некротизирующей пневмонии и абсцессе легких было показано, что при использовании клиндамицина удается чаще добиться клинического успеха, достигается более быстрое снижение лихорадки и наблюдается меньшее число рецидивов легочных инфекций. В исследовании F. Gudiol et al., включавшем 37 больных с некротизирующей пневмонией, успех антибактериальной терапии составил 18 случаев из 19 при использовании клиндамицина и 10 из 18 – при терапии пенициллином [15]. Число анаэробов, резистентных к клиндамицину, составляет около 5% (4–22% в группе Bacteroides fragilis) [11,14].
К эффективной эмпирической терапии аспирационных пневмоний также относят комбинацию внутривенных пенициллина G и метронидазола (500 мг каждые 8–12 часов). Метронидазол обладает высокой активностью в отношении практически всех анаэробов, число резистентных штаммов составляет не более 12% [11]. Следует подчеркнуть, что метронидазол не должен назначаться в виде монотерапии, т.к. в ряде исследований частота неуспеха антибактериальной терапии анаэробных легочных инфекций составляла до 50%. Причинами такой низкой эффективности монотерапии метронидазолом являются: 1) отсутствие активности в отношении микроаэрофильных и аэробных стрептококков, которые при АП присутствуют в культурах до 50% случаев; 2) относительно низкая активность по отношению к грамположительным анаэробам.
К препаратам первой линии для терапии АП некоторые согласительные документы относят также и «защищенные» пенициллины (комбинация b –лактам + ингибитор b –лактамаз) [16]. Высокая эффективность амоксициллина/клавуланата была продемонстрирована в мультицентровом проспективном исследовании P. Germaud et al., включавшем 57 больных с абсцессом легких, некротизирующей пневмонией и эмпиемой плевры (у 27 из них предшествующая антибактериальная терапия оказалась неэффективной) – терапия амоксициллином/клавуланатом оказалась успешной у 52 больных (91%) [17]. Кроме амоксициллина/клавуланата (средняя доза 1,2 г каждые 8 часов в/в), высокой анаэробной активностью обладают также и другие «защищенные» пенициллины: ампициллин/сульбактам (3 г каждые 6 часов в/в), тикарциллин/клавуланат (3,2 г каждые 6–8 часов в/в), пиперациллин/тазобактам (4,5 г каждые 8 часов в/в) (табл. 3).
Карбапенемы (имипенем/циластатин и меропенем) обладают высокой активностью против анаэробов, поэтому они могут быть использованы при аспирационных пневмониях, особенно при их тяжелом течении. В исследованиях in vitro доля анаэробов, чувствительных к имипенему/циластатину приближается к 100%. В одном из клинических исследований, посвященных использованию карбапенемов при аспирационных пневмониях, эффективность имипенема/циластатина в монотерапии составила 78,6%, отсутствие клинического эффекта было отмечено у больных с инфекцией, вызванной P.aeruginosa [18]. Имепенем и меропенем обладают примерно одинаковой активностью в отношении анаэробных микроорганизмов (оба препарата назначаются в/в в дозе 0,5–1 г каждые 8 часов). Преимуществом «защищенных» пенициллинов и карбапенемов является их широкий антибактериальный спектр, включающий грамположительные и грамотрицательные аэробы, что позволяет широко использовать их в монотерапии при тяжелых внебольничных и госпитальных аспирационных пневмониях.
К препаратам, обладающим плохой активностью при анаэробных инфекциях, а следовательно, и при АП, относятся аминогликозиды, офлоксацин, ципрофлоксацин, цефтазидим, цефтриаксон, азтреонам и триметоприм/сульфаметоксазол.
Из группы цефалоспоринов наибольшую активность по отношению к анаэробам имеют цефамицины (цефокситин, цефотетан, цефметазол), однако до 30% микроорганизмов группы B.fragilis резистентны к ним.
Среди перспективных препаратов для терапии АП необходимо отметить новые фторхинолоны – моксифлоксацин, гатифлоксацин и тровафлоксацин [19]. Также есть экспериментальные данные о высокой активности новых макролидов (кларитромицин) против анаэробов [20]. Клинических данных об эффективности новых фторхинолонов и макролидов при АП пока нет.
Предложенные схемы антибактериальной терапии нуждаются в модификации при тяжелой пневмонии, при возникновении пневмонии в стационаре и наличии факторов риска колонизации дыхательных путей больного грамотрицательными микроорганизмами (см. ниже). В таких ситуациях очень высока вероятность вирулентных аэробных патогенов как причины АП, поэтому рекомендовано дополнительное «прикрытие» также и грамотрицательных микроорганизмов, а иногда и метициллин–резистентных S.aureus. Особую проблему представляют пневмонии, вызванные P.aeruginosa, поэтому в качестве препаратов эмпирической терапии при госпитальной АП рекомендовано использовать комбинацию антибиотиков, активных против P.aeruginosa (ципрофлоксацин, цефтазидим, цефперазон) и против анаэробов (клиндамицин или метронидазол). Также возможно использование карбапенемов (имипенем/циластатин, меропенем) или «защищенных» пенициллинов в виде монотерапии или в комбинации с аминогликозидами или фторхинолонами (табл. 3). После назначения эмпирической антимикробной терапии, последующие посевы мокроты и трахеальных аспиратов (у интубированных больных) могут помочь в выявлении P.aeruginosa и других аэробных микроорганизмов, а также в дальнейшей коррекции терапии.
Факторы риска колонизации грамотрицательными микроорганизмами:
• Снижение питательного статуса
• Хронические легочные заболевания
• Предшествующее использование антибиотиков
Путь назначения антибактериальной терапии определяется тяжестью аспирационной пневмонии. Больные с тяжелой пневмонией и с осложненными формами пневмонии должны получать парентеральную терапию, при менее тяжелом течении возможно назначение пероральных препаратов. Ответ на антибактериальную терапию у 80% больных с аспирационными пневмониями наступает в течение первых 5 дней лечения. Продолжительность курса антимикробной терапии у больных без абсцесса или эмпиемы составляет около 14 дней. При наличии абсцесса лихорадка может сохраняться 5–10 дней и более, несмотря на адекватную антибактериальную терапию. Больным с абсцессами и эмпиемами необходимо назначение парентеральной терапии до достижения клинического ответа (снижение лихорадки, тенденция к нормализации числа лейкоцитов, уменьшение кашля и диспноэ), после чего, при условии нормальной абсорбции из желудочно–кишечного тракта, возможен переход на терапию антибиотиками per os (клиндамицин 300 мг каждые 6 часов; амоксициллин 500 мг каждые 8 часов + метронидазол 500 мг каждые 6–8 часов; амоксициллин/клавуланат 625 мг каждые 8 часов). Рекомендуемая длительность антибактериальной терапии у больных с абсцессом легких и эмпиемой плевры составляет 2–3 месяца [14].
При наличии абсцесса легких и эмпиемы плевры могут понадобиться дополнительные мероприятия (бронхоскопия, хирургические методы). Дренирование абсцессов часто достигается при обеспечении хорошей экспекторации мокроты и проведении физиотерапевтических процедур (перкуссия, вибрационный массаж). При медленном разрешении абсцесса, локальной обструкции бронхиального дерева (инородное тело, опухоль) адекватный дренаж может быть достигнут при помощи бронхоскопических методов, в т.ч. и трансбронхиальной катетеризации. Хирургическое вмешательство может понадобиться при больших размерах абсцесса (более 6 см) и при осложнениях абсцесса (легочное кровотечение, формирование бронхоплевральной фистулы). Альтернативой хирургическому вмешательству может быть чрескожная катетеризация полости абсцесса, которая показана больным, не отвечающим на антибиотики и имеющим периферическую локализацию абсцесса. Для лечения эмпиемы плевры, кроме использования антибиотиков, часто требуются также дополнительные методы для обеспечения дренирования плевральной полости: повторные аспирации экссудата, установка дренажной трубки, введение в плевральную полость фибринолитиков, торакоскопия, открытая торакоскопия, хирургическая декортикация.
1. Навашин СМ, Чучалин АГ, Белоусов ЮБ, Дворецкий ЛИ, Зубков МН, Ноников ВЕ, и др. Антибактериальная терапия пневмоний у взрослых. Клин Фармакол Терапия 1999; 8(1): 41–50.
2. Huxley EJ, Viroslav J, Gray WR, et al. Pharyngeal aspiration in normal adults and patients with depressed consciousness. Am J Med 1978; 64: 564–8.
3. Bartlett JG. Anaerobic bacterial infections of the lung and pleural space. Clin Infect Dis 1993; 16 Suppl 4: 248–5.
4. Croghan JE, Burke EM, Caplan S, et al. Pilot study of 12–month outcomes of nursing home patients with aspiration on videofluoroscopy. Dysphagia 1994; 9: 141–6.
5. Cassire HA, Niederman MS. Aspiration pneumonia, lipoid pneumonia, and lung abscess. In: Pulmonary diseases. Baum G.L., Crapo J.D., Celli B.R., Karlinsky J.B. (Ed). Lippincot–Raven, Philadelphia, 1998: 645–55.
6. Bartlett JG, Gorbach SL: The triple threat of aspiration pneumonia. Chest 1975; 68: 560–6.
7. Leroy O, Vandenbussche C, Coffinier C, Bosquet C, Georges H, Guery B, Thevenin D, Beaucaire G. Community–acquired aspiration pneumonia in intensive care units. Epidemiological and prognosis data. Am J Respir Crit Care Med 1997; 156: 1922–9.
8. Finegold SM. Aspiration pneumonia. Rev Infect Dis 1991;13 Suppl 9: 737– 2.
9. Bartlett JG. Anaerobic bacterial pneumonitis. Am Rev Respir Dis 1979; 119: 19–23.
10. Dore P, Robert R, Grollier G, Rouffineau J, Lanquetot H, Charriere JM and Fauchere JL. Incidence of anaerobes in ventilator–associated pneumonia with use of a protected specimen brush. Am J Respir Crit Care Med 1996; 153: 1292–8.
11. Hammond JMJ, Potgieter PD, Hanslo D, Scott H, Roditi D. The etiology and antimicrobial susceptibility patterns of microorganisms in acute community–acquired lung abscess. Chest 1995; 108: 937–41.
12. Robert R, Grollier G, Dore P, Hira M, Ferrand E, Fauchere JL. Nosocomial pneumonia with isolation of anaerobic bacteria in ICU patients: therapeutic considerations and outcome. J Crit Care 1999; 14: 114–9.
13. Mier L, Dreyfuss D, Darchy B, et al. Is penicillin G an adequate initial treatment for aspiration pneumonia? A prospective evaluation using a protected specimen brush and quantitative cultures. Inten Care Med 1993; 19: 279–84.
14. Lynch III JP. Bacterial pneumonia, pp 297– 374. In: Pulmonary disease diagnosis and therapy. A practical approach. Khan MG, Lynch III JP (Ed). Williams & Wilkins, Baltimore, 1997.
15. Gudiol F, Manresa F, Pallares R, Dorca J, Rufi G, Boada J, Ariza X, Casanova A, Viladrich PF. Clindamycin vs penicillin for anaerobic lung infections. High rate of penicillin failures associated with penicillin–resistant Bacteroides melaninogenicus. Аrch Intern Med 1990; 150: 2525–9.
16. Huchon G, Woodhead M. Management of adult community–acquired lower respiratory tract infections. Eur Respir Rev 1998; 8: 391–426
17. Germaud P, Poirier J, Jacqueme P, Guerin JC, Benard Y, Boutin C, Brambilla C, Escamilla R, Zuck P. Monotherapie par amoxicilline/acide clavulanique (AM–AC) en traitement de premiere intention dans les abces pulmonaires communautaires. A propos de 57 cas. Rev Pneumol Clin 1993; 49: 137–41.
18. Kikuchi N, Onozaki I, Kohno N, et al. Clinical evaluation of therapy for aspiration pneumonia with imipenem/cilastatin sodium. Jpn J Antibiot 1990; 43: 23–30
19. Ackermann G, Schaumann R, Pless B, Claros MC, Goldstein EJC, Rodloff AC. Comparative activity of moxifloxacin in vitro against obligately anaerobic bacteria. Eur J Clin Microbiol Infect Dis 2000; 19: 228–32.
20. Jung R, Messick CR, Pendland SL, Tesoro EP, Losendahl KJ, Schriever CA, Danziger LH. Postantibiotic effects and bactericidal activities of clarithromycin–14–hydroxy–clarithromycin, versus those of amoxicillin–clavulanate, against anaerobes. Antimicrob Agents Chemother 2000; 44: 778–9.