атрофия эндометрия что это такое симптомы
Диагностическая и лечебная тактика у пациенток с патологией эндометрия в периоде перименопаузы
Какие методы исследования применяются на первом диагностическом этапе при обследовании женщин с отягощенным онкоанамнезом в перименопаузе? Какие дополнительные методы исследования можно применять для уточнения диагноза? Рисунок 1. Железиста
Какие методы исследования применяются на первом диагностическом этапе при обследовании женщин с отягощенным онкоанамнезом в перименопаузе?
Какие дополнительные методы исследования можно применять для уточнения диагноза?
 |
| Рисунок 1. Железистая гиперплазия эндометрия климактерического периода (трансабдоминальное сканирование) |
Предшествующий менопаузе продолжительный период постепенного перехода к полному угасанию репродуктивной функции женщины имеет свои особые характеристики, проявляющиеся в изменении отдельных звеньев нейрогуморального контроля функций определенных органов и систем.
На современном уровне развития медицинской науки удается регистрировать самые незначительные отклонения в «нормальном» течении данного процесса с позиции обнаружения патологических изменений, требующих своевременной медицинской коррекции для профилактики предшественников и рака эндометрия.
До сегодняшнего дня в гинекологии не удается радикально изменить онкоэпидемиологическую ситуацию и разработать стратегию, которая позволила бы решить проблему ранней диагностики и эффективного лечения рака эндометрия — опухоли, уносящей ежегодно более 5 тыс. жизней. При этом нельзя не отметить, что вопросы ранней диагностики рака эндометрия в менопаузе решаются достаточно эффективно ввиду разработки и внедрения оптимального алгоритма диагностического исследования.
Между тем возникновение патологических состояний эндометрия начинается задолго до наступления менопаузы, чему предшествует не только широкий спектр доброкачественных заболеваний органов женской половой системы, но и определенный, наследуемый по родительской линии генетический фон, что в совокупности позволяет создать диагностический алгоритм раннего обнаружения предшественников и начального рака эндометрия.
Период перименопаузы остается еще недостаточно изученным по совокупности оценки нейрогуморальных процессов, происходящих в организме женщины и проявляющихся в органах-мишенях, одним из которых является матка и собственно эндометрий.
Нельзя не отметить, что различные аспекты проблемы перименопаузального периода постоянно находятся в зоне повышенного внимания онкологов. Это касается и вопросов выяснения причин аномальных маточных кровотечений этого периода, изучения состояния эндометрия с помощью современных диагностических методов — УЗИ, гистероскопии, МРТ и морфологического исследования, а также определения терапевтической тактики при сопутствующих перименопаузе симптомах и заболеваниях, включая тонкие методы генного анализа и др.
 |
| Рисунок 2. Диагностические маршруты больных с гиперпластическими процессами эндометрия в перименопаузальный период |
Поэтому важно формирование индивидуализированной концепции клинического подхода к признакам патологических состояний этого периода, и в частности аномальных маточных кровотечений, доминирующими причинами развития которых являются гиперпластические процессы и рак эндометрия.
Диагностическое выскабливание, традиционно выполняемое при аномальных маточных кровотечениях, оказывается малоэффективным в диагностике начальных форм рака эндометрия, провоцирует развитие внутреннего эндометриоза, миомы матки, усугубляя и осложняя их течение, что экономически обременительно для гинекологических стационаров.
Вместе с тем практически повсеместное назначение гормонотерапии при гиперпластических процессах, сопровождающихся аномальными маточными кровотечениями, в свою очередь не всегда оправданно, так как существенно повышает стоимость лечения и может оказывать отрицательное влияние на психосоматическое состояние больных, обострять течение хронических заболеваний органов сердечно-сосудистой системы и свертывающей системы крови.
Поэтому сегодня необходимо совершенствование традиционных подходов к диагностике и лечению больных с гиперпластическими процессами эндометрия в перименопаузальном периоде, сопровождающимися аномальными маточными кровотечениями, в строгом соответствии с возрастными характеристиками обследуемых и учетом факторов риска.
Научное рассмотрение данной проблемы, в частности, стало возможным благодаря привлечению современных подходов к оценке реальной клинической ситуации с использованием возможностей компьютерного анкетирования, трансабдоминальной/трансвагинальной сонографии, цветного доплеровского картирования, гистероскопии с прицельной биопсией и морфологического изучения картины эндометрия в периоде перименопаузы в сочетании с анализом результатов остеоденситометрии.
На основе привлеченного клинического материала, обобщающего наблюдения за 392 женщинами в возрасте 45-55 лет в перименопаузальном периоде, нами изучены признаки, характеризующие состояние эндометрия в перименопаузальном периоде в сочетании с оценкой показателей минеральной плотности костной ткани.
Рассматривая ультразвуковое исследование основным, неинвазивным и безвредным, что позволяет применять метод многократно, исследовали объем и качество диагностической информации, предоставляемой с его помощью у женщин перименопаузального периода. При проведении этих работ были выявлены следующие моменты, касающиеся больных с клиникой аномальных маточных кровотечений.
1. Традиционное трансабдоминальное сканирование должно являться первым диагностическим этапом при появлении каких-либо симптомов в течение перименопаузального периода и обязательным для пациенток данной возрастной группы (45-55 лет), особенно при наличии положительных онкоанамнестических данных.
Этот метод позволил установить без диагностического выскабливания подслизистую миому (27,6%), внутренний эндометриоз (9,2%) и в сочетании с аспирационной биопсией — атрофию эндометрия (36,2%), а также осуществлять динамическое наблюдение за больными в рамках диагностического центра.
2. Стойкое увеличение размеров срединных маточных структур (М-эхо) более 7 мм с эхографическими признаками нечеткости М-эхо (появление гиперэхогенных структур и утрата визуализируемой границы эндометрий — миометрий) у 19,3% обследованных потребовало подключения уточняющих современных ультразвуковых технологий — трансвагинального УЗИ, доплеровского цветного картирования. Это позволило уточнить размеры и структуру эндометрия, обнаружить наличие полипов эндометрия (14,3%), а также зон эндометрия, наиболее подозрительных с позиции пролиферативных процессов, не свойственных данному периоду жизни женщины, — атипическая гиперплазия — у 3%, рак эндометрия — у 2% обследованных.
Эффективность трансабдоминального УЗИ в перименопаузальном периоде составила по критерию точности 82,5%, чувствительности — 78,4% и специфичности — 87,3%. Эти показатели выявили целесообразность использования примерно у 15% больных перименопаузального периода возможностей трансвагинального и доплеровского УЗИ, подтвердивших, что размеры М-эхо, устойчиво определяемые при динамическом УЗИ в перименопаузе 6-8 мм с утратой четкости контура эндометрий/миометрий свидетельствуют о вероятности злокачественной трансформации, что особенно согласуется с динамическим снижением индекса резистентности с 0,6-0,8 до 0,4-0,5 при доплеровском сканировании.
 |
| Рисунок 3. Клинические подходы к индивидуальному лечению гинекологической патологии перименопаузального периода |
По данным морфологического исследования, причинами кровотечений в перименопаузальном периоде была и атрофия эндометрия — 5,1%, и полипоз эндометрия — 14,3%, а в части случаев — рак эндометрия — 2%. Однако у большинства больных имели место гиперпластические процессы эндометрия, среди которых потенциальная опасность, по нашим данным, связана с морфологическими признаками эстрогенной стимуляции — 98 (25%) обследованных. Наличие повышенной минеральной плотности костной ткани у таких больных (7,4% из числа обследованных) явилось одной из причин их включения в группу риска по онкопатологии эндометрия.
Таким образом, для периода перименопаузы характерны следующие признаки состояния эндометрия:
Морфологические признаки атипической гиперплазии, обнаруживающиеся в процессе мониторинга при длительном приеме прогестагенов, также свидетельствуют о персистенции патологического процесса, особенно в конце перименопаузального периода.
На основе анализа полученных данных были разработаны индивидуальные диагностические маршруты, позволившие с привлечением соответствующих современных методов исследования уточнить состояние эндометрия у каждой конкретной больной на основе принципов функционально щадящего лечения, исключив применение инвазивных и агрессивных методик при отсутствии объективных медицинских показаний к их использованию.
Интерпретация полученных нами клинико-диагностических данных дала возможность распределить всех обследуемых в перименопаузе пациенток, как обращающихся впервые, так и направленных специалистами других областей, на три самостоятельных потока:
1. Благоприятный анамнез и показатели УЗИ, морфологического исследования аспирата и минеральной плотности костной ткани (М-эхо менее 7 мм, четкие границы; морфология аспирата — атрофия, гиперплазия эндометрия с децидуоподобной реакцией; нормальная или сниженная минеральная плотность костной ткани) ограничивают объем диагностических мероприятий ежегодным трансабдоминальным УЗ-контролем;
2. У женщин до 50 лет с благоприятным онкоанамнезом и показателями трансабдоминального и трасвагинального УЗИ и денситометрии (остеопения, остеопороз, норма) с морфологически верифицированной железистой, железисто-кистозной гиперплазией эндометрия с/без микрофокусов атипической гиперплазии эндометрия в начале перименопаузального периода возможно консервативное ведение с УЗ-контролем в условиях цветного доплеровского картирования с гистероскопией и прицельной биопсией эндометрия;
3. УЗ-признаки увеличения М-эхо с появлением его гетерогенности, снижением индекса резистентности менее 0,5 и атипической гиперваскуляризацией в сочетании с морфологической картиной атипической гиперплазии 2-3-й степени и повышением минеральной плотности костной ткани — специальное лечение.
Была разработана индивидуальная терапевтическая тактика для пациенток перименопаузального периода с различными показателями комплексного динамического диагностического исследования:
1. При благоприятном онкоанамнезе, УЗ-признаках нормального течения перименопаузы или атрофии эндометрия специальное лечение не показано;
2. УЗ-признаки симптомной миомы матки и симптомного внутреннего эндометриоза (неэффективное гормональное лечение) не требуют диагностического выскабливания, а состояние эндометрия оценивают по результатам аспирационной биопсии (по показаниям после гистероскопии) — хирургическое лечение в гинекологическом стационаре;
3. УЗ-признаки гиперплазии эндометрия у больных моложе 50 лет при благоприятном онкоанамнезе и морфологической картине железистой гиперплазии с фокусами атипической гиперплазии 1-й степени и индексом резистентности более 0,5 позволили на I этапе, после терапевтической аблации эндометрия, ограничиться гормонотерапией прогестагенами и ультразвуковым контролем каждые три месяца в условиях диагностического центра;
4. Ультразвуковые морфологические признаки прогрессирующей атипической гиперплазии эндометрия перименопаузального периода требуют хирургического лечения в специализированном стационаре.
Таким образом, данная стратегия позволяет повысить эффективность обнаружения доброкачественных и злокачественных заболеваний эндометрия с обоснованным привлечением современных диагностических методов, а также индивидуализировать тактику ведения женщин перименопаузального периода с патологическими процессами эндометрия.
Что такое эндометрит? Причины возникновения, диагностику и методы лечения разберем в статье доктора Делеске И. А., гинеколога со стажем в 8 лет.
Определение болезни. Причины заболевания
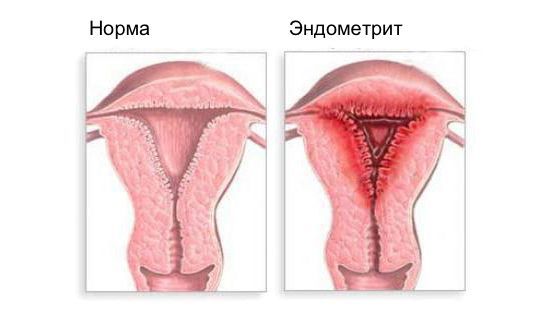
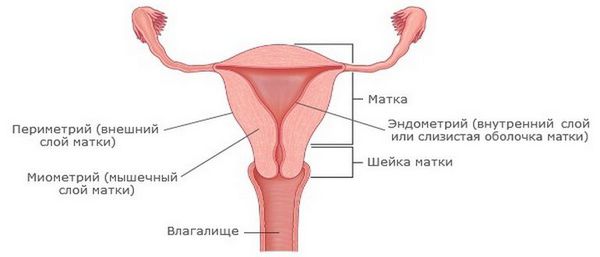
Эндометрит — это воспаление внутреннего слоя матки (эндометрия), которое приводит к изменению его функций. Возникает в результате заражения этой области микробами, вирусами и грибковыми инфекциями.
В женском репродуктивном тракте присутствуют различные микроорганизмы, среди которых преобладают Lactobacillus spp. Эндометрит чаще ассоциирован с чрезмерным размножением бактерий Enterobacter, Enterococcus, Streptococcus, Staphylococcus, Ureaplasma, Mycoplasma.
Эндометрит вызывают также вирусные инфекционные агенты: вирус герпеса, цитомегаловирус, вирус папилломы человека, энтеровирусы и аденовирусы.
Риск развития эндометрита увеличивают:
Симптомы эндометрита
Воспаление может протекать в острой и хронической форме. Чаще всего симптомы эндометрита появляются на четвёртый день после инфицирования. При острой форме эндометрита отмечаются общие симптомы воспаления, такие как слабость, быстрая утомляемость, повышение температуры тела, изменения в общем анализе крови (сдвиг лейкоцитарной формулы влево и повышение СОЭ).
К локальным симптомам острого эндометрита можно отнести:
При отсутствии правильного и своевременного лечения эндометрита в течении 10 дней возможен переход в хронический воспалительный процесс. При этом держится повышенная температура, появляются новые симптомы:
Течение острого послеродового эндометрита более тяжёлое, проявляется в следующих симптомах:
Патогенез эндометрита
На начальном этапе воспаления инфекционный агент (бактерии, вирусы или грибки) внедряется в слизистую оболочку матки. Начинается выработка медиаторов воспаления, которая приводит к нарушению микроциркуляции крови в его очаге. Миграция лейкоцитов в зону повреждения, активация нейтрафилов и макрофагов ведёт к активной выработке цитокинов и перекиси водорода, запуску перекисного окисления липидов с повреждением мембран клеток. В это время на фоне повышенной выработки цитокинов и факторов роста происходит деградация матрикса клеток. Нарушение микроциркуляции крови приводит к развитию локальной ишемии и гипоксии ткани, которые затем активируют процессы склерозирования. При длительной стимуляции иммунной системы происходит её истощение и появление аутоиммунных реакций.
При длительности воспалительного процесса более 2 месяцев можно расценивать его как хронический процесс. Развиваются изменения в структуре и функции ткани, происходит нарушение пролиферации (деления клеток) и физиологической циклической трансформации эндометрия. В связи с этим возможно нарушение нормальной имплантации эмбриона при беременности.
Классификация и стадии развития эндометрита
Эндометрит можно разделить на острую и хроническую форму.
Острый эндометрит возникает при абортах, диагностических манипуляциях, выскабливании, развивается быстро, воспаление сопровождается острыми или ноющими болями и повышением температуры. Наиболее частый путь инфекции при нём — восходящий. Распространение инфекции из влагалища в верхние отделы репродуктивного тракта происходит при несостоятельности барьера шейки матки. Воспаление может локализоваться в эндометрии, а также переходить на миометрий. При несвоевременном и неполноценном лечении возможно развитие пельвиоперитонита (воспаление оболочки брюшины в области малого таза).
Отдельно выделяется острый послеродовый эндометрит — начинается на 2-4 сутки после родов, ему может предшествовать хориоамнионит (инфицирование оболочек плода и жидкости).
При хроническом эндометрите симптоматика сглажена. Характерны периодические обострения и рецидивы после переохлаждения и воспаления другой локализации урогенитального тракта.
По клиническим проявлениям эндометрит подразделяется на клиничеcки выраженную и субклиническую форму.
По характеру воспалительного процесса эндометрит можно разделить на:
По морфологическим признакам:
Осложнения эндометрита
Осложнения у эндометрита могут быть достаточно серьёзными.
Пельвиоперитонит — воспаление выходит за пределы матки, в процесс вовлекаются листки брюшины. Пациентки отмечают резкое повышение температуры, симптомы интоксикации, тошноту, рвоту, интенсивные боли внизу живота (основная локализация ниже пупка), симптом раздражения брюшины ( резкое усиление боли в животе при быстром надавливании и снятии руки).
Диагностика эндометрита
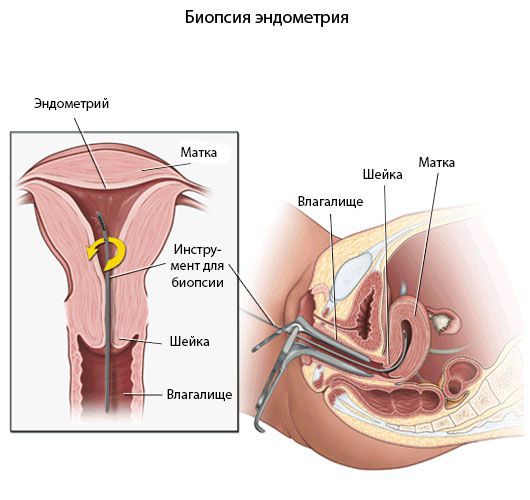
Диагностика хронического эндометрита должна быть основана на комплексном подходе анализа жалоб пациентки, анамнеза, симптомов, результатов эхографических исследований, лабораторной диагностики, данных морфологического исследования эндометрия и иммунного статуса.
Критериями хронического эндометрита является наличие очаговых или диффузных лимфоидных инфильтратов, склероз стенок спиральных артерий, фиброз стромы и наличие плазматических клеток. При этом к абсолютным признакам хронического эндометрита относят плазматические клетки.
Микробиологические посевы используются для выявления возбудителя воспалительного процесса.
При эхографии (УЗИ) хронический эндометрит определяют по:
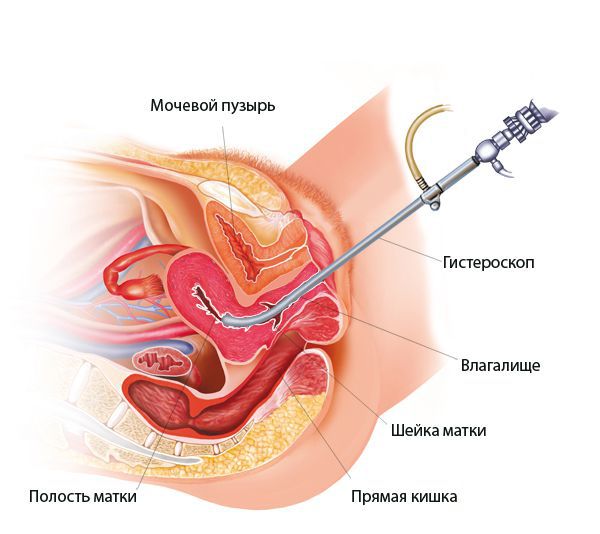
При гистероскопии определяются следующие признаки хронического эндометрита: гиперемия слизистой оболочки матки, неровномерная толщина эндометрия, полипообразные образования, кровоизлияния, очаговая гиперплазия эндометрия.
Лечение эндометрита
Контрольные критерии эффективности терапии хронического эндометрита:
Прогноз. Профилактика
При своевременном и полноценном лечении прогноз благоприятный. Пациентки отмечают улучшение состояния в течении двух суток. При запоздалом лечении эндометрита возможно развитие септического шока.
Для профилактики эндометрита рекомендуется:
Вагинальная атрофия: этиологические аспекты и современные подходы к терапии
Вагинальная атрофия – симптом постменопаузы, характеризующийся эстрогендефицитным состоянием у женщин. Урогенитальный тракт особенно чувствителен к снижению уровня эстрогенов. 27–55% всех женщин в постменопаузе испытывают симптомы, связанные с урогенитальной атрофией (уга), затрагивающей половую функцию и качество жизни.
В клинической картине урогенитальных расстройств в климактерическом периоде выделяют симптомы, связанные с вагинальной атрофией, а также расстройства с мочеиспусканием (цистоуретральная атрофия). Если вазомоторные симптомы проходят со временем, признаки вагинальной атрофии прогрессируют. У 40–57% женщин отмечается сухость влагалища, жжение и зуд, диспареуния, кровотечения, недержание мочи, инфекции органов малого таза.
Стенки влагалища состоят из трех слоев: внутреннего, среднего мышечного и наружного соединительнотканного. Атрофические процессы захватывают мышечные и соединительнотканные структуры, а также мышцы тазового дна, уретры, мочевого пузыря. Особенно выражены они в слизистой влагалища, которая состоит из 4 основных слоев эпителиальных клеток: базального, парабазального (митотически активного), промежуточного гликогенсодержащего и поверхностного слущивающегося. Эстрогеновые рецепторы в основном располагаются в базальном и парабазальном слоях и практически отсутствуют в промежуточном и поверхностном. Дефицит эстрогенов блокирует митотическую активность базального и парабазального слоев эпителия, пролиферацию влагалищного эпителия. Следствием прекращения пролиферативных процессов являются исчезновение гликогена – питательной среды для лактобактерий, полное выведение лактобацилл, которые играют ключевую роль в предотвращении заболеваний урогенитального тракта. Вследствие расщепления гликогена при условии достаточного количества эстрогенов образуется молочная кислота, обеспечивающая кислую среду в пределах колебаний РН от 3,8 до 4,4. Подобный механизм приводит к подавлению роста патогенных и условно-патогенных бактерий. В период постменопаузы слизистая оболочка утрачивает защитные свойства, истончается, легко травмируется с последующим инфицированием.
Атрофия слизистой вульвы и влагалища характеризуется истончением, уменьшением вагинальной складчатости, побледнением, наличием петехиальных кровоизлияний, признаков воспаления, а также происходит потеря упругости тканей, подкожно-жировой клетчатки, выпадение лобковых волос, снижение секреторной активности бартолиниевых желез. Как правило, врачи диагностируют вагинальную атрофию на основании сочетания клинических симптомов, визуального осмотра и субъективных жалоб пациентки.
Для диагностики и оценки эффективности лечения вагинальной атрофии необходимо: РН и подсчет вагинального индекса созревания (ВИС, преобладание клеток базального и парабазального слоев), мультистероидный профиль крови.
ЭСТРОГЕНЫ
Эстрогены являются главными регуляторами физиологических процессов во влагалище. Все клинические рекомендации по лечению урогенитальной атрофии сходны в том, что наиболее эффективным методом лечения вагинальной атрофии является локальная гормональная терапия эстрогенами. Для лечения урогенитальной атрофии, сочетающейся с симптомами климактерия, используют системную гормональную терапию. Исследования показали, что локальная терапия устраняет симптомы вагинальной атрофии в 80–90% случаев, а системная терапия – в 75%. Ультранизкие дозы эстрогенсодержащих препаратов обладают выраженным кольпотропным эффектом. Учитывая слабое пролиферативное действие на эндометрий при использовании эстрогена, дополнительного введения прогестагена не требуется.
Роль дефицита эстрогенов у женщины в патогенезе урогенитальных расстройств в период менопаузы ни у кого не вызывает сомнений. Однако клиническая картина климактерического синдрома характеризуется широкой вариабельностью проявлений, поэтому не все урогенитальные расстройства в перименопаузе и постменопаузе могут быть объяснены недостаточным эффектом эстрогенов. С возрастом у женщин происходит значительное снижение уровня как эстрогенов, так и андрогенов. Так, уровень общего и свободного тестостерона, андростендиона и дегидроэпиандростерона в 45-летнем возрасте составляет в среднем 45%, в 60-летнем – около 30%, в 70-летнем – 10% от уровня этих гормонов у 20-летних женщин. Дефицит андрогенов, которому у женщин практически не уделяется внимания, оказывает негативное влияние на все органы и системы организма, особенно на половую систему. Применение ультранизких доз локальных эстрогенсодержащих препаратов является безопасным и эффективным подходом к предотвращению и лечению вагинальной атрофии, не имеет ограничений по возрасту и длительности применения.
АНДРОГЕНЫ
Андрогены у женщин, как и у мужчин, представлены дегидроэпиандростерона сульфатом (ДГЭА-С), дегидроэпиандростероном (ДГЭА), андростендионом, тестостероном и 5α дегидротестостероном (5-α-ДГТ). Однако в отличие от мужчин концентрация первых трех гормонов у женщин выше, чем концентрация двух последних. Секреция андрогенов в надпочечниках регулируется адренокортикотропным гормоном (АКТГ), в яичниках – лютеинезирующим гормоном (ЛГ). У женщин около 25% андрогенов образуется в яичниках, 25% – в надпочечниках, остальные синтезируются в периферических тканях. После наступления менопаузы основным местом синтеза андрогенов становятся яичники. Циркулирующий в крови тестостерон у женщин функционирует как прогормон, способный к конверсии в 5-α-ДГТ или 17-β-эстрадиол в тканях-мишенях.
Андрогеновые рецепторы широко представлены в головном мозге, в изобилии – в женской мочеполовой системе, хотя влияние андрогенов на состояние влагалища изучено недостаточно. Слизистая оболочка влагалища во время возбуждения выделяет муцин и вагинальный транссудат (эстрогензависимая функция), секреция которых у женщин является андрогензависимой. Известно также, что уровень эстрогенов в крови влияет на экспрессию андрогеновых рецепторов во влагалище: у женщин, получающих препараты эстрогенов, плотность андрогеновых рецепторов оказывается ниже, чем у тех, кто такие препараты не получает. При этом показано, что плотность андрогеновых рецепторов в менопаузе существенно уменьшается. Следовательно, уменьшение плотности андрогеновых рецепторов у женщин в постменопаузе в сочетании с возрастным снижением уровня андрогенов в сыворотке крови у них может быть причиной уменьшения андроген-чувствительности тканей влагалища.
Кроме того, в женской половой системе наряду с эстрогензависимыми эффектами регуляции регионарного кровообращения выявлена андрогензависимая NO-опосредованная вазодилатация. Таким образом, уровень эстрогенов у женщин является основным, но не единственным механизмом, обеспечивающим рост клеток гладкой мускулатуры влагалища, а также регулирующим метаболизм соединительной ткани и синтез оксида азота. При дефиците эстрогенов происходит истончение эпителия влагалища, что делает его восприимчивым к травмам и инфекциям. Однако вагинальный эпителий у женщин, которым вводили тестостерон или ингибиторы ароматазы, также демонстрировал увеличение числа слоев клеток, их толщины и числа митозов.
Андрогены усливают экспрессию NO-синтазы в проксимальном отделе влагалища, что проявляется в облегчении релаксации гладких мышц влагалища. Эстрогены, с другой стороны, снижают активность NO-синтазы и повышают активность L-аргиназы, что может привести к относительному дефициту оксида азота и ослаблению релаксации вагинальной ткани. Таким образом, можно предположить, что при нормальном уровне эстрогенов имеющаяся у женщины диспареуния может быть проявлением дефицита вазомиорелаксирующего влияния андрогенов на мочеполовую систему, мионейроваскулярной недостаточностью и спазмом мышц тазового дна на фоне дефицита андрогенов.
Возрастное снижение уровня андрогенов у женщин коррелирует с развитием симптоматики цистоуретральной и вагинальной атрофии. В мышцах тазового дна и нижних мочевых путях имеется огромное количество андрогеновых рецепторов, что делает эти группы мышц также высокочувствительными к анаболическим эффектам андрогенов у женщин. Несмотря на то, что эстрогензаместительная терапия оказывает выраженное положительное влияние на клинические проявления урогенитальных расстройств, у 30–40% системная заместительная гормональная терапия (ЗГТ) не эффективна, поэтому обычно назначают местную терапию эстриолом, основным биологическим эффектом которого является трофическое воздействие на нижние отделы урогенитального тракта. Однако даже при таком подходе у значительного числа пациенток проблемы сохраняются.
СОВРЕМЕННОЕ ВИДЕНИЕ
Зарубежные и российские исследования показывают, что применение тестостерона в постменопаузе может быть эффективным средством лечения вагинальной атрофии, никтурии, недержания мочи как на фоне системной и локальной ЗГТ, так и без нее. Необходим индивидуальный подход к лечению урогенитальных расстройств, учитывающий разные типы течения пери- и менопаузы. Так, пациентки с клинически и лабораторно (мультистероидный профиль, определяемый масс-спектральным методом) подтвержденным дефицитом андрогенов не должны получать препарат ЗГТ с антиандрогенными свойствами, в связи с тем что ряд жалоб, обусловленных дефицитом эстрогенов, могут только усугубиться. В то время как при сохраненной секреции андрогенов назначение препаратов с андрогенной активностью может привести к нежелательным явлениям андрогенизации: спровоцировать рост волос на лице, прибавку мышечной массы, повысить сальность кожи, чрезмерно повысить либидо. Поэтому при выборе препаратов для лечения урогенитальной атрофии учитываются индивидуальные особенности каждой конкретной пациентки, основываясь на показателях ее гормонального профиля.
Ряд экспериментальных исследований показали эффективность применения андрогенных препаратов –
ДГЭА и тестостерона у пациенток в постменопаузе с сексуальными нарушениями и урогенитальными расстройствами. Андрогенные препараты для лечения вагинальной атрофии применяются в качестве эффективных и безопасных средств в виде трансдермального геля тестостерона пропионата, перорального тестостерона ундеканоата интравагинального геля дегидроэпиандростерона (DHEA) – 0,25% (3,25 мг), 0,5% (6,5 мг) и 10% (13 мг). Крем с 0,5% DHEA оказался самым оптимальным для лечения вагинальной атрофии, он эффективен и существенно не влияет на сывороточный уровень эстрогенов.
Помимо перечисленных выше методов лечения вагинальной атрофии, на сегодняшний день существуют такие, как терапия препаратами эстриола с низкими и ультранизкими дозами (0,3 мг и менее 0,1 мг) в сочетании с лактобактериями, селективными модуляторами эстрогеновых рецепторов (оспемифен), а также терапия комбинацией конъюгированных эстрогенов и базедоксифена – селективного модулятора эстрогеновых рецепторов, известной как тканевой селективный эстрогенный комплекс (TSEC), эффективный в соотношении 20 мг/ 0,625 мг.
Таким образом, местная терапия имеет ряд преимуществ перед системным введением препаратов, позволяет избежать первичного метаболизма в лечении, максимально воздействует на эндометрий, имеет низкую гормональную нагрузку, минимальные побочные эффекты, не требует добавления прогестагенов, оказывает в основном локальный эффект. Учитывая патогенез вагинальной атрофии (дефицит не только эстрогенов, но и андрогенов, влияющих на качество мышечной ткани малого таза, сократительную способность мочевого пузыря) рекомендована также терапия с применением интравагинальных гелей (дегидроэпиандростерона), селективных тканевых эстрогеновых комплексов, селективных модуляторов эстрогеновых рецепторов и негормональных методов лечения, а также комбинированных препаратов, содержащих
ультранизкодозированный эстриол и лактобактерин.
Несмотря на то что эффективность лечения высока, не стоит забывать о профилактике заболевания: сохранение регулярной половой жизни очень важно в период менопаузы. При половом акте улучшается циркуляция крови, а семенная жидкость содержит половые стероиды, простагландины и незаменимые жирные кислоты, способствующие сохранению вагинальной ткани.