ацетилхлорид что это такое
Ацетилхлорид
| Ацетилхлорид | |
 | |
| Общие | |
|---|---|
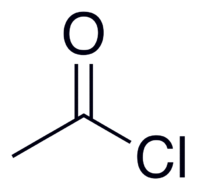
| Химическая формула | CH3СOCl |
| Физические свойства | |
| Молярная масса | 78,5 г/моль |
| Плотность | 1,105 г/см³ |
| Термические свойства | |
| Температура плавления | -112,86 °C |
| Температура кипения | 51,8 °C |
| Оптические свойства | |
| Показатель преломления | 1,3897 |
| Классификация | |
| Рег. номер CAS | 75-36-5 |
| SMILES | CC(=O)Cl |
Ацети́лхлори́д (хлористый ацетил) — хлорангидрид уксусной кислоты, летучая бесцветная жидкость с резким раздражающим запахом, дымящая на воздухе; смешивается с органическими растворителями (бензол, сероуглерод, хлороформ, эфир и т.п.).
Методы синтеза
В промышленности ацетилхлорид синтезируют реакцией уксусной кислоты с хлоридами фосфора (треххлористым или пятихлористым фосфором):
Реакционная способность и применение
Бесцветная жидкость, дымящая на воздухе вследствие гидролиза парами воды и образованием тумана из капель соляной кислоты:
Сильный электрофил, широко используется в органическом синтезе в качестве ацилирующего агента для введения в синтезируемую молекулу ацетильной группы (ацетила) CH3CO при этерификации,
Ацетилхлорид также используется для ацетилирования ароматических соединений по Фриделю-Крафтсу.
См. также
Полезное
Смотреть что такое «Ацетилхлорид» в других словарях:
ацетилхлорид — ацетилхлорид … Орфографический словарь-справочник
ацетилхлорид — CH3COCl, бесцветная жидкость с резким запахом, tкип 51,8ºC. Применяют для введения в органические соединения группы СН3СО (ацетилирования), например в производстве лекарственных препаратов. * * * АЦЕТИЛХЛОРИД АЦЕТИЛХЛОРИД, СН3СОСl, хлористый… … Энциклопедический словарь
ацетилхлорид — acetilchloridas statusas T sritis chemija formulė CH₃COCl atitikmenys: angl. acetylchloride rus. ацетилхлорид; хлористый ацетил ryšiai: sinonimas – etanoilchloridas … Chemijos terminų aiškinamasis žodynas
Ацетилхлорид — хлористый ацетил, CH3COCl, хлорангидрид уксусной кислоты (См. Уксусная кислота), бесцветная дымящая на воздухе жидкость с резким запахом, температура кипения 51,8 °С, плотность 1105 кг/м3. А. применяют для ацетилирования в производстве… … Большая советская энциклопедия
АЦЕТИЛХЛОРИД — CH3COCl мол. м. 78,50; бесцв. жидкость с резким запахом, дымящая на воздухе; т. пл. 112,86 … Химическая энциклопедия
ацетилхлорид — ацетилхлор ид, а … Русский орфографический словарь
ацетилхлорид — у, ч. Хімічна речовина, що використовується у виробництві барвників, ліків … Український тлумачний словник
ацетилхлорид — іменник чоловічого роду … Орфографічний словник української мови
ацетилхлорид — хлористый ацетил … Cловарь химических синонимов I
Ацетилхлорид (CH3COCl) является ацилхлорид происходит от уксусная кислота. Он принадлежит к классу органические соединения называется ацилгалогениды. Это бесцветный, едкий, летучий жидкость.
Содержание
Синтез
В промышленных масштабах реакция уксусный ангидрид с хлористый водород производит смесь ацетилхлорида и уксусной кислоты: [3]
Лабораторные маршруты
Ацетилхлорид был впервые получен в 1852 году французским химиком. Чарльз Герхардт лечением ацетат калия с фосфорилхлорид. [4]
Ацетилхлорид получают в лаборатории по реакции уксусная кислота с хлоргидратирующими агентами, такими как PCl3, PCl5, ТАК2Cl2, фосген, или же SOCl2. Однако эти методы обычно дают ацетилхлорид, загрязненный примесями фосфора или серы, которые могут мешать органическим реакциям. [5]
Другие методы
При нагревании смесь дихлорацетилхлорид и уксусная кислота дает ацетилхлорид. [5] Его также можно синтезировать из каталитического карбонилирование из метилхлорид. [6] Он также возникает в результате реакции уксусной кислоты, ацетонитрил, и хлористый водород. [ нужна цитата ]
Вхождение
Не ожидается, что ацетилхлорид существует в природе, потому что контакт с воды бы гидролизовать в уксусную кислоту и хлористый водород. Фактически, если обращаться с ним на открытом воздухе, он выделяет белый «дым», возникающий в результате гидролиза из-за влажности воздуха. Дым на самом деле состоит из маленьких капель соляная кислота и уксусная кислота образуется при гидролизе.
Использует
Эфиры и амид уксусной кислоты
Часто такое ацилирование проводят в присутствии основания, такого как пиридин, триэтиламин, или же DMAP, которые действуют как катализаторы чтобы способствовать реакции и как базы нейтрализовать результирующий HCl. Такие реакции часто протекают через кетен.
Ацетилирование по Friedel-Crafts
Ацетилхлорид что это такое
ГОСУДАРСТВЕННЫЙ СТАНДАРТ СОЮЗА ССР
Reagents. Acetyl chloride. Specifications
ОКП 26 3493 0060 02
1. РАЗРАБОТАН И ВНЕСЕН Министерством химической промышленности СССР
Е.П.Крысин, Л.Е.Ускова, И.Л.Ротенберг, Л.В.Кидиярова, И.С.Гладкова, Т.К.Палдина, Л.Д.Комиссаренко
2. УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Государственного комитета стандартов Совета Министров СССР от 21.09.71 N 1625
4. ССЫЛОЧНЫЕ НОРМАТИВНО-ТЕХНИЧЕСКИЕ ДОКУМЕНТЫ
Обозначение НТД, на который дана ссылка
Номер пункта, подпункта
3.2.1, 3.5, 3.6, 3.7, 3.9, 3.10, 3.11
5. Срок действия продлен до 01.01.95 Постановлением Госстандарта СССР от 25.05.89 N 1327.
6. ПЕРЕИЗДАНИЕ (апрель 1993 г.) с Изменениями N 1, 2, утвержденными в сентябре 1979 г., мае 1989 г. (ИУС 10-79, 8-89)
Настоящий стандарт распространяется на хлористый ацетил.
Хлористый ацетил представляет собой бесцветную, прозрачную, дымящую на воздухе жидкость с резким запахом. Бурно разлагается водой и спиртом, смешивается с органическими растворителями и ледяной уксусной кислотой.
Формулы: эмпирическая C H OCI
структурная
(Измененная редакция, Изм. N 1, 2).
1. ТЕХНИЧЕСКИЕ ТРЕБОВАНИЯ
1.1а. Хлористый ацетил должен быть изготовлен в соответствии с требованиями настоящего стандарта по технологическому регламенту, утвержденному в установленном порядке.
(Введен дополнительно, Изм. N 2).
1.1. Хлористый ацетил по физико-химическим показателям должен соответствовать требованиям и нормам, указанным в таблице.
Чистый для анализа (ч.д.а.)
ОКП 26 3493 0062 00
Чистый (ч.)
ОКП 26 3493 0061 01
1. Массовая доля хлористого ацетила (C H OCI), %, не менее
2. Плотность при 20 °С, г/см
3. Массовая доля нелетучего остатка, %, не более
4. Массовая доля сульфатов (SO ), %, не более
5. Массовая доля фосфора в виде фосфатов (PO ), %, не более
6. Массовая доля железа (Fe), %, не более
7. Массовая доля тяжелых металлов (Pb), %, не более
8. Растворимость в воде
Должен выдерживать испытание по п.3.10
9. Смешиваемость с бензолом или хлороформом
Должен выдерживать испытание по п.3.11
(Измененная редакция, Изм. N 1, 2).
2а. ТРЕБОВАНИЯ БЕЗОПАСНОСТИ
2а.1. Хлористый ацетил обладает общетоксическим действием на организм человека. Оказывает раздражающее действие на кожу и слизистые оболочки глаз, верхние дыхательные пути.
2а.2. Помещения, в которых проводится работа с препаратом, должны быть оборудованы непрерывно действующей приточно-вытяжной вентиляцией. Анализ препарата необходимо проводить в вытяжном шкафу.
При работе с хлористым ацетилом следует применять индивидуальные средства защиты.
Для тушения загоревшегося препарата используют пенные составы (химическую воздушно-механическую высокократную пену).
2а.4. Разлитый хлористый ацетил засыпают сухими опилками, собирают совком в герметичную тару и отправляют на сжигание.
Разд.2а. (Введен дополнительно, Изм. N 2).
2. ПРАВИЛА ПРИЕМКИ
2.2. Массовые доли нелетучего остатка, тяжелых металлов, смешиваемость с бензолом или хлороформом и плотность изготовитель определяет периодически в каждой 20-й партии.
Разд.2. (Измененная редакция, Изм. N 2).
3. МЕТОДЫ АНАЛИЗА
При взвешивании применяют лабораторные весы общего назначения 2-го класса точности с наибольшим пределом взвешивания 200 г и ценой деления 0,1 мг и 3-го класса точности с наибольшим пределом взвешивания 500 г или 1 кг и ценой деления 10 мг или 4-го класса точности с наибольшим пределом взвешивания 200 г и ценой деления 1 мг.
Допускается применение импортной лабораторной посуды и аппаратуры с техническими и метрологическими характеристиками, а также реактивов по качеству не ниже отечественных.
(Введен дополнительно, Изм. N 2).
3.1. Пробы отбирают по ГОСТ 3885-73. Масса средней пробы не должна быть менее 500 г.
(Измененная редакция, Изм. N 2).
3.2. Определение массовой доли хлористого ацетила
3.2.1. Аппаратура, реактивы и растворы
колба Кн-1-100-14/23 ТХС или Кн-2-250-19/26 (24/29) ТХС, по ГОСТ 25336-82;
пипетки 4(5)-2-1(2), 6(7)-2-10 и 2-2-10 по ГОСТ 20292-74;
способ получения ацетилхлорида
Изобретение относится к технологии получения ацетилхлорида, применяющегося в производстве красителей, лекарственных средств и других органических продуктов. Ацетилхлорид получают действием уксусной кислоты на бензальхлорид или кубовые остатки производства хлористого бензила, содержащие не менее 38% бензальхлорида. Процесс ведут при температуре 90-125 o С в течение 5,0-8,0 ч в присутствии 0,15-0,4 мас.% хлористого алюминия, хлорного железа или хлористого цинка. Конечный продукт выделяют перегонкой. В результате повышается выход ацетилхлорида. 1 табл.
Формула изобретения
Описание изобретения к патенту
Изобретение относится к области технологии получения хлорорганичесних соединений, а именно к способу получения ацетилхлорида, применяющегося в производстве красителей, лекарственных средств, а также в качестве катализатора хлорирования уксусной кислоты в производстве монохлоруксусной кислоты.
Известны способы получения ацетилхлорида взаимодействием уксусной кислоты с хлоридами фосфора [«Препаративная органическая химия», сборник под редакцией И. С.Вульфсона, Госкомиздат, М., 1959, стр. 428, И. Губен «Методы органической химии», т. Ill, выпуск 2, стр. 478] при температуре 40- 50 o C. Ацетилхлорид выделяют двухкратной перегонкой реакционной смеси и ацетилхлорида-сырца.
Недостатками способов являются невысокий выход целевого вещества (60-68% от теоретического в расчете на уксусную кислоту) и необходимость повторной перегонки ацетилхлорида для разложения эфиров фосфорной кислоты, образующихся в результате побочной реакции.
Известны способы получения ацетилхлорида взаимодействием измельченного ацетата натрия с четыреххлористым кремнием [М.М. Кацнельсон «Приготовление синтетических химико-фармацевтических препаратов», М., 1923, стр. 53], смесью хлора и сернистого ангидрида [«Химическая энциклопедия»., т. 1, М., 1988, стр. 230] и хлорокисью фосфора [Л. Геттерман, Г. Виланд » Практические работы по органической химии», Госкомтехиздат, Ленинград, 1932, стр. 93].
Недостатками способа являются нетехнологичность процессов, связанная с необходимостью обработки порошкообразного ацетата натрия газообразными хлорирующими агентами в первых двух случаях, и образование большого количества побочных продуктов во всех способах.
Недостатками указанных способов являются высокие энергетические затраты и недостаточно высокие выходы (84,2%) в первом способе, низкие выходы (50-60%), а также сложность реализации способа, вызванная разложением хлорсульфоновой кислоты в условиях реакций, во втором способе.
Описан способ получения ацетилхлорида взаимодействием винилиденхлорида с уксусной кислотой [Патент ФРГ N 2059597, 1969, кл. C 07 C].
Недостатками способа являются низкая степень конверсии винилиденхлорида (58%) и образование побочных смолообразных продуктов реакции.
Недостатками способа являются сложность аппаратурного оформления процесса и низкая селективность, приводящая к содержанию в реакционной массе до 33,4% метилхлороформа и 7,1% хлорацетилхлорида.
Недостатками способа являются невысокий выход целевого вещества, низкая селективность процесса и большое количество побочных продуктов.
Известны способы получения ацетилхлорида взаимодействием уксусного ангидрида с фосгеном в присутствии амидов [Патент США N 3318950, 1963, кл. 260-544] и солей железа [Патент США N 3337622, 1969, кл. 260-544].
Недостатками способа являются недостаточно высокий выход ацетилхлорида (до 74%) и высокая токсичность хлорирующего агента.
Недостатками способа являются сложность процесса, вызванная необходимостью работать с аппаратурой, находящейся под высоким давлением, и трудность выделения чистого ацетилхлорида из реакционной смеси в связи с близостью температур кипения компонентов и образованием азеотропных смесей.
Недостатками способа являются нетехнологичность процесса, связанная с применением пожароопасного, труднодоступного трифенилфосфина.
Выход ацетилхлорида не превышает 90,7%.
Недостатками данного способа являются недостаточно высокий выход ацетилхлорида и низкая степень использования хлора хлорирующего агента (33,3%) для получения целевого вещества.
При создании изобретения ставилась задача повысить выход ацетилхлорида и увеличить степень использования хлора хлорирующего агента для получения целевого вещества.
Используемые в процессе получения ацетилхлорида кубовые остатки производства хлористого бензила практически никогда не содержат менее 38% бензальхлорида и только этим объясняется ограничение его содержания. Конверсия бензальхлорида достигает 99%. В процессе реакции в качестве побочных продуктов образуется хлористый водород и бензальдегид, который может быть выделен перегонкой как товарный продукт.
Взаимодействие уксусной кислоты с бензальхлоридом может быть представлено следующей схемой: 
Изобретение поясняется следующими конкретными примерами.
Получают 27,4 г ацетилхлорида с содержанием основного вещества 98,6%. Выход целевого вещества составляет 97,1%.
Получают 46,0 г ацетилхлорида с содержанием основного вещества 99,0%. Выход целевого вещества 96,8%.
Выход ацетилхлорида составляет 96,0%.
Влияние условий реакции на выход ацетилхлорида приведено в таблице.
Как видно из приведенных примеров, предлагаемый способ позволяет увеличить не менее чем на 7,1% выход ацетилхлорида и использовать 50% хлора, содержащегося в бензальхлориде на получение ацетилхлорида, что на 16,7% увеличивает степень использования хлора в хлорирующем агенте для получения целевого вещества.
Лекция 25. Производные циклопентанпергидрофенантрена (стероиды)
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Производные циклопентанпергидрофенантрена (стероиды).
Производные этого класса широко представлены как биологически активные вещества, они являются незаменимыми фрагментами биологических обменных процессов в живом организме.
Структура стероидных гормонов – естественных метаболитов, выполняющих регуляторные функции в организме, включает циклопентановые и циклогексановые фрагменты. Гормоны стероидного типа, в отличие от пептидных гормонов могут проникать в клетку в виде комплекса с рецептором и воздействовать на клеточное ядро и синтез нуклеиновых кислот.
Особенность одного из представителей стероидов – холестерина является его участие в строении клеточной мембраны, которая состоит из фосфолипидных молекул, триглицеридов, жирных кислот и холестерина – именно наличием холестерина отличаются клетки эукариоты (животные клетки), от клеток прокариотов (микробные клетки).
Принято делить все производные циклопентанпергидрофенантрена на следующие классы:
1.Стероиды:
1.1.Гестагены;
1.2.Кортикостероиды;
1.3.Андрогены;
1.4.Эстрогены.
2.Сердечные гликозиды.
3.Анаболики.
4.Витамины группы D.
Общую структуру циклопентанпергидрофенантрена принято изображать следующим образом:
Вещества, содержащие эту циклическую структуру называют стеринами. По их происхождению, стерины принято подразделять:
1.Зоостерины – С27;Главным образом это холестерин. Содержатся в клетках животного происхождения.
2.Фитостерины –С28-29; Основной представитель – эргостерин. Фитостерины выделяют обычно из растительного сырья.
3.Микостерины. Стероиды, содержащиеся в клеточной стенке грибов.
Особое место среди стероидов занимают витамины группы D. Распространение и свойства. Витамин D встречается в печени разных рыб, им очень богат рыбий жир. Если пища бедна витамином D, возникает предрасположение к заболеванию рахитом. Рахит — авитаминоз детского возраста, хроническое заболевание всего организма, вызываемое расстройством солевого обмена, главным образом фосфора и кальция, в результате чего получается недостаточное отложение извести в растущих костях и неправильное их развитие.
Большое влияние на содержание витамина D в растительных и животных жирах имеет облучение ультрафиолетовыми лучами. Так, например, прованское и хлопковое масло, молоко, как свежее, так и консервированное, при получасовом облучении кварцевой лампой приобретают такие же свойства, как свежий рыбий жир. Овощи, выращиваемые в парниках, содержат меньше витамина D, чем овощи, выращиваемые на огороде, так как стекла парниковых рам не пропускают этих лучей. Отсюда понятно благоприятное влияние солнечного света на детей, больных рахитом.
Химическая природа. Доказано, что витамин D содержится в неомыляемой части рыбьего жира, куда входят так называемые стерины. Стеринами называются весьма распространенные в растительном (фитостерины) и животном (зоостерины) мире высокомолекулярные спирты, важные в физиологическом отношении, без них невозможно развитие живых клеток. Установлено, что они содержатся во всех органах, главным образом в мозговом веществе и нервной ткани. Наиболее изучен холестерин.
Холестерин был выделен из неомыляемой части рыбьего жира, который при облучении ультрафиолетовыми лучами приобретает свойства витамина D. Когда опыт был проделан с чистым препаратом холестерина, то последний свойств витамина D не получил; было установлено, что не холестерин, а что-то сопутствующее ему и удаляемое при очистке обладает способностью при облучении приобретать свойства витамина D. Вскоре был выделен часто сопутствующий холестерину эргостерин. Оказалось, что именно он приобретает свойства витамина D2 после облучения. Установлено, что для получения из холестерина активного продукта необходимо до облучения его предварительно дегидрировать. Эргостерин считают провитамином D2, а холестерин —провитамином D3. Эргостерин впервые был выделен из спорыньи; его можно изолировать также из дрожжей. Эргостерин по составу и строению, как видно из формулы близок к холестерину:
Эргостерин является провитамином D. Получают его экстракцией из дрожжей. Наиболее дешевым является мицеллий в производстве пенициллина, содержащий до 0,5% смеси стеринов. В последние годы источником стероидов служат также и растительные объекты, в частности разработаны методы получения ситолстеринов из продукции лесохимии, которая в настоящее время практически исчезла в России.
Механизм образования кальциферолов (витаминов группы D) основан на фотохимических процессах природных стеринов (эргостерин, холестерин, ситостерин и др.).
При фотолизе эргостерина происходит пространственная изомеризация при атоме С-10 и образуется люмистерин. Процесс фотолиза достаточно капризный, т.к. в молекуле имеется несколько оптически активных центров:
Дальнейший фотолиз в более жестких условиях приводит к разрыву связи С-9-С-10 и образованию тахистерина с одновременной перегруппировкой двойных связей и, наконец, к образованию эргокальциферола, имеющего экзоциклическую двойную связь:
Выход продукта сильно зависит от условий реакции: частота УФ освещения, продолжительность, растворитель и т.д. Процесс получения эргокальциферола из тахистерина может быть проведен термолизом, правда больше осмоление. При неконтролируемом фотолизе возможно образование токсичных продуктов, таких как токсистерин и супрастерин. В получаемых эргокальциферолах кольца А и С соединены между собой этиленовым мостиком с двумя экзоциклическими двойными связями, обуславливающими цис-транс-изомерию. Природные кальциферолы имеют транс-конфигурацию.
Эргокальциферол-Ergocalciferol-Витамин D2
Свойства. Белый кристаллический порошок без запаха. Неустойчив по отношению к кислороду воздуха и свету. Т.пл. 115-118°C. Удельное вращение от + 103 до + 108° (15%-ный раствор в абсолютном этаноле).
Получение. Эргокальциферол в промышленности получают полусинтетическим путем из природных стеринов. Полный синтез осуществляется из нафталина или тетралина надстраиванием циклов, однако он очень сложен и затратен. Исходным веществом служит эргостерин:
Производные эргокальциферола практически нерастворимы в воде, легко растворимы или растворимы в этаноле, мало и медленно (эргокальциферол и дигидротахистерол умеренно) в растительных маслах и очень легко в хлороформе.
Чистота и примеси. Испытания проводят на микробиологическую чистоту.
Методом ТСХ на наличие посторонних примесей. Эргокальциферол проверяют на наличие исходных веществ: эргостерина и группы восстанавливающих веществ, на вещества подобные тахистерину. Контролируют также остаточные растворители, возникающие к процессе синтеза.
Количественное определение.
1.УФ спектрофотометрия (265 нм).
2.Колориметрия (500 нм).
3.ВЭЖХ в сравнении со стандартным образцом.
Формы выпуска. Драже по 12,5 мкг; 0,5% масляный раствор во флаконах по 5 мл; 0,125% масляный раствор во флаконах по 10 мл;
Применение. Витамины группы D регулируют обмен фосфора и кальция в организме. Эргокальциферол-эффективное средство для профилактики и лечения заболеваний кожи и слизистых оболочек, их применяют при рахите, некоторых формах туберкулеза и др.
Холекальциферол-Колекальцтферол-Colecalciferol-Витамин D3
Свойства. Бесцветные кристаллы, нерастворимые в воде. Т.пл.84-86°C, удельное вращение от +105 до +112°. Малоустойчив к действию света, легко окисляется.
Получение. Получают аналогично эргокальциферолу из холестерина. Другим источником получения являются дрожжи.
Подлинность и количественное определение аналогично эргокальциферолу.
Формы выпуска. Масляный раствор 0,5 мг в 1 мл, таблетки 0,025 мг. Применяют внутрь и внутримышечно. Синоним Вигантол (ФРГ).
Применение. Для лечения и профилактики рахита,спазмофилия, остеомаляция.
Дигидротахистерол-Dihydrosterol
(5Е, 7Е, 22Е)-(3S,10S)-9,10-секоэргоста-5,7,22-триен-3β-ол
Свойства. Белые кристаллы или белый кристаллический порошок без запаха. Т.пл. 125-132 °C или 112-114°C. Удельное вращение от +100 до +103°(2%-ный раствор в этаноле).
Получение. Получают фотохимической изомеризацией из цис– тахистерина:
Количественное определение.
1.УФ спектрофотометрия при 251 нм.
2.ВЭЖХ.
Посторонние примеси. ВЭЖХ и ТСХ.
Формы выпуска. 0,15 раствор в масле для приема внутрь.
Применение. Лечение и профилактика рахита.
Альфакальцидол-Alfacalcidol
Свойства. Бесцветные кристаллы или белый кристаллической порошок. Неустойчив по отношению к свету и кислороду воздуха. Т.пл. 137-144°C.
Получение.
Подлинность.
1.ИК спектр.
2.УФ спектр. Имеет максимум поглощения при 265 нм.
3.ТСХ.
Количественное определение.
1.УФ спектрофотометрия.
2.ВЭЖХ.
Форма выпуска. Капсулы по 0,001; 0,0005; 0,00025 г; раствор в масле 0,0009%.
Применение. Аналогично всем витаминам группы D.
Карденолиды (гликозиды сердечного действия).
Пo химической структуре сердечные, как и другие, гликозиды представляют собой эфиры, в молекулах которых гликозидной связью связаны между собой агликон и остатки моно-, ди-, три- или тетрасахарида. У некоторых первичных гликозидов к сахарному компоненту присоединен остаток уксусной кислоты. Сахара, входящие в состав сердечных гликозидов, за исключением глюкозы и рамнозы, специфичны для данной группы веществ и представляют собой 6-дезоксигексозы или их 3-О-метиловые эфиры. Из сердечных гликозидов выделено более 50 углеводов. Важнейшими моносахаридами, входящими в состав сердечных гликозидов, являются:
Агликоны (генины) сердечных гликозидов имеют стероидную структуру, т. е. являются производными циклопентанпергидрофенантрена. Они представляют собой ненасыщенные стероидные лактоны. По химическому строению агликоны можно разделить на две группы, отличающиеся структурой присоединенного в положении 17 лактонного цикла, который обычно занимает β-конфигурацию. Пятичленный лактонный цикл входит в структуру агликонов карденолидов, а шестичленный — буфадиенолидов. В отличие от большинства других стероидов кольца С и D в карденолидах и буфадиенолидах имеют цис-сочленение, а кольца А и В могут иметь как цис- так и транс-сочленение. Кольца В и С всегда имеют транс-сочленение. Общие формулы этих групп гликозидов:
В стероидной части молекулы могут также быть кето-, ацильные, эпоксигруппы, изолированные С=С связи.
Карденолиды содержатся в различных видах наперстянки, строфанта, ландыша, желтушника, олеандра, горицвета весеннего и др. Буфадиенолиды входят в состав морозника, морского лука, а также найдены у животных (жабы).
Между химической структурой и фармакологическим действием сердечных гликозидов существует определенная взаимосвязь. Носителем биологической активности является агликон. Сахарный компонент, присоединенный в положении 3 к агликону, влияет на скорость всасывания, а следовательно, на продолжительность действия. Чем больше остатков моносахаридов в молекуле гликозида, тем активнее он действует.
Специфическое действие гликозида на сердце (замедление частоты и усиление сердечных сокращений) обусловлено наличием в молекуле агликона пяти- или шестичленного лактонного цикла, присоединенного в положении 17, и гидроксила в положении 14. На кардиотоническое действие большое влияние оказывает заместитель в положении 10. Большая часть агликонов в этом положении имеет метильную или альдегидную группу. Окисление альдегидной группы до карбоксильной значительно ослабляет действие на сердечную мышцу. Замена стероидного цикла агликонов производными бензола, нафталина, так же как замена лактонного цикла другими радикалами и даже изменение характера связи между стероидным ядром и лактоном, приводит к потере фармакологической активности.
Большинство сердечных гликозидов по химическому строению представляют собой карденолиды. Их агликоны имеют общую формулу и отличаются друг от друга радикалами R, Х1,Х2,Х3: