ацетон почему так называется
про Ацетон!
Для начала немного теории.
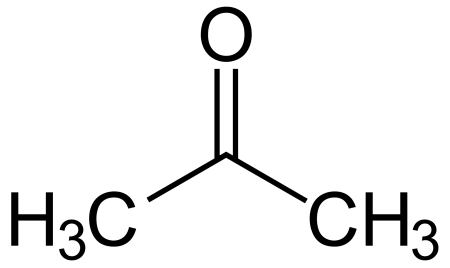
Ацетон — (диметилкето́н, систематическое наименование: пропано́н) — простейший представитель кетонов. Формула: CH3-C(O)-CH3. Бесцветная легкоподвижная летучая жидкость с характерным запахом. При 20°C растворимость газа О2: 3,1 мл на 100 мл воды, 22 мл на 100 мл этанола, 23,1 мл на 100 мл ацетона. Полностью смешивается с водой и большинством органических растворителей. Ацетон хорошо растворяет многие органические вещества (ацетилцеллюлозу и нитроцеллюлозу, воск, резину и др.), а также ряд солей (хлорид кальция, иодид калия).
3. Ацетон растворяет всякое разное гумно. Это гумно нагарает на свечах и форсунках. По сравнению с использованием спец. чистящих средств, ацетон более мягко отчищает элементы двигателя и на нем можно ездить каждый день, а не ставить машину на сервис для чистки. Он всегда присутствует в системе не давая образоваться новому налету гумна.
4. Ацетон отлично смешивается с самим бензином из-за схожей плотности (Плотность бензина = 0,75 г/см³, плотность ацетона = 0,78 г/см³).
5. Безопасность для двигателя.
Температура горения ацетона в 10 раз ниже чем у бензина, что благотворно сказывается на работе самого двигателя при высоких нагрузках.
Плюсы ацетона в бензе:
Меньше риск детонации (повышения октанового числа)
Удаление гумна на свечах и форсунках
Удаление воды из системы
Понижение расхода
Более ровная работа на холостых
Повышается тяга на низах
Далее я расскажу о Применении.
Дозировка.
Я лью на полный бак 300-350 мл.
При единичной заправке на 15 литров я сначала плескаю 70-100 мл ацетона. Потом лью бенз чтобы лучше перемешалось.
Покупка.
Покупаем чистый технический ацетон без присадок и добавок. Тупо ацетон.
Стоит рублей 70 бутылка 500 мл.
Вроде все рассказал.
Статья принадлежит мне! © Роман Гришин. :))) woltswagin
Ацетон
| Ацетон | |
|---|---|
 | |
 | |
| Систематическое наименование | пропан-2-он |
| Традиционные названия | ацетон, диметилкетон |
| Хим. формула | C3H6O |
| Рац. формула | CH3—C(O)—CH3 |
| Состояние | жидкость |
| Молярная масса | 58,08 г/моль |
| Плотность | 0,7899 г/см³ |
| Энергия ионизации | 9,69 ± 0,01 эВ |
| Т. плав. | −95 °C |
| Т. кип. | 56,1 °C |
| Т. всп. | −20 °C |
| Т. свспл. | 465 ± 1 градус Цельсия |
| Пр. взрв. | 2,5 ± 0,1 об.% |
| Кр. точка | 235,5°C; 4.7МПа |
| Энтальпия образования | −216,5 кДж/моль |
| Энтальпия плавления | 5,69 кДж/моль |
| Давление пара | 180 ± 1 мм рт.ст. |
| pKa | 19,16 ± 0,04 |
| Показатель преломления | 1,3588 |
| ГОСТ | ГОСТ 2603-79 ГОСТ 2768-84 |
| Рег. номер CAS | 67-64-1 |
| PubChem | 180 |
| Рег. номер EINECS | 200-662-2 |
| SMILES | |
| RTECS | AL3150000 |
| ChEBI | 15347 и 40571 |
| Номер ООН | 1090 |
| ChemSpider | 175 |
| ЛД50 | 1159 мг/кг |
| Токсичность | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Ацетон (диметилкетон, пропанон-2) — органическое вещество, имеющее формулу CH3—C(O)—CH3 (C3H6O), простейший представитель насыщенных кетонов.
Своё название ацетон получил от лат. acetum — уксус. Это связано с тем, что ранее ацетон получали из ацетатов, а из самого ацетона получали синтетическую ледяную уксусную кислоту. В 1848 году немецкий профессор медицины и химии Леопольд Гмелин ввёл термин в официальное употребление, использовав старое немецкое слово Aketon (кетон, ацетон), которое также берёт корни от латинского acetum.
Содержание
Открытие
Один из простейших и в то же время важнейших из кетонов — ацетон — впервые выявлен в 1595 году немецким химиком Андреасом Либавием в процессе сухой перегонки ацетата свинца. Однако точно определить его природу и химический состав удалось только в 1832 году Жану-Батисту Дюма и Юстусу фон Либиху. До 1914 года ацетон получали практически исключительно коксованием древесины, однако повышенный спрос на него в годы Первой мировой войны очень быстро стимулировал создание новых методов производства.
Физические свойства
Ацетон — бесцветная подвижная летучая жидкость (при н.у.) с характерным резким запахом. Во всех соотношениях смешивается с водой, диэтиловым эфиром, бензолом, метанолом, этанолом, многими сложными эфирами и так далее.
Основные термодинамические свойства ацетона:
Ацетон хорошо растворяет многие органические вещества, в частности, ацетил- и нитроцеллюлозы, воски, алкалоиды и так далее, а также ряд солей.
Ацетон образуется при ацетоновом (ацетон-бутиловом) брожении углеводов, вызываемом Clostridium acetobutylicus. В результате образуется ацетон и бутанол-1, а также ряд побочных примесей. В качестве промышленного такой метод получения ацетона был популярен в XIX — начале XX вв., но был вытеснен технологиями химического синтеза.
Химические свойства
Ацетон является одним из наиболее реакционноспособных кетонов. Так, он один из немногих кетонов образует бисульфитное соединение:
Под действием щелочей вступает в альдольную самоконденсацию, с образованием диацетонового спирта:
Восстанавливается цинком до пинакона:
При пиролизе (700 °C) образует кетен:
Легко присоединяет циановодород с образованием ацетонциангидрина:
Атомы водорода в ацетоне легко замещаются на галогены. Под действием хлора (иода) в присутствии щёлочи образует хлороформ (йодоформ).
Hal2 + 2NaOH ⟶ NaHal + NaOHal + H2O
Качественной реакцией на диметилкетон есть наличие интенсивно-красной окраски с нитропруссидом натрия в щелочной среде. При добавлении CH3COOH окраска переходит в красно-фиолетовую.
Получение
Мировое производство ацетона составляет более 6,9 миллионов тонн в год (по данным на 2012 г.) и устойчиво растёт.
В промышленности получается напрямую или косвенно из пропена.
Основную часть ацетона получают как сопродукт при получении фенола из бензола по кумольному способу. Процесс протекает в 3 стадии.
На первой стадии бензол алкилируется пропеном с получением кумола, на второй и третьей (реакция Удриса — Сергеева) полученный кумол окисляется кислородом воздуха до гидропероксида, который при действии серной кислоты разлагается на фенол и ацетон:
По данному методу изопропанол окисляют в паровой фазе при температурах 450—650 °C на катализаторе (металлические медь, серебро, никель, платина). Ацетон с высоким выходом (до 90 %) получают на катализаторе «серебро на пемзе» или на серебряной сетке:
Ацетон получают также прямым окислением пропена в жидкой фазе в присутствии PdCl2 в среде растворов солей Pd, Cu, Fe при температуре 50-120 °C и давлении 50-100 атм:
Некоторое значение имеет метод брожения крахмала под действием бактерий Clostridium acetobutylicum с образованием ацетона и бутанола. Метод характеризуется малыми выходами. Используются также методы получения из изопропилового спирта и ацетилена.
Применение
Ацетон применяется как сырьё для синтеза многих важных химических продуктов, таких как уксусный ангидрид, кетен, диацетоновый спирт, окись мезитила, метилизобутилкетон, метилметакрилат, дифенилпропан, изофорон, бисфенол А и так далее; пример:
Последний широко применяется при синтезе поликарбонатов, полиуретанов и эпоксидных смол.
Ацетон также является популярным растворителем. В частности он используется как растворитель
Без ацетона невозможно хранить в компактном (сжиженном и в баллоне) состоянии ацетилен, который под давлением в чистом виде крайне взрывоопасен. Для этого используют ёмкости с пористым материалом, пропитанным ацетоном. 1 литр ацетона растворяет до 250 литров ацетилена.
Ацетон используется также при экстракции многих растительных веществ.
Ацетон служит также сырьём для синтеза уксусного ангидрида, кетена, диацетонового спирта и многих других соединений.
Лабораторное применение
В органической химии ацетон применяется в качестве полярного апротонного растворителя, в частности, в реакции алкилирования
для окисления спиртов в присутствии алкоголятов алюминия по Оппенауэру
Ацетон применяется для приготовления охлаждающих бань в смеси с «сухим льдом» и жидким аммиаком (охлаждает до температуры −78 °C).
В лабораториях используется для мытья химической посуды благодаря низкой цене, малой токсичности, высокой летучести и лёгкой растворимости в воде, а также для быстрой сушки посуды и неорганических веществ.
Для очистки в лабораторных условиях ацетон перегоняют в присутствии небольшого количества перманганата калия (до слабо-розовой окраски раствора).
Обнаружение
В химико-токсикологическом анализе для обнаружения ацетона применяют реакции с растворами йода, нитропруссида натрия, фурфурола, ο-нитробензальдегида и метод микродиффузии.
Реакция на образование йодоформа.
При взаимодействии ацетона с раствором йода в щелочной среде образуется трииодметан (йодоформ):
К 1 мл исследуемого раствора прибавляют 1 мл 10%-го раствора аммиака и несколько капель раствора йода в йодиде калия (йодной настойки). В присутствии йода образуется желтый осадок трииодметана с характерным запахом, а его кристаллы имеют характерную гексалучевую форму. Предел обнаружения — 0,1 мг ацетона в пробе.
Реакция с нитропруссидом натрия (проба Легаля).
Ацетон с нитропруссидом натрия в щелочной среде дает интенсивно-красную окраску. При подкислении уксусной кислотой окраска переходит в красно-фиолетовую. Кетоны, в молекулах которых отсутствуют метильные группы, непосредственно связанные с кетоновыми (СО—) группами, не дают такой реакции. Соответственно такие кетоны как метилэтилкетон, метилпропилкетон и другие — также дадут красную окраску с нитропруссидом.
К 1 мл исследуемого раствора прибавляют 1 мл 10%-го раствора гидроксида натрия и 5 капель 1%-го свежеприготовленного раствора нитропруссида натрия. При наличии ацетона в пробе появляется красная или оранжево-красная окраска. При прибавлении 10%-го раствора уксусной кислоты до кислой реакции через несколько минут окраска переходит в красно-фиолетовую или вишнёво-красную. Следует заметить, что бутанон дает аналогичную окраску с нитропруссидом натрия.
Пожароопасность
Одна из основных опасностей при работе с ацетоном — его легковоспламеняемость. Температура самовоспламенения +465 °C, температура вспышки −20 °C. Воздушные смеси, содержащие от 2,5 % до 12,8 % (по объёму), взрывоопасны. С этим необходимо считаться, так как ацетон быстро испаряется, и образующееся облако может распространиться до места воспламенения (нагрев или искра) вдали от места работы с ним.
Метаболизм и токсикология
Ацетон является естественным метаболитом, производимым организмами млекопитающих, в том числе и человеческим организмом. Некоторое количество вещества выводится с выдыхаемым воздухом и выделениями кожи, некоторое — с мочой. В медицине ацетон относят к кетоновым телам. Нарушение нормального метаболизма, например, при сахарном диабете, приводит к так называемой ацетонурии — избыточному образованию и выведению ацетона.
В крови в норме содержится 1-2 мг/100 мл ацетона, в суточном количестве мочи — 0,01-0,03 г. При нарушениях обмена веществ, например, при сахарном диабете, в моче и крови повышается содержание ацетона. Незначительная часть ацетона превращается в оксид углерода (IV), который выделяется с выдыхаемым воздухом. Некоторое количество ацетона выделяется из организма в неизменном виде с выдыхаемым воздухом и через кожу, а некоторое — с мочой.
Ацетон ядовит, но относится к малоопасным веществам (класс опасности IV, категория безопасности для здоровья по NFPA — 1). Сильно раздражает слизистые оболочки: длительное вдыхание больших концентраций паров приводит к возникновению воспаления слизистых оболочек, отёку лёгких и токсической пневмонии. Пары оказывают слабое наркотическое действие, сопровождаемое, чаще всего, дисфорией. При попадании внутрь вызывает состояние опьянения, сопровождаемое слабостью и головокружением, нередко — болями в животе; в существенных количествах возникает выраженная интоксикация, хотя, как правило, отравления ацетоном не смертельны. Возможно поражение печени (токсический гепатит), почек (уменьшение диуреза, появление крови и белка в моче) и коматозное состояние. При ингаляционном воздействии ацетон выводится гораздо медленнее (в течение нескольких часов), чем поступает, и поэтому может накапливаться в организме.
АЦЕТОН
АЦЕТОН (латинский acetum уксус; диметилкетон; CH3COCH3) — органическое вещество; простейший представитель класса кетонов. В организме человека и животных ацетон является промежуточным продуктом обмена веществ: определяется в составе кетоновых тел.
Действие ацетона на организм
Ацетон обладает возбуждающим и наркотическим действием, поражает центральную нервную систему; токсический эффект в связи со способностью ацетона накапливаться в организме зависит не только от концентрации, но и от времени действия. Отравление ацетоном сопровождается ощущением жара, головокружением, обмороками; появляются конъюнктивиты, дерматиты, а также катары верхних дыхательных путей.
В промышленных условиях при длительной работе с ацетоном возможны случаи хронического отравления.
Как правило, в организме человека находятся лишь следы ацетона, но при различных нарушениях обмена (например, сахарный диабет) Ацетон появляется в крови и моче больных (см. Ацетонемия, Ацетонурия).
Ацетон в моче или других жидкостях качественно определяют реакциями с нитропруссидом натрия (красное окрашивание в щелочной среде, не исчезающее при подкислении уксусной кислотой — проба Легаля) и по образованию йодоформа с раствором йода в йодистом калии — проба Либена.
Ацетон в судебно-медицинском отношении
Ацетон в судебно-медицинском отношении имеет значение при острых отравлениях, например, при употреблении его как суррогата алкоголя. При вскрытии: запах ацетона, признаки асфиксии, отек и полнокровие мозга и его оболочек, отек и полнокровие легких, кровоизлияния в слизистую оболочку желудочно-кишечного тракта; микроскопически — зернистая дистрофия миокарда, печени, почек.
Судебно-химическим исследованием определяется в мозге, селезенке, печени, легких, почках.
Библиография: Вайсбергер А. и др. Органические растворители, пер. с англ., с. 128, М., 1958; Вредные вещества в промышленности, под ред. Н. В. Лазарева, ч. 1, с. 389, Л., 1971;Физер Л.и Физер М. Органическая химия, пер. с англ., т. 1, М., 1969.
М. А. Чельцова, Я. С. Смусин (суд.-мед.).
Ацетон – физические характеристики, химические и биологические свойства, применение
Ацетон – это вещество органического происхождения, представляющее собой летучую жидкость с характерным запахом уксуса. Формула ацетона CH3 – C(O) – CH3.
Диметилкетон в печени млекопитающих образуется как продукт метаболизма и входит в состав кетоновых тел, поддерживающих энергетический баланс. При нарушении обменных процессов концентрация компонента возрастает. Ацетон легко смешивается с водой и растворителями, характеризуется невысокой токсичностью, используется во многих отраслях промышленности, в лабораторных синтезах.
История открытия
Углеродистое соединение из группы кетонов получил в конце XVI столетия при нагревании ацетата цинка без доступа кислорода химик из Германии Андреас Либавиль Описали свойства, определили природу вещества, присвоили ацетону систематическое название пропан-2-он в 1832 г. ученые Юстус фон Либих и Дюма Жан-Батист. Официальный термин Aceton ввел немецкий профессор Леопольд Гмелин спустя 16 лет.
Продолжительный период ацетон получали при сухой перегонке древесины, а новые методы производства диметилкетона стали применяться в годы I Мировой войны, когда резко возросла потребность в слезоточивых газах.
Способы получения
Для выделения ацетона чаще применяют кумольный метод, включающий 3 этапа. В начальной стадии при повышенной температуре и в присутствии катализатора, создаваемого в отдельном реакторе путем смешивания серной кислоты с фенолом, и выдерживании при 60–80%, происходит разложение пропена до гидропероксида кумола:
На следующих двух этапах путем гидролиза полученных веществ в кислой среде при нагревании до 90° и добавлении небольшого количества воды образуется 2 компонента – ацетон и фенол:
Применение кумольного способа помогает уменьшить выделение диметилкетона, негативно влияющего на качество фенола.
Получают ацетон в газовой фазе, окисляя изопропанол или вторичный одноатомный спирт при 450–600°:
Для ускорения реакции используют металлы типа:
Ацетон выделяли при брожении крахмала с помощью анаэробных микроорганизмов из рода клостридий. В результате реакции наблюдался малый выход пропанона, и для покрытия потребности стали отдавать предпочтение химическому синтезу.
Чтобы выделить диметилкетон, в жидкой фазе проводят окисление пропена в растворах солей железа, меди, палладия под давлением от 50 до 100 атм. Синтезируют пропан-2-он из ацетилена и изоприлового спирта.
При применении технологии перегонки ацетатов кальция, алюминия, получаемых при взаимодействии извести и уксуса из древесины, в ацетоне оставалось много примесей, и от данного метода со временем отказались.
Физические свойства и характеристики
Бесцветная жидкость растворяет соли калия и кальция, резину, жиры, соединяется с водой, в соответствии с ГОСТом содержит от 99,5% ацетона, 0,15 метилового спирта. Плотность органического вещества составляет от 0,78,9 до 79,1 г/ куб. см. Диметилкетон имеет следующие термодинамические характеристики:
Показатель
Единица измерения
Значение
Поверхностное натяжение при 20°C
В нормальном состоянии ацетон, рациональная формула которого обозначается в виде CH3 – C(O) – CH3, является бесцветной жидкостью с динамической вязкостью 0,36 (при 10°C), при 41 градусе по Цельсию – 0,28.
Пары ацетона раздражают конъюнктиву глаз, всасываются при вдыхании через кожу, вызывая при продолжительном контакте симптомы дерматита. Диметилкетон негативно действует на пищеварительные органы, печень, быстро загрязняет воздух, при распылении, испаряется при +20. При соприкосновении с перекисью, азотной и уксусной кислотой ацетон, который относят к III классу огнеопасности, образует взрывчатые соединения, при взаимодействии с хлороформом провоцирует возгорание, появление пожара.
Показатель преломления пропанона при 20° составляет 1,359, при 25 –1,3588
Ацетон приобретают для хранения ацетилена, применяемого при сварке и резке металлов, горючий газ держат в пористой таре, пропитанной диметилкетоном. Один литр летучего средства способен растворить 250 г непредельного углеводорода.
Химические свойства
Среди всех представителей группы насыщенных кетонов ацетон обладает наибольшей способностью вступления в реакцию. Диметилкетон с химической формулой C3H6O содержится в промышленных растворителях, но испаряется быстрее и легче такой продукции.
При термическом разложении, что происходит при температуре, превышающей 700°, ацетон преобразуется в бесцветные газы в виде метана и кетена.
При взаимодействии с цианистым водородом диметилкетон образует ацетонциангидрид–разлагаемый в кислотах продукт, что применяется как сырье для акрила, а также в производстве:
В щелочной среде ацетон вступает в химическую реакцию альдольной самоконденсации, при которой образуется растворитель, обладающий свойствами спирта и кетона. Для придания блеска и формирования защитной пленки пропан-2-он добавляют в лакокрасочные материалы, что производятся на основе эфира целлюлозы.
Ацетон образует кристаллические вещества, что растворяются в кислотах, в щелочах металлов и распадаются на альдегиды и кетоны.
Под действием хлора диметилкетон, атомы водорода в котором замещаются галогенами, преобразуется в трихлорметан. В щелочной среде йод превращает ацетон в желтый кристаллический порошок трийодметана, которым дезинфицируют гнойные раны, обеззараживают эрозии, язвы.
Биологические свойства
Ацетон вырабатывается в организме животных и человека, синтезируется в результате метаболизма. В норме содержание вещества на 100 мл крови не превышает 2 г, небольшая часть ацетона выделяется с мочой. Растет уровень диметилкетона при нарушении обмена веществ, у больных сахарным диабетом, после тяжелых физических нагрузок, голодания. При содержании компонента в дозе, превышающей 60 мл, поражаются почки, возникает опасность появления изменений в легких.
Малая часть ацетона, присутствующего в крови, преобразуется в углекислоту и выделяется с воздухом, выдыхаемым человеком, небольшая доля диметилкетона в неизменном состоянии уходит с мочой, потом.
Особенности очистки
В техническом ацетоне содержится вода и другие компоненты, а в соответствии с ГОСТом для продажи годится продукт с примесями до 0,1%. Чтобы определить наличие восстановителей, в 10 мм диметилкетона капают жидкий марганцовокислый калий. Если спустя четверть часа смесь становится светлее, это указывает на то, что добавок больше нормы.
Для сушки технического ацетона используют углекислый калий. Раствор хорошо нагревают в течение нескольких часов, охлаждают и опять пропускают над свежим поташом.
Для получения диметилкетона высокой степени очистки при 25 или 30° его насыщают порошком иодида натрия. Смесь сливают и охлаждают до 10 градусов, чтобы убрать кристаллы, пропускают через фильтр. Соль помещают в колбу и нагревают. Ацетон отправляют в перегонную емкость, где очищают от оставшегося дистиллята.
Применение
Характеристики диметилкетона, доступная цена позволяют использовать едкое средство во многих сферах деятельности человека.
В лабораторных условиях
Ацетоном, который имеет низкую токсичность, хорошо растворяется в воде, моют химическую посуду. С помощью диметилкетонв сушат пробирки, колбы, другие емкости. При окислении спиртов в процессе введения алкильного заместителя в молекулу, ацетону отводится основная роль.
Диметилкетон соединяют с жидким аммиаком, сухим льдом и при 78° и создают охлаждающие бани.
В промышленности
Не обходится без технического ацетона, который на предприятия поставляется в цистернах, в бутылях и бочках, производство нитрокрасок, эмали. Лак, в который наливают быстро испаряющийся пропанон, моментально сохнет, образует эластичную пленку и поступает на обувные фабрики, в авиастроение, в автомобильные корпорации.
Пока не удалось найти, чем заменить ацетон в производстве:
В пищевой промышленности диметилкетон используется при создании добавок, улучшающих вкус выпечки, сладостей, при выделении экстрактов, при изготовлении ряда жиров. Ацетон принимает участие в синтезировании ароматических соединений, добавляемых в туалетную воду, одеколон, духи, поэтому заказывается компаниями, выпускающими парфюмерию.
Для обработки нитроцеллюлозы, из которой делают вискозу, для обеззараживания шерсти и меха, заказывают ацетон текстильные и швейные фабрики. Входит летучий пропанон в средства, с помощью которых окрашивают ткани, наносят узоры, печатают рисунки.
В качестве вспомогательных компонентов ацетон присутствует в обезболивающих препаратах, используется фармацевтическими компаниями для извлечения из растительного сырья многих вытяжек, основных экстрактов, для производства пленок, что накладывают на швы, раны.
Покупают технический ацетон фирмы, которые выпускают:
Не обходятся без диметилкетона в ряде других промышленных отраслей – в электронике, в производстве пороха, чернил. Покупают не один литр ацетона, а тонны предприятия, где делают сигареты.
В быту
Средством, которое стоит дешевле пятновыводителей, убирают следы от краски на покрывалах коврах, одежде, не затрагивая структуру, очищают застывший силикон, засохший клей, воск. Вместо дорогого растворителя ацетоном обезжиривают металлические поверхности, керамику перед нанесением лака, бетон и дерево обрабатывают до покраски. Для удаления потертостей на кафельной плитке, ламинате средством смачивают бумажное полотенце и аккуратно протирают. Чтобы избавиться от пятен кофе или чая, в чашку наливают 2 ч. ложки растворителя и очищают следы губкой.
Владельцы автомобилей добавляют пропанон в бензобак, что помогает улучшить характеристики двигателя. Ацетоном вытирают нагар, оседающий на свечах, на поверхности форсунок, удаляют конденсат. Поскольку в данном средстве высокая концентрация кислорода, улучшается сгорание топлива, уменьшается потребление бензина
Как выявляют ацетон
Чтобы обнаружить диметилкетон в биохимическом анализе, применяют метод микродиффузии и реакции, в которых участвуют растворы фурфурола, нитропруссида натрия, нитробензальдегида.
В 1 миллилитр исследуемого состава прибавляют такое же количество жидкого 10% аммиака и 2 или 3 капли йодной настойки. В пробе, где появляется осадок трийодметана с характерным запахом, окрашенный в желтый цвет, обнаруживают максимум 0,1 г ацетона.
При взаимодействии диметилкетона с нитропруссидом натрия в щелочной среде раствор приобретает выраженный красный оттенок, при добавлении этановой кислоты становится фиолетовым, что свидетельствует о наличии ацетона.
На присутствие диметилкетона указывает оранжевый оттенок, который исследуемый раствор приобретает при добавлении производных натрия, с уксусной эссенцией окрашивается в вишневый цвет.
Меры предосторожности при работе
В небольших объемах у ацетона низкая токсичность, высококонцентрированное средство раздражает кожу, провоцирует жжение в глазах. Если приходится контактировать на работе с данным веществом продолжительное время, рекомендуют соблюдать правила предосторожности, надевать перчатки, защищать бронхи, горло с помощью респиратора, при попадании растворителя на кожу смывать водой.
Хотя ацетон является малоопасным для здоровья, при вдыхании большого объема паров:
В условиях продолжительной работы и попадании внутрь организма высококонцентрированных паров ацетон действует подобно наркотику. Человек жалуется на слабость и головокружение, состояние опьянения, возникновение дискомфорта в животе. Интоксикация ацетоном обычно не заканчивается смертельным исходом, но оказывает негативное действие на легкие, поражает почки, приводит к появлению крови в моче, к временной утрате ориентации в пространстве.
При вдыхании ацетон выводится длительный период, что чреватом накапливанием в тканях и органах, а это представляет опасность для здоровья. В России оборот диметилкетона контролируется, данное вещество включено в таблицу Перечня наркотических и психотропных средств и прекурсоров. В химических лабораториях поступление и расход материала заносят в журнал регистрации.




