ацетонемический синдром у ребенка что это такое
Ацетонемический синдром
Что делать если у ребенка развивается ацетонемический синдром? Причины и рекомендации по лечению
Ацетонемический синдром выражается симптомами, которые спровоцированы сбоем в обмене веществ. Появляется неприятное состояние при накоплении в крови кетоновых тел. Часто могут возникать ацетонемические кризы: дегидратация, многократная рвота, запах ацетона изо рта, субфебрилитет, абдоминальный синдром.
Недуг диагностируют на основе некоторых симптомов, а также анализов – определяют кетонурию, повышенный уровень мочевины, нарушение электролитного баланса. В случае ацетонемического криза важно как можно раньше для ребенка провести инфузионную терапию, поставить очистительную клизму, посадить его на диету, в которой будут легкоусвояемые углеводы.
Что это такое?
Ацетонемический синдром — это состояние, возникающее при нарушении обменных процессов в организме ребенка, своего рода сбой в процессах метаболизма. При этом никаких пороков развития органов, нарушения в самом их строении не выявляется, просто функционирование, например, поджелудочной железы и печени не отрегулировано.
Сам же этот синдром является одним из проявлений так называемой нервно-артритической аномалии конституции (нервно-артритический диатез — старое название этого же состояния). Это определенный набор черт характера в сочетании с определенной работой внутренних органов и нервной системы ребенка.
Причины возникновения
Чаще возникает ацетонемический синдром у детей, но встречается и у взрослых. К его причинам можно отнести:
У младенцев подобное состояние может быть следствием позднего гестоза беременной или нефропатии.
Внешние факторы, вызывающие ацетономический синдром:
У взрослых наиболее часто накопление кетоновых тел вызывается сахарным диабетом. Недостаток инсулина блокирует поступление в клетки органических систем глюкозы, которая накапливается в организме.
Симптомы
Ацетонемический синдром часто встречается у детей с аномалиями конституции (нервно-артритическим диатезом). Таких детей отличает повышенная возбудимость и быстрая истощаемость нервной системы; они имеют худощавое телосложение, часто излишне пугливы, страдают неврозами и беспокойным сном.
В то же время у ребенка с нервно-артрической аномалией конституции быстрее сверстников развиваются речь, память и другие познавательные процессы. Дети с нервно-артрическим диатезом склонны к нарушению обмена пуринов и мочевой кислоты, поэтому в зрелом возрасте подвержены развитию мочекаменной болезни, подагры, артритов, гломерулонефрита, ожирения, сахарного диабета второго типа.
Симптомы ацетонемического синдрома:
Зачастую симптомы ацетонемического синдрома возникают при нарушении питания – малое количество в рационе углеводов и преобладание в нем кетогенных и жирных аминокислот. У детей ускоренный метаболизм, и еще недостаточно адаптирована пищеварительная система, вследствие чего происходит снижение кетолиза – замедляется процесс утилизации кетоновых тел.
Диагностика синдрома
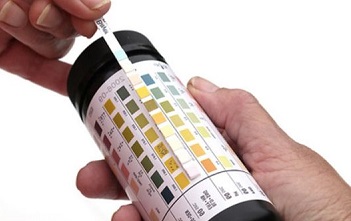
Сами родители могут провести экспресс-диагностику на определение ацетона в моче — в этом могут помочь специальные диагностические полоски, которые продаются в аптеке. Их нужно опустить в порцию мочи и, воспользовавшись специальной шкалой, определить уровень ацетона.
В лаборатории в клиническом анализе мочи наличие кетонов определяется от «одного плюса» (+) до «четырех плюсов» (++++). Легкие приступы — уровень кетонов на +или ++, тогда ребенка можно будет полечить и дома. «Три плюса » соответствуют повышению уровня кетоновых тел в крови в 400 раз, а четыре — в 600 раз. В этих случаях требуется госпитализации в стационар — такое количество ацетона опасно развитием комы и повреждением мозга. Врач непременно должен определить природу ацетонемического синдрома: первичный ли он, или вторичный — развился, например, как осложнение диабета.
На международном педиатрическом консенсусе в 1994 году врачи определили специальные критерии постановки такого диагноза, они разделяются на основные и дополнительные.
К дополнительным критериям относят:
Диагноз ставится еще и при исключении диабетического кетоацидоза (осложнения диабета), острой хирургической патологии ЖКТ — перитонита, аппендицита. Исключаются и нейрохирургическая патология (менингиты, энцефалиты, отек мозга), инфекционная патология и отравления.
Как лечить ацетонемический синдром
При развитии ацетонемического криза ребенка необходимо госпитализировать. Проводят диетическую коррекцию: рекомендовано употреблять легкоусвояемые углеводы, строго ограничивают жирную пищу, обеспечивают дробное питье в большом количестве. Неплохой эффект от очистительной клизмы с гидрокарбонатом натрия, раствор которого способен нейтрализовать часть попавших в кишечник кетоновых тел. Показано проведение оральной регидратации при помощи комбинированных растворов (орсоль, регидрон и др.), а также щелочной минеральной воды.
Основные направления лечения недиабетического кетоацидоза у детей:
1) Диета (обогащённая жидкостью и легкодоступными углеводами с ограничением жиров) назначается всем пациентам.
2) Назначение прокинетиков (мотилиум, метоклопрамид), ферментов и кофакторов метаболизма углеводов (тиамин, кокарбоксилаза, пиридоксин) способствует более раннему восстановлению толерантности к пище и нормализации обмена жиров и углеводов.
3) Инфузионная терапия:
4) Этиотропная терапия (антибиотики и противовирусные препараты) назначается по показаниям.
В случаях умеренновыраженного кетоза (ацетонурия до ++), не сопровождающегося существенным обезвоживанием, водно-электролитными нарушениями и неукротимой рвотой, показана диетотерапия и оральная регидратация в сочетании с назначением прокинетиков в возрастных дозах и этиотропной терапией основного заболевания.
При лечении ацетонемического синдрома главными методами являются те, которые направлены на борьбу с кризами. Очень важно поддерживающее лечение, которое помогает снизить обострения.
Инфузионная терапия
Показания для назначения инфузионной терапии:
Перед началом проведения инфузионной терапии необходимо обеспечить надёжный венозный доступ (предпочтительнее периферический), определить показатели гемодинамики, кислотно-щелочного и водно-электролитного баланса.
Рекомендации по питанию
Продукты, которые категорически исключаются из диеты детей, страдающих ацетонемическим синдромом:
В меню диеты обязательно входят: каши из риса, овощные супы, картофельное пюре. Если в течение недели симптомы не вернулись, можно постепенно добавлять диетическое мясо (не жареное), сухарики, зелень и овощи.
Диету можно всегда откорректировать, если снова вернуться признаки синдрома. При появлении неприятного запаха изо рта, нужно добавить много воды, которую необходимо пить маленькими порциями
Ни в коем случае не завершайте диету, если симптомы ушли. Врачи рекомендуют строго придерживать всех ее правил. На седьмой день вы можете добавить в рацион галетное печенье, рисовую кашу (без масла), суп из овощей. Если температура тела не повышается, а запах ацетона пропал, то питание малыша можно делать более разнообразным. Можете добавить нежирную рыбу, овощное пюре, гречку, кисломолочные продукты.
Какой прогноз?
В целом он благоприятный:
Меры профилактики
Родители, ребенок которых склонен к появлению этой болезни, должны иметь в домашней аптечке препараты глюкозы, фруктозы. Также под рукой всегда должны иметься курага, изюм, сухофрукты. Питание малыша должно быть дробным (5 раз в сутки) и сбалансированным. Как только появится какой-либо признак повышения ацетона, надо тут же дать ребенку что-то сладкое.
Нельзя позволять деткам чрезмерно перенапрягаться, ни в психологическом, ни в физическом плане. Показаны ежедневные прогулки на природе, водные процедуры, нормальный восьмичасовой сон, закаливающие процедуры.
Между приступами хорошо проводить профилактическое лечение кризов. Это лучше осуществлять в межсезонье дважды в год.
Ацетонемический синдром
Ацетонемический синдром – симптомокомплекс, обусловленный нарушением обменных процессов и накоплением в крови ребенка кетоновых тел. Ацетонемический синдром проявляется ацетонемическими кризами: многократной рвотой, дегидратацией, интоксикацией, запахом ацетона изо рта, абдоминальным синдромом, субфебрилитетом. Ацетонемический синдром диагностируется на основании клинических данных и лабораторных показателей (выявления кетонурии, нарушения электролитного баланса, повышения уровня мочевины и др.). При ацетонемическом кризе показана инфузионная терапия, постановки очистительной клизмы, оральная дегидратация, диета с включением легкоусвояемых углеводов.
Общие сведения
Ацетонемический синдром (синдром циклической ацетонемической рвоты, недиабетический кетоацидоз) – патологическое состояние, сопровождающееся повышением содержание в крови кетоновых тел (ацетона, b-оксимасляной кислоты, ацетоуксусной кислоты), образующихся вследствие нарушения обмена аминокислот и жиров. Об ацетонемическом синдроме у детей говорят в случае повторяющихся ацетонемических кризов.
В педиатрии различают первичный (идиопатический) ацетонемический синдром, являющийся самостоятельной патологией, и вторичный ацетонемический синдром, сопровождающий течение ряда заболеваний. К развитию первичного ацетонемического синдрома склонны около 5% детей в возрасте от 1 года до 12-13 лет; соотношение девочек к мальчикам составляет 11:9.
Вторичная гиперкетонемия может возникать при декомпенсированном сахарном диабете у детей, инсулиновой гипогликемии, гиперинсулинизме, тиреотоксикозе, болезни Иценко-Кушинга, гликогеновой болезни, ЧМТ, опухолях мозга в области турецкого седла, токсических поражениях печени, инфекционном токсикозе, гемолитической анемии, лейкемии, голодании и др. состояниях. Поскольку течение и прогноз вторичного ацетонемического синдрома определяется основным заболеванием, в дальнейшем речь пойдет о первичном недиабетическом кетоацидозе.
Причины
При абсолютной или относительной недостаточности углеводов энергетические потребности организма компенсируются усиленным липолизом с образованием избытка свободных жирных кислот. В условиях нормального метаболизма в печени происходит трансформация свободных жирных кислот в метаболит ацетил-коэнзим А, который в дальнейшем участвует в ресинтезе жирных кислот и образовании холестерина. Лишь небольшая часть ацетил-коэнзима А расходуется на образование кетоновых тел.
При усиленном липолизе количество ацетил-коэнзима А избыточно, а активность ферментов, активизирующих образование жирных кислот и холестерина, недостаточна. Поэтому утилизация ацетил-коэнзима А происходит в основном путем кетолиза.
Большое количество кетоновых тел (ацетона, b-оксимасляной кислоты, ацетоуксусной кислоты) вызывает нарушение кислотно-основного и водно-электролитного равновесия, оказывает токсическое действие на ЦНС и желудочно-кишечный тракт, что находит свое выражение в клинике ацетонемического синдрома.
Симптомы ацетонемического синдрома
Ацетонемический синдром часто встречается у детей с аномалиями конституции (нервно-артритическим диатезом). Таких детей отличает повышенная возбудимость и быстрая истощаемость нервной системы; они имеют худощавое телосложение, часто излишне пугливы, страдают неврозами и беспокойным сном. В то же время у ребенка с нервно-артрической аномалией конституции быстрее сверстников развиваются речь, память и другие познавательные процессы. Дети с нервно-артрическим диатезом склонны к нарушению обмена пуринов и мочевой кислоты, поэтому в зрелом возрасте подвержены развитию мочекаменной болезни, подагры, артритов, гломерулонефрита, ожирения, сахарного диабета 2 типа.
Типичными проявлениями ацетонемического синдрома служат ацетонемические кризы. Подобные кризы при ацетонемическом синдроме могут развиваться внезапно или вслед за предвестниками (так называемой аурой): вялостью или возбуждением, отсутствием аппетита, тошнотой, мигренеподобной головной болью и др.
Типичная клиника ацетонемического криза характеризуется многократной или неукротимой рвотой, которая возникает при попытке покормить или напоить ребенка. На фоне рвоты при ацетонемическом синдроме быстро развиваются признаки интоксикации и дегидратации (мышечная гипотония, адинамия, бледность кожи с румянцем).
Двигательное возбуждение и беспокойство ребенка сменяются сонливостью и слабостью; при тяжелом течении ацетонемического синдрома возможны менингеальные симптомы и судороги. Характерны лихорадка (37,5-38,5°С), спастические боли в животе, диарея или задержка стула. Изо рта ребенка, от кожных покровов, мочи и рвотных масс исходит запах ацетона.
Первые приступы ацетонемического синдрома обычно появляются в возрасте 2-3-х лет, учащаются к 7 годам и полностью исчезают к 12-13-летнему возрасту.
Диагностика ацетонемического синдрома
Распознаванию ацетонемического синдрома способствует изучение анамнеза и жалоб, клинической симптоматики, результатов лабораторных исследований. Обязательно следует различать первичный и вторичный ацетонемический синдром.
При объективном обследовании ребенка с ацетонемическим синдромом во время криза выявляются ослабление тонов сердца, тахикардия, аритмия; сухость кожи и слизистых, снижение тургора кожи, снижение слезовыделения; тахипноэ, гепатомегалия, уменьшение диуреза.
Клинический анализ крови при ацетонемическом синдроме характеризуется лейкоцитозом, нейтрофилезом, ускорением СОЭ; общий анализ мочи – кетонурией различной степени (от + до ++++). В биохимическом анализе крови может наблюдаться гипонатриемия (при потере внеклеточной жидкости) или гипернатриемия (при потере внутриклеточной жидкости), гипер- или гипокалиемия, повышение уровня мочевины и мочевой кислоты, нормо- или умеренная гипогликемия.
Дифференциальная диагностика первичного ацетонемического синдрома проводится с вторичным кетоацидозом, острым животом (аппендицитом у детей, перитонитом), нейрохирургической патологией (менингитом, энцефалитом, отеком мозга), отравлениями и кишечными инфекциями. В связи с этим ребенок должен быть дополнительно проконсультирован детским эндокринологом, детским инфекционистом, детским гастроэнтерологом.
Лечение ацетонемического синдрома
Основными направлениями лечения ацетонемического синдрома служат купирование кризов и поддерживающая терапия в межприступные периоды, направленная на снижение количества обострений.
При ацетонемических кризах показана госпитализация ребенка. Производится диетическая коррекция: строго ограничиваются жиры, рекомендуются легкоусвояемые углеводы и обильное дробное питье. Целесообразна постановка очистительной клизмы с раствором гидрокарбоната натрия, нейтрализующим часть кетоновых тел, попавших в кишечник. Оральная регидратация при ацетонемическом синдроме производится щелочной минеральной водой и комбинированными растворами. При выраженном обезвоживании проводится инфузионная терапия – внутривенное капельное введение 5% глюкозы, солевых растворов. Симптоматическая терапия включает введение противорвотных препаратов, спазмолитиков, седативных препаратов. При правильном лечении симптомы ацетонемического криза стихают на 2-5 день.
В межприступные периоды наблюдение ребенка с ацетонемическим синдромом осуществляется педиатром. Необходима организация правильного питания (растительно-молочная диета, ограничение продуктов, богатых жирами), профилактика инфекционных заболеваний и психоэмоциональных перегрузок, проведение водных и закаливающих процедур (ванн, контрастного душа, обливаний, обтираний), достаточный сон и пребывание на свежем воздухе.
Ребенку с ацетонемическим синдромом показаны профилактические курсы поливитаминов, гепатопротекторов, ферментов, седативной терапии, массажа; контроль копрограммы. Для контроля ацетона мочи рекомендуется самостоятельно исследовать мочу на содержание кетоновых тел с помощью диагностических тест-полосок.
Дети с ацетонемическим синдромом должны состоять на диспансерном учете у детского эндокринолога, ежегодно проходить исследование глюкозы крови, УЗИ почек и УЗИ брюшной полости.
Синдром гиперкетонемии у детей и подростков: патогенез, причины, диагностика
В статье представлены современные данные о физиологии энергетического обмена и роли в нем кетоновых тел. Рассмотрены основные причины избыточного образования кетонов, методы диагностики, подходы к лечению.
The article presents modern data on the physiology of energy metabolism and the role of ketone bodies in it. The main causes of excessive ketone formation, diagnostic methods, approaches to treatment are considered.
Часть 2. Начало статьи читайте в № 6, 2017 г.
Голодание
Голодание — это состояние организма, связанное с частичным или полным нарушением поступления пищи. В состоянии голодания резко снижаются источники энергии организма для важнейших структур организма. В условиях дефицита питательных веществ в организме образование энергии происходит за счет интенсификации глюкогенеза и синтеза кетоновых тел. Содержание глюкозы в крови уменьшается до нижних пределов нормы (3,5 ммоль/л) и на этом уровне поддерживается и в последующие периоды голодания. В печени при голодании глюкоза не в состоянии обеспечить должного количества оксалоацетата, поскольку ее просто нет в клетке. Поэтому при голодании жирные кислоты не «сгорают» в ЦТК, а превращаются в кетоновые тела.
Снижение запасов гликогена в печени сопровождается усиленным поступлением в нее свободных жирных кислот из адипоцитов. Концентрация жирных кислот в крови увеличивается в 3–4 раза по сравнению с постабсорбтивным состоянием. Уровень кетоновых тел в крови через неделю голодания повышается в 10–15 раз. В то же время дефицит углеводов тормозит окисление кетоновых тел, замедляя ресинтез их в высшие жирные кислоты [13].
Энергетические потребности мышц и большинства других органов удовлетворяются за счет жирных кислот и кетоновых тел. При низком уровне инсулина глюкоза в мышечные клетки не проникает, потребителями глюкозы являются инсулинонезависимые клетки и прежде всего клетки мозга, но и в этой ткани биоэнергетика частично обеспечивается кетоновыми телами. При такой концентрации ацетоуксусная кислота активно декарбоксилируется с образованием ацетона, который выводится с выдыхаемым воздухом и через кожу. Уже на 3–4 день изо рта и от кожи голодающего исходит запах ацетона.
Организм включает альтернативные способы выработки энергии — это глюконеогенез и синтез кетокислот, которые потребляются центральной нервной системой. При голодании повышается выброс глюкагона, который активирует липолиз в адипоцитах и окисление в печени. Количество оксалоацетата в митохондриях уменьшается, так как он, восстановившись до малата, выходит в цитозоль клетки, где опять превращается в оксалоацетат и используется в глюконеогенезе.
Глюконеогенез продолжается за счет распада тканевых белков. Аминокислоты образуются в результате распада мышечных белков и включаются в глюконеогенез при длительном голодании. Пируват образуется в печени из лактата и аланина. Аланин и глутамин являются наиболее важными глюкогенными аминокислотами при голодании. Пируват и метаболиты ЦТК способны образовывать оксалоацетат и включаться в глюконеогенез.
При голодании подавляется использование ацетил-КоА в ЦТК, и он используется исключительно для синтеза оксиметилглутарил-КоА, что приводит к увеличению образования кетоновых тел. В этих условиях кетоновые тела являются альтернативным (глюкозе) энергетическим материалом для мозга и других тканей. 75% потребности мозга в энергии удовлетворяется за счет ацетил-КоА [4].
Если голодание продолжается дни, недели — включаются другие гомеостатические механизмы, которые обеспечивают сохранение белковой структуры организма, замедляя глюконеогенез и переключая мозг на утилизацию кетоновых молекул. Сигналом для использования кетонов служит повышение их концентрации в артериальной крови. При длительном голодании наблюдаются крайне низкие концентрации инсулина в крови. В этом случае интенсивный кетогенез представляет собой компенсаторно приспособительную реакцию.
Интенсивность обмена веществ в целом снижена: через неделю голодания потребление кислорода уменьшается примерно на 40%, происходят торможение окислительных процессов в митохондриях и угнетение окислительного фосфорилирования с образованием АТФ, т. е. развивается гипоэнергетическое состояние.
Накапливаясь в крови, кетоновые тела подавляют секрецию и активность глюкокортикоидов, тем самым препятствуя разрушению структурных белков организма и угнетая секрецию глюкагона [2]. Если в это время голодающему вводить аланин или другие гликогенные аминокислоты, уровень глюкозы в крови повышается, а концентрация кетоновых тел снижается.
При голодании кетоз опасности не представляет, так как не достигает степени кетоацидоза. Последний развивается при сопутствующих факторах — дегидратации, алкогольной интоксикации и других состояниях.
Алкогольная интоксикация
Гиперпродукция кетокислот и кетоацидоз после чрезмерного употребления спиртного частое наблюдаемое состояние. Катаболизм этилового спирта осуществляется главным образом в митохондриях печени. Здесь окисляется от 75% до 98% введенного в организм этанола. Окисление алкоголя — сложный биохимический процесс. Основную роль в метаболизме этанола играет никотинамидадениндинуклеотид (NAD). Этот фермент превращает этанол в токсический метаболит — ацетальдегид и восстановленный NADH, а последний соответствует синтезу ацетоацетата и β-оксибутирата.
Алкогольдегидрогеназа катализирует обратимую реакцию, направление которой зависит от концентрации ацетальдегида и соотношения NADH/NAD + в клетке. Повышение концентрации ацетальдегида в клетке вызывает индукцию фермента альдегидоксидазы. В ходе реакции образуются уксусная кислота.
Полученная в ходе реакции уксусная кислота активируется под действием фермента ацетил-КоА-синтетазы. Реакция протекает с использованием кофермента А и молекулы АТФ. Образовавшийся ацетил-КоА, в зависимости от соотношения АТФ/АДФ и концентрации оксалоацетата в митохондриях гепатоцитов, может «сгорать» в ЦТК или использоваться на синтез жирных кислот или кетоновых тел.
На начальных стадиях алкоголизма ацетил-КоА в ЦТК — основной источник энергии для клетки. Избыток ацетил-КоА в составе цитрата выходит из митохондрий, и в цитоплазме начинается синтез жирных кислот.
В период острой алкогольной интоксикации, несмотря на наличие большого количества ацетил-КоА, недостаток оксалоацетата снижает скорость образования цитрата. В этих условиях избыток ацетил-КоА идет на синтез кетоновых тел. Увеличение концентрации NADH по сравнению с NAD + замедляет реакцию окисления лактата, увеличивается соотношение лактат/пируват. В крови возрастает концентрация лактата, это приводит к гиперлактацидемии и лактоацидозу. Повышение в крови содержания лактата, ацетоуксусной кислоты и β-гидроксибутирата служит причиной метаболического ацидоза при алкогольной интоксикации [14].
Способствует усиленному кетогенезу при алкогольной интоксикации гипогликемические состояния, связанные с рвотой и голоданием. Известно также, что у таких пациентов уровень инсулина в крови снижен, тогда как содержание кортизола, гормона роста, глюкагона и адреналина повышено. Этанол тормозит глюконеогенез. Дегидратация в этих случаях способствует кетогенезу.
Кетоз при нарушении гормональной регуляции
На уровень глюкозы в крови влияет широкий спектр гормонов, при этом только инсулин вызывает гипогликемический эффект. Контринсулярным действием с повышением уровня глюкозы крови обладают все гормоны: глюкагон, адреналин, глюкокортикоиды, адренокортикотропный (АКТГ), соматотропный (СТГ), тиреотропный (ТТГ), тиреоидные.
Эффекты инсулина и контринсулярных гормонов в норме регулируют стабильный уровень глюкозы в крови. При низкой концентрации инсулина усиливаются гипергликемические эффекты других гормонов, таких как глюкагон, адреналин, глюкокортикоиды и гормон роста. Это происходит даже в том случае, если концентрация этих гормонов в крови не увеличивается.
Патогенез кетоза при избытке тироксина, глюкокортикоидов, соматотропина или/и других гормонов, в сущности, аналогичен уже рассмотренным механизмам гиперпродукции кетокислот вследствие избытка контринсулярных гормонов [6]. Известно, что в период усиленного роста, а также при гипертиреозе наступает значительное похудание.
Стресс
При стрессе активируется симпатическая нервная система и выброс контринсулярных гормонов, происходит истощение углеводных резервов организма, нарушается способность печени синтезировать и откладывать гликоген. Происходит избыточное поступление в печень неэтерифицированных жирных кислот. В результате повышенной продукции глюкокортикоидов идет распад белков и усиленное образование кетоновых тел из кетогенных аминокислот.
Гиперкортицизм
Ацетонемический синдром может быть первым клиническим проявлением гиперкортицизма, когда характерные признаки заболевания еще не сформировались.
Глюкокортикоиды способствуют усилению мобилизации нейтральных жиров из жировой ткани и тормозят липогенез. Но это действие в организме может перекрываться другими эффектами данных гормонов: способностью вызывать гипергликемию и стимулировать секрецию инсулина, накопление гликогена в печени, что приводит к торможению мобилизации жира и его отложению в жировой ткани; способностью в больших дозах задерживать жиромобилизующее и стимулирующее окисление жиров соматотропином.
Этим можно объяснить накопление жира в жировых депо при гиперкортицизме (болезни и синдроме Иценко–Кушинга). Кроме того, при этом состоянии увеличено образование дигидрокортизона, который стимулирует пентозный цикл и превращение углеводов в жиры. Кортикотропин, стимулируя секрецию глюкокортикоидов, может влиять на жировой обмен в том же направлении, но, помимо этого, обладает еще и экстраадреналовым жиромобилизующим действием [6].
Тиреотоксикоз
Избыток тиреоидных гормонов в крови может быть следствием заболеваний, проявляющихся гиперфункцией щитовидной железы. Тяжелым осложнением основного заболевания, сопровождающегося гиперфункцией щитовидной железы, является тиреотоксический криз, который представляет собой резкое обострение всех симптомов тиреотоксикоза. Чрезмерное поступление в кровь тироидных гормонов вызывает тяжелое токсическое поражение сердечно-сосудистой системы, печени, нервной системы и надпочечников. В клинической картине характерны резкое возбуждение (вплоть до психоза с бредом и галлюцинациями), которое затем сменяется адинамией, сонливостью, мышечной слабостью, апатией. Усиливаются диспепсические расстройства: жажда, тошнота, рвота, жидкий стул. Возможно увеличение печени. На этом фоне резко усиливаются процессы кетогенеза, что может спровоцировать симптомы ацетонемии.
Тироксин обладает жиромобилизующим эффектом. При гипертиреозе усилен обмен углеводов. Увеличена утилизация глюкозы тканями. Активируется фосфорилаза печени и мышц, следствием чего является усиление гликогенолиза и обеднение этих тканей гликогеном. Увеличивается активность гексокиназы и всасывание глюкозы в кишечнике, что может сопровождаться алиментарной гипергликемией. Активируется инсулиназа печени, что вместе с гипергликемией вызывает напряженное функционирование инсулярного аппарата и в случае его функциональной неполноценности может привести к развитию сахарного диабета. Усиление пентозного пути обмена углеводов способствует образованию НАДФ-Н2. В надпочечниках это вызывает повышение стероидогенеза и большее образование кортикостероидов [4].
Дефицит гормонов
Гипогликемия всегда встречается при пангипопитуитаризме — заболевании, характеризующемся снижением и выпадением функции передней доли гипофиза (секреции адренокортикотропина, пролактина, соматотропина, фоллитропина, лютропина, тиреотропина). В результате резко снижается функция периферических эндокринных желез. Однако гипогликемия встречается и при первичном поражении эндокринных органов (врожденная дисфункция коры надпочечников, болезнь Аддисона, гипотиреоз, гипофункция мозгового слоя надпочечников, дефиците глюкагона). При дефиците контринсулярных гормонов снижается скорость глюконеогенеза в печени (влияние на синтез ключевых ферментов), повышается утилизация глюкозы на периферии, снижается образование аминокислот в мышцах — субстрата для глюконеогенеза.
Дефицит глюкокортикоидов
Первичная надпочечниковая недостаточность является следствием уменьшения секреции гормонов коры надпочечников. Под этим термином подразумевают различные по этиологии и патогенезу варианты гипокортицизма. Симптомы надпочечниковой недостаточности развиваются только после разрушения 90% объема ткани надпочечников.
Причины гипогликемии при надпочечниковой недостаточности схожи с причинами гипогликемии при гипопитуитаризме. Отличием является уровень возникновения блока — при гипопитуитаризме снижается секреция кортизола из-за дефицита АКТГ, а при надпочечниковой недостаточности из-за разрушения ткани самих надпочечников.
Гипогликемические состояния у больных с хронической надпочечниковой недостаточностью могут возникать как натощак, так и через 2–3 часа после приема пищи, богатой углеводами. Приступы сопровождаются слабостью, чувством голода, потливостью. Гипогликемия развивается в результате снижения секреции кортизола, уменьшения глюконеогенеза, запасов гликогена в печени.
Дефицит катехоламинов
Данное состояние может возникать при надпочечниковой недостаточности с поражением мозгового слоя надпочечников. Катехоламины, попадая в кровь, регулируют высвобождение и метаболизм инсулина, снижая его, а также увеличивают высвобождение глюкагона. При снижении секреции катехоламинов наблюдаются гипогликемические состояния, вызванные избыточной продукцией инсулина и пониженной активностью гликогенолиза.
Дефицит глюкагона
Глюкагон — гормон, являющийся физиологическим антагонистом инсулина. Он участвует в регуляции углеводного обмена, влияет на жировой обмен, активируя ферменты, расщепляющие жиры. Основное количество глюкагона синтезируется альфа-клетками островков поджелудочной железы. Однако установлено, что специальные клетки слизистой оболочки двенадцатиперстной кишки и слизистой оболочки желудка также синтезируют глюкагон. При поступлении в кровоток глюкагон вызывает повышение в крови концентрации глюкозы, вплоть до развития гипергликемии. В норме глюкагон предотвращает чрезмерное снижение концентрации глюкозы. Благодаря существованию глюкагона, препятствующего гипогликемическому действию инсулина, достигается тонкая регуляция обмена глюкозы в организме.
При дефиците вышеперечисленных гормонов содержание инсулина снижено, а экскреция кетоновых тел с мочой повышена [4].
Роль печени в нарушении энергетического обмена
Печень участвует в поддержании нормального уровня глюкозы в сыворотке крови путем гликогеногенеза, гликогенолиза и глюконеогенеза. В основе нарушений обмена углеводов при болезнях печени лежат повреждения митохондрий, которые ведут к снижению окислительного фосфорилирования. Вторично страдают функции печени. При тяжелом остром гепатите, как правило, отмечается гипогликемия, а при циррозах печени это наступает в конечной стадии — при печеночной недостаточности [15]. Гипогликемия объясняется снижением способности печени (из-за обширного поражения ее паренхимы) синтезировать гликоген и уменьшением выработки инсулиназы (фермента, разрушающего инсулин).
Дефицит углеводов приводит также к усилению анаэробного гликолиза, вследствие чего в клетках накапливаются кислые метаболиты, вызывающие снижение рН. При циррозе печени может повышаться и уровень лактата в сыворотке крови в связи со сниженной способностью печени утилизировать его для глюконеогенеза.
При заболеваниях печени увеличивается роль жиров в качестве источника энергии. В печени происходят синтез жирных кислот и их расщепление до ацетил-КоА, а также образование кетоновых тел, насыщение ненасыщенных жирных кислот и их включение в ресинтез нейтральных жиров и фосфолипидов. Катаболизм жирных кислот осуществляется путем β-окисления, основной реакцией которого является активирование жирной кислоты с участием кофермента ацетил-КоА и АТФ. Освобождающийся ацетил-КоА подвергается полному окислению в митохондриях, в результате чего клетки обеспечиваются энергией.
При ряде заболеваний печени снижается и синтез липопротеидов, что ведет к накоплению триацилглицеридов с последующей инфильтрацией и жировой дистрофией печени. Причинами возникновения этого состояния, в частности, является недостаток в пище липотропных веществ (холина — составной части лецитина, метионина). Увеличивается образование кетоновых тел [4].
Итак, клиническая картина вторичного ацетонемического синдрома включает в себя непосредственно явления кетоза, признаки основного заболевания, на фоне которого развился кетоз, а также проявления того состояния, которое запустило патологический процесс (стресс, чрезмерная физическая нагрузка, инфекция и т. д.).
Ацетонемическая циклическая рвота
В практике приходится сталкиваться с идиопатической ацетонемической рвотой, которая протекает с кетоацидозом (ацетонемическая рвота, недиабетический кетоацидоз). В англоязычной литературе она входит в синдром идиопатической циклической рвоты [16, 17].
Патогенез ацетонемической рвоты полностью не выяснен. Предполагается, что у детей после перенесенных инфекционных заболеваний, травм черепа, органических заболеваний центральной нервной системы в течение длительного времени в гипоталамо-диэнцефальной области остается доминантный очаг застойного возбуждения, индуцирующий нарушения жирового обмена (усиление кетогенеза, нарушение нормального использования кетоновых тел в связи с истощением углеводных запасов в организме). В патогенезе ацетонемической рвоты могут иметь значение аномалии конституции, относительная несостоятельность энзимных систем печени, нарушения эндокринной регуляции метаболизма.
Перспективными являются представления о синдроме циклической рвоты как о митохондриальной патологии [18, 19]. Поскольку митохондрии являются, образно выражаясь, энергетическими станциями клетки, при данном заболевании нарушается энергетический обмен. В условиях стресса и гипоксии энергетический обмен нарушается с преобладанием более быстрого анаэробного гликолиза, но при этом образуется только 2 молекулы АТФ, тогда как при аэробном — 38 [5]. Возникает дефицит энергии.
Такие нарушения тесно связаны с нарушениями пуринового обмена, поскольку энергия в организме хранится в виде нуклеотидов, среди которых аденин и гуанин являются пуриновыми, и они метаболизируются до мочевой кислоты, а тимин, цитозин и урацил являются пиримидиновыми и метаболизируются с образованием кетоновых тел, аммиака и β-изомасляной кислоты. Данные представления патогенетически сближают синдром циклической рвоты и синдром ацетонемической рвоты, а также объясняют необходимость и возможные пути метаболической коррекции.
Другие считают, что причиной резкого повышения кетоновых тел может быть недостаточное потребление детьми углеводов при избытке жиров и кетогенных аминокислот.
Кризы могут возникать внезапно с промежутками в несколько недель или месяцев. Провоцирующими факторами могут быть: нарушение диеты (жареные и печеные продукты), лихорадка, отказ от еды, физические и психические перегрузки.
Предвестниками синдрома циклической рвоты является анорексия, вялость или повышение возбудимости, тошнота, головные боли, абдоминальные боли, запах ацетона изо рта.
Затем появляется многократная или неукротимая рвота, которая может продолжаться от одного до пяти дней. Схваткообразные боли в животе усиливаются. Во время криза больной становится сонливым. В результате рвоты могут развиваться гемодинамические нарушения: тахикардия, мягкий пульс, приглушенность сердечных тонов, гипотония.
Печень умеренно увеличена. В некоторых случаях повышается температура. В выдыхаемом воздухе и рвотных массах ощущается запах прелых яблок. В моче высокая концентрация кетоновых тел. Приступы могут ликвидироваться спонтанно, без лечения.
Избыток кетоновых тел оказывает наркотическое действие на центральную нервную систему, что клинически проявляется вялостью, заторможенностью.
В биохимическом анализе крови обнаруживают нарушение липидного обмена (гиперхолестеринемию), тенденцию к гипогликемии, гиперкетонемию. В общем анализе крови: умеренный лейкоцитоз, нейтрофилез, ускоренная СОЭ.
В моче и выдыхаемом воздухе обнаруживается ацетон, в крови — повышенная концентрация кетоновых тел. На электроэнцефалограмме выявляются различные отклонения, не исчезающие полностью после прекращения приступа.
Этот синдром чаще встречается в дошкольном возрасте и сопровождается приступами многократной рвоты и кетонемии. У таких больных нередко выявляют повышенную возбудимость, мочекислую нефропатию, сахарный диабет, ожирение.
Кетоз при длительной рвоте, недоедании или голодании представляет классический компенсаторный процесс, призванный восполнить энергетический дефицит, точнее, недостаток углеводов, за счет альтернативных энергосубстратов кетокислот.
Диагноз синдрома ацетонемической рвоты можно подтвердить только после исключения других заболеваний, сопровождающихся рвотой: аппендицита и перитонита, энцефалитов, менингитов, начала отека головного мозга, отравления, токсикоза и инфекционных заболеваний и др. Но в первую очередь диабетического кетоацидоза.
Ацетонемические кризы у большинства детей прекращаются после 10–12 лет, но сохраняется большая вероятность развития таких патологических состояний, как подагрические кризы, вегетососудистые дистонии по гипертоническому типу, артериальная гипертензия.
Транзиторный кетоз у детей и подростков может выявляться при лихорадке, стрессах, инфекционных заболеваниях, голодании (во время болезни), употреблении богатой жирами пищи, напряженной физической активности. В этих случаях содержания кетоновых тел в моче не более 2+.
Лечение
Лечение и профилактика гиперкетонемии зависят от причины ее возникновения, но во всех случаях направлены на улучшение функции печени и нормализацию энергетического обмена. Это достигается ограничением содержания жира в пищевом рационе, назначением липотропных средств (метионина и др.), витаминов группы В, при необходимости — инсулина, кокарбоксилазы.
В период приступа синдрома циклической ацетонемической рвоты выраженная дегидратация, гиповолемия, метаболический ацидоз и электролитные нарушения — это основные факторы, которые определяют тяжесть состояния. Необходимо в первую очередь ликвидировать ацидоз: назначить промывание желудка и кишечника 1–2% раствором бикарбоната натрия. Антикетогенными свойствами обладает 5–10% раствор глюкозы, с добавлением необходимого количества инсулина, а также раствор Рингера [20].
Если питье не провоцирует рвоту, рекомендуется подслащенный чай, Регидрон, Оралит — частыми и небольшими объемами. После улучшения состояния и появления возможности приема жидкости назначается кормление ребенка. Диета должна содержать легкоусвояемые углеводы и ограниченное количество жиров (манная, овсяная, гречневая каши; картофельное пюре, печеные яблоки, сухари, сухое печенье).
Итак, выяснение механизмов развития кетонемического синдрома, выделение наиболее вероятных причин формирования кетоза дают возможность установить генез заболевания, а тем самым нормализовать состояние больного и предупреждать рецидивы кетонемии.
Литература
ФГБОУ ВО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва