аутофагия что это и зачем
Что такое аутофагия и действительно ли это путь к вечной молодости
Любовь Карась
У клеток организма есть способность к самовосстановлению, или регенерации. Этот процесс называется аутофагией, и он необходим для адаптации и очищения от «мусора». После открытия этого механизма фармацевтические компании и ученые стремятся разработать лекарства, которые могли бы стимулировать аутофагию. Многие пытаются достичь этой цели посредством голодания. Диетологи из «интернета» обещают легкие способы похудения и омоложения. Но так ли это? Объясняем, как работает процесс аутофагии и связан ли он с голоданием.
Значение для медицины
Аутофагия — естественный процесс регенерации, который происходит на клеточном уровне. Таким образом клетка адаптируется к тяжелым условиям. Например, когда она получает недостаточно питательных веществ извне, она жертвует частью собственных макромолекул и органелл, чтобы получить элементы, из которых могут быть синтезированы необходимые для дальнейшего существования вещества.
Аутофагия позволяет избавиться от поврежденных белков и органелл и тем самым бороться с последствиями старения организма
Аутофагия играет важную роль при ряде заболеваний, включая канцерогенез ❓ Многоэтапный процесс, ведущий к глубокой опухолевой реорганизации нормальных клеток организма. и нейродегенеративные болезни (болезнь Паркинсона и деменцию). Хотя роль аутофагии в канцерогенезе противоречива, отмечает доктор химических наук Александра Евстафьева. С одной стороны, процесс аутофагии способствует выживанию опухолевых клеток, с другой — может стать супрессором развития новообразований (иными словами, предотвращает их).
Напротив, в случае нарушения процессов аутофагии клетки разрушаются, на их месте появляется соединительная ткань. Это часто ведет к развитию сердечной недостаточности, а также к воспалительным процессам, так как часть мертвых клеток не удаляется.
Аутофагия и голодание
Биохакеры и некоторые ученые считают, что один из способов ускорить процесс аутофагии — делать паузы в питании, или, иными словами, начать голодать. Тогда клетка сталкивается с недостатком энергии и самостоятельно начинает вырабатывать необходимые ей вещества. Старый белок уничтожается и становится источником энергии для клеток.
В Кремниевой долине биохакеры создали онлайн-сообщество, где делятся советами и опытом голодания. Участники придерживаются метода «Пост монаха» — 36 часов голодания на воде. По мнению адептов интервального голодания, голод укрепляет иммунную систему, замедляет процесс старения организма и, кроме того, способствует продуктивности.
Однако единого мнения насчет этого нет: ученые до сих пор спорят о плюсах и минусах такого подхода. Сам по себе человек адаптирован к вынужденному голоданию, однако в современном мире это кажется крайне непривычным.
Сам же Осуми не утверждал, что голодание способствует процессу аутофагии. Кроме того, стоит учитывать, что ученый изучал гены аутофагии не людей, а дрожжей
Гарвардская медицинская школа опубликовала гайд, посвященный интервальному голоданию. Эксперты утверждают, что этот способ помогает снизить вес. Это происходит потому, что уровень инсулина снижается, жировые клетки организма начинают расходовать запасенную в них глюкозу и жировая масса уменьшается. Все же длительное или частое голодание может нанести вред здоровью. Перед тем как приступить к подобным практикам, необходимо проконсультироваться с врачом.
Аутофагия и её роль в сохранении молодости
Аутофагия: что это такое?
В переводе c греческого “аутофагия” означает “самопоедание”. Причем исключительно в хорошем смысле. Ведь так организм очищается от поврежденных клеток и токсинов.
Тело человека содержит триллионы клеток. Со временем в наших тканях накапливаются различные мертвые органеллы, поврежденные белки и окисленные частицы, которые мешают нормальной работе организма. Это ускоряет эффекты старения и возрастных заболеваний.
Этот механизм регенерации клеток имеет решающее значение для состояния здоровья в целом. Например, дисфункцию аутофагии связывают с несколькими нейродегенеративными расстройствами, включая болезнь Альцгеймера.
Аутофагия – это регулируемый процесс, с помощью которого клетка разрушает свои дисфункциональные или чужеродные компоненты. Затем она может перерабатывать полезные химические компоненты для других целей.
Это позволяет аутофагии регулировать баланс белкового состава в клетке, предотвращать накопление токсичных продуктов жизнедеятельности, поддерживать функцию клеточных органелл, удалять вторгшиеся патогены и поддерживать клетки в периоды низкого энергопотребления из-за голодания.
ВАЖНО: Аутофагию не следует путать с апоптозом, который представляет собой запрограммированную гибель клеток. Это процесс, отличный от устранения дегенерации внутри клеток.
О научной важности понимания аутофагии говорит тот факт, что в 2016 году японский ученый Ёсинори Осуми получил Нобелевскую премию по физиологии и медицине за открытие механизмов аутофагии.
Механизм действия
По сути, аутофагия – это создание «мусорного мешка» (аутофагосома), который собирает клеточные компоненты, а затем доставляет их в «центр переработки» клетки (лизосомы), где они делятся на части и могут быть переработаны в новые компоненты.
Аутофагия обычно запускается недостатком питательных веществ в клетке. Считается, что инсулин подавляет аутофагию, а глюкагон может активировать этот процесс.
После еды тело человека вырабатывает инсулин, а голодание вызывает высвобождение гормона глюкагона, поскольку уровень сахара в крови начинает снижаться. Глюкагон сигнализирует организму о необходимости использования гликогена в печени для повышения уровня сахара в крови.
После активации аутофагии процесс происходит в четыре этапа:
Четвертый и последний этап аутофагии в конечном итоге связан с недостатком клеточных питательных веществ. Использование продуктов распада в конечном итоге необходимо для обеспечения аминокислотами для глюконеогенеза (процесса, при котором организм синтезирует глюкозу из неуглеводных источников).
Аминокислоты служат источником энергии для цикла трикарбоновых кислот (цикла Кребса), и эти аминокислоты могут быть переработаны для синтеза новых белков.
Все процессы аутофагии важны для поддержания баланса или гомеостаза в организме.
Изучайте тонкости антивозрастной медицины из любой точки мира. Для удобства врачей мы создали обучающую онлайн-платформу Anti-Age Expert: Здесь последовательно выкладываются лекции наших образовательных программ, к которым открыт доступ 24/7. Врачи могут изучать материалы необходимое количество раз, задавать вопросы и обсуждать интересные клинические случаи с коллегами в специальных чатах
Как запустить процесс аутофагии
Есть несколько способов активизировать процесс аутофагии в организме. Это поможет очистить свои клетки и снизить уровень воспаления, а также поддерживать тело в отличной форме в целом.
Что может вызвать аутофагию?
Запустить этот процесс может не только голодание в чистом виде, но и так называемое интервальное голодание, когда пища употребляется, например, трижды в день в течение 16 часов, а 8 часов организм отдыхает от процессов пищеварения.
Это говорит о том, что люди могут использовать физнагрузки для запуска процесса самоочищения организма. Уже есть доказательства того, что упражнения усиливают аутофагию в скелетных мышцах человека.
Куркумин – это природное химическое вещество, которое содержится в корне куркумы, популярной во всем мире специи.
Другое исследование на мышах показало, что куркумин помогает бороться с когнитивными нарушениями из-за химиотерапии, вызывая аутофагию в определенных областях мозга.
Хотя эти предварительные результаты обнадеживают, важно отметить, что необходимы дополнительные исследования, прежде чем ученые смогут сделать конкретные выводы относительно воздействия на организм человека.
Роль аутофагии в сохранении молодости
Когда в клетке все работает нормально, аутофагия идет в “фоновом режиме”, помогая перерабатывать изношенные клеточные компоненты.
Но если клетка подвергается стрессу (недостаток питательных веществ или энергии, дисфункциональные компоненты или вторжение микробов), включается аутофагия.
Но как именно она может помочь в продлении молодости?
Активация аутофагии противодействует возрастному накоплению поврежденных клеточных компонентов и повышает метаболическую эффективность клеток. Так они становятся более устойчивыми, помогая противостоять процессам старения.
В частности, аутофагия может быть активирована для удаления дисфункциональных митохондрий, которые производят множество вредных для клеток активных форм кислорода (АФК).
Исследователи предполагают, что эти процессы важны для нескольких состояний и их предупреждения:
Психические расстройства.П Посмертные исследования мозга людей с депрессией и шизофренией выявили дефицит основных путей аутофагии.
Нейродегенерация. Многие нейродегенеративные расстройства возникают из-за накопления деформированных белков в нейронах и вокруг них, вызывая постепенную гибель клеток мозга и последующую потерю умственных способностей. Процесс аутофагии защищает нас, устраняя эти белки.
Прямое удаление микробов изнутри клеток (ксенофагия);
Удаление токсинов, созданных инфекциями;
Модуляция иммунного ответа на инфекции.
Инфекционные микробы (такие как Mycobacterium tuberculosis и Streptococcus группы A), вирусы, такие как ВИЧ, и простейшие удаляются посредством процессов аутофагии.
Это лишь некоторые из известных на сегодняшний день эффектов аутофагии. Она также играет важную роль для работы иммунной системы, очищая тело от токсинов и инфекционных агентов.
А в 2019 году было проведено исследование, посвященное взаимосвязи “самопоедания” и рака. Было обнаружено, что, хотя аутофагия может помочь остановить развитие раковых клеток, она также может способствовать и их росту, в зависимости от стадии опухоли.
Несмотря на то, что существует множество исследований о влиянии аутофагии на клетки, исследователи все еще не уверены в том, может ли усиление этого процесса быть новым способом лечения различных состояний.
Получайте знания, основанные на доказательной медицине из первых уст ведущих мировых специалистов. В рамках Модульной Школы Anti-Age Expert каждый месяц проходят очные двухдневные семинары, где раскрываются тонкости anti-age медицины для врачей более 25 специальностей
Краткие выводы
Хотя исследования показали, что ограничение в питании, физические упражнения и употребление куркумина могут влиять на аутофагию, большинство исследований проводилось на животных.
На сегодняшний день ученые не имеют полного представления о последствиях аутофагии для здоровья и того, как именно люди могут ее вызывать.
Поэтому тем, кто серьезно подумывает об изменении своего образа жизни, чтобы активировать аутофагию, следует заранее проконсультироваться с врачом.
Список использованной литературы
Takeshige, K., Baba, M., Tsuboi, S., Noda, T. and Ohsumi, Y. (1992). Autophagy in yeast demonstrated with proteinase-deficient mutants and conditions for its induction. Journal of Cell Biology 119, 301-311
Аутофагия
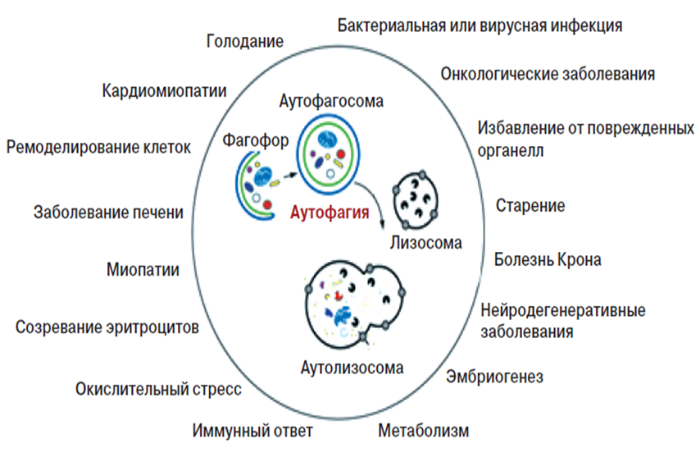
Аутофагия — это процесс прижизненной деградации с помощью лизосом измененного метаболитами содержимого цитоплазмы для поддержания клеточного и энергетического гомеостаза [1]. Аутофагия считается «программируемой» гибелью всей клетки или отдельных ее частей. У млекопитающих аутофагия наблюдается во многих физиологических процессах: реакции на голодание, контролировании роста клеток, процессах врожденного иммунитета и защите от старения, избавлении от долгоживущих белков и поврежденных органелл, при дифференцировке и трансформации клеток (Рис. 1). Это играет важную роль в поиске решений лечения ряда заболеваний, включая канцерогенез и нейродегенеративные болезни [2].
Рисунок 1 | Некоторые физиологические процессы, которые сопровождаются участием аутофагии
Процесс «самопоедания» впервые был отмечен Портером К.Р. и его учеником в 1962 году, когда они сообщили о увеличении числа лизосом в клетках печени крыс после добавления глюкагона и о том, что некоторые лизосомы содержали в себе митохондрии. Термин «аутофагия» ввели в 1963 г. Кристиан де Дюв и Новиков А.Б., описывая его как процесс доставки цитоплазматического материала клетки в лизосомы с целью последующей деградации [3]. О «программируемой» гибели клетки или ее частей заговорили еще в 1990-х годах, когда впервые поступили данные о том, что некоторые группы ученых обнаружили гены, связанные с процессом аутофагии.
Однако только в 2016 году Есинори Осуми получил Нобелевскую премию по медицине и физиологии за исследование аутофагии в дрожжевых клетках и обнаружение с помощью генетического подхода полутора десятков генов, которые отвечают за образование аутофагосом. В дальнейшем исследование функционирования белковых продуктов этих генов привело к выяснению молекулярных механизмов индукции, протекания и регуляции аутофагии [4].
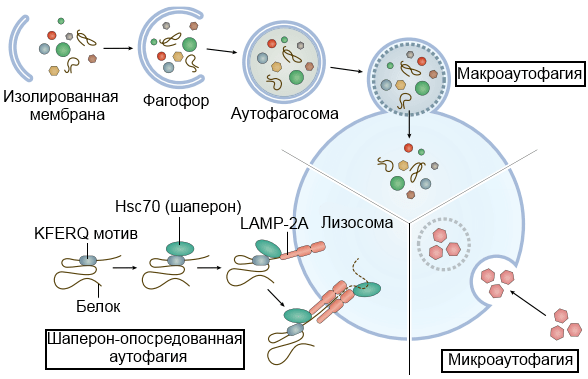
Согласно современным данным, аутофагия подразделяется на три типа: микроаутофагия, шаперон-зависимая аутофагия, макроаутофагия (Рис. 2).
Рисунок 2 | Типы аутофагии
Микроаутофагия. Макромолекулы и обломки клеточных мембран попадают в лизосому путем инвагинации ее мембраны. Благодаря этому клетка может расщеплять белки при нехватке энергии или «строительного материала». Данный тип аутофагии подробно описан и наблюдается у дрожжей, однако слабо охарактеризован у млекопитающих.
Шаперон-зависимая аутофагия. При данном типе аутофагии не требуется реорганизация лизосомальной мембраны или формирование дополнительных везикул. Данный процесс происходит при участии цитоплазматических белков-шаперонов семейства Heat shock protein 70 (Hsp 70), вспомогательных белков и Lysosome-associated membrane protein type 2A (LAMP-2). При участии белков происходит направленный транспорт частично денатурированных белков из цитоплазмы сквозь мембрану лизосомы в ее полость, где они подвергаются деградации.
Макроаутофагия. При данном типе из участка цитоплазмы, окруженного мембранным компартментом, формируются аутофагосомы, которые потом соединяются с лизосомами, образуя аутофаголизисомы. Именно в них и происходит дальнейшая деградация органелл и остального содержимого аутофаголизосомы. При этом процесс аутофагии можно разделить на несколько основных стадий: инициацию, элонгацию, формирование аутофагосомы и формирование аутофаголизосомы. Все стадии процесса контролируются специфическими генами Autophagy-related Genes (ATG). Именно при данном типе аутофагии происходит деградация митохондрий, эндоплазматического ретикулума, пероксисом, рибосом, белков, липидов и РНК.
Существуют и механизмы регуляции процессов аутофагии: сигнальный путь PI3K класса I, активируемый в ответ на ростовые факторы; сигнальный путь PI3K класса III, регулирующий количество аминокислот в клетке, и сигнальный путь LKB1/AMPK, который чувствителен к уровню АТФ. Основным компонентом вышеуказанных путей регуляции является киназа mTOR, которая ингибирует процесс аутофагии в клетках.
Есинори Осуми при изучении белка LC3 млекопитающий, гомолога дрожжевого белка ATG8, обнаружил укороченную и липидированную формы данного белка — LC3-I и LC3-II соответственно. Именно эти формы в настоящее время считаются маркерами аутофагосом и индикаторами аутофагии.
Роль аутофагии в гемопоэзе. Недавние исследования показали, что ген Atg7 является важнейшим регулятором гемопоэтических стволовых клеток, при его отсутствии происходит усиление пролиферации и повреждение ДНК. Также основные белки регуляторы аутофагии (Atg5, LC3, Beclin-1) обнаруживаются в лимфоцитах CD4+ и CD8+, и их содержание повышается в активированных Т-клетках [5]. Кроме того, Atg5 участвует в развитии В-клеток, а его отсутствие приводит к патологиям данного типа клеток.
Аутофагия значительно влияет и на окончательную дифференцировку ретикулоцитов, избавляя их от митохондрий. При ингибировании mTOR процесс аутофагии позволяет уменьшить размер мегакариоцитов и вызывает задержку их дифференцировки. Кроме того, имеются данные, что активация аутофагии является непосредственным участников в формировании иммунного ответа [6].
Роль аутофагии в канцерогенезе. Известно, что неопластические клетки имеют свойство подавлять в себе процессы апоптоза, в связи с этим возможность запустить аутофагию считается более перспективным выходом для супрессии неопластического процесса. Однако по литературным данным указывается, что запуск аутофагии данного типа клеток на разных стадиях канцерогенеза может дать и отрицательные результаты, наоборот ингибируя перерождение нормальных клеток в опухолевые [6]. Кроме этого, аутофагия важна и в процессах опухолевой прогрессии, а именно инвазии и метастазирования.
Роль аутофагии в нейродегенеративных заболеваниях. Возможность клеток самим избавляться от дефектных белков и органелл особенно актуальна для неделящихся долгоживущих клеток, таких как нервные клетки. Так, при болезни Альцгеймера в клетках накапливается агрегаты неправильно свернутого белка бета-амилоида, а при болезни Паркинсона — альфа-синуклеина. Удаление данных частиц может помочь в достижении положительной динамики в вышеуказанных заболеваниях и, как следствие, замедлению их прогрессирования. Однако мутации в ATG-генах, нарушение баланса между образованием аутофагосом и их деградацией в лизосомах приводят к гибели нервных клеток.
Аутофагия вовлечена во многие процессы жизнедеятельности всех клеток организма. И нарушение данного процесса влечет за собой развитие многих патологий. Остаются еще нерешенные вопросы влияния аутофагии на дифференцировку и развитие большинства клеток организма. До сих пор не полностью понятны механизмы ингибирования и супрессии аутофагии и последствия к которым приведет то или иное состояние в отдельных системах организма. Кроме того, остаются споры о влиянии аутофагии на канцерогенез и изменение этого процесса при взаимодействии с различными лекарственными препаратами, но в настоящее время активно продолжаются клинические исследования ингибиторов аутофагии, использование которых представляется перспективным в терапии злокачественных новообразований.
Трансляция: как и зачем ингибировать биосинтез белка в собственных клетках?
Трансляция: как и зачем ингибировать биосинтез белка в собственных клетках?
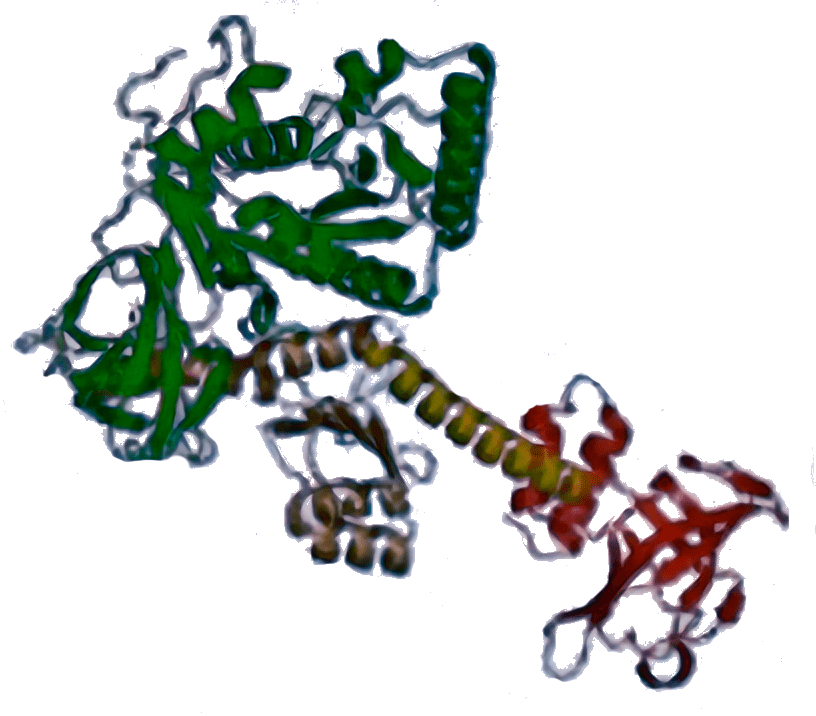
3D-структура эукариотической рибосомы
визуализация автора статьи с использованием скрипта проф. Ненада Бана на основе структуры рибосомы 4V88 [17]
Автор
Редакторы
Статья на конкурс «Био/Мол/Текст»: Биосинтез белка (трансляция) — ключевой процесс клеточного метаболизма, в ходе которого специальные молекулярные машины — рибосомы, — раскодируя последовательность нуклеотидов в матричной РНК, производят полипептидную цепь. Как и к любым другим биомолекулам, к компонентам трансляционного аппарата можно подобрать ингибиторы. Подавление трансляции в эукариотических клетках с помощью малых молекул в последние годы всё чаще применяется при терапии различных заболеваний (в том числе генетических). Казалось бы, для чего ингибировать процесс, который обеспечивает клетку строительным материалом, ферментами, регуляторами и прочими необходимыми для жизни компонентами? Дело в том, что часто при раковой трансформации или вирусной инфекции рибосомы начинают «подыгрывать» врагу, смещая трансляцию в сторону «нежелательных» мРНК. Например, вирусы, чтобы качнуть чашу весов в свою сторону, могут использовать множество интересных механизмов для модификации клеточной трансляции. Таким образом, лекарства, которые подавляют биосинтез белка, могут намного сильнее затормозить рост клеток, вышедших из-под контроля, нежели «законопослушных». Это их свойство и используется при терапии.
Конкурс «Био/Мол/Текст»-2021/2022
Эта работа опубликована в номинации «Своя работа» конкурса «Био/Мол/Текст»-2021/2022.
Партнер номинации — компания Cytiva.
Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.
Генеральный партнер конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Я работаю в лаборатории системной биологии старения в отделе взаимодействия вирусов с клеткой НИИ физико-химической биологии имени А.Н. Белозерского МГУ. На втором курсе моя курсовая работа была связана с поиском ингибиторов трансляции у эукариот и созданием базы таких ингибиторов. Данная статья подготовлена по материалам обзора, опубликованного в спецвыпуске журнала «Биохимия» [1].
Молекулярный аппарат трансляции и его консервативность
Трансляционный цикл на множестве этапов может быть нарушен или замедлен многочисленными и разнородными по химическому строению ингибиторами. Ключевые компоненты трансляционного аппарата клетки — это рибосомы и факторы трансляции (белки, помогающие рибосоме реализовывать разные этапы трансляционного цикла), а также большое количество вспомогательных белков, необходимых для обеспечения синтеза нужными материалами: например, аминоацил-тРНК-синтетазы (АРСазы) — ферменты, соединяющие тРНК с соответствующей ей аминокислотой; или регуляторы биосинтеза белка — компоненты сигнальных путей, связанных с трансляцией. При подборе ингибиторов нельзя не учитывать, что многие из этих молекул есть у всех живых организмов, и некоторые из них довольно консервативны. А значит, одни и те же вещества могут действовать как на про-, так и на эукариот, что не всегда приемлемо.
Каждый живой организм на Земле может быть отнесен к одному из трех доменов жизни: это максимально удаленные друг от друга в эволюционном смысле группы — эукариоты (здесь ищите самые известные царства: животных, растений и грибов), бактерии и археи [2]. Эта удаленность означает, что они давно разошлись (то есть их последний общий предок жил давно [3]), и у представителей групп накопилось множество отличий. Но есть и признаки, по которым представители различных доменов похожи друг на друга. Речь идет об основополагающих признаках: например, способности удваивать ДНК, синтезировать на ее основе РНК и в конце концов получать закодированный в ней белок. Трансляция относится к самым консервативным биологическим процессам.
При ближайшем рассмотрении оказывается, что устройство белоксинтезирующего аппарата довольно схоже у представителей разных доменов. К примеру, основные факторы инициации и элонгации у бактерий имеют гомологов у архей, а рибосомы архей по многим аспектам строения очень напоминают рибосомы эукариот (что даже позволило создать из рибосом дрожжей гибридные рибосомы, в которых одна из субъединица очень напоминала рибосомную субъединицу архей [4]). В пределах этих трех доменов есть отличия, но мы видим, что трансляционная машинерия в целом очень консервативна, и таких отличий не так много. Это является несомненным свидетельством общности (монофилетичности) происхождения жизни.
Хотя это зависит от того, какие критерии для отнесения к живому используются. В зависимости от них под определение «живое» может попасть даже клетка из компьютерной игры Конвея «Жизнь», но под критерии классического определения жизни подпадают всё же только представители этих трех доменов.
Ингибиторы трансляции как антибиотики
Подробнее про различные классы антибиотиков и про то, как они действуют, можно прочитать в статье «Биомолекулы» «Антибиотики vs Бактерии. “Война Бесконечности” или всему есть предел?» [6].
Однако в этой статье речь пойдет об ингибиторах эукариотической трансляции — ведь многие из них служат мощными противоопухолевыми и антивирусными препаратами, используются для иммуносупрессии при пересадке органов или для обезболивания. Некоторые из этих веществ рассматривают даже как возможное «лекарство от старости». Но перед тем как переходить к их рассмотрению, нам придется вспомнить основные этапы трансляционного цикла.
Трансляционный цикл
Чтобы оценить все разнообразие ингибиторов биосинтеза белка, давайте для начала ознакомимся с теми этапами трансляционного цикла, на которые может быть направлено их действие. Эти этапы изображены на рисунке 1 (кликнув на элемент, вы можете прочитать про него подробнее в «Википедии»). Кстати, некоторые этапы этого сложного процесса до сих пор плохо изучены.
Рисунок 1. Трансляционный цикл эукариот (с подсказками!) и избранные сигнальные каскады, влияющие на него. Также показаны самые известные и изученные ингибиторы цикла (черная рамка означает принципиально другой механизм действия). Вещества сгруппированы в соответствии со стадиями синтеза белка, в которых участвуют их мишени. Стадии обозначены кодами. Инициация трансляции: i.1 — связывание eIF2 с Met-тРНК и образование тройного комплекса eIF2/Met-тРНКi/GTP (TC); i.2 — взаимодействие eIF4A и eIF4G; i.3 — взаимодействие eIF4E и eIF4G; i.4 — связывание eIF4E с m 7 G-кэпом на 5′-конце мРНК; i.5 — ингибирование хеликазной (расплетающей мРНК) активности eIF4A при посадке eIF4F на мРНК и последующем рибосомном сканировании; i.6 — узнавание AUG-кодона при сканировании; i.7 — взаимодействие eIF5B с 60S-субъединицей; i.8 — взаимодействие eIF6 с 60S-субъединицей; i.9 — присоединение 60S-субъединицы к 48S преинициаторному комплексу (48S PIC) с образованием 80S инициаторного комплекса (80S IC). Элонгация и сопутствующие реакции: e.1 — аминоацилирование тРНК; e.2 — диссоциация eEF1A/GDP после доставки аминоацил-тРНК (Аа-тРНК); e.3 — продвижение полипептида в рибосомном тоннеле; e.4 — декодирование; e.5 — пептидилтрансферазная реакция; e.6 — транслокация; e.7 — диссоциация eEF2/GDP после транслокации. Терминация: t.1 — узнавание стоп-кодона; t.2 — гидролиз пептидил-тРНК. Рециклинг: r.1 — диссоциация 60S-субъединицы. Коды модуляторов сигнальных каскадов: s.1–s.3 — активаторы киназ фактора eIF2; s.4 — ингибиторы фосфатаз фактора eIF2; s.5 — ингибиторы киназы PI3K; s.6 — ингибиторы активного центра киназы mTOR; s.7 — аллостерические ингибиторы mTOR в составе комплекса mTORC1. Рисунок позаимствован из нашей статьи в журнале «Биохимия» [1]. Более полная его версия с поясняющими таблицами доступна на сайте базы ингибиторов EuPSIC
Схема может показаться сложной, но в действительности это не так. Попробуйте выхватить взглядом желтую 40S-субъединицу (в свободном от других компонентов трансляции виде ее можно найти рядом со стадией i.1) и пройтись по циклу, как в настольной игре, посмотрев на все, что успевает с ней за это время произойти. Особенно любознательным предлагаем покликать по элементам схемы и прочитать о каждом из этапов дополнительно.
Этапы трансляции
Трансляционный цикл принято подразделять на несколько этапов:
Отдельно происходит активация аминокислот с помощью аминоацил-тРНК-синтетаз (см. e.1 на рисунке 1).
Некоторые трансляционные факторы известны уже очень давно, для них понятна функция, известны ортологи у архей и бактерий (подробнее про гомологичные взаимоотношения генов можно прочитать здесь [7]) и выяснено, являются ли они строго необходимыми для синтеза белка — ведь некоторые вирусные мРНК, например, могут обходиться без целого ряда факторов инициации трансляции [8], [9]. Роль других участников была открыта относительно недавно. Примером таких белков служат факторы DENR и MCTS1 (см. область рециклинга (r) на рисунке 1), изучением которых, кстати, занимается наша лаборатория.
На рисунке 1 (см. s.1, s.2) также изображена часть путей внутриклеточного сигналинга, которые непосредственно регулируют трансляцию. Кроме того, существует еще и сложнейший процесс сборки рибосомы из рибосомной РНК и белков, который протекает по большей части в ядре. Его также можно подавить низкомолекулярными веществами, но о них известно гораздо меньше, а их специфичность часто оставляет желать лучшего.
Типы ингибиторов
С ингибиторами трансляции удобно знакомиться, если классифицировать их согласно мишеням, на которые они воздействуют.
Ингибиторы эукариотической рибосомы
Многие из ингибиторов действуют на рибосомы. При этом они могут быть универсальными (подавлять трансляцию у всех доменов живого), а могут — специфичными (например, к рибосоме эукариот или даже каких-то узких таксономических групп). Специфичность действия, как правило, определяется тонкими различиями в строении места связывания: структурные исследования показывают, что часто достаточно замены одного нуклеотида в рРНК или разницы в единственной аминокислотной позиции рибосомного белка, чтобы конфигурация участка не позволяла ингибитору связаться. Подавляющее большинство ингибиторов рибосомы действует на стадии элонгации, однако существуют и другие типы, перечисленные в таблице 1 (заметьте, что пункты могут перекрываться).
| Типы ингибиторов | Классы химических веществ и известные представители | Краткие комментарии |
|---|---|---|
| Рибосом-направленные ингибиторы инициации трансляции | Эдеин, MDMP, eIFsixty-4 | Небольшая группа ингибиторов, механизмы действия которых сильно различаются. Основной механизм — нарушение взаимодействия с лигандами: блокирование связывания факторов инициации или нарушение аккомодации инициаторной тРНК (рис. 1: i.6–i.9). |
| Рибосом-направленные ингибиторы элонгации (кроме веществ, вызывающих ошибки декодирования) | Анизомицин, гомохаррингтонин, трихотецины, квассиноиды, амикумацин A, циклогексимид, эметин, лиссоклимид, гигромицин B, тетраценомицин X и другие | Большая и разнообразная по химическому строению и механизмам действия группа. Могут действовать на транспептидацию, транслокацию, вызывать преждевременную терминацию или блокировать пептидный тоннель. Как правило, связываются с функциональными сайтами рибосомы. Эти сайты вместе с избранными ингибиторами, присоединенными к рибосоме, можно изучить на рис. 5. Интересно, что некоторые ингибиторы элонгации, действующие на ее самые начальные стадии, часто путают с ингибиторами инициации. Самым известным таким ингибитором является гомохаррингтонин (рис. 2). Все ингибиторы, представленные на рисунке 5, кроме TC007 и паромомицина, относятся именно к данному типу (рис. 1: e.3, e.5, e.6). |
| Вещества, вызывающие ошибки декодирования | Аминогликозиды (преимущественно с 2-DOS кольцом) и ряд других ингибиторов [6] | Основное место связывания таких веществ на эукариотической рибосоме — декодирующий центр малой субъединицы (спираль h44, см. рис. 5). Это связывание вызывает стабилизацию той конформации, которую рибосома должна принимать при наличии «правильной» аминоацил-тРНК в А-сайте. В результате реакция по переносу остатка аминокислоты может произойти, даже если там находится не соответствующая кодону тРНК, что вызывает ошибки декодирования, а также «проскок» стоп-кодона (подробнее это описано ниже на примере аталурена) — рис. 1: e.4. |
| Рибосомные ингибиторы, влияющие на терминацию | Аминогликозиды, гиролин | Совсем небольшая группа ингибиторов. У эукариот вещества, специфично блокирующие собственно терминацию (высвобождение полипептида), изучены плохо. Поэтому список ингибиторов t.1 в основном представлен веществами из предыдущего списка (e.4), т.к. их влияние на точность декодирования сказывается в том числе и на узнавании стоп-кодона, что вызывает его «проскок». Подтвержденным ингибитором высвобождения пептида у эукариот является, пожалуй, пока только гиролин (рис. 1: t.1, t.2). |
| Ингибиторы рибосомного рециклинга | Некоторые аминогликозиды, бацифелацин и неоквассин | Пока что веществ, которые бы специфично действовали на эту стадию, не обнаружено, но, возможно, это просто вопрос времени. Механизмы рециклинга и вовлеченные в него факторы сильно различаются у эукариот и бактерий, а у архей эта стадия изучена особенно плохо (рис. 1: r.1). |
Если классифицировать по сайтам связывания, то выделяют: ингибиторы пептидилтрансферазного центра; ингибиторы транслокации, узнающие E-сайт; ингибиторы, связывающиеся в пептидном тоннеле; ингибиторы, взаимодействующие с декодирующим центром; ингибитор, связывающийся с ГТФаза-активирующим центром (пока достоверно описан только один такой пример).
Пока не так много веществ этого типа допущены до практического применения (самое известное из них — гомохаррингтонин (рис. 2)), но их число постепенно растет. Клинические и доклинические испытания проходили, например, такие ингибиторы пептидилтрансферазного центра, как ликорин, нарциклазин и бруцеантин, а ингибитор транслокации эметин используется как антигельминтное и противомалярийное средство.
Интересные случаи применения
Гомохаррингтонин. Рибосом-направленные ингибиторы элонгации
Гомохаррингтонин — ингибитор пептидилтрансферазного центра в виде полусинтетического аналога омацетаксина мепесукцината (продаваемого под торговой маркой Synribo; рис. 2) активно применяется для лечения хронического миелоидного лейкоза, а также проходит испытания в терапии ряда других онкологических заболеваний. Кроме того, его широко используют в научной работе: его способность прекращать трансляцию новоинициировавших рибосом (при этом не трогая рибосомы, которые уже успели синтезировать несколько пептидных связей) применяется для картирования старт-кодонов в мРНК.
Рисунок 2. «Синрибо». Применяется для лечения хронического миелоидного лейкоза у людей, лечение которых ингибиторами тирозинкиназ не дало желаемого эффекта. Одобрен одновременно как американским (FDA), так и европейским (EMA) медико-биологическим агентствами.
Аталурен и гентамицин. Вещества, вызывающие ошибки декодирования
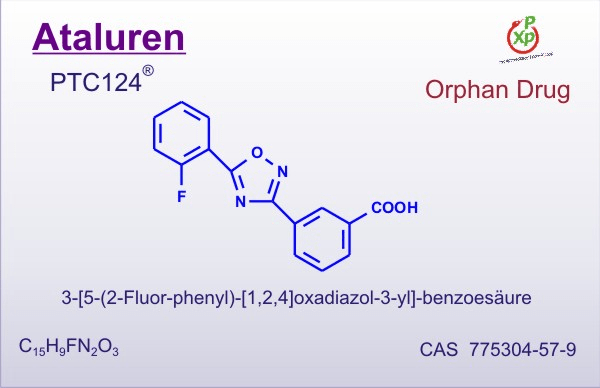
Рисунок 3. Аталурен. Индуцирует «проскакивание» стоп-кодонов. Лекарство применяется для лечения людей с генетическими заболеваниями, вызванными появлением преждевременного стоп-кодона в важных генах (нонсенс-мутациями). В том числе зарегистрирован и в России. К сожалению, из-за очень высокой цены — от пяти до семи тысяч евро за упаковку, которой хватит на месяц, — не все могут получить доступ к этому лечению.
Рисунок 4. Гентамицин. Пока что препарат прошел клинические испытания только как антибиотик, однако у его производных есть потенциал и в терапии генетических заболеваний. Препарат, продаваемый в аптеках, представляет собой смесь более четырех похожих веществ. Его стоимость куда ниже, чем у аталурена: купить тюбик мази для наружного применения можно за 40 рублей. Однако в нынешнем виде гентамицин нельзя принимать в дозах, достаточных для устранения эффектов нонсенс-мутаций: из-за воздействия на рибосомы митохондрий он имеет побочные эффекты в виде нефро- и ототоксичности.
Более 10% генетических заболеваний вызвано однонуклеотидными мутациями, которые привели к появлению преждевременного стоп-кодона в кодирующей части какого-либо важного гена (такие мутации называют нонсенс-мутациями). К примеру, нонсенс-мутации в гене белка дистрофина могут вызывать миодистрофию Дюшенна. Интересно, что механизм терминации на таком случайно возникшем, не прошедшем эволюционный отбор стоп-кодоне несколько отличается от нормального. Это связано с тем, что получившийся «преждевременный» сигнал терминации чаще всего находится далеко от 3′-конца мРНК и расположен не в последнем экзоне (как «настоящие» стоп-кодоны), а также лишен нужного нуклеотидного контекста. В клетке действует специальная защитная система, которая обнаруживает «неправильную» терминацию на таком стоп-кодоне и отправляет транскрипты с нонсенс-заменой на деградацию. Однако примерно в одном из 100–10000 случаев (в зависимости от условий) рибосома проскакивает стоп-кодон, вместо терминации вставляя в пептид какую-либо аминокислоту и продолжая синтез [10], [11]. Долю таких сквозных прочтений можно увеличить с помощью специальных ингибиторов, самыми известными из которых являются аталурен и аминогликозиды, к коим относится гентамицин (рис. 4). Несмотря на то, что сквозные прочтения могут вызывать несколько классов веществ, обычно эта активность ассоциируется с самым большим классом — аминогликозидами. Эти вещества сильнее действуют на преждевременные стоп-кодоны, чем на «правильные», благодаря чему они могут иметь потенциал в терапии заболеваний, вызываемых нонсенс-мутациями. Однако аминогликозиды известны своей токсичностью — ведь они, помимо индукции сквозного прочтения, еще и снижают точность работы рибосомы. Из веществ неаминогликозидной природы, действующих аналогичным образом, лучше всего изучен аталурен (рис. 3), однако он также не очень хорошо показал себя в клинических испытаниях; более того, в некоторых работах приведены аргументы в пользу того, что это вещество может и вовсе не работать так, как заявлено, а его эффекты в экспериментах были связаны с влиянием на стабильность белка-репортера. Поэтому поиски индукторов ошибок декодирования, приемлемых для терапии наследственных заболеваний, продолжаются.
Чтобы понять, как именно ингибиторы могут подавлять активность рибосомы, полезно вспомнить ее общее строение. Это удобно сделать с помощью интерактивного аплета (см. рис. 5).
Рисунок 5. Пристальный взгляд на эукариотическую рибосому. В верхней кнопочной панели можно изучить структурные элементы рибосомы. Для того чтобы узнать о структурном элементе или сайте связывания, наведите курсор на кнопку. В нижней панели можно найти распространенные ингибиторы, которые действуют на разные части эукариотической рибосомы, визуализированные в предыдущем разделе. В виде на лиганд взаимодействующие основания выделены оранжевым. Встроенный в статью этот апплет очень маленький, поэтому рекомендуем открыть полноэкранную версию.
Для показа структурных элементов использована структура дрожжевой рибосомы, полученная методом криоэлектронной микроскопии группой Р. Бекманна (6SNT). Для визуализации используется веб-плагин MolStar.
Ингибиторы трансляционных факторов
Трансляционные факторы — белки, помогающие рибосоме реализовывать разные этапы трансляционного цикла. Чаще всего эти факторы жизненно необходимы для нормального синтеза белка в клетках или митохондриях/пластидах, которые, как правило, тоже имеют свой трансляционный аппарат.
Эта группа веществ взаимодействует с факторами в растворе, блокируя их активность или препятствуя присоединению к рибосоме (во втором случае они могут контактировать не только с фактором, но и с рибосомой, что приводит к неоднозначности в классификации: иногда их относят к ингибиторам рибосомы).
Ингибиторы факторов инициации трансляции
Инициация трансляции в эукариотических клетках устроена сложнее, чем у бактерий: факторов инициации здесь больше, и многие из них являются эукариот-специфичными. Поэтому и набор мишеней для ингибиторов довольно разнообразен. Со всем многообразием факторов инициации и их набором у трех доменов живого удобно ознакомится в таблице 2.
Наиболее перспективными с точки зрения применения в клинике блокаторами этой стадии являются, пожалуй, ингибиторы РНК-хеликазы eIF4A, которые демонстрируют яркую антивирусную активность. В частности, два вещества, относящиеся к семейству рокаглатов, — сильвестрол и зотатифин — в данный момент проходят клинические испытания на больных COVID-19 [12], [13]. Вообще, биосинтез белка является «ахиллесовой пятой» многих вирусов, поскольку большинству клеток обычно не нужно синтезировать белки в таких количествах, как при вирусной инфекции, и незараженная клетка может безболезненно пережить невысокие концентрации трансляционных ингибиторов, которые убьют инфицированную или просто заблокируют размножение вируса.