азотная кислота хч что значит хч
Классификация химических реактивов в РФ
Единой система классификации чистоты реактивов в Российской Федерации нет, поэтому в качестве нее выступает система, унаследованная от СССР. Поэтому она применима только для реактивов, произведённых на территории страны. Тем не менее существует ряд ГОСТов и ТУ, которые контролируют качество производимых реактивов. Зарубежные производители используют собственные системы определения и маркировки чистоты веществ.
В России чистота маркируется при помощи аббревиатур и цветовой маркировки на упаковке. В теории химически чистый реактив должен состоять из молекул одного вещества, однако на практике этого добиться практически невозможно. Примеси из воздуха, воды, других реактивов и даже из материалов оборудования, используемого в производстве, всегда присутствуют в готовом продукте.
Технический (ТЕХ.)
Низшей степенью чистоты обладают технические реактивы (тех.). В них содержание основного вещества выше 95%. Маркируются коричневым цветом. Это продукты промышленного синтеза, которые чаще применяются в производственных целях, а не для исследований.
Чистый (Ч.)
Обо значение «чистый» присваивается реактивам с содержанием основного вещества выше 98%. Такие вещества обладают постоянными качественными параметрами и чаще всего служат для качественного анализа в стандартизированных лабораторных исследованиях. Также применяются для субстратов для синтеза и вспомогательных веществ. Маркируются зеленым цветом.
Чистый для анализов (ЧДА)
Главная характеристика чистого для анализа (ч.д.а) реактива – концентрация примесей, которая не влияет на точность аналитических исследований. Количество основного компонента выше 98% или значительно выше, в зависимости от назначения конкретного реагента. Маркируется синим цветом. Служат ч.д.а для выполнения научных исследовательских и аналитических работ в области химии и смежных областях.
Химически чистый (ХЧ)
Химически чистые (х.ч) реактивы содержат более 99% основного компонента. Такая маркировка означает, что количество примесей ниже предела обнаружения химическими методами. Маркируются красным цветом и служат для проведения специальных лабораторных исследований.
Особо чистый (Ос.Ч.)
Особо чистые вещества обладают наивысшей из доступных степеней содержания основного компонента. Количество примесей настолько мало, что не влияет на основные свойства вещества. Но даже у наиболее высокой степени чистоты есть градации. Различия диктуются практическими потребностями практики. Такие реактивы маркируются желтым цветом.
Особо чистые вещества также делятся по количеству и концентрации контролируемых примесей:
Область применения особо чистых реактивов лежит в сфере спектральных анализов (ВЭЖХ, ГХ/МС).
Марки химических реактивов: Х., Ч.Д.А., Х.Ч.
Марки химических реактивов: Х., Ч.Д.А., Х.Ч.
Зачастую различают следующие степени чистоты химических реактивов:
Многие химические реактивы специально производятся для лабораторного использования, но находят применение и очищенные химические продукты, выпускаемые для промышленных целей.
Чистота химических реактивов в России регламентируется Государственными стандартами (ГОСТ) и техническими условиями (ТУ).
Reagents grade (реактивная чистота)
Существует даже такое широко применяемое выражение, как Reagents grade (реактивная чистота). Выражение «технический продукт» применяется как синоним определения «неочищенный». Но в большинстве случаев такое представление о технических продуктах давно устарело.
По степени чистоты химические реактивы делятся на следующие категории:
Квалификацию «чистый» (ч.) присваивают реактивам химическим с содержанием осн. компонента не ниже 98,0%. Для реактивов химических квалификации «чистый для анализа» (ч. д. а.) содержание осн. компонента м. б. выше или значительно ниже 98,0% в зависимости от области применения.
Химреактивы особой чистоты оптическое стекловарение, волоконная оптика
Химреактивы особой чистоты используются для специальных целей, например, в оптическом стекловарении или в волоконной оптике.
Для различия подклассов веществ особой чистоты введена маркировка. На таре с реактивом каждого подкласса имеется этикетка особого цвета:
| Подкласс | Цвет этикетки | Содержание основного компонента, % | Содержание примесей, % |
| А1 | Коричневый | 99,9 | 10-1 |
| А2 | Серый | 99,99 | 10-2 |
| B3 | Синий | 99,999 | 10-3 |
| B4 | Голубой | 99,9999 | 10-4 |
| B5 | Темно-зеленый | 99,99999 | 10-5 |
| B6 | Светло-зеленый | 99,999999 | 10-6 |
| C7 | Красный | 99,9999999 | 10-7 |
Другие методы классификации веществ особой чистоты
Существуют и другие методы классификации веществ особой чистоты. Так, в научно-исследовательском институте химических реактивов и особо чистых веществ (ИРЕА) предложено характеризовать чистоту препарата по суммарному содержанию определенного числа микропримесей.
Особо чистый SiO2 нормируется десять примесей
Например, для особо чистого SiO2 нормируется десять примесей (Al, B, Fe, Ca, Mg, Na, P, Ti, Sn, Pb), причем общее содержание их не превышает 1·10-5. Для такого препарата устанавливается индекс «ос. ч. 10-5». Для упаковки препаратов высокой чистоты необходимо полностью
отказаться от стеклянной посуды, являющейся источником загрязнений. Поэтому чаше всего используют полиэтиленовые банки, еще лучше применять банки из тефлона (фторопласт-4).
или количественно определены при добавлении реактива. Специфическими химическими реактивами, в свою очередь, считаются такие реагенты, которые дают характерную реакцию с анализируемым веществом или ионом в известных условиях, независимо от присутствия других ионов.
Для контроля качества питьевой воды и воды источников водоснабжения применяют специальные наборы химических реактивов.
Наборы химических реактивов
В наборы химических реактивов включены эталонные растворы определяемых ионов для градуировки измерительных приборов и оценки точности измерений.
Химреактивы в наборах расфасованы по принципу точных навесок (фиксаналов) и приготовление рабочих растворов сводится к разведению химических реактивов, входящих в набор, дистиллированной водой по прилагаемой к набору инструкции.
Купить азотную кислоту. Цена, свойства, применение, транспортировка. Фасовка в тару
Азотная кислота неконцентрированная ГОСТ Р 53789-2010. Азотная кислота концентрированная ГОСТ 701-89
Основные характеристики азотной кислоты.
НАИМЕНОВАНИЕ ПОКАЗАТЕЛЯ
ВЫСШИЙ СОРТ
ПЕРВЫЙ СОРТ
ВТОРОЙ СОРТ
Внешний вид
Бесцветная или слегка желтоватая прозрачная жидкость без механических примесей
Азотной кислоты, %, не менее
Оксидов азота (в пересчете на N2O4), %, не более
Остатка после прокаливания, %, не более
0,004
Химические свойства азотной кислоты
Особенности отгрузки азотной кислоты
ТИП ТАРЫ
ВЕС НЕТТО, КГ
ВЕС БРУТТО, КГ
ПЭТ-канистра 10,5 л
13,55
ПЭТ-канистра 21 л
Кубовая емкость 1000 л (еврокуб)
1355,0
1425,0
Автоцистерна
22000-24000
УСЛОВИЯ ТРАНСПОРТИРОВКИ И ХРАНЕНИЯ АЗОТНОЙ КИСЛОТЫ
Растворы азотной кислоты перевозятся железнодорожным и автомобильным транспортом в соответствии с правилами перевозок опасных грузов, действующими на данном виде транспорта. Цистерны должны быть заполнены не более чем на 90% их вместимости. Неконцентрированную азотную кислоту хранят в герметичных резервуарах-хранилищах, изготовленных из кислотостойких материалов, на открытых площадках. Неконцентрированную азотную кислоту, упакованную в тару, хранят в крытых складских помещениях при температуре не более 40°С. Не допускается совместное хранение и транспортирование неконцентрированной азотной кислоты с органическими веществами, легковоспламеняющимися и горючими веществами. Особого внимания заслуживает хранение вещества. Азотная кислота должна содержаться в закрытых помещениях без горючих и легковоспламеняющихся веществ.
Типы тары для доставки азотной кислоты
ЖД цистерна
Автоцистерна
Мелкогабаритные
Применение азотной кислоты
В зависимости от концентрации азотная кислота применяется в различных отраслях: производство широкого спектра азотных удобрений; оборонно-промышленный комплекс ; травление печатных форм в станковой графике; подкисление тонирующих растворов при производстве фотографии; фармацевтика, изготовление лекарственных средств производство отравляющих и взрывчатых веществ;производство ракетного топлива;растворение, травление, гравировка металлов, гальванизация и многое другое
Где применяется химический реактив азотная кислота?
Область применения азотной кислоты
в производстве минеральных удобрений;в военной промышленности (дымящая — в производстве взрывчатых веществ, как окислитель ракетного топлива, разбавленная — в синтезе различных веществ, в том числе отравляющих);крайне редко в фотографии — разбавленная — подкисление некоторых тонирующих растворов; в станковой графике — для травления печатных форм (офортных досок, цинкографических типографских форм и магниевых клише); в производстве красителей и лекарств (нитроглицерин); в ювелирном деле — основной способ определения золота в золотом сплаве; в основном органическом синтезе (нитроалканы, анилин, нитроцеллюлоза, тротил).
Техника безопасности при обращении с кислотой
Азотная кислота опасна для человека и требует при работе с ней соблюдения мер предосторожности. В первую очередь необходимо защитить органы дыхания и слизистые оболочки. Если пары азотной кислоты попадут в организм, это грозит раздражением дыхательных путей. При воздействии азотной кислоты на кожу остаются долгозаживляющие раны, поэтому при работе с ней необходимо использовать защитную одежду и перчатки. Для человека допустимая концентрация азотной кислоты в воздухе рабочей зоны ровняется 2 мг/м. При работе с азотной кислотой нужно учесть, что данный химический реактив является сильной кислотой, которая относиться к веществам 3 класса опасности. Для сотрудников лабораторий, а также лиц, допущенных к работе с подобными веществами, существуют особые правила. Во избежание прямого контакта с реактивом все работы проводить строго в специальной одежде, которая включает: кислотозащитные рукавицы и обувь, комбинезон, перчатки нитриловые, а также очки и респираторы, как средства защиты органов дыхания и зрения. Несоблюдение данных требований может привести к самым серьезным последствиям: при попадании на кожу – ожогам, язвам, а при попадании в вдыхательные пути – отравлениям, вплоть до отека легких.
Воздействие на организм человека азотной кислоты
Раствор и пары азотной кислоты оказывают сильное коррозионное воздействие на кожу, глаза и слизистые оболочки. Вдыхание паров приводит к бронхиальному катару, пневмонии и прижиганию альвеол. Что в итоге может привести к отеку легких и смерти. При кратковременном вдыхании кислоты возможен сильный кашель (до рвоты), ангина, ожег слизистых горла, сильная головная боль. Азотная кислота может попасть в организм человека несколькими путями: ингаляционно (через дыхательные пути). Интересным фактом является то, что ученые доказали, что если человек постоянно имеет контакт с азотной кислотой, то она оказывает значительно менее разрушительное воздействие на его организм, чем в тех случаях, когда такое воздействие происходит редко. Проведя исследования на лабораторных животных, ученые установили, что при некотором незначительном, но постоянном воздействии на организм подопытных азотной кислоты, в их организме образуется своеобразный барьер, который при следующих контактах не позволяет парам проникать в альвеолы и легочные капилляры. Азотная кислота и её воздействие на организм человека. Водные растворы соляной кислоты представляют опасность для человека при попадании на кожу и слизистые оболочки. Кроме того, концентрированные растворы кислоты выделяют пары, опасные при вдыхании. ПДК паров соляной кислоты в рабочих помещениях промышленных предприятий 5 мг/м3. Запах паров начинает ощущаться при концентрации С0 = 2 мг/м3. Поражающая концентрация С = 640 мг/м3. При вдыхании паров соляной кислоты человек ощущает боль в горле и раздражение слизистой оболочки рта и носа. Появляется сухой кашель, тошнота и рвота с выделением слизи и крови.
Условия хранения азотной кислоты
Азотную кислоту желательно хранить в тёмных ёмкостях, так как при ярком освещении она разлагается на один из оксидов азота (бурый газ – NO2) и воду. Также ее можно хранить в стеклянных или керамических бутылях, специально предназначенных для хранения кислот или в алюминиевых сосудах, но при условии содержания в темном помещении.
Хранение и транспортировка азотной кислоты
Производство азотной кислоты
Современный способ её производства основан на каталитическом окислении синтетического аммиака на платино-родиевых катализаторах (процесс Оствальда) до смеси оксидов азота (нитрозных газов), с дальнейшим поглощением их водой
4NH3 + 5O2 →Pt 4NO + 6H2O
2NO + O2 → 2NO2
4NO2 + O2 + 2H2O → 4HNO3
Все три реакции — экзотермические, первая — необратимая, остальные — обратимые. Концентрация полученной таким методом азотной кислоты колеблется в зависимости от технологического оформления процесса от 45 до 58 %. Для получения концентрированной азотной кислоты либо смещают равновесие в третьей реакции путём повышения давления до 50 атмосфер, либо в разбавленную азотную кислоту добавляют серную кислоту и нагревают, при этом азотная кислота, в отличие от воды и серной кислоты, испаряется. Впервые азотную кислоту получили алхимики, нагревая смесь селитры и железного купороса:
4KNO3 + 2FeSO4 ⋅ 7H2O →ot Fe2O3 + 2K2SO4 + 2HNO3↑ + 2NO2↑ + 6H2O
Чистую азотную кислоту получил впервые Иоганн Рудольф Глаубер, действуя на селитру концентрированной серной кислотой
KNO3 + H2SO4 →ot KHSO4 + HNO3↑
Дальнейшей дистилляцией может быть получена т. н. «дымящая азотная кислота», практически не содержащая воды. Полезно знать В реакциях азотной кислоты с металлами никогда не образуется водород. Окислителем в этих реакциях выступает атом азота кислотного остатка, поэтому продуктами реакции являются соединения азота в разной степени окисления. Состав соединений зависит от активности металла и концентрации азотной кислоты. Концентрированная азотная кислота пассивирует железо и алюминий. На их поверхности под действием концентрированной кислоты образуется прочная плёнка, которая защищает металл от дальнейшей реакции. Поэтому концентрированную азотную кислоту можно транспортировать в стальных или алюминиевых цистернах.
Плотность растворов различной концентрации азотной кислоты
Плотность,
г/см3
Концентрация
Плотность,
г/см3
Классификация реактивов по чистоте
Недавно посетитель сайта задал нам вопрос: 
«техн» — технический
Считается низшей квалификацией реактива. Основного вещества в нем должно быть не менее 95%. Такие реактивы обычно допустимо применять в промышленности.
«ч» — чистый
Основного вещества в нем не менее 98%. Соответственно, до 2% могут составлять примеси. Посторонние запахи у такого реактива присутствуют крайне редко, вид тоже соответствует нормам, но цвет может незначительно отличаться.
«чда» — чистый для анализа
Средняя квалификация реактива. Показывает, что в нем не менее 99% чистого вещества, а оставшиеся 1 или менее 1% примесей не мешают применять вещество в аналитических целях.
«хч» — химически чистый
Высшая квалификация реактива, означающая, что оно содержит более 99% основного вещества, точно соответствует нормам по внешнему виду и окраске.
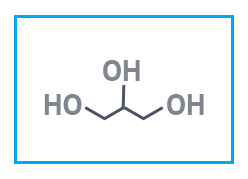 |  | 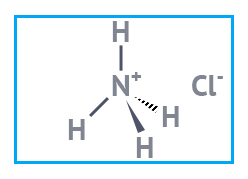 |
| Глицерин USP | Акридиновый желтый «чда» | Аммоний хлористый BASF |
Реактивы высокой частоты подразделяют еще на два класса:
«о.с.ч.» — особо чистый
Самые чистые реагенты, с содержанием отдельных примесей от 0,00001 до 0,0000000001%, в зависимости от конкретного вещества, возможностей его очистки, возможностей получить такое чистое вещество или выявить имеющиеся примеси.
Приведенная выше классификация — российская, ее требования регламентируются ГОСТом 13867-68: «Продукты химические. Обозначение чистоты» или ТУ (Техническими условиями). За рубежом тоже существуют свои классификации, причем во многих странах они свои.
Наиболее часто встречающиеся импортные квалификации:
Technical — технический. Примерно соответствует нашей квалификации «техн». Реактивы для промышленного применения, запрещенные к использованию в пищепроме, медицине и фармацевтике.
Еxtra pure — особо чистый. Реагент содержит не менее 99% основного вещества.
For synthesis — для синтеза. Содержание основного вещества — около 99%, то есть степень чистоты почти такая же высокая, как у реагентов extra pure, но цена, обычно, более доступная.
Purified — очищенный. Реактив высокой степени очистки. Как правило, это квалификацию присваивают только неорганическим веществам и тогда, когда официальных стандартов, регламентирующих допустимое содержание примесей в этом веществе, просто нет.
USP (фармакопея США) — квалификация, подтверждающая соответствие вещества требованиям фармакопеи США.
BP (фармакопея Британская) — квалификация, подтверждающая соответствие вещества требованиям фармакопеи Британии.
DAB (фармакопея Германии) — квалификация, подтверждающая соответствие вещества требованиям фармакопеи Германии.
Ph. Eur (фармакопея Европейская) — квалификация, подтверждающая соответствие вещества требованиям европейской фармакопеи.
Некоторые другие буквенные обозначения 
«для МБЦ» — для микробиологических исследований.
«б/в» — безводный.
BASF — реагент производства крупнейшего в мире, германского химического концерна BASF.
«в/с» — высший сорт.
«пищ.» — пищевой.
«имп» — импортный.
Кислота азотная тех., Ч, ХЧ
Применение азотной кислоты:
Азотная кислота и её пары очень вредны для организма человека: пары азотной кислоты вызывают раздражение дыхательных путей, а сама кислота оставляет на коже язвы.
Показатели качества по ГОСТ 14192-77:
При кристаллизации из водных растворов азотная кислота образует кристаллогидраты:
моногидрат HNO3·H2O, Tпл = −37,62 °C
тригидрат HNO3·3H2O, Tпл = −18,47 °C
Высококонцентрированная HNO3 имеет обычно бурую окраску вследствие происходящего на свету процесса разложения:
При нагревании азотная кислота распадается по той же реакции. Азотную кислоту можно перегонять (без разложения) только при пониженном давлении (указанная температура кипения при атмосферном давлении найдена экстраполяцией).
Золото, некоторые металлы платиновой группы и тантал инертны к азотной кислоте во всём диапазоне концентраций, остальные металлы реагируют с ней, ход реакции при этом определяется её концентрацией.
HNO3 как сильная одноосновная кислота взаимодействует:
а) с основными и амфотерными оксидами:
в) вытесняет слабые кислоты из их солей:
При кипении или под действием света азотная кислота частично разлагается:
Азотная кислота в любой концентрации проявляет свойства кислоты-окислителя, при этом азот восстанавливается до степени окисления от +4 до −3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты. Как кислота-окислитель, HNO3 взаимодействует:
а) с металлами, стоящими в ряду напряжений правее водорода:
б) с металлами, стоящими в ряду напряжений левее водорода:
С золотом и платиной азотная кислота, даже концентрированная не взаимодействует. Железо, алюминий, хром холодной концентрированной азотной кислотой пассивируются. С разбавленной азотной кислотой железо взаимодействует, причем в зависимости от концентрации кислоты образуются не только различные продукты восстановления азота, но и различные продукты окисления железа:
Азотная кислота окисляет неметаллы, при этом азот обычно восстанавливается до NO или NO2:
Некоторые органические соединения (например амины и гидразин, скипидар) самовоспламеняются при контакте с концентрированной азотной кислотой.
Некоторые металлы (железо, хром, алюминий, кобальт, никель, марганец, бериллий), реагирующие с разбавленной азотной кислотой, пассивируются концентрированной азотной кислотой и устойчивы к её воздействию.
Смесь азотной и серной кислот носит название «меланж». Благодаря наличию амила достигается концентрация в 104 %[источник не указан 198 дней] (то есть при добавлении к 100 частям меланжа 4 частей дистиллята концентрация остаётся на уровне 100 %, вследствие поглощения воды амилом[источник не указан 198 дней]).
Азотная кислота широко используется для получения нитросоединений.
Смесь трех объёмов соляной кислоты и одного объёма азотной называется «царской водкой». Царская водка растворяет большинство металлов, в том числе золото и платину. Её сильные окислительные способности обусловлены образующимся атомарным хлором и хлоридом нитрозила.
HNO3 — сильная кислота. Её соли — нитраты — получают действием HNO3 на металлы, оксиды, гидроксиды или карбонаты. Все нитраты хорошо растворимы в воде.
Соли азотной кислоты — нитраты — при нагревании необратимо разлагаются, продукты разложения определяются катионом:
Нитраты в водных растворах практически не проявляют окислительных свойств, но при высокой температуре в твердом состоянии нитраты — сильные окислители
Цинк и алюминий в щелочном растворе восстанавливают нитраты до NH3:
С азотной кислотой не реагируют стекло, фторопласт-4.
Методика получения разбавленной азотной кислоты путём сухой перегонки селитры с квасцами и медным купоросом была, по видимому, впервые описана трактатах Джабира (Гебера в латинизированных переводах) в VIII веке. Этот метод с теми или иными модификациями, наиболее существенной из которых была замена медного купороса железным, применялся в европейской и арабской алхимии вплоть до XVII века.
В XVII веке Глаубер предложил метод получения летучих кислот реакцией их солей с концентрированной серной кислотой, в том числе и азотной кислоты из калийной селитры, что позволило ввести в химическую практику концентрированную азотную кислоту и изучить её свойства. Метод Глаубера применялся до начала XX века, причём единственной существенной модификацией его оказалась замена калийной селитры на более дешёвую натриевую (чилийскую) селитру.
Во времена М. В. Ломоносова, азотную кислоту называли крепкой водкой.
Промышленное производство, применение и действие на организм
Азотная кислота является одним из самых крупнотоннажных продуктов химической промышленности.
Производство азотной кислоты
Современный способ её производства основан на каталитическом окислении синтетического аммиака на платино-родиевых катализаторах (процесс Оствальда) до смеси оксидов азота (нитрозных газов), с дальнейшим поглощением их водой
Концентрация полученной таким методом азотной кислоты колеблется в зависимости от технологического оформления процесса от 45 до 58 %. Впервые азотную кислоту получили алхимики, нагревая смесь селитры и железного купороса:
Чистую азотную кислоту получил впервые Иоганн Рудольф Глаубер, действуя на селитру концентрированной серной кислотой:
Дальнейшей дистилляцией может быть получена т. н. «дымящая азотная кислота», практически не содержащая воды.
в ювелирном деле — основной способ определения золота в золотом сплаве;
в производстве минеральных удобрений;
в военной промышленности (дымящая — в производстве взрывчатых веществ, как окислитель ракетного топлива, разбавленная — в синтезе различных веществ, в том числе отравляющих);
крайне редко в фотографии — разбавленная — подкисление некоторых тонирующих растворов[3];
в станковой графике — для травления печатных форм (офортных досок, цинкографических типографских форм и магниевых клише).
в производстве красителей и лекарств (нитроглицерин)
Действие на организм
Азотная кислота и её пары очень вредны: пары вызывают раздражение дыхательных путей, а сама кислота оставляет на коже долгозаживающие язвы. При действии на кожу возникает характерное желтое окрашивание кожи, обусловленное ксантопротеиновой реакцией. При нагреве или под действием света кислота разлагается с образованием высокотоксичного диоксида азота NO2 (газа бурого цвета). ПДК для азотной кислоты в воздухе рабочей зоны по NO2 2мг/м3.




