бактероиды что это такое
Бактероиды
История обнаружения
Бактероиды (Bacteroides) были впервые обнаружены в 1898 году учеными Вейоном и Зюбером (A. Veillon, H. Zuber). Микроорганизмы выделены у больного с абдоминальным абсцессом и получили название Bacillus fragilis. Спустя 14 лет Дистазо (A. Distaso) обнаружил их у здоровых людей, а через семь лет Кастеллани (A. Castellani) и Чалмерс (A. J. Chalmers) дали этим палочкам название Бактероиды.
Внешний вид под микроскопом
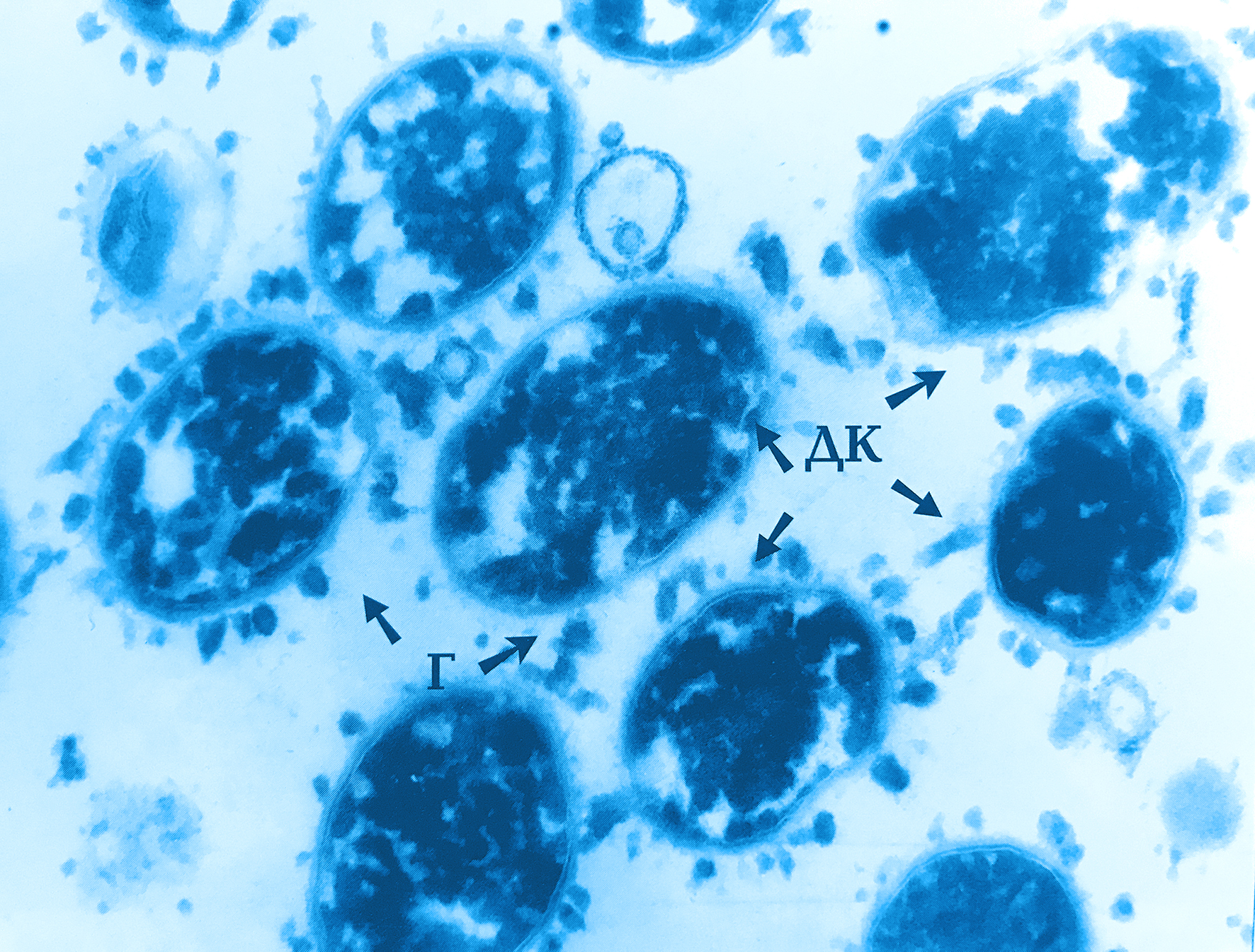
Бактероиды при микроскопии могут иметь разную форму. Преимущественно это небольшие палочки, не окрашивающиеся по Граму. У отдельных видов эти палочки не обособляются при размножении, в результате чего получаются скопления бактерий, напоминающие ветви. Иногда у бактероидов имеются в одном из концов утолщенные вакуоли, за счет чего клетка приобретает форму кеглей или булавы. Поэтому их легко спутать с коринебактериями или спорообразующими бактериями. Бактероиды имеют жгутики и способны к образованию капсулы, позволяющей переждать неблагоприятные для жизни условия.
Где обитает
В норме представители Bacteroides у человека колонизируют толстую кишку и являются типичными представителями нормофлоры, наряду с лакто- и бифидобактериями. В фекалиях здорового человека около 40-50% всех микробных клеток составляют бактероиды.
Классификация
Царство
Bacteria
Тип
Bacteroidetes
Класс
Bacteroidia
Порядок
Bacteroidales
Семейство
Bacteroidaceae
Род
Bacteroides
Prevotella
Свойства
Бактероиды способны утилизировать сахарозу, мальтозу, глюкозу, рамнозу. Продуцируют янтарную, изовалериановую, уксусную и масляную кислоту. Вырабатывают вещества, способные инактивировать антибиотики пенициллового и цефалоспоринового ряда. Для роста необходим углекислый газ в концентрации 5-10% и температурный диапазон от +25 до +45°С. Оптимальная температура +37°С.
Функции
Биологическая роль бактероидов в толстом кишечнике изучена недостаточно. Однако доказана их антагонистическая активность по отношению к сальмонеллам, шигеллам и некоторым патологическим эшерихиям. Можно предположить, что, колонизируя толстый кишечник, представители Bacteroides защищают своего хозяина от инфекционных энтероколитов, вызванных патогенными микроорганизмами.
Вызываемые заболевания
В условиях нарушения иммунитета бактероиды проявляют свою патогенную активность. Они не вырабатывают эндотоксичные вещества, но, поскольку имеют полисахаридную капсулу, могут спровоцировать выработку антител в организме хозяина. В ассоциации с другими патогенными и условно-патогенными бактериями, Bacteroides способны вызывать перитонит, кольпит, пневмонию, пародонтоз, абсцессы, аппендицит, эндокардиты, заболевания слизистых оболочек и кожи.
Профилактика и лечение
Для подавления роста и размножения бактероидов используются антибиотики, в частности, ципрофлоксацин, офлоксацин, метронидазол, клиндамицин, левомицитин. Общеукрепляющие процедуры и элементарная гигиена, защита от стрессов и нормализация пищевого поведения (отказ от голодания и переедания), а также сбалансированный рацион питания способствуют защите от чрезмерного размножения бактероидов.
БАКТЕРОИДЫ
БАКТЕРОИДЫ (греческий bakterion палочка + eidos вид) облигатноанаэробные, не образующие спор, грамотрицательные бактерии палочковидной формы, относящиеся к роду Bacteroides семейства Bacteroidaceae. Бактероиды — одни из наиболее частых возбудителей неклостридиальных анаэробных и смешанных анаэробно-аэробных инфекций у человека.
Впервые грамотрицательные бесспоровые анаэробы были выделены Вейоном и Зюбером (A. Veillon, H. Zuber) в 1898 году у больного с абдоминальным абсцессом, о писаны как Bacillus fragilis; эти анаэробы вызывали абсцессы при экспериментальном заражении подопытных животных. В 1912 году Дистазо (A. Distaso) обнаружил подобные микробы в испражнениях здоровых людей. Кастеллани (A. Castellani) и Чалмерс (A. J. Chalmers) в 1919 году предложили для этих бактерий родовое название Bacteroides.
Семейство Bacteroidaceae состоит из трех родов; Bacteroides, насчитывающий 22 вида, Fusobacterium, объединяющий 16 видов, и Leptotri-chia, включающий 5 видов. В 1979 году Колли (J. G. Collee) предложил разделить род Bacteroides на три группы на основе их устойчивости к 20% желчи в питательной среде, пигментообразовании и сахаролитической активности в отношении глюкозы, мальтозы, сахарозы, маннита, рамнозы, трегаллозы (табл. 1).
Бактероиды — палочки с биполярной окрашиваемостью, размером 0,5—0,8 X 1 —3 мкм, морфологически сходные или с выраженным полиморфизмом, неподвижные или движущиеся с помощью перитрихиально расположенных жгутиков, нередко имеют полисахаридную капсулу, являющуюся важным фактором вирулентности (см.). Различные виды варьируют по своей чувствительности к окислительно-восстановительному потенциалу. Окисленные среды тормозят рост бактероидов. В пределах вида рост бактероидов зависит также от величины посевной дозы.
При росте на кровяном агаре бактероиды образуют округлые, слабо выпуклые, полупрозрачные сероватые или черно-коричневые колонии, часто имеющие внутри включения в форме концентрических колец, диаметр колоний 1—3 мм, менее 1% штаммов бактероидов вызывают гемолиз. При росте бактероидов на жидкой питательной среде происходит равномерное помутнение бульона и образование осадка. Основными компонентами питательных сред для культивирования бактероидов являются пептон, мясной экстракт, дрожжевой экстракт, глюкоза и кровь. Стимулируют рост бактероидов гемин, витамин Кх (менадион), для некоторых видов — бычья желчь. Рост бактероидов улучшается также, если в окружающей анаэробной атмосфере содержится углекислый газ (5—10%). Бактероиды растут в значительном диапазоне температур (от 25 до 45°), оптимум роста при t 37°. Оптимальное значение pH питательных сред 7,0.
При росте на глюкозопеитонном бульоне бактероиды продуцируют в качестве конечного продукта метаболизма смесь жирных кислот: большое количество янтарной и небольшое количество уксусной, пропионовой, изовалериановой, изомасляной и масляной. Бактероиды образуют протеолитические ферменты, некоторые виды продуцируют нейраминидазу, действующую как фактор распространения бактерий. Устойчивые к Р-лактамным антибиотикам бактероиды продуцируют Р-лак-тамазы, разрушающие пенициллины и цефалоспорины.
Антигенные свойства бактероидов изучены недостаточно. Общий родовой антиген для бактероидов не описан. Bacteroides fragilis — пока единственный вид бактероидов, для которого доказано наличие видоспецифического антигена; в диагностических целях используют капсульный полисахаридный антиген.
Бактероиды —одни из основных представителей нормальной микрофлоры человека (см.) и животных. В наибольшем количестве бактероиды содержатся в толстой кишке (около 30% всех микробов), значительно преобладая над аэробной микрофлорой, в том числе в сотни раз превышая количество кишечных палочек. Среднее количество бактероидов в 1 г фекалий взрослого здорового человека составляет св. 10 млрд. и зависит от физиологического состояния организма и диеты. У лиц, находящихся на смешанной диете, обнаруживается больше бактероидов, чем у людей, в диете которых преобладают углеводы. Более интенсивному размножению и метаболизму бактероидов способствует диета, богатая животными продуктами. При стрессовых состояниях содержание В. thetaiotaomicron в толстой кишке может быть повышено и составлять 20—30% всей микрофлоры (при норме 2—4%). Наиболее часто в микрофлоре фекалий здорового взрослого человека встречаются В. vulgatus (12%), В. thetaiota-omicron (до 4,5%), В. fragilis (0,5%). Из бактероидов, являющихся условно-патогенными микробами (см.), наиболее частым возбудителем анаэробных и смешанных анаэробно-аэробных инфекций является В. fragilis.
Физиологическое значение бактероидов во многом не ясно, однако известно, что они проявляют антагонистическую активность по отношению к шигеллам, сальмонеллам и некоторым эшерихиям.
Бактероиды проявляют патогенные свойства при изменении иммунитета. Они выступают в качестве инфекционных агентов при самых разнообразных заболеваниях гнойного и септического характера, могут поражать любые органы и ткани организма человека или животного, в очагах инфекции находятся в ассоциации с другими анаэробными и аэробными микробами. Бактероиды выделяют при гнойном перитоните, аппендиците, эндометрите, аднексите, кольпите, септическом аборте, абсцессе внутренних органов, плеврите, пневмонии, при поражениях костей и суставов, при пародонтозе и воспалительных заболеваниях ротовой полости, кожи, подкожной клетчатки. Бактероидный инфекционный процесс любой локализации может осложниться эндокардитом (см.) или сепсисом (см.).
Для эффективного лечения болезней, вызванных бактероидами, большое значение имеет микробиологическая диагностика. Успешное выделение бактероидов во многом зависит от правильного забора и доставки материала в лабораторию. Если есть возможность получить патологический материал с помощью пункции, его следует доставить в шприце, вытеснив из него воздух. Доставка материала на обычном тампоне малоэффективна. Тампоны лучше доставлять в транспортной среде либо забирать материал тампоном, имнрегнированным 10% раствором гемоглобина. Вместо гемоглобина можно использовать лизированную донорскую кровь (10% лизированной крови, 10% глицерина, 80% изотонического раствора хлорида натрия).
Посев материала производят на плотные и жидкие питательные среды. Плотные среды содержат лизированную кровь и при необходимости канамицин или неомицин — ингибиторы сопутствующей факультативно-анаэробной микрофлоры. Посевы инкубируют не менее 2 суток (из-за медленного роста бактероидов) в анаэробных условиях при t° 37°. Одновременно с посевом производят микроскопию окрашенного по Граму мазка из патологического материала.
Посевы просматривают с помощью лупы с 6—8-кратным увеличением или стереоскопического микроскопа (см.). Описывают морфологию каждого вида колоний, пересевают их на жидкую питательную среду и инкубируют в анаэробных условиях в течение 48—72 часов (для получения чистой культуры), а также пересевают на кровяной агар и инкубируют в аэробных условиях в течение 24—48 часов (для определения аэротолерантности). Из этих же колоний готовят мазки для окраски по Граму. Выросшие на кровяном агаре в аэробных условиях колонии расцениваются как факультативно анаэробные бактерии. Чистую культуру грамотрицательных анаэробных бактерий, полученную на жидкой питательной среде, исследуют на подвижность (с помощью фазовоконтрастного микроскопа) и на чувствительность к антимикробным препаратам.
До уровня семейства бактероиды можно идентифицировать на основании отрицательной окраски по Граму, отсутствия роста в аэробных условиях, отсутствия спорообразования, установления перитрихиально расположенных жгутиков, если бактерии подвижны. Способность к спорообразованию проверяют прогреванием пятисуточной культуры на жидкой питательной среде с крахмалом (1 г на 1 i среды) при t° 80° в течение 10 минут. Выжившие клетки свидетельствуют о их спорогенности. Тип жгутиков определяют соответствующим методом окраски (см. Леффлера методы).
До рода и вида бактероиды идентифицируют на основании определения продуктов метаболизма (состав жирных к-т Ci—Св, а также янтарной и молочной кислот) с помощью газожидкостной хроматографии (см.) и изучения ферментативной активности. В таблице 2 представлены данные Бартлетта (J. G. Bartlett) с сотр. (1975), позволяющие ориентировочно идентифицировать бактероиды группы В. fragilis.
Предпринимаются попытки ускоренной идентификации бактероидной группы
В. fragilis и В. melaninogenieus с помощью реакции иммунофлюоресценции (см.) в прямой и непрямой модификациях. Для обнаружения бактероидов непосредственно в патологическом материале необходимы соответствующие специфические диагностические сыворотки. Для подтверждения этиологической роли бактероидов при различных воспалительных заболеваниях (например, при поражениях тазовых органов у женщин) используют серологическую диагностику. При этом применяют радиоиммунологический метод (см.) и иммуно-ферментный метод выявления антител, а также определяют титры антител против В. fragilis в парных сыворотках.
Бактероиды наиболее чувствительны к метранидазолу, левомицетину, некоторым цефалоспоринам и др. Некоторые виды бактероидов, за исключением В. fragilis, могут быть чувствительны к пенициллину, но необходимо учитывать, что бактероиды могут продуцировать бета-лактамазы. Бактероиды устойчивы к стрептомицину, гентамицину, канамицину, мономицину. Для успешной антибактериальной терапии необходимо определение чувствительности выделенных бактерий к химиопрепаратам. При лечении инфекций, вызываемых бактероидами, также необходимо помнить, что эти инфекции носят смешанный характер: бактероиды чаще всего выделяются в ассоциации с другими микроорганизмами.
Специфическая профилактика бактероидных инфекций — вакцины и сыворотки — пока не разработана.
Таблица 1. КЛАССИФИКАЦИЯ НЕКОТОРЫХ ВИДОВ БАКТЕРОИДОВ ПО ГРУППАМ В ЗАВИСИМОСТИ ОТ ИХ ОТНОШЕНИЯ К САХАРАМ, УСТОЙЧИВОСТИ К ЖЕЛЧИ И ОБРАЗОВАНИЮ ПИГМЕНТА (по Колли, 1979)
Признаки, отличающие различные виды бактероидов
В. fragilis, В. thetaiotaomicron, В. ovatus, В. distasonis, В. vulgatus, В. splan-chnicus, В. eggerthii, В. hypermegas, В. multiacidus
Сахаролитические, не образуют пигмента, устойчивы к желчи
В. melaninogenicus subsp. melaninogenicus, subsp. intermedius, subsp. levii B. bivius, B. disiens, B. oralis, B. rumini-cola
Сахаролитические, образуют пигмент, чувствительны к желчи Сахаролитические, не образуют пигмента, чувствительны к желчи
B. asaccharolyticus, B. putredinis, B. praeacutus, B. pneumosint.es, B. corrodens*, B. nodosus
H e с а х а р о литические
* Новое название В. ureolyticus.
Таблица 2. ОТЛИЧИТЕЛЬНЫЕ ПРИЗНАКИ НЕКОТОРЫХ ВИДОВ БАКТЕРОИДОВ, НАИБОЛЕЕ ЧАСТО ВЫДЕЛЯЕМЫХ ИЗ ПАТОЛОГИЧЕСКОГО МАТЕРИАЛА (по Бартлетту, 1975)
Bacteroides (бактероиды, род бактерий)

В связи с трудностью анаэробного культивирования и, следовательно, с высокой стоимостью исследования бактероиды при анализах во многих лабораториях не определяются (Ардатская М.Д., Минушкин О.Н.). Бактероиды — антагонисты шигелл, сальмонелл, некоторых видов эшерихий (Лобзин Ю.В. и др.).
Основными продуктами брожения являются уксусная кислота, изовалериановая кислота, янтарная кислота.
Бактероиды — нормальная микрофлора человека
Учёными американской Human Microbiome Project (HMP) и европейской Metagenomics of human intestinal tract (MetaHIT) был введен термин «энтеротипы» – это устойчивые кластеры на основе микробного состава в образцах из кишечника человека, которые определяются преобладанием тех или иных ключевых родов бактерий и не являются популяционно- и континент-специфичными. Их исследования установили, что у взрослых в 1-м энтеротипе доминируют представители рода Bacteroides, во 2-м — Prevotella, в 3-м — Ruminococcus. Однако чёткие критерии определения энтеротипов отсутствуют; кроме того, результаты ряда исследований указывают на незначительное преобладание в биотопах организма ключевых бактериальных родов (Кожевников А.А. и др.).
Бактероиды и заболевания человека
Присутствуя в организме человека бактероиды могут вызывать различные гнойно-воспалительные заболевания после травм, оперативных вмешательств, инструментальных исследований, при онкопатологиях или иммунодефиците, такие как перитонит, абсцессы, эндокардит, сепсис, тонзиллит, пародонтоз, анальная трещина и другие. Бактероиды являются причиной более чем половины всех внутрибрюшинных анаэробных инфекций.
Наиболее изучены патогенные свойства бактероидов вида Bacteroides fragilis. Этот вид может вызывать как внутрибрюшинные инфекции, такие как перитонит, хронический язвенный колит, но и синовиит, сальпингит, болезнь Рейтера, хронический тонзиллит. Бактероиды часто вызывают поражение женских внутренних половых органов: цервициты, эндометриты, аднекситы, инфекции в малом тазу. Обнаруживают бактероиды и при простатитах, хронически протекающих осложнённых уретритах у мужчин, у пациентов с упорным течением заболевания и частыми рецидивами.
Бактероиды ассоциируются с колоректальным раком, бронхиальной астмой (Bacteroides fragilis), воспалительными заболеваниями кишечника (ВЗК), сахарным диабетом, ожирением, неалкогольной жировой болезнью печени (НАЖБП) (Bacteroides thetaiotaomicron); титр бактероидов уменьшается при болезни Крона (Карпеева Ю.С. и др.).
Ассоциация бактероидов с Gardnerella vaginalis, Mobiluncus характерна для бактериального вагиноза.
Бактероидные инфекции лечатся метронидазолом, тинидазолом, левомицетином, эритромицином, рифаксимином.
Материалы для пациентов
Публикации для профессионалов здравоохранения, затрагивающие роль бактероидов в заболеваниях человека
Чувствительность бактероидов к антимикробным препаратам
Бактероиды устойчивы к аминогликозидам (стрептомицину, гентамицину, канамицину, мономицину). Большинство штаммов бактероидов устойчивы к тетрациклину. Доксициклин активен в отношении некоторых штаммов бактероидов, но большинство штаммов Bacteroides fragilis к нему устойчивы. В отношении бактероидов активен линкомицин.

Чувствительность Bacteroides spp. к антибактериальным препаратам (Косинец В.А.)
Бактероиды в систематике бактерий
По современной систематике род бактероиды входит в семейство Bacteroidaceae, порядок Bacteroidales, класс Bacteroidia, тип Bacteroidetes, Bacteroidetes/Chlorobi group, Fibrobactere-Chlorobi-Bacteroidetes superphylum, царство Бактерии.
В состав рода бактероиды входят виды: B. acidifaciens, B. barnesiae, B. caccae, B. caecicola, B. caecigallinarum, B. cellulosilyticus, B. caecimuris, B. clarus, B. coprocola, B. coprophilus, B. coprosuis, B. denticanum, B. dorei, B. eggerthii, B. faecichinchillae, B. faecis, B. finegoldii, B. fluxus, B. fragilis, B. galacturonicus, B. gallinaceum, B. gallinarum, B. graminisolvens, B. helcogenes, B. heparinolyticus, B. intestinalis, B. luti, B. massiliensis, B. mediterraneensis, B. neonati, B. nordii, B. oleiciplenus, B. ovatus, B. paurosaccharolyticus, B. plebeius, B. propionicifaciens, B. pyogenes, B. reticulotermitis, B. rodentium, B. salanitronis, B. salyersiae, B. sartorii, B. stercorirosoris, B. stercoris, B. thetaiotaomicron, B. timonensis, B. uniformis, B. vulgatus, B. xylanisolvens, B. xylanolyticus, B. zoogleoformans.
Ранее к роду бактероиды относился целый ряд видов, впоследствии реклассифицированые в виды рода Prevotella. В частности, Bacteroides melaninogenicus и Bacteroides intermedius были реклассифицированы в Prevotella melaninogenica и Prevotella intermedia. Вид Bacteroides urealyticus перенесён в род Campylobacter и назван Campylobacter ureolyticus, виды Bacillus necrogenes, Bacteroides freundii и Bacteroides russii перенесены в род Fusobacterium и названы Fusobacterium necrogenes, Fusobacterium mortiferum и Fusobacterium russii, виды Bacteroides distasonis, Bacteroides goldsteinii и Bacteroides merdae реклассифицированы в виды Parabacteroides distasonis, Parabacteroides goldsteinii и Parabacteroides merdae рода парабактероидов, соответственно. Вид Bacteroides termitidis — в Sebaldella termitidis, Bacteroides corrodens — в Eikenella corrodens, Bacteroides hypermegas — в Megamonas hypermegale, вид Bacteroides forsythus — в Tannerella forsythia и т.д.
ПЦР-диагностика анаэробных инфекций, вызываемых бактериями рода Bacteroides
Струкова Л.А. (специалист по продукции), Атрошкина М. Е. (научный сотрудник) OOO НПФ «Литех»
В настоящее время отмечается значительное увеличение доли инфекционных заболеваний, в патогенезе которых ведущую роль играют анаэробные бактерии. Подобные инфекции, как правило, полимикробные, при этом анаэробные возбудители встречаются в ассоциации с другими анаэробными или аэробными микроорганизмами.
Выявление анаэробных микроорганизмов традиционно является серьезной проблемой для клинической бактериологической лаборатории. Большинство видов плохо культивируются или не культивируются вообще, кроме того стандартные микробиологические методы длительны по времени и их результаты становятся известны лишь на 3 – 4 день от момента взятия материала. Однако, во многих случаях, в частности при развитии анаэробной инфекции в ранах у хирургических больных, времени на длительные исследования просто нет, поскольку необходим срочный выбор адекватной антибактериальной терапии.
Ускорить диагностику и облегчить понимание генетических основ патогенности и антибиотикорезистентности анаэробных бактерий, вызывающих тяжелые инфекции человека, возможно путем применения в практике бактериологических лабораторий новых методов на основе анализа генетического материала бактерий, в частности метода полимеразной цепной реакции (ПЦР) (1).
Возбудителей анаэробных инфекций принято разделять на 2 группы. К первой группе относят спорообразующих анаэробов, или клостридий. Вторая группа представлена неспорообразующими, или неклостридиальными, анаэробами (бактероиды, фузобактерии, пептококки, пептострептококкиидр.).
Анализ видового состава бактерий, выделяемых из очагов воспаления с участием анаэробной микрофлоры, показал, что среди неспорообразующих анаэробов основную долю составляют Bacteroides fragilis (85,7 %), Peptococcus spp. (71,4 %), Peptostreptococcus spp. (69,8 %), Prevotella melaninogenica (68,7 %), Fusobacterium nucleatum (42,6 %) Частота выделения неспорообразующих анаэробов при тяжелых гнойных заболеваниях колеблется от 57,1 % до 98,8 % в зависимости от характера и локализации патологического процесса. (2).
Осознавая необходимость и востребованность надежных тест-систем для выявления анаэробной флоры, начиная с 2012 года в ООО НПФ «Литех» ведутся работы над созданием соответствующих диагностических панелей. Поскольку среди анаэробов, выделяемых из клинического материала человека, представители рода Bacteroides spp. занимают лидирующие позиции, а их рутинная фенотипическая идентификация представляет собой весьма трудоемкий процесс с частыми ошибками (1), первыми на рынок диагностических услуг выпущены ПЦР тест-системы «БАКТОПОЛ» для обнаружения различных видов бактероидов, а также штаммов B.fragilis, продуцирующих энтеротоксин:
Лабораторная диагностика анаэробной инфекции в среднем занимает от 7 до 10 суток, что не может удовлетворять клиницистов. Основными способами диагностики анаэробной инфекции являются биохимический, культуральный, микроскопический, газожидкостной хроматографии, люминесцентной микроскопии, способы определения токсинов анаэробов в отделяемом из ран и крови больных. Но всем этим способам присущи те или иные недостатки: длительность исследования, малая точность, громоздкость анализа, неотработанность методик и др.
В последнее время накапливается все больше информации об успешном применении метода ПЦР для быстрого и качественного обнаружения бактерий рода Bacteroides по сравнению с традиционными способами идентификации анаэробных микроорганизмов. ПЦР-диагностика занимает всего несколько часов и отличается высокой чувствительностью и специфичностью. При изучении 400 образцов хирургической раневой инфекции путем количественной ПЦР в режиме реального времени (кРВ-ПЦР) Tong J. с соавт. в 132 образцах (33%) идентифицировали виды Bacteroides spp (7). Методом культивирования бактероиды были обнаружены только в 31 образце (8%). B. uniformis был наиболее распространенным видом (44 положительных образца) по результатам кРВ-ПЦР, в то время как метод культивирования идентифицировал эту бактерию как B. fragilis (16 положительных образцов). Данное исследование подтвердило, что ПЦР является быстрым, специфичным и чувствительным методом, который имеет большой потенциал для выявления группы B. fragilis и родственных организмов в образцах ран.
Liu C. и соавт. представили новую схему для идентификации 10 видов бактероидов из группы Bacteroides fragilis с помощью мультиплексной ПЦР. В результате были идентифицированы 155 изолятов этой группы, ранее определенных с помощью стандартных фенотипических тестов (8). Эффективность стандартных способов идентификации составила всего 84.5%. Таким образом, мультиплексная ПЦР оказалась простым, быстрым и надежным методом для определения видов группы B.fragilis. Этот метод может позволить более точно определять роль представителей этой группы в развитии инфекций и их степень устойчивости к противомикробным препаратам.
Для обнаружения токсинов «золотым стандартом» в мире является исследование цитотоксического эффекта на различные клеточные линии, в случае B. fragilis – это линия HT-29. Наличие цитопатического эффекта (ЦПЭ) должно сравниваться с отрицательным контролем (фосфатно-солевой буфер или клеточная среда). Если ЦПЭ обнаружен, проводят нейтрализацию с антитоксином для подтверждения энтеротоксина, поскольку некоторые вирусы и бактерии также могут привести к возникновению ЦПЭ у клеточных линий. Недостатками этого метода являются его трудоемкость и большие временные затраты (1).
В течение последних 5 лет было разработано много способов на основе метода ПЦР для обнаружения токсина B. fragilis. Чувствительность и специфичность этих способов по сравнению с культивированием составляют около 91 % и 100 %, соответственно, но эти значения могут быть немного меньше при работе с образцами кала из-за присутствия ингибиторов ПЦР (1).
В последние годы было отмечено повышение устойчивости к противомикробным препаратам для некоторых анаэробных бактерий, особенно для видов группы B. fragilis (9). Связанная с продукцией пенициллаз устойчивость к пенициллинам и цефалоспоринам среди анаэробов приближается к 100%, быстро растет резистентность к тетрациклинам; резистентность к цефамицину (цефокситину), эритромицину и клиндамицину составляет около 12-30% во всем мире, что делает их непригодными для эмпирической терапии против Bacteroides (1). Интересно, что B. fragilis более восприимчив к антимикробным препаратам, чем другие виды Bacteroides. B. vulgatus наиболее устойчив к ампициллину-сульбактаму и пиперациллин-тазобактаму. Штаммы B. thetaiotaomicron/ovatus показывают самый высокий уровень устойчивости к карбапенемам с неизвестным механизмом резистентности. B. vulgatus резистентен к моксифлоксацину (10).
Учитывая устойчивость отдельных видов Bacteroides spp. к разным антибиотикам, при выборе адекватной антимикробной терапии желательно опираться на данные ПЦР-тестирования, охватывающего все разнообразие видов, ассоциированных с тяжелыми инфекциями человека.
Таким образом, метод ПЦР имеет решающее значение для диагностики инфекций, вызванных представителями рода Bacteroides. Несмотря на тот факт, что роль анаэробных бактерии в патогенезе различных заболеваний человека подтверждена, качество лабораторной диагностики анаэробных инфекций остается спорным. Тем не менее, выявление и изучение важных генов анаэробных бактерий с помощью молекулярно-генетических методов могут привести к получению более точных данных об их патогенности и позволят избежать проблем, связанных с особыми условиями культивирования и крайне медленным ростом (1). Применение наборов серии «БАКТОПОЛ» как дополнение к традиционному бактериологическому тестированию, позволяет существенно повысить результативность и информативность проводимых клинико-лабораторных исследований, что в свою очередь снизит риск возникновения осложнений и смерти при инфекциях, вызванных группой B. fragilis, а также будет способствовать назначению эффективной этиотропной терапии.
Наша клиника проводит все виды анализов (анализ на сахар, на аллергию, ПЦР, генетический анализ и др.) с применением современного оборудования и проверенных методов.
Литература:
1) Nagy E, et al. The place of molecular genetic methods in the diagnostics of human pathogenic anaerobic bacteria. A minireview. Acta Microbiol Immunol Hung. 2006 Jun; 53(2):183-94.
2) А. М. Светухин А. Б. Земляной В. Г. Истратов Л. А. Блатун Р. П. Терехова. Клиническое значение ранней диагностики анаэробной неклостридиальной инфекции.Хирургия. Журнал им. Н.И. Пирогова № 8. 2005.
3) Hannah M. Wexler. Bacteroides: the Good, the Bad, and the Nitty-Gritty. Clin Microbiol Rev. 2007 October; 20(4): 593–621.
4) Brook, I. 2002. Clinical review: bacteremia caused by anaerobic bacteria in children. Crit. Care. 6:205-211.
5) Merino VR et al. Quantitative detection of enterotoxigenic Bacteroides fragilis subtypes isolated from children with and without diarrhea. J Clin Microbiol. 2011 Jan; 49(1):416-8.
6) Durmaz B, Dalgalar M, Durmaz R. Prevalence of enterotoxigenic Bacteroides fragilis in patients with diarrhea: a controlled study. Anaerobe. Dec 2005; 11(6):318-21.Anaerobe. 2005 Dec; 11(6):318-21.
7) Tong J, Liu C, Summanen P, Xu H, Finegold SM. Application of quantitative real-time PCR for rapid identification of Bacteroides fragilis group and related organisms in human wound samples. Anaerobe.2011 Apr;17(2):64-8.
8) Liu C. et al. Rapid identification of the species of the Bacteroides fragilis group by multiplex PCR assays using group- and species-specific primers. FEMS Microbiol Lett. 2003 May 16; 222(1):9-16.
9) Simmon KE, Mirrett S, Reller LB, Petti CA. Genotypic diversity of anaerobic isolates from bloodstream infections. J Clin Microbiol. 2008 May; 46(5):1596-601.
10) Fernández-Canigia L. et al. First national survey of antibiotic susceptibility of the Bacteroides fragilis group: emerging resistance to carbapenems in Argentina. Antimicrob Agents Chemother. 2012 Mar;56(3):1309-14.