без признаков атипии что это значит в гинекологии
Атипичные клетки – это рак или нет?
Атипичные клетки – это такие клетки, которые под воздействием различных неблагоприятных факторов из обычной нормальной клетки человеческого организма преобразовались в нехарактерную структуру, изменили свой размер и форму. Организм в свою очередь теряет контроль над такими клетками, поэтому существует риск перерождения атипических клеток, что может привести к образованию рака.
Что может повлиять на образование атипичных клеток:
Это некоторые факторы, которые могут привести к образованию атипичных клеток. К сожалению, точной причины их возникновения сказать никто не может. Даже какой-то незначительный сбой в организме может привести к возникновению не одной и даже не двух таких клеток, а тысяч.
Как происходит перерождение атипичных клеток в рак
Давно известно, что образование клеток с измененной ДНК появляются постоянно. Но появление атипичных клеток не всегда приводят к раку. В нашем организме есть защитный механизм, процесс старение и уничтожение клеток, так называемый апоптоз. Он отвечает за то, чтобы аномальные клетки исчезали из организма. Но любая система может дать сбой, и в результате атипичные клетки затаятся в организме. При таком раскладе есть вероятность их перерождения в раковые клетки.
Что делать, если обнаружили атипичные клетки во время биопсии? Рак это или нет?
В такой ситуации лучше перестраховаться, чем что-то пропустить. Ведь ранняя диагностика рака может спасти вам жизнь.
Иногда врач назначает какое-то конкретное лечение, чтобы постараться остановить образование атипичных клеток. Либо может понадобиться еще один образец ткани – дополнительная биопсия, чтобы быть уверенным в отсутствии рака или какого-то другого заболевания.
Онкологические аспекты гиперпластических процессов эндометрия
Гиперплазия — это увеличение количества клеток без увеличения их размеров. Гиперпластические процессы могут предшествовать развитию онкологического заболевания. Гиперплазия эндометрия — одна из форм патологических пролиферативных изменений эндометрия, с преимущественной пролиферацией железистого компонента по сравнению со стромальным компонентом [1].
Существует гистологическая классификация гиперпластических процессов эндометрия, предложенная ВОЗ (2014) [2]:
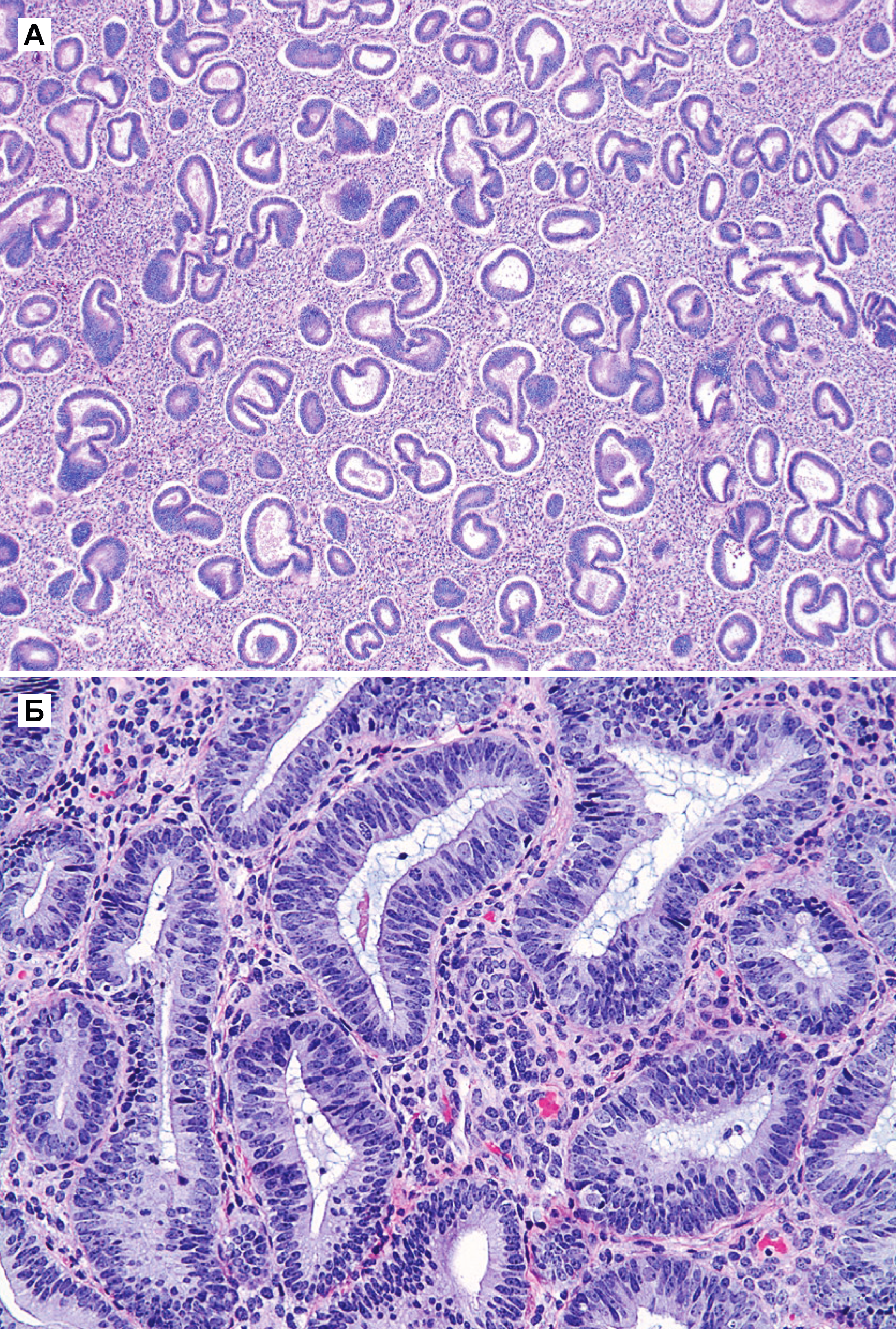
Гиперплазия эндометрия без атипии — это пролиферация с изменением строения желез и клеток, но без клеточной атипии. Изменения в строении обычно видны при малом увеличении, но важной особенностью, которая определяет прогноз и возможность малигнизации — это клеточная атипия. Все типы гиперплазии характеризуются увеличением отношения железы к строме, неравномерностью формы железы и изменением размера железы (рис. 1 а и б). При гиперплазии без атипии железистый эпителий напоминает пролиферирующий эндометрий (рис. 1 б). Клетки столбчатые с амфофильной цитоплазмой и имеют псевдостратифицированные ядра, ориентированы к базальной мембране и имеют овальную форму с гладкими контурами, равномерно распределенный хроматин и небольшие незаметные ядрышки. Митотическая активность может быть переменной и может быть меньше, чем в пролиферирующем эндометрии. Частота митоза не влияет на диагноз [5].
Как правило, гиперплазия диффузная, но может быть очаговой из-за локальных различий в содержании рецепторов эстрогена и прогестерона в эндометрии. При простой гиперплазии присутствует строма в значительном объеме. Строение стромы напоминает нормальное, характерное для пролиферативной фазы, строма состоит из маленьких овальных клеток со скудной цитоплазмой. Как и в железах, в строме отмечена митотическая активность. Когда гиперплазия является полипоидной, строма может содержать артерии с толстой стенкой, подобные тем, которые наблюдаются в полипах. По мере прогрессирования гиперплазии железы располагаются более тесно. Обычно железы плотно прилегают друг к другу, хотя всегда присутствует небольшое количество стромы между ними [5].
К предраковым заболеваниям эндометрия относятся [2]:
Эндометрий — мишень половых гормонов, так как эта ткань имеет специфические рецепторы. Клетки эндометрия обновляются ежемесячно под влиянием гормональной регуляции. Нарушение гормонального статуса женщины может изменять рост и дифференцировку клеток. Поэтому могут возникнуть гиперпластические процессы [2].
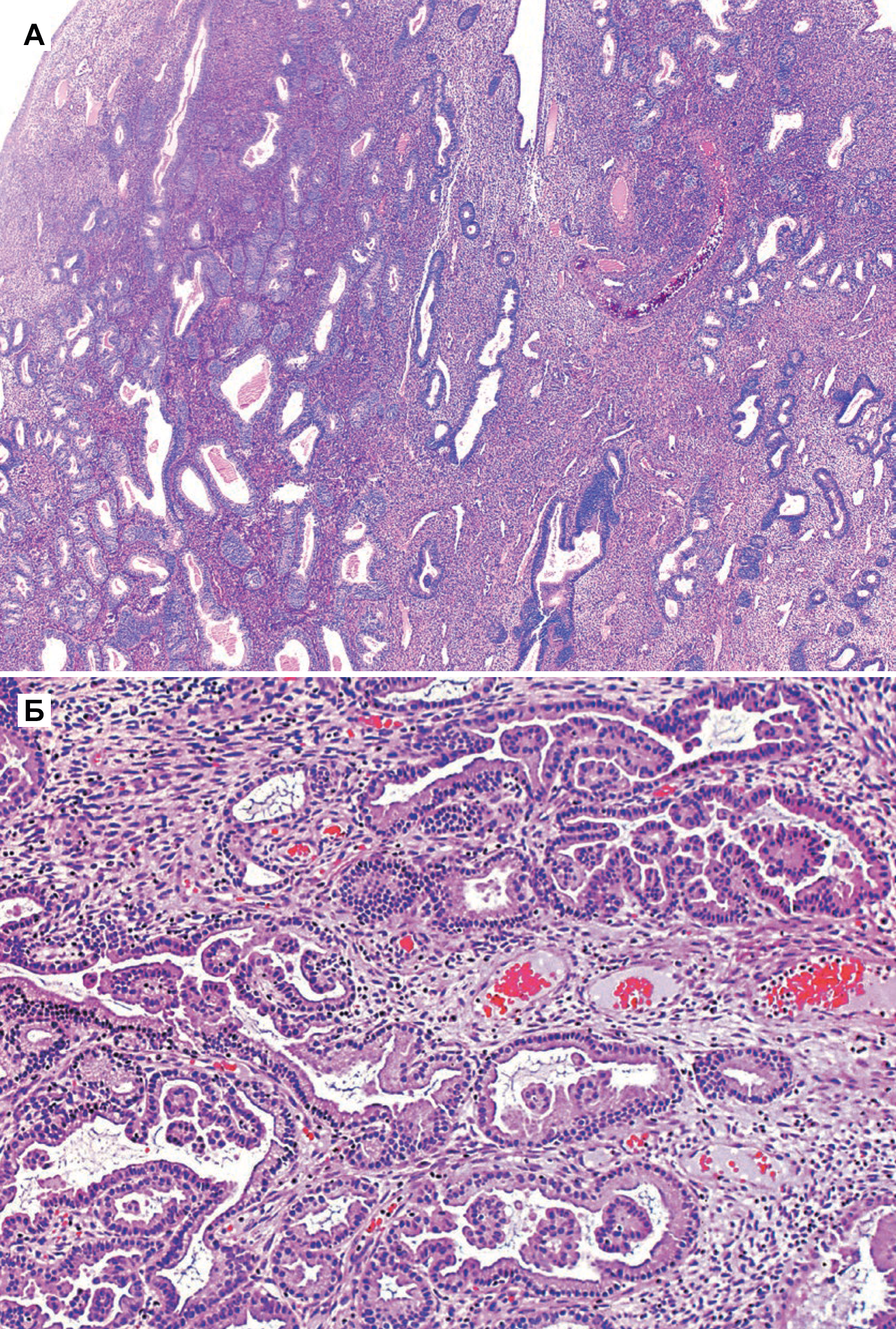
Атипичная гиперплазия отличается наличием ядерной атипии и сложным строением с тесно расположенными железами. Железы обычно неправильной формы и размера. Каждая железа имеет базальную мембрану, окруженную тонким слоем стромы, отделяющей его от соседних желез. Однако в некоторых случаях железы расположены далеко друг от друга. Встречаются как железы без клеточной атипии, так и атипичные [5].
Специфические особенности при атипичной гиперплазии включают: стратификацию, увеличение размера ядер с измененным хроматином и ядрышками. В ядрах отмечена истинная стратификация (2–4 слоя), и потеря ориентирования к базальной мембране [5].
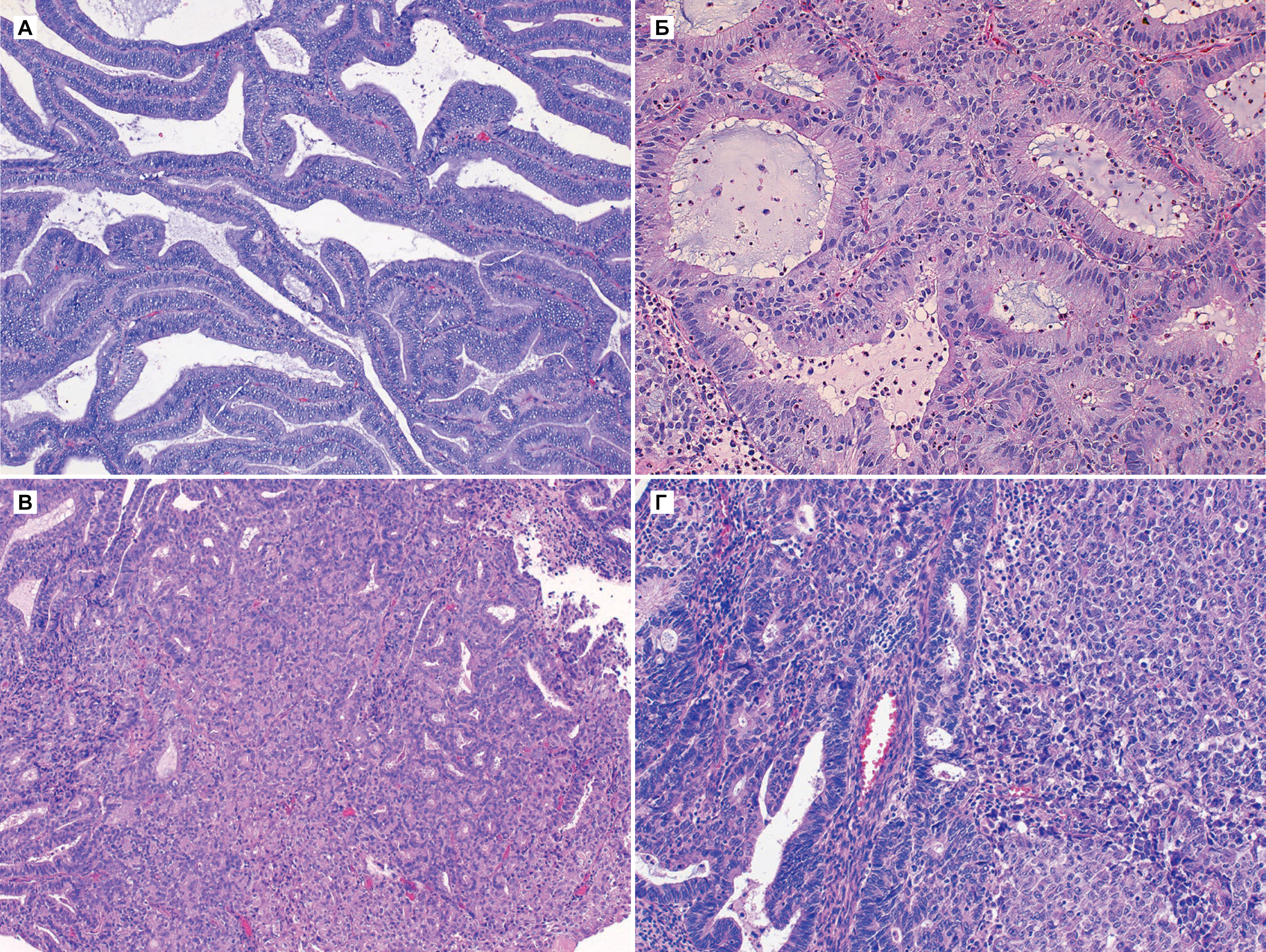
На фоне гиперпластических процессов в эндометрии, возникающих при длительной пролиферации желез эндометрия без перехода их в секреторную фазу, может развиваться рак тела матки (РТМ) — это злокачественная опухоль, происходящая из слизистой оболочки тела матки (эндометрия). Чаще всего РТМ носит спорадический характер, и в 5 % случаев РТМ ассоциирован с наследственными синдромами, например, с синдромом Линча. Среди факторов риска: гиперэстрогения, ранние менархе, отсутствие родов в анамнезе, поздняя менопауза, возраст старше 55 лет, применение тамоксифена [3].
Эпидемиология РТМ
РТМ — самая частая злокачественная опухоль женских половых органов в развитых странах и вторая по частоте после рака шейки матки злокачественная опухоль женских половых органов в мире. В США в 2015 г. зарегистрировано более 54800 новых случаев заболевания РТМ, и более 10150 смертей от этого заболевания. В России ежегодно регистрируется более 21 тысячи больных РТМ. В структуре заболеваемости женского населения в России в 2016 г. РТМ занимал 3-е ранговое место (7,7 %). Средний возраст заболевших РТМ в России составляет 62,6 года [3,4].
Патогенез
Развитие РТМ обусловлено гиперэстрогенией, основной причиной которой является нарушение овуляции. Клиническое изучение метаболических нарушений у больных раком тела матки и морфологические особенности рака эндометрия позволили обосновать концепцию о двух основных патогенетических вариантах заболевания [2].
I тип (более частый). Опухоль развивается в более молодом возрасте, в отличие от пациенток II патогенетического варианта, на фоне длительной гиперэстрогении и гиперплазии эндометрия. У больных РТМ I патогенетического типа часто наблюдаются ожирение, сахарный диабет и гипертоническая болезнь, возможны эстрогенсекретирующие опухоли яичников или синдром склерокистозных яичников. Опухоли I патогенетического варианта, как правило, высокодифференцированные, имеют более благоприятный прогноз [2].
II тип. Опухоли эндометрия обычно низкодифференцированные, имеют менее благоприятный прогноз. Опухоли II патогенетического типа возникают в более старшем возрасте, в отсутствие гиперэстрогении, на фоне атрофии эндометрия. Примерно у 80% больных РТМ диагностируют эндометриоидную аденокарциному [2].
Выделяют три степени дифференцировки аденокарциномы эндометрия [2]:
G1 — высоко дифференцированная;
G2 — умеренно дифференцированная;
G3 — низко дифференцированная или недифференцированная.
Клиника
Ранний симптом прогрессирования рака эндометрия — появление жидких водянистых белей, нередко с примесью крови, и зуда наружных половых органов. Кровянистые выделения из половых путей бывают в виде мажущих серозно-кровянистых выделений, которые становятся порой обильными. Кровотечение, как правило, контактное или появляется после физической нагрузки [2].
Возможны боли внизу живота, которые на ранних стадиях рака носят схваткообразный характер. Это связано с сокращениями эндометрия и опорожнением матки от скопившейся в ней крови или гноевидной жидкости (гематометра, пиометра), отток которой в результате обтурации внутреннего зева затруднен. После таких схваткообразных болей появляются обильные выделения из матки — гной и кровь. При поздних стадиях боли постоянные, особенно интенсивные по ночам, связаны со сдавлением раковым инфильтратом нервных сплетений в малом тазу. При переходе процесса на мочевой пузырь и прямую кишку появляются симптомы нарушения функционирования этих органов [2].
Хирургическое вмешательство рекомендуется как наиболее эффективный метод лечения РТМ независимо от стадии как самостоятельно, так и в комбинации с другими методами [6].
Список литературы:
Что такое атипичные клетки шейки матки
» data-image-caption=»» data-medium-file=»https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2019/02/atipichnye-kletki.png?fit=450%2C300&ssl=1″ data-large-file=»https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2019/02/atipichnye-kletki.png?fit=829%2C550&ssl=1″ />
Нарушение строения эпителиальных клеток — это термин для обозначения клеток необычного размера или формы, обнаруженных на шейке матки. Этот результат теста, чаще всего полученный после мазка Папаниколау, не обязательно указывает на злокачественный рост опухоли, но уже говорит о том, что могут быть предраковые клетки или начальные раковые клетки.
Особенности анализа на атипичные клетки
Типы аномалий
Атипичные эпителиальные клетки делятся на две широкие категории: плоскоклеточные и железистые.
Наиболее распространенными типами являются атипичные плоскоклеточные клетки (ASC), плоскоклеточные интраэпителиальные образования (SIL) или плоскоклеточный рак. Проблемы, возникающие обнаружением железистых клеток обычно классифицируются как атипичные железистые клетки (AGC) или аденокарцинома.
Из обнаруженных плоскоклеточных и железисто-клеточных аномалий только имеющие признаки плоскоклеточного рака и аденокарциномы почти наверняка указывают на развитие рака.
ASC-клетки
ASC-клетки явно не нормальны, но не совсем понятно, почему. Клетки в этой категории могут быть либо атипичными плоскоклеточными неопределенного значения (ASCUS), либо атипичными плоскоклеточными клетками с возможными изменениями высокого уровня риска рака (ASC-H).
Кольпоскопия — диагностический тест, при котором гинеколог визуально исследует внутреннюю часть влагалища на наличие патологий или повреждений.
SIL-клетки
SIL — это клетки, образующие наросты на поверхности шейки матки, которые могут привести к раку. Они относятся к категории среднего или высокого риска в зависимости от вероятности возникновения рака.
После обнаружения SIL-клеток специалист обычно рекомендует кольпоскопию или биопсию, чтобы подтвердить уровень риска, связанного с обнаружением данной клетки.
Плоскоклеточный рак
Плоскоклеточный рак — наиболее распространенный тип рака шейки матки и может быть смертельным, если его не лечить.
Если на него указывает мазок Папаниколау, гинекологи срочно проводят кольпоскопию или биопсию, чтобы определить, на какой стадии находится рак, начиная с «in situ», что означает, что раковые клетки существуют, но еще не распространились в ткани, до стадии 4, на которой рак распространился за пределы шейки матки.
Как только это будет определено, женщина может начать лечение.
AGC-клетки
Их обнаружение может указывать на то, что у железистых клеток в шейке матки или слизистой оболочке матки, также называемой эндометрием, могут возникнуть проблемы. Около половины случаев обнаружения AGC-клеток не вызывают беспокойства, как ASCUS. Однако они могут быть предраковыми, поэтому также нужно пройти биопсию для уверенности.
Аденокарцинома
Это довольно редкий тип рака, который похож на плоскоклеточный рак, но поражает железистые клетки.
Как и в случае обнаружения плоскоклеточного рака, необходимо срочное дополнительное тестирование для определения стадии рака, а затем начинают лечение.
Причины
Одна из причин появления аномальных эпителиальных клеток — дисплазия шейки матки. В этом случае шеечные клетки растут ненормально, и они либо имеют странную форму, либо разрастаются в огромных количествах.
Рост клеток не является однозначно злокачественным симптомом, но со временем аномальная клетка может переродиться в рак в течение примерно 10 лет или немного дольше. Дисплазия шейки матки чаще встречается у женщин от 25 до 35 лет и обычно не имеет симптомов.
Иногда сообщается о необычных клетках, возникающих из-за инфекций, таких как герпес и вирус папилломы человека. ВПЧ — один из ведущих факторов риска развития рака шейки матки.
Наличие паразитов или грибковых инфекций также может дать положительный результат. Клеточная ткань может оказаться ненормальной из-за травмы. Если есть подозрение на инфекцию или травму, то, как правило, не возникает проблем с диагностикой рака в результате обнаружения такой аномалии эпителиальных клеток.
Лечение
Лечение аномалий эпителиальных клеток зависит от конкретной проблемы.
Цитологическая диагностика заболеваний шейки матки
Цитологическое исследование мазков из шейки матки позволяет оценить состояние слизистой оболочки, наличие или отсутствие признаков патологических процессов (реактивных, предопухолевых, опухолей). При выявлении другими лабораторными методами инфекционного агента (вирус папилломы человека, бактериальные и паразитарные инфекции), цитологический метод позволяет оценить реакцию организма на инфекционный агент, наличие или отсутствие признаков повреждения, пролиферации, метаплазии или трансформации эпителия. Возможно также при исследовании мазка определить причину изменений эпителия (наличие воспаления с ориентировочным или уверенным определением патогенной микробиоты (микрофлоры), патологических процессов, связанных с гормональным, лекарственным, механическим, лучевым воздействием на организм женщины и шейку матки, состояний, чреватых опасностью возникновения дисплазии и рака шейки матки, а при их развитии установить правильный диагноз. В связи с этим цитологическое исследование применяют как при скрининге (мазки с визуально нормальной шейки матки), так и при наличии видимых при гинекологическом осмотре изменений слизистой оболочки.
Получение материала
Рак шейки матки чаще всего развивается в зоне трансформации, ему предшествуют фоновые процессы и внутриэпителиальные поражения (дисплазия эпителия), которые могут располагаться на небольших участках, поэтому важно, чтобы материал был получен со всей поверхности шейки матки, особенно из зоны стыка плоского и цилиндрического эпителия. Число измененных клеток в мазке бывает различным, и если их мало, то увеличивается вероятность, что патологические изменения могут быть пропущены при просмотре препарата. Для эффективного цитологического исследования необходимо учитывать:
Материал из шейки матки должен брать врач-гинеколог или (при скрининге, профилактическом осмотре) хорошо обученная медицинская сестра (акушерка).
Важно, чтобы в мазок попадал материал из зоны трансформации, так как около 90% опухолей исходит из зоны стыка плоского и цилиндрического эпителия и зоны трансформации и только 10% из цилиндрического эпителия цервикального канала.
С диагностической целью материал получают раздельно из эктоцервикса (влагалищной порции шейки матки) и эндоцервикса (цервикального канала) с помощью шпателя и специальной щетки (типа Cytobrush). При проведении профилактического осмотра используют Cervex-Brush, различные модификации шпателя Эйра и другие приспособления для получения материала одновременно из влагалищной части шейки матки, зоны стыка (трансформации) и цервикального канала.
Перед получением материала шейку матки обнажают в “зеркалах”, дополнительных манипуляций не проводят (шейку не смазывают, слизь не удаляют; если слизи много – ее аккуратно снимают ватным тампоном, не надавливая на шейку матки.). Щетку (шпатель Эйра) вводят в наружный зев шейки матки, осторожно направляя центральную часть приспособления по оси цервикального канала. Далее ее наконечник поворачивают на 360° (по часовой стрелке), достигая тем самым получения достаточного числа клеток из эктоцервикса и из зоны трансформации. Введение инструмента выполняют очень бережно, стараясь не повредить шейку матки. Затем щетку (шпатель) выводят из канала.
Приготовление препаратов
Перенос образца на предметное стекло (традиционный мазок) должен происходить быстро, без подсушивания и потери прилипших к инструменту слизи и клеток. Обязательно перенести на стекло материал с обеих сторон шпателя или щетки.
Если предполагается приготовление тонкослойного препарата с помощью метода жидкостной цитологии, головку щетки отсоединяют от ручки и помещают в контейнер со стабилизирующим раствором.
Фиксация мазков выполняется в зависимости от предполагаемого метода окрашивания.
Окрашивание по Папаниколау и гематоксилин-эозином наиболее информативны в оценке изменений эпителия шейки матки; любая модификация метода Романовского несколько уступает этим методам, однако при наличии опыта позволяет правильно оценить и характер патологических процессов в эпителии и микрофлору.
Клеточный состав мазков представлен слущенными клетками, находящимися на поверхности эпителиального пласта. При адекватном получении материала с поверхности слизистой оболочки шейки матки и из цервикального канала в мазок попадают клетки влагалищной порции шейки матки (многослойный плоский неороговевающий эпителий), зоны стыка или трансформации (цилиндрический и, при наличии плоскоклеточной метаплазии, метаплазированный эпителий) и клетки цервикального канала (цилиндрический эпителий). Условно клетки многослойного плоского неороговевающего эпителия принято делить на четыре типа: поверхностные, промежуточные, парабазальные, базальные. Чем лучше выражена способность эпителия к созреванию, тем более зрелые клетки попадают в мазок. При атрофических изменениях на поверхности эпителиального пласта расположены менее зрелые клетки.
Интерпретация результатов цитологического исследования
Наиболее распространенная в настоящее время – классификация Bethesda (The Bethesda System), разработанная в США в 1988 г, в которую вносили несколько изменений. Классификация создана для более эффективной передачи информации из лаборатории врачам клинических специальностей и обеспечения стандартизации лечения диагностированных нарушений, а также последующего наблюдения за больными.
В классификации Bethesda выделяют плоскоклеточные интраэпителиальные поражения низкой и высокой степени (squamous intraepithelial lesions of low grade and high grade – LSIL и HSIL) и инвазивный рак. Плоскоклеточные интраэпителиальные поражения низкой степени включают изменения, связанные с папилломавирусной инфекцией и слабой дисплазией (CIN I), высокой степени – умеренную дисплазию (CIN II), тяжелую дисплазию (CIN III) и внутриэпителиальный рак (cr in situ). В этой классификации имеются также указания на специфические инфекционные агенты, вызывающие заболевания, передавае мые половым путем.
Для обозначения клеточных изменений, которые трудно дифференцировать между реактивными состояниями и дисплазией предложен термин ASCUS – atypical squamous cells of undetermined significance (клетки плоского эпителия с атипией неясного значения). Для клинициста этот термин мало информативен, однако он нацеливает врача на то, что данная пациентка нуждается в обследовании и/или в динамическом наблюдении. В классификацию Bethesda в настоящее время введен также термин NILM – no intraepithelial lesion or malignancy, объединяющий норму, доброкачественные изменения, реактивные изменения.
Так как данные классификации используются в практике врача-цитолога, ниже приведены параллели между классификацией Bethesda и классификацией, распространенной в России (Табл. 22). Цитологическое стандартизованное заключениепо материалу из шейки матки (форма № 446/у), утверждено приказом Минздрава России от 24.04.2003 № 174.
Причины получения неполноценного материала различны, поэтому цитолог перечисляет типы клеток, обнаруженные в мазках и по возможности указывает причину, по которой материал признан неполноценным.
Атипическая гиперплазия эндометрия
Атипическая гиперплазия эндометрия – это патологическое разрастание внутреннего слоя матки с появлением атипических клеток. Провоцируется избытком эстрогенов и недостатком прогестерона. Рассматривается, как предраковое заболевание. Может развиваться в любом возрасте, однако чаще выявляется после 45 лет. Сопровождается нарушениями менструального цикла и маточными кровотечениями (меноррагиями, метроррагиями). Диагноз устанавливается на основании жалоб, анамнеза и данных дополнительных исследований. Лечение – гормонотерапия, выскабливание или абляция слизистой оболочки.
МКБ-10
Общие сведения
Атипическая гиперплазия эндометрия – усиленная пролиферация эндометрия, сопровождающаяся изменением морфологии клеток. Данные о распространенности отсутствуют. Патология чаще выявляется у женщин в возрасте 45-55 лет. Длительная повторяющаяся гиперплазия в период климакса и менопаузы рассматривается как предраковое заболевание. Вероятность злокачественного перерождения в зависимости от формы болезни колеблется от 8 до 29%. Атипическая гиперплазия эндометрия нередко сочетается с другими заболеваниями репродуктивной системы. Тактика лечения определяется в зависимости от возраста больной, ее желания иметь детей, наличия или отсутствия сопутствующей генитальной и экстрагенитальной патологии. Лечение осуществляют специалисты в области клинической гинекологии и онкологии.
Причины
Развитие данного заболевания обусловлено увеличением уровня эстрогенов, уменьшением уровня прогестерона и наличием или отсутствием овуляции. Эстрогены и прогестерон участвуют в регуляции циклических изменений эндометрия. В первой фазе менструального цикла эстрогены обеспечивают пролиферацию клеток. Во второй фазе прогестерон подавляет пролиферацию и стимулирует секрецию. При отсутствии овуляции, относительной или абсолютной гиперэстрогенемии фаза секреции либо не наступает, либо проявляется недостаточно ярко. Клетки функционального слоя эндометрия продолжают разрастаться, возникает гиперплазия.
Факторы риска
Предрасполагающими факторами развития атипической гиперплазии эндометрия являются:
Патогенез
Атипическая гиперплазия эндометрия характеризуется патологическим разрастанием функционального слоя слизистой оболочки матки, при этом железистая ткань эпителия подвергается более выраженным изменениям по сравнению с элементами стромы. В процессе гистологического исследования выявляется увеличение количества желез и отек стромы. Железы располагаются близко друг к другу. Сосуды расположены неравномерно. Клетки эпителия с гиперхромными ядрами. Определяются многочисленные патологические митозы.
В зависимости от особенностей расположения железистых клеток различают две формы атипической гиперплазии эндометрия: простую и аденоматозную. При простой форме наблюдается увеличение количества и избыточное разрастание клеток без изменения структуры слизистой оболочки. При аденоматозной форме из железистых клеток формируются особые структуры, отсутствующие в эндометрии здоровой матки. Эти структуры могут быть расположены на всем протяжении эндометрия (диффузная форма) или образовывать отдельные очаги (очаговая форма). Кроме того, участки аденоматозной гиперплазии могут обнаруживаться в области полипов матки.
Симптомы
Основным симптомом данного заболевания являются маточные кровотечения. У большинства пациенток такие кровотечения возникают на фоне задержки менструации сроком на 1-3 месяца. Реже (как правило, при отсутствии ожирения и явной эндокринной патологии) наблюдаются регулярные циклы при продолжительности меноррагии более 7 дней. Примерно у четверти больных с атипической гиперплазией эндометрия выявляются ановуляторные маточные кровотечения. В 5-10% случаев диагностируются метроррагии. Возможны скудные кровянистые выделения в середине менструального цикла либо при отсутствии менструаций.
Более чем у половины пациенток диагностируется ожирение. В 70-75% случаев лишний вес сочетается с симптомами вирилизации: оволосением по мужскому типу, огрублением голоса, увеличением клитора и т. д. При нормальной массе тела признаки вирилизации наблюдаются у 30% больных. Все категории пациенток с атипической гиперплазией эндометрия часто страдают хроническими воспалительными заболеваниями репродуктивной системы, невынашиванием беременности, вторичным бесплодием, эндометриозом, аденомиозом и мастопатией, однако у больных без ожирения перечисленные патологические состояния выявляются в два раза чаще.
Диагностика
Диагноз устанавливают на основании жалоб, данных анамнеза и результатов инструментальных исследований. В ходе опроса гинеколог выясняет возраст менархе, устанавливает длительность цикла, продолжительность и обильность менструаций, уточняет, были ли задержки цикла и кровянистые выделения. Затем врач осуществляет гинекологический осмотр и назначает на трансвагинальное УЗИ для оценки состояния эндометрия (его структуры, толщины, однородности) и выявления патологических изменений яичников (признаков опухоли, кисты или СПЯ).
Точность диагностики гиперпластических процессов при проведении УЗИ составляет 60-70%, однако подтвердить или опровергнуть атипию эндометрия с помощью ультразвукового исследования обычно не удается. Больную направляют на УЗИ на 5-7 день цикла. При длительных кровотечениях УЗИ назначают вне зависимости от фазы цикла. В норме в детородном возрасте толщина слизистой оболочки матки составляет не более 7 мм, при постменопаузе длительностью менее 5 лет – не более 5 мм, при постменопаузе длительностью более 5 лет – не более 4 мм. Увеличение толщины, неоднородность структуры и наличие эхогенных включений позволяют заподозрить гиперплазию эндометрия.
В ряде случаев после УЗИ осуществляют аспирационную биопсию с последующим гистологическим или цитологическим исследованием аспирата. Эта процедура относится к категории скрининг-тестов и выполняется в амбулаторных условиях. Однако золотым стандартом диагностики атипической гиперплазии эндометрия является гистероскопия и раздельное диагностическое выскабливание. Информативность исследования составляет более 90%.
При подозрении на СПЯ и метаболический синдром назначают анализы крови для определения уровня прогестерона, тестостерона, эстрадиола, ЛГ, ФСГ, гормонов надпочечников и щитовидной железы. Выполняют маммографию. При частых рецидивах проводят лапароскопию с биопсией или клиновидной резекцией яичников и последующим гистологическим исследованием материала.
Атипическую гиперплазию эндометрия дифференцируют с другими заболеваниями, провоцирующими маточные кровотечения:
Лечение атипической гиперплазии эндометрия
Лечение данной патологии может быть как консервативным, так и оперативным, проводиться амбулаторно или в условиях стационара. Показанием к плановой госпитализации в репродуктивном возрасте являются кровотечения и кровянистые выделения, в постменопаузе – кровотечения, продолжительные водянистые или гнойные выделения. Экстренная госпитализация показана при обильных кровотечениях. Тактика лечения атипической гиперплазии эндометрия определяется с учетом возраста больной, ее желания иметь детей, наличия соматических заболеваний и болезней репродуктивной системы (особенно – аденомиоза или миомы), формы атипической гиперплазии эндометрия и количества рецидивов.
Диспансерное наблюдение после консервативного лечения осуществляют в течение 5 лет, после хирургического вмешательства – в течение 6 месяцев.
Прогноз
Прогноз при атипической гиперплазии эндометрия зависит от возраста, склонности болезни к рецидивированию, наличия сопутствующей генитальной и экстрагенитальной патологии. Возможно полное выздоровление с сохранением репродуктивной функции, выздоровление с утратой репродуктивной функции или перерождение в злокачественную опухоль эндометрия. В последнем случае потребуется гистерэктомия или пангистерэктомия (удаление матки совместно с аднексэктомией). Прогностически неблагоприятными считаются сочетания атипической гиперплазии эндометрия с любыми обменными нарушениями и заболеваниями эндокринной системы, особенно – в возрасте старше 45 лет. Риск злокачественного перерождения при простой форме заболевания составляет 8%, при аденоматозной – 29%.