истощение костного мозга что это
Синдромы поражения костного мозга: истощение
Содержание
Определение
Истощение костного мозга – это разрушение и исчезновение клеток кроветворного костного мозга с последующим замещением жировым костным мозгом.
Классификация
J. B. Vogler и соавт. (1988) выделили пять основных патофизиологических синдромов поражения костного мозга, которые могут быть выявлены при МРТ. К этим синдромам относятся – отек, некроз, реконверсия, истощение и инфильтрация костного мозга.
Патогенез
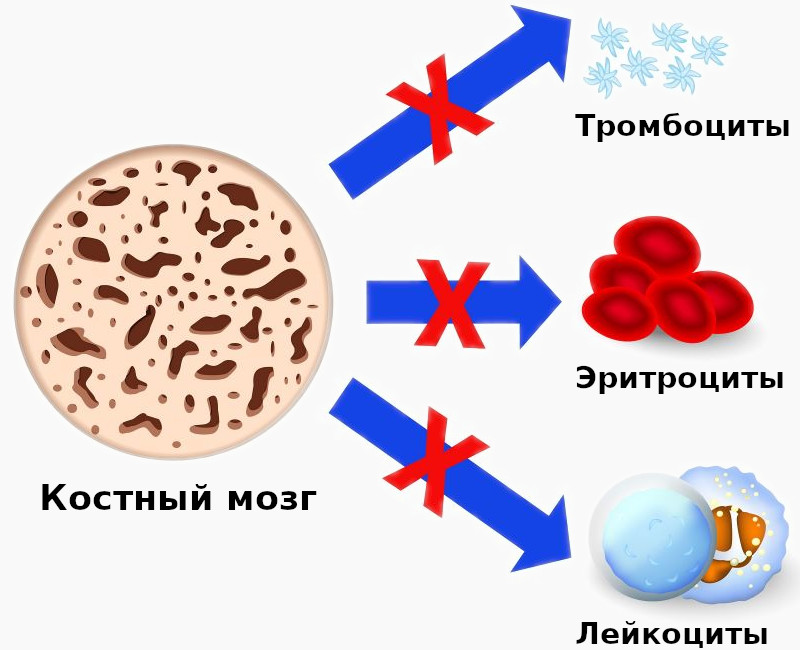
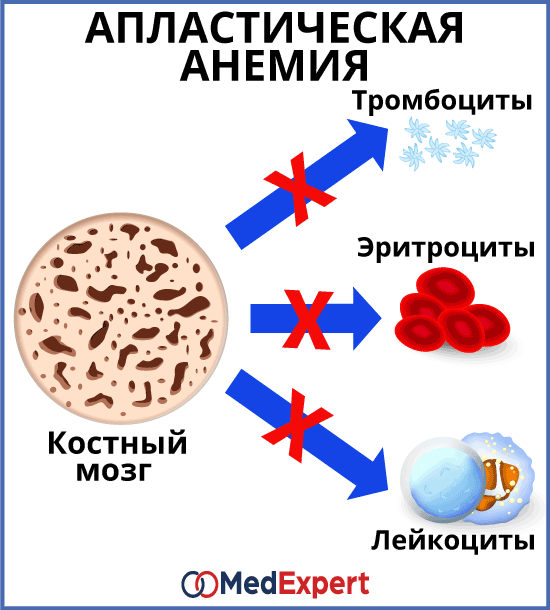
Истощение костного мозга характеризуется разрушением и исчезновением клеток кроветворного костного мозга с последующим замещением жировым костным мозгом. Наиболее частыми причинами этого состояния являются апластическая анемия, проведение лучевой или химиотерапии.
Эпидемиология
Распространенность истощения костного мозга напрямую связана с этиологическими факторами.
Визуализация
Клинические проявления
Истощения костного мозга напрямую связана с этиологическими факторами. Общие проявления этиологических факторов, вызывающих истощение костного мозга, аналогичны общим симптомам реконверсии костного мозга: 1. Слабость, быстрая утомляемость; 2. Учащение сердечного ритма, особенно на фоне физических нагрузок; 3. Появление одышки, а также головной боли из-за физических нагрузок; 4. Человек не может сконцентрироваться; 5. Появление головокружения; 6. Бледность кожи; 7. Появление судорог в ногах; 8. Больного мучает бессонница. Кроме того, существуют симптомы, которые характерны для каждого вида этиологического фактора.
Лучевая диагностика
МРТ-семиотика
Т1-ВИ и Т2-ВИ: истощение костного мозга проявляется возникновением участков высокоинтенсивного МР-сигнала на Т1- и Т2-ВИ, соответствующих жировому костному мозгу в тех отделах скелета, где в норме содержится красный костный мозг.
Пример описания
Заключение: Структурные изменения в проксимальном метафизе бедренной кости (признаки истощения красного костного мозга).
Апластическая анемия
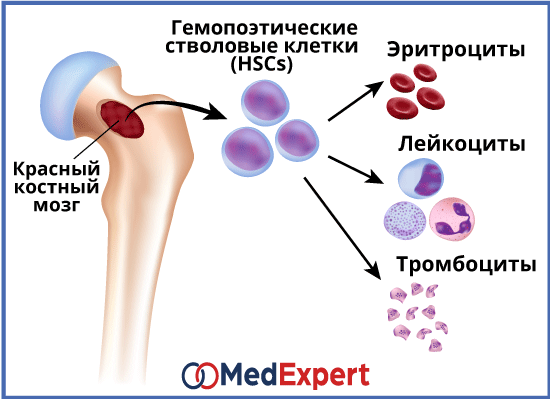
Апластическая анемия – серьёзное нарушение формирования, развития и созревания клеток крови. Оно характеризуется угнетением кроветворной функции костного мозга, что проявляется дефицитом образования белых и красных кровяных клеток, а также тромбоцитов. Иногда наблюдается недостаток формирования только эритроцитов. Заболевание считается одним из самых тяжёлых расстройств гемопоэза и при отсутствии адекватного лечения может стать причиной летального исхода в течение нескольких месяцев. Оно в одинаковой степени поражает пациентов мужского и женского пола в возрасте от десяти до двадцати пяти лет или старше пятидесяти. Согласно медицинской статистике каждый год диагностируют два случая патологии на один миллион человек.
Пройти диагностику и лечение апластической анемии в Москве предлагает отделение гематологии ЦЭЛТ. Наша многопрофильная клиника одна из первых в РФ начала деятельность на рынке платных медицинских услуг и успешно продолжает её уже третье десятилетие. В отделении гематологии ведут приём ведущие отечественные специалисты, в арсенале которых имеется современная лечебно-диагностическая база, позволяющая точно ставить диагноз и проводить лечение в соответствии с международными стандартами. Стоимость услуг доступна в нашем прайс-листе, который мы регулярно обновляем. Во избежание недоразумений просим Вас уточнять цифры у операторов нашей информационной линии: +7 (495) 788 33 88.
Апластичная анемия: этиология
Согласно происхождению, выделяют врождённую и приобретённую анемию. Первая развивается вследствие хромосомных мутаций, вторая – под воздействием химических веществ, излучения, инфекций. Специалисты считают, что угнетение кроветворения костного мозга может быть инициировано появлением в нём и в крови цитотоксических Т-лимфоцитов. Они производят ФНО (внеклеточный белок) и интерферон “y”, которые подавляюще воздействуют на ростки кроветворения. Причина запуска механизма может крыться в:
В 50% случаев причину развития патологии установить не удаётся. Такая форма апластической анемии называется идиопатической.
Классификация апластической анемии
| Форма патологии | Чем отличается? |
| По продолжительности течения | |
| Острая | Не более одного месяца |
| Подострая | От одного месяца до полугода |
| Хроническая | Более полугода |
| По степени тяжести при избирательной аплазии | |
| Умеренная | Гранулоцитов менее 0,0х10 9 /л, тромбоцитов менее 20,0х10 9 /л. |
| Тяжёлая | Гранулоцитов менее 0,5х10 9 /л, тромбоцитов менее 20,0х10 9 /л. согласно результатам диагностики клеточность костного мозга составляет менее трети от нормы. |
| Очень тяжёлая | Гранулоцитов более 0,5х10 9 /л, тромбоцитов более 20,0х10 9 /л. |
Апластическая анемия: симптомы
Заболевание начинается остро, оно сопровождается ощущением сильной слабости и быстрой утомляемостью. Кожные покровы больного и видимые слизистые оболочки выглядят бледными, а сам он страдает от следующих клинических проявлений:
При снижении количества тромбоцитов в единице объёма крови проявляется геморрагический синдром:
Снижение количества лейкоцитов в единице объёма крови характеризуется регулярным частым развитием инфекционных заболеваний кожи и структур мочевыводящей системы, воспалительными процессами слизистой оболочки рта, воспалениями лёгких.
Врождённая форма анемии развивается у детей до десяти лет и сопровождается целым рядом других нарушений:
Апластическая анемия: осложнения
Отсутствие лечения апластической анемии может привести к летальному исходу из-за развития таких осложнений, как:
Апластическая анемия: диагностика
Перед тем, как приступить к лечению заболевания, гематологи ЦЭЛТ проводят комплексную диагностику, направленную на точную постановку диагноза и выявление этиологического фактора. Она включает в себя:
При наличии заболевания у пациента выявляют серьёзное снижение гемоглобина, вплоть до критического уровня – 20-30 г/л, наблюдается агранулоцитоз – снижение зернистых лейкоцитов и моноцитов. Количество лимфоцитов может быть в норме или сниженным, тромбоцитов – всегда снижено, иногда их не обнаруживают вовсе. Скорость оседания эритроцитов – повышается до 4-60 мм/ч. Исследование образца костного мозга выявляет повышенное содержание жировой ткани – 90%, включающее в себя элементы стромы и лимфы, а вот гематогенные клетки имеются в очень малом количестве.
Лечение апластической анемии
Лечение идиопатической и других видов апластической анемии – очень сложная задача, требующая комплексного индивидуального подхода. При разработке тактики специалисты ЦЭЛТ учитывают результаты диагностики и показания пациента. Больного помещают в изолятор с асептическими условиями, что позволяет исключить риск развития инфекций и их осложнений. Медикаментозная терапия заключается в приёме:
Всем больным апластической анемией проводят переливание эритроцитарной и/или тромбоцитарной массы, в объёмах, определяемых исходя из клинической картины и показателей периферической крови. Кроме того, пациенту могут назначить спленэктомию – хирургическое вмешательство, направленное на удаление селезёнки. Самые благоприятные прогнозы может обеспечить трансплантация костного мозга. Она заключается в пересадке донорских или собственных стволовых кроветворных клеток, предварительно изъятых из подвздошных костей путём пункции. К сожалению, процедура недоступна для широкого применения из-за сложности подбора совместимого донора. В том случае, если это невозможно, пациенту назначают паллиативную терапию с применение циклоспорина А.
В отделении гематологии нашей клиники ведут приём кандидаты, доктора и профессоры медицинских наук с опытом практической и научной работы от двадцати пяти лет. Вы можете записаться к ним на приём онлайн или обратившись к нашим операторам. Специалисты высокой квалификации работают и в отделении урологии. К ним можно записаться на цистоскопию мочевого пузыря.
Записавшись на прием гематолога, вы сможете получить всестороннюю консультацию. В компетенции врача находится лечение различных заболеваний крови, большинство из которых можно выявить на ранних стадиях и назначить своевременное лечение, позволяющее справиться с болезнью быстро и легко.
АПЛАСТИЧЕСКАЯ АНЕМИЯ (НЕДОСТАТОЧНОСТЬ КОСТНОГО МОЗГА)
Апластическая анемия – это заболевание, при котором костный мозг перестает производить клетки крови в достаточном количестве. Апластическая анемия сопровождается слабостью, повышает риск развития инфекционных заболеваний и неконтролируемых кровотечений.
Апластическая анемия – редкое, но очень тяжелое заболевание, которое может развиться в любом возрасте. Она может появиться внезапно или прогрессировать медленно в течение длительного времени, ухудшая состояние пациента.
Различают два вида заболевания:
СИМПТОМЫ АПЛАСТИЧЕСКОЙ АНЕМИИ
Каждый вид кровяных клеток выполняет свои функции:
Симптомы болезни зависят от того, каких кровяных клеток недостаточно, однако в некоторых случаях, может присутствовать дефицит всех трех видов клеток одновременно. Характерными симптомами являются:
При низком количестве эритроцитов:
При низком количестве лейкоцитов:
При низком количестве тромбоцитов:
Почему апластическую анемию можно спутать с миелодиспластическим синдромом?
Апластическую анемию можно спутать с заболеванием, которое называется миелодиспластическим синдромом. Миелодиспластический синдром – это группа заболеваний, при которых костный мозг вырабатывает новые кровяные клетки, но они деформированы или недоразвиты. При этом синдроме костный мозг иногда характеризуют как «гиперпластический», имея в виду, что в нем содержится много кровяных клеток. Но у некоторых пациентов с этим синдромом костный мозг почти пуст, поэтому заболевание может быть ошибочно диагностировано как апластическая анемия.
Взаимосвязь с другими редкими заболеваниями
У части больных с апластической анемией может наблюдаться такая редкая аномалия, как пароксизмальная ночная гемоглобинурия, при которой происходит слишком быстрое разрушение эритроцитов. Пароксизмальная ночная гемоглобинурия может привести к развитию апластической анемии, а также апластическая анемия может развиться в пароксизмальную ночную гемоглобинурию.
Анемия Фанкони – это редкое, наследственное заболевание, которое приводит к развитию апластической анемии. Дети, рожденные с болезнью Фанкони, обычно, отстают в развитии и могут иметь различные врожденные дефекты, такие как недоразвитость конечностей. Болезнь диагностируется при помощи лабораторных исследований крови.
ЛЕЧЕНИЕ АПЛАСТИЧЕСКОЙ АНЕМИИ
Лечение апластической анемии может заключаться в наблюдении и контроле состояния пациента при легкой степени тяжести заболевания, переливании крови и медикаментозном лечении в более тяжелых случаях, и в необходимости проведения трансплантации костного мозга в тяжелых случаях. Тяжелая форма апластической анемии, при которой количество кровяных клеток слишком низкое, представляет угрозу жизни и требует немедленной госпитализации и лечения.
Переливание крови
Лечение апластической анемии, обычно, включает переливание крови для того, чтобы контролировать кровотечения и уменьшить интенсивность симптомов. Переливание крови не может излечить от болезни, но будет способствовать уменьшению признаков и симптомов, восполняя кровяные клетки, которые костный мозг не в состоянии производить. Переливание крови может включать:
И хотя официально нет ограничений для количества переливания крови, все же многоразовые процедуры могут привести к осложнениям. Переливаемые эритроциты содержат железо, которое, накапливаясь в организме, может нанести ущерб жизненно важным органам при отсутствии необходимой терапии, способствующей его выведению из организма. Применение специальных препаратов поможет организму избавиться от избытка железа. Другое возможное осложнение может развиться со временем в связи с тем, что организм начнет вырабатывать антитела к переливаемым кровяным клеткам, что сделает лечение менее эффективным. Для снижения вероятности развития этого осложнения назначается иммуносупрессивная терапия.
Пересадка стволовых клеток
Пересадка стволовых клеток для восстановления здоровья костного мозга с помощью донорских стволовых клеток может быть единственным выбором для лечения тяжелой апластической анемии. Трансплантация стволовых клеток, иногда называемая пересадкой костного мозга, является предпочтительным методом лечения для пациентов молодого возраста, имеющих подходящего донора – чаще всего таковым является брат или сестра.
Если донор найден, то перед трансплантацией стволовых клеток пациент подвергается воздействию лучевой и химиотерапии, которые разрушают его собственный костный мозг, а вместе с ним злокачественные клетки, и освобождают место для нового костного мозга. Далее у донора производится забор стволовых клеток. Здоровые стволовые клетки вводят внутривенно, и по кровеносной системе они транспортируются в полости костей, где начинают производить новые клетки крови. Эта процедура требует длительной госпитализации. С целью предотвращения отторжения донорских стволовых клеток, после трансплантации назначаются специально действующие препараты.
Трансплантация стволовых клеток сопряжена с риском. Есть вероятность, что организм начнет отторгать трансплантат, что может привести к угрожающим жизни осложнениям. Кроме того, пересадка костного мозга показана не каждому пациенту, а также не всегда удается найти подходящего донора.
Иммуносупрессивная терапия
В случаях, когда пациенту невозможно провести пересадку костного мозга, или апластическая анемия является результатом аутоиммунных нарушений, для лечения заболевания назначают препараты, которые изменяют или подавляют иммунную систему (иммуносупрессанты).
К таким препаратам относятся циклоспорин (Gengraf, неорал, сандиммун) и антитимоцитарный глобулин (Тимоглобулин). Эти лекарственные везества подавляют деятельность иммунных клеток, которые повреждают костный мозг. Лечение помогает восстановить костный мозг и повысить содержание кровяных телец в крови. Циклоспорин и антитимоцитарный глобулин часто используются комбинировано.
В комплексе с этими препаратами часто назначаются кортикостероидные лекарства, такие как метилпреднизолон (медрол, солу-медрол).
Иммуносупрессоры могут быть очень эффективными для лечения апластической анемии. Отрицательным моментом является то, что эти препараты ослабляют иммунную систему. Кроме того, существует вероятность, что после отмены лекарств апластическая анемия может возвратиться.
Стимуляторы кроветворения в костном мозге
Некоторые препараты, включая колониестимулирующие факторы, такие как сарграмостим (лейкин), филграстим (нейпоген), пегфилграстим (нейласта) и эпоэтин альфа (эпоген, прокрит), могут стимулировать кроветворение в костном мозге. Препараты, стимулирующие кроветворение, могут применяться в комбинации с иммуносупрессорами.
Антибактериальное и противовирусное лечение
Апластическая анемия ослабляет иммунную систему в связи с тем, что в крови снижен уровень лейкоцитов, которые защищают организм от инфекций. Это делает больного восприимчивым к различным инфекционным заболеваниям.
При первых признаках инфекционного заболевания, таких как повышенная температура, жар, ломота во всем теле необходимо обратиться к врачу. Развитие инфекционного заболевания может быть опасным для жизни больного с апластической анемией. Для лечения и профилактики инфекционных заболеваний назначают антибактериальные и противовирусные препараты.
МЕТОДЫ ДИАГНОСТИКИ АПЛАСТИЧЕСКОЙ АНЕМИИ
Для диагностики апластической анемии рекомендуются следующие методы:
Истощение костного мозга что это
В результате заболевания раком и его лечения могут возникнуть острые и часто угрожающие жизни состояния. Ятрогенные смерти не редки, потому что многие типы лечения, в частности интенсивная химиотерапия, по своей природе очень опасны. Тем не менее большую часть смертей можно избежать. Риски минимизируются, если пациенты лечатся в специализированных онкологических отделениях при участии опытного служебного персонала, который помогает избегать этих проблем или лечить их.
Цитотоксические препараты нарушают воспроизводительную способность клеток. Гемопоэтические клетки костного мозга относятся к наиболее быстро делящимся клеткам тела и высокочувствительны к действию большинства противоопухолевых агентов. Некоторые препараты — например, винкристин и блеомицин — вызывают незначительное ухудшение работы костного мозга, в то время как большая часть цитотоксических агентов значительно ослабляют процесс гемопоэза.
Одним из главных осложнений таких препаратов, как доксорубицин, является миелосупрессия. Цитотоксические агенты воздействуют на разные пролиферативные отделы в костном мозге. Это ведет к отдельным видам повреждений даже внутри одного и того же класса цитотоксических агентов. Например, циклофосфамид, который употребляют в виде единичного внутривенного введения, вызывает предсказуемую гранулоцитопению через 4-7 дней, с менее заметным влиянием на количество тромбоцитов.
В отличие от него, мелфалан и бусульфан вызывают более медленное ухудшение работы костного мозга с появлением первых эффектов через 7-8 дней и максимумом подавления функции белых клеток примерно через 7-8 недель. Для производных нитрозомочевины, таких как цис-хлорэтилнитрозомочевина (ЦХНМ), типична задержка влияния на количество клеток крови, равная 4-5 недель. Причина этих различий неизвестна и не объясняется химическими характеристиками лекарств. Например, карбоплатин регулярно вызывает повреждение костного мозга, в то время как цисплатин менее токсичен для костного мозга.
Эти различные особенности действия подчеркивают, насколько упрощен наш взгляд на действие, например, алкилирующих агентов и на то, что они в каком-то смысле вызывают неспецифическое повреждение клеток.

Скорость атаки и степень повреждения, с которыми разрушается костный мозг, также зависят от дозы и времени приема лекарства. Хотя количество тромбоцитов не падает значительно при приеме классических доз циклофосфамида, оно уменьшается при приеме значительно большего количества препарата. Нейтропения и тромбоцитопения обычно наступают через 4-5 недель после приема обычных доз ЦХНМ. Однако при очень больших дозах, таких, которые были использованы в экспериментах по лечению опухоли мозга, развитие нейтропении и тромбоцитопении может произойти значительно раньше, уже через 4-5 дней после приема лекарства.
Хотя некоторые вещества (мелфалан, бусульфан, ЦХНМ) могут вызывать длительное подавление функции костного мозга даже после первого приема, у пациента, принимающего цитотоксическую химиотерапию периодически, в первое время подавление функции костного мозга носит временный характер, и количество клеток крови возвращается к нормальному уровню в течение 2-3 недель, когда может быть начат следующий курс.
С увеличивающейся продолжительностью химиотерапии, однако, пролиферативные отделы в костном мозге могут опустошаться все быстрее, и нижняя граница количества белых клеток крови впоследствии станет еще ниже, а скорость образования новых менее быстрой, поэтому последующие курсы химиотерапии должны быть отложены или доза сокращена. Для того чтобы избежать угрожающего жизни повреждения костного мозга, необходима осведомленность о цитотоксическом режиме, а также о том, какова вероятность увеличивающегося подавления функции костного мозга со временем.
Однако, каким бы опытным ни был клинический врач, подавление функции костного мозга может произойти неожиданно. С некоторыми курсами лечения — например, в течение индукции ремиссии при острой миелобластической лейкемии, или с использованием высокодозной химиотерапии при некоторых солидных опухолях — панцитопения будет неизбежным следствием лечения.
Гранулоцитопения клинически проявляется только при инфицировании. Она обычно сопровождается жаром, недомоганием, лихорадкой и ознобом, иногда изъязвлением ротовой полости и воспалением промежности. При снижении количества тромбоцитов у пациента может развиться носовое кровотечение или пурпура. Симптомы анемии обычно не появляются внезапно; даже если полностью останавливается эритропоэз, гемоглобин обычно снижается незначительно после единичного лечения до того, как произойдет наработка новых клеток, так как времени полужизни красных клеток хватает для этого (25 дней).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Множественная миелома
Множественная миелома — это вид онкопатологии, локализованной в костном мозге и поражающей кровеносную систему. Заболевание приводит к увеличению количества кальция, который откладывается в органах. Опухоль костного мозга влияет на окружающие ткани и кости: позвоночник, череп, таз. Кровь становится гуще за счёт повышенного количества белка. Обычно выявляется у людей от 60 лет и старше.
Акции
Оперативные вмешательства со скидкой 7%.
Онкоконсилиум может потребоваться как при лечении в «СМ-Клиника», так и пациентам других медицинских учреждений с целью получения альтернативного мнения.
«СМ-Клиника» предоставляет своим пациентам предоперационное обследование со скидкой до 72%!
Консультация врача-хирурга по поводу операции бесплатно!
Содержание статьи:
Множественная миелома (ММ) представляет собой злокачественное опухолевое поражение B-лимфоцитов – плазматических клеток, отвечающих за иммунные функции. Относится к группе хронических миелобластных лейкозов. Патология также именуется миеломной болезнью, плазмоцитомой, болезнью Рустицкого-Калера.
Среди всех злокачественных опухолей на долю множественной миеломы приходится около 1%, среди опухолей органов кроветворения и лимфоидной ткани – 10-15%.
В России, по данным на 2017 год, заболеваемость ММ составила 2,78 случаев на 100 тыс. населения.
Множественная миелома на сегодня считается неизлечимым заболеванием, терапия направлена на сдерживание роста опухоли, продление жизни больных и поддержание ее качества. Прогноз зависит от того, на какой стадии выявлено заболевание, возраста пациента, степени поражения и соответствующих лабораторных показателей. К сожалению, миеломная болезнь часто диагностируется только с появлением клинических симптомов, при этом с момента начала заболевания до явной симптоматики может пройти достаточно долгое время, в течение которого выявить патологию можно только по анализу крови.
Причины и факторы риска возникновения множественной миеломы
Болезнь развивается вследствие мутаций в клетках-предшественниках B-лимфоцитов. Причины возникновения мутаций неизвестны, но существуют факторы риска, их провоцирующие. Это:
Симптоматика заболевания
В период клинических симптомов, как правило, раньше других появляются боли практически во всех костях скелета – позвоночнике, ребрах, грудине, тазовых, бедренных, плечевых костях. Боли возникают самопроизвольно при движении или пальпации. Позднее развивается остеопороз, могут возникать переломы, в таких случаях боль носит постоянный локализованный характер. Вследствие компрессионных переломов позвонков появляются сопутствующие симптомы, характерные для сдавления корешков спинного мозга, изменение чувствительности, параплегии, нарушение моторики мочевого пузыря и кишечника.
При ММ поражаются различные органы с соответствующей симптоматикой.
Миеломная нефропатия
Поражение почек, развивающееся вследствие склерозирования почечных канальцев, вынужденных фильтровать большой объем миеломного белка. Кроме того, в поражении почек при множественной миеломе принимают участие дегидратация, повышение уровня кальция в крови, сопутствующие инфекции и прием высоких доз нестероидных противовоспалительных препаратов. Миеломная нефропатия имеет различные проявления, от бессимптомной протеинурии (наличие белка в моче) до тяжелой почечной недостаточности. К нефропатии могут присоединяться инфекционные поражения почек.
Анемия
Инфильтрация костного мозга миеломными клетками приводит к снижению количества эритроидных клеток-предшественников, из которых образуются эритроциты. Помимо снижения гемоглобина и цветового показателя, в анализах крови обнаруживается значительно ускоренная СОЭ (скорость оседания эритроцитов). Больные с анемией испытывают слабость, беспричинную усталость, головокружения. У них отмечается сухость и бледность кожи, ломкость ногтей и волос.
Гиперкальциемия
Повышенное содержание кальция в крови приводит к появлению тошноты с приступами рвоты, учащенному мочеиспусканию, мышечной слабости, вялости, сонливости, потере сознания, вплоть до коматозного состояния в терминальной стадии болезни.
Инфекционные осложнения
При ММ в несколько раз повышается риск возникновения бактериальных и вирусных осложнений. Наиболее часто у пациентов развиваются инфекционные поражения почек и легких (пневмония). Присоединение инфекции – одна из ведущих причин смертности от множественной миеломы.
Нарушения свертываемости крови
Белки, вырабатываемые миеломными клетками, провоцируют повышенную вязкость крови, из-за чего появляются как местные симптомы – кровоизлияния в сетчатку глаза, носовые, маточные и другие кровотечения, так и общие – одышка, головокружение, инсультоподобные признаки.
Миеломный амилоидоз
Инфильтрация тканей миеломными клетками. Поражаются практически все органы и системы – сердечно-сосудистая, выделительная, нервная системы, желудочно-кишечный тракт, роговица глаз, суставы, кожа – с соответствующими поражениями.
Обращаться к врачу следует при появлении первых, даже неспецифических признаков заболевания, – слабости, вялости, болей в костях.
Классификация множественной миеломы
ММ классифицируют по характеру распространения новообразований, с учетом характеристик клеток, по секретированию парапротеинов.
По характеру распространения опухолевого инфильтрата:
По характеристикам клеток:
По секреции парапротеинов:
Стадии множественной миеломы
Стадирование множественной миеломы осуществляется на основании системы Дьюри-Салмона либо согласно международной системе ISS/R-ISS (международная система, пересмотренная в 2014 году).
По Дьюри-Салмону для определения стадии заболевания рассматривают следующие критерии:
В соответствии с этими критериями выделяют три стадии ММ.
| Стадия | Признаки | Клеточная масса (1012/м2) |
| I | Моноклональный глобулин – незначительное количество; Уровень кальция в крови – норма; Гемоглобин – норма или незначительно понижен (не менее 10 г/дл); Переломы или другие повреждения костей – отсутствуют либо единичный эпизод. | 1,2 |
Для каждой из стадий выделяют подстадию A или B, в зависимости от нарушения функции почек:
Для цитогенетического исследования опухолевых клеток показана биопсия костного мозга. Также проводится иммунофенотипирование клеток крови.
Для исключения поражения различных органов или при имеющейся симптоматике назначаются:
При метастазировании ММ малигнизированные клетки лимфогенным путем распространяются в костную ткань. Метастатические очаги определяются с помощью рентгенографии или компьютерной томографии костей.
Лечение множественной миеломы
Тактика лечения ММ зависит от того, на какой стадии выявлено заболевание, а также от особенностей его течения. В случаях бессимптомной (тлеющей) миеломы (около 10% больных) болезнь прогрессирует очень медленно и не требует противоопухолевого лечения. Поэтому иногда на первых стадиях заболевания врачи выбирают выжидательную тактику, чтобы оценить скорость развития патологии.
При имеющейся симптоматике больным показано специфическое противоопухолевое лечение. Его схема назначается врачом с учетом всех факторов: вида множественной миеломы, возраста больного, имеющихся сопутствующих заболеваний, данных лабораторных анализов. Пациенту могут быть назначены химиотерапия, лучевая терапия, трансплантация костного мозга. В сочетании с основными методами лечения могут использоваться иммунотерапия (биотерапия), плазмаферез крови, терапия глюкокортикостероидами.
Совместно с противоопухолевым лечением проводится симптоматическая терапия для поддержания нормального функционирования пораженных органов и систем.
При болевом синдроме рекомендуется проведение обезболивающей терапии, при сильных болях – с применением наркотических и психотропных лекарственных препаратов.
Прогноз и профилактика заболевания
На сегодняшний день ММ считается неизлечимым заболеванием с неизбежным возникновением рецидивов. Как правило, рецидивы развиваются в течение года после лечения миеломной болезни, каждая последующая ремиссия короче предыдущей.
Прогноз выживаемости зависит от стадии, на которой выявлена множественная миелома, и ее вида. При выявлении на I и II стадиях средняя продолжительность жизни составляет 4-4,5 лет, при IIIA стадии – около 2,5 лет.
Самый неблагоприятный прогноз при ММ, выявленной на IIIB стадии, продолжительность жизни больных около 15 месяцев. При первичной резистентности к химиотерапии выживаемость составляет менее года.
Профилактики множественной миеломы не существует, так как неизвестны факторы, приводящие к мутации клеток. Больным после прохождения лечения ММ в течение всей жизни необходимо наблюдение гематолога.
Источники: