как образуются нейроны в головном мозге
Как образуются нейроны?
Механизм дифференцировки предшественников нейронов в нейроны с узкой специализацией изучен крайне слабо. Но ведь кроме возможностей использовать данные знания для терапии различных расстройств, затрагивающих нервную систему, понимание механизмов дифференциации нейронов позволит значительно продвинуться в исследованиях стволовых клеток и методов их перепрограммирования.
Специалисты из Медицинской школы Джона Хопкинса, США, (Johns Hopkins School of Medicine) выяснили механизм приобретения нейронами их специфических функций и обнаружили белок-антиоксидант Prdx1, который этот процесс контролирует.
В развивающейся нервной системы, предшественники нейронов «выключают» программу деления и «включают» программу узкой функциональной дифференциации. Учёные выяснили роль GDE2 мембранных белков и пероксиредоксина Prdx1, которые и инициируют развитие нейронов спинного мозга. Исследователи предположили, что этот механизм общий и лежит в основе процесса образования и других типов нейронов.
Предыдущие исследования показали, что протеин GDE2 стимулирует развитие незрелых нейронов в двигательные (моторные), передающие сигнал и контролирующие мышечные сокращения. Низкая концентрация GDE2 не позволяет предшественникам нервных клеток дифференцировать в мотонейроны.
Основываясь на этих данных, учёные определили круг соединений, влияющий на работу GDE2 в течение всего цикла его синтеза и функционирования в клетке. Изучив потенциальные регуляторные факторы, исследователи выделили несколько наиболее вероятных белков и определили гены, отвечающие за их синтез. Так, «выключив» ген синтеза пероксиредоксина Prdx1 в куриных эмбрионах, учёные получили эмбрионы с неразвитыми мотонейронами, аналогичные получаемым при «выключении» гена GDE2.
Чтобы убедится, что отсутствие Prdx1 тормозит развитие мотонейронов именно воздействием на GDE2, а не каким-либо другим путём, исходные белки заменили мутантными, которые не могли образовывать между собой связи. Это полностью затормозило дифференциацию нейронов.
Результаты этого исследования опубликованы в Cell.
NAME] => URL исходной статьи [
Ссылка на публикацию: STRF.ru
Код вставки на сайт
Как образуются нейроны?
Механизм дифференцировки предшественников нейронов в нейроны с узкой специализацией изучен крайне слабо. Но ведь кроме возможностей использовать данные знания для терапии различных расстройств, затрагивающих нервную систему, понимание механизмов дифференциации нейронов позволит значительно продвинуться в исследованиях стволовых клеток и методов их перепрограммирования.
Специалисты из Медицинской школы Джона Хопкинса, США, (Johns Hopkins School of Medicine) выяснили механизм приобретения нейронами их специфических функций и обнаружили белок-антиоксидант Prdx1, который этот процесс контролирует.
В развивающейся нервной системы, предшественники нейронов «выключают» программу деления и «включают» программу узкой функциональной дифференциации. Учёные выяснили роль GDE2 мембранных белков и пероксиредоксина Prdx1, которые и инициируют развитие нейронов спинного мозга. Исследователи предположили, что этот механизм общий и лежит в основе процесса образования и других типов нейронов.
Предыдущие исследования показали, что протеин GDE2 стимулирует развитие незрелых нейронов в двигательные (моторные), передающие сигнал и контролирующие мышечные сокращения. Низкая концентрация GDE2 не позволяет предшественникам нервных клеток дифференцировать в мотонейроны.
Основываясь на этих данных, учёные определили круг соединений, влияющий на работу GDE2 в течение всего цикла его синтеза и функционирования в клетке. Изучив потенциальные регуляторные факторы, исследователи выделили несколько наиболее вероятных белков и определили гены, отвечающие за их синтез. Так, «выключив» ген синтеза пероксиредоксина Prdx1 в куриных эмбрионах, учёные получили эмбрионы с неразвитыми мотонейронами, аналогичные получаемым при «выключении» гена GDE2.
Чтобы убедится, что отсутствие Prdx1 тормозит развитие мотонейронов именно воздействием на GDE2, а не каким-либо другим путём, исходные белки заменили мутантными, которые не могли образовывать между собой связи. Это полностью затормозило дифференциацию нейронов.
Результаты этого исследования опубликованы в Cell.
Основы развития мозга
За последние несколько десятилетий были достигнуты значительные успехи в нашем понимании основных этапов и механизмов развития мозга млекопитающих. Исследования, касающиеся нейробиологии развития мозга, охватывают уровни организации мозга от макроанатомических, до клеточных и молекулярных. Эти знания обеспечивают картину развития мозга как продукта сложной серии динамических и адаптивных процессов, работающих в условиях ограниченного, генетически организованного, но постоянно меняющегося контекста.
Развитие мозга продолжается в течение длительного периода времени. Мозг увеличивается в четыре раза в дошкольный период, достигая примерно 90% взрослого объема в возрасте до 6 лет. Но структурные изменения в основных отделениях серого и белого вещества ( материи ) продолжаются в детском и подростковом возрасте, и эти изменения в структуре параллельных изменений и функциональной организации, отражаются на поведении детей и подростков. В раннем послеродовом периоде уровень связности нейронов во всем развивающемся мозге намного превышает уровень взаимодействия нейронов у взрослых (Innocenti, Price 2005 ). Эта интнсивная связь постепенно слабеет в своей выраженности вследсвие конкурентных процессов, на которые влияет опыт организма человека. Ранние процессы, зависящие от опыта, лежат в основе пластичности и способности к адаптации, что является отличительной чертой раннего развития мозга.
Дифференциация всех линий эмбриональных стволовых клеток связана с комплексными каскадами молекулярной сигнализации. В начале гаструляции клетки слоя эпибласта, которые будут дифференцироваться в клетки нейронных предшественников, расположены вдоль рострально-каудальной срединной линии двухслойного эмбриона. Дифференциация этих клеток в клетки нейронных предшественников является результатом комплексной молекулярной сигнализации, которая включает в себя несколько продуктов гена (т.е. белков), которые продуцируются несколькими различными популяциями эмбриональных клеток. Напомним, что в начале гаструляции клетки эпибласта начинают мигрировать в определенном направлении, а затем проходят через примитивную полоску. Поскольку подмножество клеток, которые мигрируют вдоль рострально-каудальной срединной линии эмбриона, приближается к открытию, они проходят другую структуру, называемую примитивным узлом, которая расположена на ростральном конце примитивной полосы. Примитивный узел является молекулярным сигнальным центром. Клетки примитивного узла посылают молекулярный сигнал на подмножество клеток, которые мигрируют вдоль рострально-каудальной средней линии эмбриона, и этот сигнал, в свою очередь, вызывает экспрессию генов в мигрирующих клетках. Экспрессия гена в мигрирующей клетке продуцирует белок, который секретируется в пространство между мигрирующими клетками и клетками, которые остаются в области средней линии верхнего слоя эпибласта. Секретируемый белок связывается с рецепторами на поверхности клеток в верхнем слое эмбриона и побуждает клетки эпибласта дифференцироваться в клетки нейронных предшественников.
Зрелый неокортекс разделен на четко определенные структурно и функционально различные «области», которые дифференцируются по их клеточной организации и структурам нейронной связи.
Родословная нейронов: как носить в себе множество мутаций и выглядеть совершенно здоровым
Родословная нейронов: как носить в себе множество мутаций и выглядеть совершенно здоровым
Автор
Редактор
Статья на конкурс «био/мол/текст»: На протяжении долгой истории развития нейробиологии ученые придерживались догмы: мозг взрослого человека не подвержен изменениям. Однако в ходе нового исследования впервые было показано, что значительное количество мутаций присутствует в мозговом веществе абсолютно здоровых людей, причем чаще всего они обнаруживаются в генах, которые нейрон использует наиболее активно. Попробуем разобраться, как этим можно воспользоваться и чем это грозит.
Обратите внимание!
Эта работа опубликована в номинации «лучшее новостное сообщение» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Мутации: патология или норма?
Каждая клетка нашего тела была создана путем деления клеток-предшественниц, которые, в свою очередь, восходят в развитии к зиготе. Значит ли это, что общий путь развития всех клеток организма обеспечивает общность генетического материала? Нет, и виной тому — мутации (рис. 1).
Рисунок 1. «Древо развития» мутаций в организме человека. Нарушения, обнаруженные в коре головного мозга, часто встречаются и в периферических органах. Рисунок из [4].
Мутации — коварные преобразования ДНК, которые страшны тем, что могут возникать в клетках любых тканей многоклеточного организма и на любых стадиях его развития. Распространено мнение, что мутации опасны потому, что могут наследоваться потомством. Действительно, мутации, передающиеся по наследству, приводят к возникновению и развитию таких серьезных заболеваний нервной системы, как шизофрения, аутизм, болезнь Альцгеймера. Виной тому — приобретаемые детьми генетические нарушения половых клеток родителей. Однако существуют и другие, ненаследуемые мутации, которые возникают в соматических клетках человека на протяжении всей его жизни.
Большинство людей имеет определенное количество соматических мутаций. Известным примером следствий соматических мутаций является появление опухолевых клеток, для которых характерны генетические нарушения*. Однако далеко не всегда соматическая мутация приводит к развитию онкологических заболеваний. Часто изменения генома не выливаются в какие-либо серьезные заболевания и могут встречаться у полностью здоровых людей. До настоящего момента ученые точно не знали, накапливаются ли они в головном мозге в таком количестве, чтобы послужить причиной серьезных нарушений нервной системы.
По мере роста и взросления человека геномы нейронов его головного мозга накапливают существенные различия. К такому выводу пришли ученые Бостонской детской больницы (Boston Children’s Hospital) и Гарвардской медицинской школы (Harvard Medical School), опровергнув утверждение, что мозг взрослого человека не изменяется в течение жизни* [4, 5].
* — Последние годы оказались особенно урожайными на опровержения железобетонных нейробиологических догм. Как нам на радость разобрались с приговором «нервные клетки не восстанавливаются», описано в статье «Всё, что вы всегда хотели знать о взрослом нейрогенезе, но боялись спросить» [6]. — Ред.
Результаты недавнего исследования показали, что значительное количество соматических мутаций можно обнаружить в мозге полностью здоровых людей. Так, со временем геномы нейронов головного мозга человека начинают различаться — появляется мозаицизм. Это научное открытие позволит изучать роль соматических мутаций отдельных нейронов в развитии человека и ряда нервно-психических заболеваний.
Сколько мутаций может содержать в себе геном нейрона?
Ранее не было точно известно, способны ли соматические мутации, возникающие в нейронах головного мозга, провоцировать возникновение и развитие нейродегенеративных заболеваний. Для того чтобы установить истину, ученые решили изучить особую разновидность мутаций — однонуклеотидные варианты (single-nucleotide variants, SNVs). Эти нарушения могут возникнуть в нескольких или даже всего в одной клетке головного мозга. Исследователи проанализировали 36 нейронов, взятых из головного мозга трех умерших людей: 15-летней девушки, 17-летнего юноши и 42-летней женщины, которые не страдали нейродегенеративными заболеваниями.
Используя методы капиллярной цифровой полимеразной цепной реакции (digital PCR) и секвенирования геномов единичных клеток [7], ученые обнаружили, что каждый отдельный нейрон из трех образцов ткани мозга содержит в среднем от 1468 до 1580 однонуклеотидных вариантов (рис. 2). И если появление SNVs в опухолевых клетках связано преимущественно с ошибками при репликации ДНК, то нейронные мутации возникают в основном вследствие активной транскрипции генов.
Рисунок 2. Карта мутаций генома корковых нейронов одного человека. 136 нейронов головного мозга 17-летнего человека распределены по четырем группам (обозначены разными цветами), выделенным по одной или нескольким мутациям (буквами A-D обозначены 18 клональных соматических мутаций). Рисунок из [5].
Дополнительно ученые сравнили гены нервных клеток с генетическим материалом, взятым из других тканей — в частности, сердца и кожи. Этот анализ показал, что мутации в нейронах в целом совпадают с однонуклеотидными вариантами в других типах клеток, то есть такие мутации присутствуют и в нейронах, и в других частях организма человека. Более того, был установлен следующий интересный факт: в ряде случаев клетки коры мозга показывали более высокую степень родства не с соседними нейронами, а с другими клетками организма (например, кардиомиоцитами).
Также было проведено исследование нервных клеток, взятых из разных областей головного мозга, с целью обнаружения аналогичных мутаций. Полученные результаты позволили сделать предположение о происхождении нервных клеток.
«Генеалогическое древо» нейронов
Рисунок 3. «Родословное древо» человека из книги Э. Геккеля «Антропогения». Идея объединения всех живых существ в единое «древо» имеет более чем 150-летнюю историю. Рисунок с сайта vivovoco.astronet.ru.
Мутации возникают как за счет ошибок копирования ДНК, которые потенциально могут сопровождать каждый репликационный цикл, так и в результате иных мутационных процессов — например, под действием ультрафиолетового света. Закономерное следствие — каждая клетка организма может иметь свой собственный уникальный геном, который несет в себе информацию о происхождении и развитии клетки, воздействии на нее внешних факторов. Такие «записи» онтогенеза отдельных клеток позволят создать их «родословное древо».
В разных клетках происходят разные мутации, что обеспечивает несходство геномов. Кроме этого, мутационный профиль несет в себе долговременную память о происхождении и развитии каждой клетки. Информация, полученная при секвенировании геномов индивидуальных нейронов, может быть использована для декодирования всей картины развития человеческого мозга — для реконструкции своеобразного «генеалогического древа» нейронов. Этот подход позволит расширить знания о природе возрастных заболеваний и выявить различия между мозгом человека и мозгом других животных.
Основоположником генеалогии можно считать Чарльза Дарвина, который впервые изобразил филогенетическое древо живых организмов еще в 1837 году. В его основу легла идея о том, что все виды живых существ связаны друг с другом общим происхождением, подобно ветвям дерева, которые объединяет общий корень (рис. 3). Подобные мысли использовали при создании клеточной теории ученые Т. Шванн и М. Шлейден, определившие клетку как единый структурный элемент всех живых организмов. Наконец, более чем через 150 лет, в 2005 году, Д. Фрумкин и соавторы в своем исследовании показали, что соматические мутации присутствуют в клетках в достаточном количестве и могут быть использованы для воссоздания взаимосвязей всех клеток человека [8]. Таким образом, далеко не свежие идеи лежат в основе нового заключения о том, что каждый человек несет в себе собственное (клеточное) генеалогическое древо*.
* — Дерево — это красиво и понятно, дерево — это аллегория из мира эукариот. А как же работают биологи с прокариотическими дебрями, где схемы родственных связей не то что дерево не напоминают, даже лес для них простоват — сеть да и только? Об эволюционных перипетиях в разных мирах читайте: «Эволюция между молотом и наковальней, или как микробиология спасла эволюцию от поглощения молекулярной биологией» [9], «Карл Вёзе (1928–2012)» [10], «Вирусные геномы в системе эволюции» [11] и «Закинули археи эволюционный невод и вытянули. » [12]. — Ред.
Кристофер Уолш и другие сотрудники Гарвардской медицинской школы в результате исследования однонуклеотидных вариантов предложили подход к установлению происхождения нервных клеток человека [5]. Так, если в двух отдельно взятых нейронах присутствуют одни и те же мутации, то они с высокой долей вероятности происходят от одной клетки-предшественницы. В том случае, если совпадает лишь часть мутаций, пути развития нейронов в какой-то момент времени разошлись.
Сравнивая геномы нейронов и других клеток организма, можно сделать следующий вывод: если какая-то мутация присутствует и в головном мозге, и в других соматических клетках — она возникла на раннем этапе онтогенеза. Если же определенная мутация встречается лишь в некоторых нейронах, это говорит о том, что она появилась сравнительно недавно. Таким образом можно проследить «родословную» нейронов вплоть до конкретного дня эмбрионального развития.
«Движение — это смерть»
Выше упоминалось, что мутации, обеспечивающие различия геномов соматических клеток, могут быть вызваны многими факторами. Так, длительное время считалось, что основной причиной мутаций в клетках головного мозга являются ошибки репликации ДНК. Однако в результате настоящего исследования ученые установили, что нарушения возникают не во время деления клетки, а при экспрессии генов. Всем известный девиз «Движение — это жизнь» не работает в случае соматических мутаций нейронов. Исследователи установили, что каждый раз, когда гены нейронов нашего мозга начинают активно работать — запуская программу синтеза новых белков, — появляется определенный риск возникновения мутаций.
Ученые пришли к выводу о том, что мутации в головном мозге накапливаются с возрастом и могут быть причастны к развитию нейродегенеративных заболеваний. Получается, что любой человек, сколь бы здоровым он ни был, является носителем огромного количества соматических мутаций — своеобразных «факторов риска». Чем это реально может грозить и как этого избежать — покажет время и будущие исследования нейробиологов.
Всё, что вы всегда хотели знать о взрослом нейрогенезе, но боялись спросить
Всё, что вы всегда хотели знать о взрослом нейрогенезе, но боялись спросить
Картина художника и дипломированного нейрофизиолога Грега Данна, изображающая одну из главных зон взрослого нейрогенеза — гиппокамп.
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Выражение «нервные клетки не восстанавливаются» является одним из лидеров среди расхожих в быту утверждений о человеческом мозге. При этом уже 20 лет как доказана его ложность, а количество рассматривающих это самое восстановление статей до сих пор увеличивается чуть ли не по экспоненте. Уже установлены зоны, где оно проходит, его функциональное значение, а также огромное количество влияющих на него факторов. А сколько еще предстоит открыть.
Конкурс «био/мол/текст»-2015
Эта работа опубликована в номинации «Лучшая обзорная статья» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: лаборатория биотехнологических исследований 3D Bioprinting Solutions и студия научной графики, анимации и моделирования Visual Science.
Пошатнуть стереотип оказалось непросто.
Еще в начале прошлого века потеря нейронов в результате травмы или старения считалась фатальной — ведь даже лучшие умы настаивали на невозможности новообразования нейронов (или нейрогенез) у взрослых особей высших позвоночных. Впервые это постулировал гениальный С. Рамон-и-Кахаль [1], у которого на тот момент просто не могло быть инструментов исследования мозга, способных фиксировать малоинтенсивные постнатальные процессы. Авторитет Рамон-и-Кахаля был огромен, к тому же было известно, что с возрастом масса мозга снижается. О наличии малого пула стволовых клеток поводов задуматься не было, а отсутствие знаний о пластичности мозга не позволяло решить проблему интеграции новых нейронов в сложнейшую систему старых.
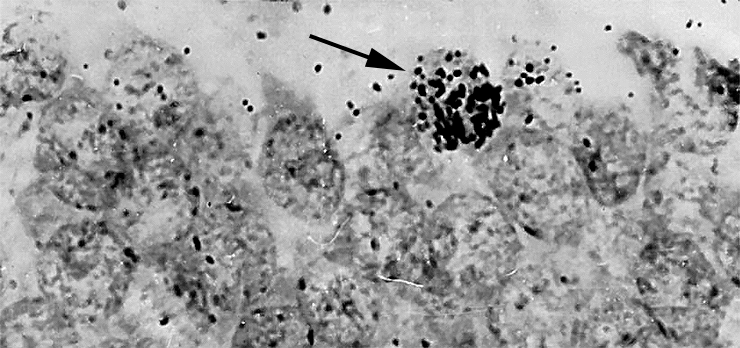
В результате убежденность в невозможности образования нервных клеток во взрослом состоянии была настолько твердой, что стала причиной ряда драматических историй в науке. Одним из первых, кто говорил о существовании взрослого нейрогенеза, был Джозеф Альтман. Используя новый для того времени метод авторадиографии с меченым тимидином (рис. 1), он и его сотрудники выпустили в 60-х целый ряд работ, утверждавших протекание нейрогенеза в зубчатой фасции гиппокампа, обонятельных луковицах и коре головного мозга у взрослых крыс, морских свинок, а также в новой коре у кошек [2].
Рисунок 1. Первые признаки взрослого нейрогенеза. Животным вводили 3 Н-тимидин — радиоактивный аналог обычного нуклеотида тимидина, — который тоже встраивается в ДНК делящейся клетки, но который потом можно регистрировать методом авторадиографии.
Альтман также предположил, что «взрослорождённые» нейроны имеют ключевое значение в процессах обучения и формирования памяти. Несмотря на то, что работы были выпущены в ведущих научных журналах, ученое сообщество проигнорировало их выводы, противоречившие установившемуся стереотипу. В результате Альтман прекратил работы по этому направлению. В начале 80-х его утверждения дополнились ультраструктурными доказательствами того, что возникающие в мозге взрослых крыс клетки похожи на нейроны. Кроме того, процессы деления были зафиксированы уже в мозге взрослых приматов — макак. Эти результаты получил Майкл Каплан, известный биолог и врач, позднее работавший в Университете Джонса Хопкинса и Национальном институте по проблемам старения (США). В ответ на его статьи некоторые именитые ученые говорили, что подобные результаты, полученные на крысах, не могут быть показательными, так как крысы не прекращают расти в течение жизни, следовательно, не могут когда-либо считаться «взрослыми». А обнаруженные деления в мозге макак сочли недостаточными для доказательства существования у них значительного нейрогенеза. Такие реакции не вдохновляли Каплана на продолжение исследований этой проблемы, и он занялся реабилитационной медициной [3].
. и всё же это удалось!
Одним из поворотных моментов в изучении нейрогенеза стала серия статей Фернандо Ноттебома, вышедшая в 80-х и 90-х годах. Сейчас Ноттебом — глава отдела экологии и этологии Рокфеллеровского университета, а тогда он занимался мозгом птиц, в частности — вокальным центром канареек. В ходе его работы выяснилось, что в отделах их мозга, гомологичных коре и гиппокампу приматов, помимо гибели происходит образование огромного количества новых клеток! При этом многие новые клетки являются нейронами и образуют синапсы, а активность всего этого процесса коррелирует со сложностью окружающей птицу среды. Несмотря на то, что многими эти результаты списывались на некую специфику птиц, они сильно сдвинули общественное мнение [3].
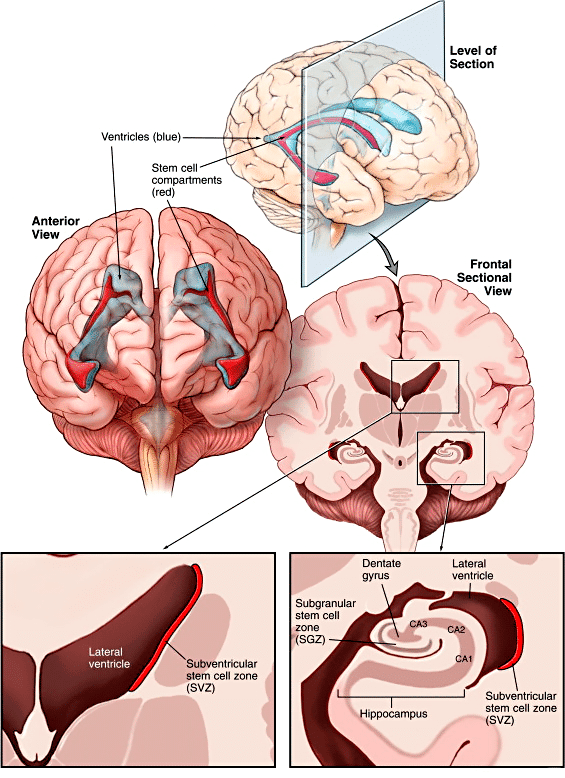
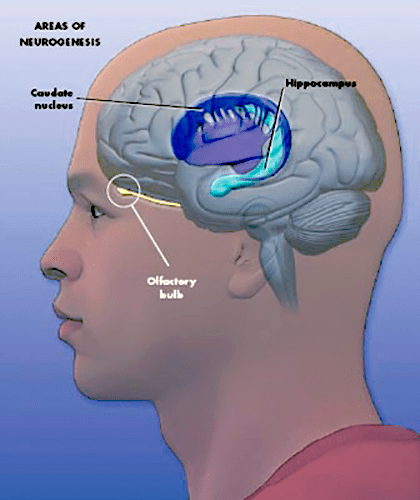
Исследование нейрогенеза продолжилось с новыми силами после введения в научную практику синтетических аналогов тимидина. Такие аналоги куда легче потом обнаружить в тканях, чем радиоактивные, которые использовал Альтман. Кроме того, были открыты маркеры клеток разных типов: нейронов различной степени зрелости, клеток глии, а также любых клеток, находящихся в фазе митоза, то есть делящихся. Это позволило еще увереннее говорить об активном нейрогенезе в зубчатой фасции гиппокампа и в стенках желудочков мозга с проекциями в обонятельные луковицы (рис. 2) [4]. Последние работы демонстрируют нейрогенез и в ряде других структур мозга: в хвостатом ядре, фронтальной коре, первичной и вторичной моторной и соматосенсорной коре (рис. 3) [5], [6]. Но недостаточно высокая активность процесса всё же не позволяет называть эти зоны нейрогенными, в отличие от двух вышеназванных.
Рисунок 2. Зоны мозга, в которых происходит нейрогенез: субвентрикулярная зона мозга (SVZ) в боковых стенках первых двух желудочков и субгранулярная зона зубчатой фасции гиппокампа (SGZ). У грызунов образующиеся в SVZ клетки потом мигрируют по ростральному миграционному тракту в обонятельные луковицы.
Рисунок 3. Зоны мозга человека, в которых происходит нейрогенез. У приматов клетки, образующиеся в субвентрикулярной области, мигрируют еще и в полосатое тело, которое представляет собой анатомическую структуру мозга, отвечающую за мышечный тонус, формирование условных рефлексов, а также регулирующую некоторые поведенческие реакции.
Нейрогенез в желудочках мозга значительно усиливается при каком-либо обонятельном опыте, а также при беременности у грызунов, так как узнавание детенышей у них сильно связано с обонянием [7], [8]. Результаты работ по исследованию нейрогенеза в этой зоне у человека пока не приводят к окончательным выводам: часть из них свидетельствует о его протекании у человека, другая ставит под сомнение миграцию нейронов в обонятельные луковицы. Недавно было показано, что у приматов новообразованные нейроны из субвентрикулярной зоны могут мигрировать в полосатое тело (или стриатум), отвечающее за сложные двигательные реакции и формирование условных рефлексов [9]. С повреждениями стриатума связан синдром Туретта, а также более серьезные проблемы, такие как болезни Паркинсона и Хантингтона. Поэтому в будущем можно рассчитывать на появление ряда работ по связанному с этой областью нейрогенезу.
Нейрогенез оказался важным инструментом в нашем организме.
Пожалуй, для человека самой важной нейрогенной зоной всё же можно назвать зубчатую фасцию гиппокампа. Гиппокамповая формация является частью лимбической системы и участвует в исполнении таких функций мозга, как интеграция и распределение по мозгу сенсорной информации, ответ на новизну, регуляция настроения и активности организма. Будучи частью круга Пейпеца, гиппокамп удерживает информацию при бодрствовании и участвует в ее переводе в кору больших полушарий во время сна, то есть из кратковременной памяти в долговременную. Нейрогенез вовлечен в осуществление некоторых из этих функций, выполнение которых становится возможным благодаря специфическим характеристикам образующихся клеток — в частности, молодые гранулярные клетки зубчатой фасции имеют более низкий порог долговременной потенциации, чем старшие [10]. Считается, что подобная пластичность играет роль в процессах обучения и памяти [11].
Скорость образования новых нейронов гиппокампа для взрослой крысы оценивается в 9000 клеток в сутки, однако большинство новообразованных клеток погибает между первой и второй неделями после своего рождения, из-за чего число окончательно интегрировавшихся в гиппокамп новых нейронов в месяц равно примерно 25000, что составляет около 3,3% их популяции [12]. Скорость нейрогенеза у человека оценивается в 700 нейронов ежедневно, а в год обновляется около 1,75% всего гиппокампа или же 0,004% нейронов его зубчатой фасции [13]. Половая специфика в этих показателях отсутствует, а с возрастом активность процесса снижается, при этом «качество» предшественников остается прежним, так как in vitro они культивируются так же хорошо, как и в молодом возрасте. Это позволяет предположить, что с возрастом происходит удлинение продолжительности клеточного цикла предшественников нервных клеток in vivo [14].
Стадии нейрогенеза в зубчатой фасции подробно описаны по морфологии клеток и набору специфических клеточных маркеров (рис. 4) [15].
Рисунок 4. Схема дифференцировки нервных стволовых клеток зубчатой фасции со специфическими маркерами разных стадий. Покоящиеся нервные предшественники (quiescent neural progenitors, в ранней классификации называемые радиальной глией) после активации цитокинами, ростовыми или иными факторами начинают делиться асимметричным митозом с образованием в базальной части делящегося нервного предшественника (amplifying neural progenitor, в ранней классификации — нерадиальный предшественник). Он, в свою очередь дважды поделившись, выходит из клеточного цикла и становится постмитотическим нейробластом (neuroblast 1, ранее — промежуточный прогенитор). Именно на этой стадии погибает большинство клеток. Оставшиеся превращаются в нейробласты второго порядка (neuroblasts 2, ранее — нейробласты) и затем в незрелые нейроны, мигрирующие в гранулярный слой, где завершается их созревание. Полное превращение нервной (нейральной) стволовой клетки в функциональный нейрон занимает около месяца.
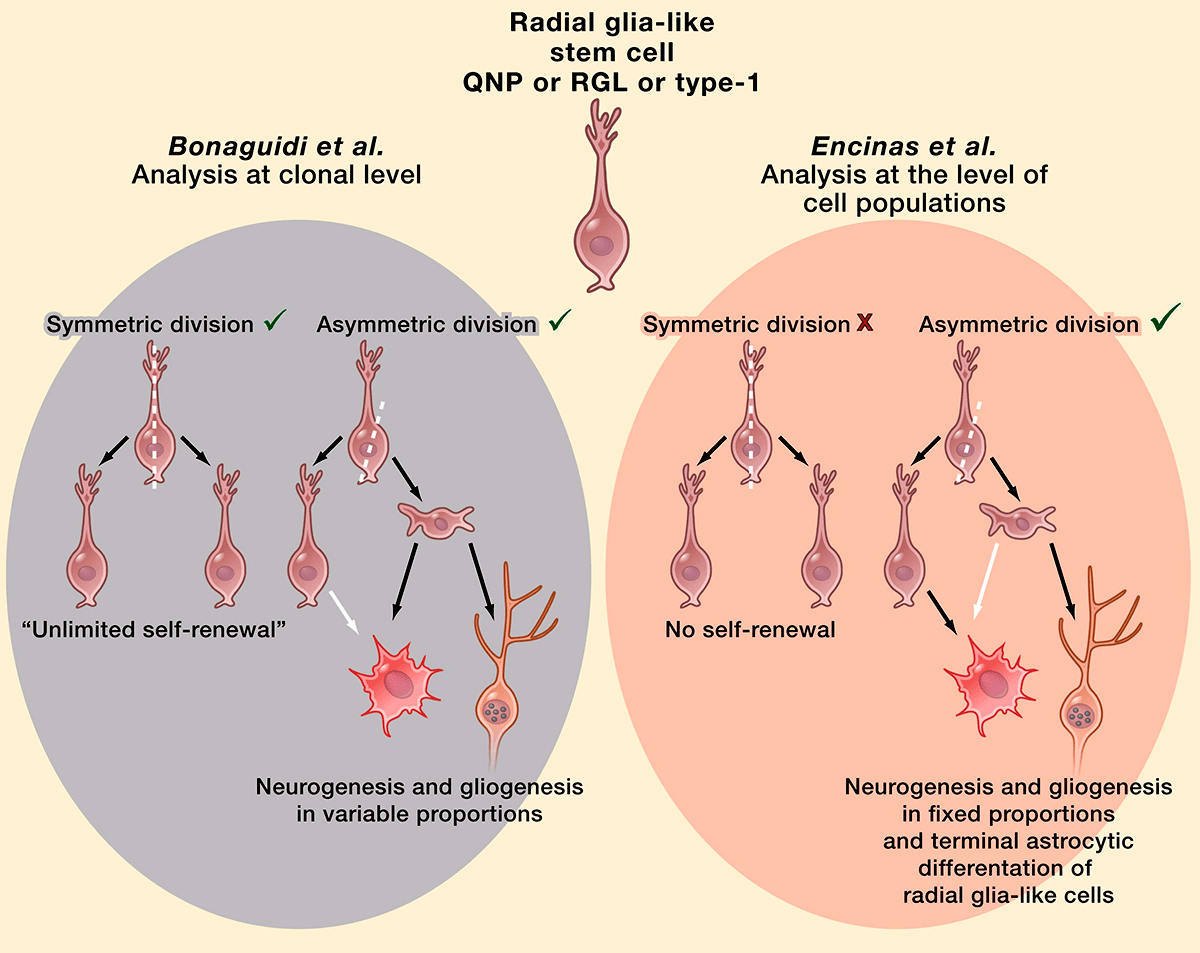
В настоящее время ведутся споры относительно судьбы QNP (quiescent neural progenitors, покоящихся нервных предшественников) после деления. Согласно «оптимистической» модели, стволовые клетки мозга — по аналогии с гемопоэтическими стволовыми клетками — являются самовозобновляемыми: в результате асимметричного деления они дают клетку, дифференцирующуюся потом в нейрон, а затем возвращаются в покоящееся состояние и могут быть заново активированы. В противоположность этому, согласно «пессимистической» модели, стволовые клетки зубчатой фасции не способны к самовоспроизведению, и их активация в конечном итоге приводит к превращению в астроциты. Предполагают, что сами стволовые клетки используются только единожды в течение взрослой жизни, выходя из этого пула после серии быстрых делений, в результате которых образуются прогениторы. Это объясняет и связывает между собой снижение темпов нейрогенеза и рост количества астроцитов в течение жизни (рис. 5) [16].
Рисунок 5. «Оптимистическая» (слева) и «пессимистическая» (справа) модели деления стволовых клеток.
В то же время вторая модель не исключает возможности нахождения в зубчатой фасции или малых популяций самовоспроизводящихся стволовых клеток, или клеток с удлиненными G2/M-фазами, или же каких-то специфических клеток, не экспрессирующих нестин. В последнем случае их просто не удалось бы обнаружить при использованном дизайне эксперимента.
. на работу которого многое может повлиять
Уровень новообразования нервных клеток — в частности, в зубчатой фасции — может меняться под воздействием множества факторов. Если принять во внимание «пессимистическую» модель и роль нейрогенеза в осуществлении некоторых функций гиппокампа, а также патогенез ряда нейродегенеративных заболеваний, станет очевидной важность определения мишеней для этих факторов — влияют ли они на молчащие стволовые клетки, расходуя их пул, или же способствуют выживаемости их потомков, или увеличивают количество их делений. Все влияния на нейрогенез в конечном итоге можно подразделить по результату их действия на положительные и отрицательные. К первым относятся как банальные (содержание в обогащенной среде, физическая нагрузка, прием антидепрессантов или мелатонина, социальные взаимодействия), так и специфические — вроде одноночной бессонницы или приема каннабиноидов. Ко вторым — радиация, стресс, хроническое недосыпание, злоупотребление опиатами, алкоголем и множество прочих общенегативных для мозга вещей.
Хотя в целом результат воздействия многих перечисленных факторов можно предугадать, механизм их воздействия, а также влияние их комбинаций требуют изучения — как для выстраивания правильной общей профилактики, так и для лечения конкретных заболеваний. Среди так называемых позитивных факторов особенно эффективным является обогащенная среда, включающая в себя физические упражнения. По различным данным, нахождение в течение небольшого количества времени (примерно от недели до месяца) в такой среде стабильно и значимо повышает уровень нейрогенеза, причем увеличение может быть даже пятикратным — в зависимости от возраста, состояния здоровья и других параметров [17]. Несмотря на активное изучение эффектов обогащенной среды на нейрогенез, на современном этапе исследований остается открытым вопрос о том, какие именно из ее компонентов (физическая или исследовательская активность) оказывают влияние на процесс формирования новых нейронов в мозге, а также на какие этапы нейрогенеза эти эффекты распространяются. Разрешение этих вопросов важно для поиска новых терапевтических и нейропротекторных воздействий и для нахождения эффективных путей регуляции нейрогенеза во взрослом мозге. Именно поэтому интерес к этой теме лишь усиливается, и количество статей по ней будет расти еще долгое время.