как стимулировать костный мозг
Концентрат клеток костного мозга (BMAC)
Автор статьи
Показания
BMAC используют в разных областях медицины. Если говорить об ортопедии, то основные области применения концентрата клеток костного мозга следующие:
Таким образом, любые заболевания и состояния, при которых необходимо простимулировать регенераторные процессы и ускорить заживление повреждений, могут считаться показаниями для проведения клеточной терапии концентратом клеток костного мозга.
Как используют BMAC?
Суть процедуры сводится к следующему:
1. Из крыла подвздошной кости (одна из костей таза) врач получает костный мозг, богатый стволовыми клетками.
2. Биоматериал центрифугируют, в результате чего костный мозг разделяется на фракции.
3. Врач отбирает нужную часть фракции, богатую стволовыми клетками.
4. Полученный концентрат вводят внутрь проблемного сустава.
5. В течение нескольких часов пациент находится в клинике, под наблюдением врачей.
Подготовка
Процедура забора красного костного мозга выполняется под наркозом. Поэтому требуется подготовка к этой процедуре. Основные рекомендации:
Больно ли лечить суставы?
Больно ли лечить суставы?
Процедура получения красного костного мозга для выделения из него концентрата болезненна для пациента. Поэтому она проводится под анестезией. Виды обезболивания могут использоваться разные. Так как процедура не занимает много времени, может быть использован поверхностный внутривенный наркоз. Иногда пункцию проводят под местной анестезией с использованием седации.
После наркоза человек несколько часов проводит в клинике. Когда врач убедится в том, что пациент пришёл в себя и его здоровью ничего не угрожает, он отпускает человека домой. Процедура выполняется за 1 день и не требует госпитализации.
BMAC вводят в сустав при помощи инъекции. Процедура неприятна, поэтому тоже требует обезболивания. Применяется местная анестезия. Врач вводит обезболивающие препараты в ткани, постепенно нагнетая их по мере продвижения иглы. Затем, когда она окажется в суставной полости, проводится замена шприца и введение концентрата красного костного мозга.
После процедуры
В течение первых суток возможны болевые ощущения в зоне пункции красного костного мозга. Обычно они незначительны, но иногда требуют применения нестероидных противовоспалительных средств.
Рекомендации после процедуры:
Эффект от процедуры развивается не сразу. Если BMAC используется для лечения остеоартроза, то введенный в сустав концентрат клеток костного мозга начинает работать лишь через 1 неделю. К концу первого месяца достигаются максимальные результаты. Они сохраняются в течение минимум 6 месяцев. Затем начинается отрицательная динамика. При необходимости процедуру можно выполнить повторно.
Преимущества
Использование стволовых клеток красного костного мозга – малоинвазивная процедура, обеспечивающая долговременные результаты. В отличие от постоянного приёма лекарственных средств для устранения боли, BMAC:
Уколы стволовых клеток в сустав безопасны, потому что используются собственный, а не донорский концентрат костного мозга. Поэтому у пациента никогда не развиваются иммунные осложнения.
Процедура малоинвазивная и хорошо переносится пациентом. Костный мозг получают под наркозом – человек ничего не чувствует. После завершения процедуры выраженных болевых ощущений нет. Небольшая боль сохраняется лишь в течение первых суток и легко купируется анальгетиками.
BMAC выгодно отличается от хирургических методов лечения заболеваний суставов тем, что не требует больших материальных затрат и длительной реабилитации. Уже на следующий день после внутрисуставного укола человек может вернуться к прежнему ритму жизни, а через неделю снимаются все ограничения. Использование стволовых клеток красного костного мозга часто позволяет пациенту обойтись без хирургической операции или значительно отсрочить необходимость в её проведении.
Где сделать процедуру?
Чтобы воспользоваться всеми преимуществами клеточно-регенеративной терапии, обратитесь в Клинику доктора Глазкова. Мы специализируемся на лечении болезней суставов, поэтому достигаем в этой области медицины лучших результатов. Наши врачи всегда отдают предпочтение консервативным методам терапии, а операцию рекомендуют пациенту только в крайних случаях, когда без неё действительно нельзя обойтись.
Преимущества использования красного костного мозга для лечения суставов в нашей клинике:
Уколы концентрата клеток красного костного мозга позволят вам надолго уменьшить боли в суставах или избавиться от них полностью, ускорить регенерацию тканей, добиться долговременного регресса заболевания. Вы сможете уменьшить дозы обезболивающих лекарств или отказаться от них полностью. Вполне вероятно, что благодаря BMAC и другим консервативным методам лечения вы сможете избежать хирургической операции.
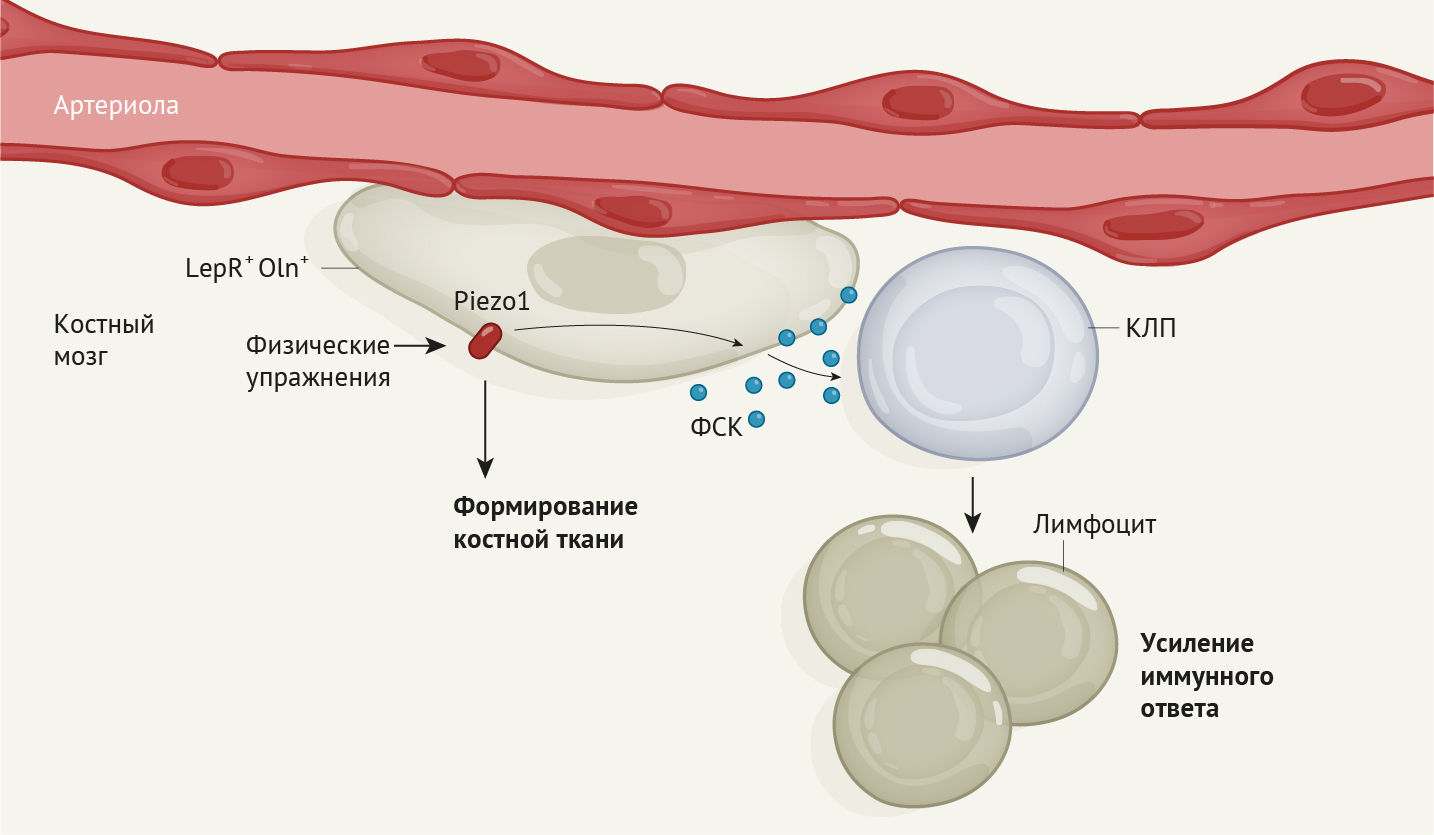
Физическая нагрузка стимулирует иммунные клетки костного мозга
В костном мозге был обнаружен особый тип предшественников остеоцитов, который, как выяснилось, помогает поддерживать образование иммунных клеток лимфоцитов в ответ на физические упражнения.
В костном мозге по-настоящему тесно от клеток. Бок о бок сосуществует много типов стволовых клеток [1, 2] и клеток-предшественников (например, предшественников иммунокомпетентных клеток). Их жизнедеятельность поддерживается за счет соседей, которые создают специальную защитную среду для стволовых клеток, называемую нишей. Взаимодействие между клетками ниши, также известными как стромальные клетки, и ранними предшественниками иммунных клеток в костном мозге изучено плохо. Понимание того, как координируется это взаимодействие, поможет лучше понять, как образуются предшественники иммунных клеток. В своей статье в «Nature» Shen с соавт. [3] решили часть этой загадки, определив роль физической нагрузки в процессе стимулирования связи между одним типом стромальных клеток и предшественниками иммунокомпетентных клеток у мышей, что в итоге помогло организму животных бороться с инфекцией.
Затем Shen с соавт. вывели генетически мутантных мышей, у которых Oln + клетки были лишены способности кодировать ФСК. Отсутствие этого фактора у Oln + клеток в итоге не влияло на гемопоэтические стволовые клетки или большинство иных типов гемопоэтических клеток-предшественников в костном мозге. Тем не менее, это привело к значительному уменьшению численности одного специфического типа гемопоэтических клеток — клеток-предшественников лимфопоэза (КПЛ), из которых развиваются лимфоциты. В поддержку гипотезы о том, что Oln + клетки способствуют образованию и поддержанию пула КПЛ, авторы исследования продемонстрировали, что Oln + клетки и КПЛ располагаются близко друг к другу в костном мозге. Затем ученые заразили мутантных мышей болезнетворной бактерией Listeria monocytogenes, от которой обычно организм очищают лимфоциты. Уничтожение патогенов в организме животных-мутантов происходило гораздо менее эффективно, чем у животных из группы контроля. Вследствие снижения численности КПЛ в организме животных не производились в достаточном количестве лимфоциты.
Известно, что механическая стимуляция костей во время выполнения упражнений способствует их формированию [6]. В заключительной серии экспериментов Shen с соавт. поместили мышей в клетки с беговыми колесами и обнаружили, что бег приводит к увеличению количества как Oln + клеток, так и КПЛ в костном мозге. Ученые выявили экспрессию белка механочувствительного ионного канала Piezo1 клетками Oln + и обнаружили, что у генетической линии мышей, у которых отсутствует этот белок, количество КПЛ аномально низкое. Таким образом, ученые открыли ранее неизвестный путь, с помощью которого физическая нагрузка, воспринимаемая через механочувствительный белок Piezo1, запускает экспрессию ФСК в клетках-предшественниках остеогенеза для поддержки функционирования КПЛ. В конечном счете, так контролируется часть функций иммунной системы (рис. 1).
Открытие того, что механочувствительные клетки-предшественники остеогенеза участвуют в борьбе с бактериальными инфекциями, впечатляет. Известно, что физические нагрузки могут стимулировать иммунную систему [7], однако успех работы Shen с соавт. показывает, почему это так. У результатов данной работы есть прямое клиническое применение. К примеру, существование механизма, раскрытого учеными в текущем исследовании, может быть использовано для разработки более эффективных методов усиления иммунного клеточного ответа (его запуск с помощью физических упражнений). Логичным следующим шагом станет проверка, действительно ли бег может улучшить элиминацию бактериальных патогенов у мышей. Еще один ключевой вопрос, который необходимо разрешить, заключается в том, поможет ли увеличение количества Oln + клеток и КПЛ в костном мозге обеспечить защиту от иных болезнетворных бактерий или даже вирусов, и может ли это усилить ответ на действие вакцинации.
Авторы также обнаружили, что количество ниш Oln + и количество КПЛ ниже в костном мозге 18-месячных мышей, чем их 2-месячных собратьев. Пожилые животные также активны [8], поэтому на снижение количества ниш и КПЛ, связанное со старением, влияют другие факторы, помимо снижения двигательной активности.
Крайне важно исследовать, к примеру, изменяется ли способ, с помощью которого ниши Oln + воспринимают механическую стимуляцию с течением времени. Или какие эпигенетические изменения (модификации ДНК, которые могут изменять экспрессию гена без изменения самой последовательности нуклеотидов ДНК) в старых Oln + клетках способствуют снижению эффективности восприятия механической стимуляции для генерации сигнальных молекул, таких как ФСК.
Хорошо известно, что механочувствительность играет важную роль в физиологии костной ткани, но ключевое значение механических сигналов было также описано для иных типов клеток, например, клеток-предшественников ткани поджелудочной железы, стволовых клеток кишечника и эндотелиальных клеток, образующих выстилку кровеносных сосудов. Хотя о клеточных нишах, которые поддерживают функционирование стволовых клеток вне костного мозга, известно меньше, мелкие сосуды и, следовательно, эндотелиальные клетки являются главными кандидатами на роль структурных элементов таких ниш. Тогда, возможно, что механочувствительность в формирующих ниши эндотелиальных клетках может способствовать поддержанию других типов стволовых клеток и клеток-предшественников. В таком случае работа Shen с соавт. может иметь большое значение для биологии стволовых клеток.
Использование стимулированного костного мозга для трансплантации в онкологии
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Реферат. В настоящей статье рассмотрены источники гемопоэтических клеток, их иммунологическая характеристика, оценка сроков восстановления, значение стимулированного костного мозга.
Ключевые слова: гемопоэтические стволовые клетки, костный мозг, стимулированный костный мозг, аллогенная трансплантация, аутологичная трансплантация, Г–КСФ.
В настоящее время в онкологии для трансплантации используются такие источники гемопоэтических стволовых клеток (ГСК), как костный мозг (КМ), стволовые клетки периферической крови (СКПК), их сочетание (обычно статистически засчитывается как трансплантация СКПК) и клетки пуповинной/плацентарной крови (ПК) [1]. Костный мозг исторически является первым клинически значимым источником гемопоэтического материала для трансплантации, как в случае аллогенных (аллоТ), так и аутологичных трансплантаций (аутоТ). С появлением и распространением методик заготовки и трансплантации СКПК, обладающих свойством более быстро по сравнению с КМ восстанавливать гемопоэз, доля трансплантаций КМ (ТКМ) стала сокращаться. Так, при выполнении аутологичных трансплантаций ГСК, основным показанием к проведению которых являются множественная миелома (ММ) и лимфомы, КМ используется менее чем в 5% случаев (данные Европейского регистра трансплантаций ГСК, ЕВМТ). При выполнении как родственных, так и неродственных аллоТ, которые чаще всего выполняются при лечении лейкозов, КМ в качестве источника ГСК до сих пор используется в более чем 20% случаев.
Роль источника ГСК для трансплантации очень важна и не до конца изучена. Известно, что содержание CD34+–клеток в разных источниках ГСК схожее – 0,6–1% мононуклеаров. Однако абсолютное содержание CD34+–клеток в разных источниках ГСК существенно отличается, что обусловлено разным объемом исходного материала. При получении трансплантата КМ этот объем составляет порядка 1–1,5 л, СКПК – 10–20 л, ПК – 0,1 л. От источника гемопоэтического материала зависят темпы и стабильность восстановления гемопоэза, в том числе моноцитов, Т– и В–лимфоцитов, NK–клеток, дендритных клеток. Источник ГСК оказывает существенное влияние на развитие и степень таких реакций, как «трансплантат против хозяина» (РТПХ), «трансплантат против опухоли» (РТПО), на полноту донорского химеризма и эффективность борьбы с инфекцией.
Сравнение СКПК и КМ в качестве источника ГСК при аллоТ (донор–сиблинг) проводилось в ряде рандомизированных исследований. Основные результаты представлены в таблице 1. Было показано, что использование КМ в качестве трансплантата при более медленном восстановлении гемопоэза значительно снижает риск развития хронической, в том числе экстенсивной РТПХ.
Относительно новым источником ГСК является стимулированный (или праймированный) КМ (стКМ), использующийся при ТКМ в ряде зарубежных и российских центров. Несет ли в себе этот источник ГСК сочетание преимуществ СКПК, а именно – сокращение сроков восстановления гемопоэза (преимущество СКПК) и снижение частоты РТПХ при аллоТ (преимущество КМ)? Возрастают ли риски донорства из–за необходимости анестезии в сочетании с применением Г–КСФ?
На самом деле понятие «стимулированный КМ» достаточно неопределенное. В отличие от режимов мобилизации СКПК, ставших классическими, в различных исследованиях и центрах используются различные схемы стимуляции КМ. Отличия касаются как дозы Г–КСФ, так и сроков стимуляции. Оптимальный режим праймирования еще предстоит определить. Сравнительная характеристика стКМ (3 режима стимуляции) и двух других источников ГСК для трансплантации (СКПК и КМ) по клеточному составу представлена в таблице 2.
При выборе источника ГСК для трансплантации существенное значение имеют возможные риски и осложнения донорства.
При донорстве КМ наиболее значительным фактором, способным ограничить применение этого источника ГСК, является необходимость проведения анестезии. Эксфузия КМ обязательно проводится в условиях операционной. Кроме того, к частым осложнениям (20–85% случаев) относится послеоперационная боль. Клинически значимыми ( муж.), иммунизация донора (беременности, гемотрансфузии) и источник ГСК (СКПК>КМ>ПК). Также важны такие факторы, как возраст реципиента, режим кондиционирования, режим профилактики РТПХ. Для развития хронической РТПХ факторами риска будут как признаки, предшествующие развитию острой РТПХ (старший возраст реципиента, неполная HLA–совместимость, пол донора и реципиента (жен.>муж.), источник ГСК (СКПК), переливание лимфоцитов донора), так и ряд дополнительных факторов. К ним относятся: переливание большого количества CD34+–клеток в случае СКПК, малых доз CD34+–клеток – в случае КМ, быстрое достижение полного химеризма, ЦМВ–серопозитивность или реактивация, диагноз (хронический миелолейкоз или апластическая анемия), режим профилактики РТПХ. В случае трансплантации ПК отмечается низкая частота РТПХ. Так, например, в нашей группе в каждом третьем случае аллогенная ТКМ проводилась от женщины мужчине, возраст реципиента превышал 40 лет, 16 из 17 аллоТ выполнены после миелоаблативного режима кондиционирования с достижением быстрого полного химеризма и т.д.
Частота острой РТПХ, по литературным данным, составляет: при трансплантации СКПК – 44–64%, КМ – 37–57%, стКМ – 52% [7]. В нашей группе она составила 47%. Только исследование S.–Q. Jil [6] показало снижение частоты острой РТПХ при пересадке стКМ по сравнению с КМ (р
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Как стимулировать костный мозг
Регенерация костной ткани за короткое время претерпела значительные изменения.
Она представляет область интереса для многих хирургических специальностей, включая челюстно-лицевую хирургию, пластическую хирургию, отоларингологию, нейрохирургию, общую хирургию и онкологию.
Костнозамещающие материалы для восстановления утраченной кости часто применяют в пародонтологии, ортодонтии, эндодонтии и общей стоматологической практике. Некоторые новинки оказались полезными, другие вызывают большое разочарование.
Значительная роль в последнее время принадлежит особой группе биологических веществ — стимуляторов регенерации костной ткани, которые вводят в состав новых материалов. Также внедряются физические методы стимуляции репаративных процессов, основанные на ультразвуковом или электромагнитном воздействии.
Дентоальвеолярные костные дефекты широко распространены, и представляют актуальную проблему в стоматологическом лечении и реабилитации.
Реконструкция костных дентоальвеолярных дефектов с использованием минимально инвазиных методов и стимуляторов регенерации может значительно улучшить успехи реконструктивной хирургии полости рта и челюстно-лицевой системы.
Многие пациенты только сейчас узнают, что жевательную функцию возможно полностью восстановить с помощью дентальных имплантатов. Большинство пациентов нуждаются в регенерации костной ткани, создавая спрос на дентоальвеолярную реконструкцию.
По данной причине в относительно небольшой анатомической области предпринято так много усилий по усовершенствованию методов реконструкции.
Однако пациенты, в лучшем случае, восприняли такие восстановительные процедуры с осторожностью. Во многом это связано тем, что и практикующие врачи, и сами больные воспринимают нынешние опции как болезненные и инвазивные.
Уменьшение болезненности и травматичности лечения может быть достигнуто за счет двух подходов: либо разработки менее инвазивных методов забора костных трансплантатов, либо отказа от забота аутокости с использованием костнозамещающих материалов или инновационных стимуляторов репаративных процессов.
Чрезвычайно привлекательным направлением являются гибридные материалы, которые базируются на использовании принципов и методов тканевой инженерии. Они достойны занять свое законное место в арсенале современного врача.
Структура, функции и физиология костной ткани
Кость представляет собой специализированную соединительную ткань с минерализованным внеклеточным матриксом, который необходим для формирования и поддержания прочности человеческого скелета, а также обеспечивает запас кальция для гомеостаза.
С эмбриологической точки зрения, кость формируется в ходе двух отдельных процессов развития, известных как внутримембранная и эндохондральная оссификация.
Если оссификация протекает напрямую, она описывается как внутримембранная. Эмбриональные мезенхимальные клетки с обильным кровоснабжением образуют локусы внутриклеточного осаждения коллагена. Остеобласты начинают формировать остеоид, который усиливается оседающими солями кальция.
Такое «прямое» формирование костной ткани отвечает за генезис черепного свода, лицевого скелета и части нижней челюсти, лопатки и ключицы.
Формирование эндохондральной кости проходит через хрящевую фазу, когда эмбриональные мезенхимальные стволовые клетки дифференцируются в примитивный гиалиновый хрящ. Кровеносные сосуды и остеогенные элементы резорбируют хрящ и заменяют его остеоидом при проникновении в матрикс.
Таким путем формируются нагруженные кости скелета, оканчивающиеся суставами. Считается, что большая часть основания черепа, а также часть нижней челюсти имеют эндохондральное происхождение.
Почему это важно? Эмбриологическую «историю» кости следует учитывать в контексте регенерации костной ткани и будущих попыток тканевой инженерии.
Костная ткань преимущественно состоит остеобластов, остеоцитов и остеокластов.
Остеобласты представляют собой кубоидные клетки, обладающие выдающимся аппаратом Гольджи и хорошо развитым эндоплазматическим ретикулумом, гистологическим признаком активного синтеза белка. Эти хорошо дифференцированные клетки синтезируют как коллаген I типа, так и неколлагеновые белки органического матрикса кости.
Остеобласты также способны регулировать минерализацию костного матрикса.
Считается, что остеоцит — это зрелый остеобласт, который попадает в костный матрикс. Хотя их основной функцией является структурная поддержка, они продемонстрировали способность как синтезировать, так и резорбировать кость.
Клетки костной выстилки — это плоские фузиформные клетки, покрывающие неактивные костные поверхности. Сегодня мало что известно о функционировании этих клеток, однако они могут быть предшественниками остеобластов.
Предполагается, что так называемые остеопрогениторные клетки запрограммированы на превращение в костные клетки, и их происхождение лежит в основе примитивных мезенхимальных стволовых клеток.
Остеокласты, в отличие от остальных клеток местного происхождения, возникают в результате слияния моноядерных предшественников, происходящих из кроветворных тканей. Они участвуют в резорбции костной ткани. Гистологически они характеризуются складчатой мембраной, где происходит резорбция костей.
Все вышеперечисленные элементы обеспечивают образование и резорбцию кости, поддерживаемую в тонком физиологическом равновесии.
Как только баланс нарушен, чрезмерная активность остеокластов может привести к таким проблемам, как остеопороз, в то время как повышенная активность остеобластов отражает рост костей, заживление или патологические реакции.
Архитектура кости такова, что внешняя оболочка, называемая кортикальной или же компактной костью, обеспечивает механическую поддержку. Метаболические функции кости контролируются расположенной в центре кортикальной и трабекулярной (губчатой) костью.
В отличие от плотно упакованных фибрилл кортикальной кости, матрикс губчатой кости организована слабо. С макроскопической точки зрения, она представляет собой ячеистую решетку, в которой расположены кроветворные элементы.
Кость по весу состоит из 65-70% кристаллических солей, преимущественно в виде гидроксиапатита, а остальные 30-35% состоят из органического матрикса.
Органический матрикс состоит из коллагена I типа (90-95%) с неколлагеновыми белками, такими как остеопонтин, костный сиалопротеин, остеокальцин, остеонектин и различные факторы роста — стимуляторы регенерации кости.
Физическая стимуляция регенерации костной ткани
Существует большое количество устройств, которые продаются под категорией «стимуляторы роста костей». Эти устройства привлекательны, поскольку что они менее инвазивные, а осложнения, связанные с забором костного трансплантата, отсутствуют.
В западной медицине основные категории методов физической стимуляции, используемые для лечения переломов, включают электромагнитные поля, низкоинтенсивный импульсный ультразвук и экстракорпоральную ударно-волновую терапию.
Электростимуляция костной ткани
Электростимуляция основана на теории, согласно которой механическое напряжение, приложенное к кости, ведет к генерации электрических потенциалов.
Сжатие приводит к возникновению электроотрицательных потенциалов, которые ведут к образованию кости. Растяжение, наоборот, ведет возникновению к электроположительных потенциалов, которые активируют процесс резорбции кости.
Теоретически, генерация электрического поля в участке повреждения должна усиливать образование костной ткани. В то время как ряд фундаментальных научных исследований продемонстрировали эффективность электростимуляции, дальнейшие клинические исследования дали противоречивые результаты.
В мета-анализе 11 рандомизированных контролируемых исследований (2008) авторы обнаружили, что из 4 испытаний, включающих 106 несрастающихся переломов, метод электромагнитной стимуляции ускоряет регенерацию в среднем на 76%.
Однако неоднородность полученных данных не позволяет утверждать, что методика действительно эффективна, и может применяться в клинической практике. Для этого необходимо провести более качественные клинические испытания.
Импульсный ультразвук низкой интенсивности
Второй категорией физической стимуляции служит импульсный ультразвук низкой интенсивности (LIPUS). Метод работает путем образования звуковых волн, которые генерируют микромеханическое напряжение в месте перелома.
Эти микромеханические стрессы стимулируют различные клеточные и молекулярные изменения, способствующие заживлению. LIPUS был в основном изучен у пациентов с переломами длинных костей, остеотомией и у курильщиков с переломами.
В недавнем крупном исследовании было продемонстрировано, что LIPUS является безопасным методом лечения свежих переломов длинных костей или несращений. Авторы отметили, что лечение занимает очень много времени: средняя продолжительность воздействия составляет по 20 минут в день в течение 5 месяцев.
Недавний метаанализ 13 рандомизированных контролируемых исследований указывает на противоречивость и ограниченность сведений об эффективности импульсного ультразвука низкой интенсивности при стимуляции регенерации костной ткани.
Интересен метаанализ 2014 года, который был проведен для косвенного сравнения электростимуляции с LIPUS в контексте заживления переломов.
У пациентов со свежим переломом исследование продемонстрировало предполагаемое, но незначительное преимущество LIPUS через 6 месяцев (ОР 1,17, 95% ДИ 0,97–1,41).
У пациентов с несращенным или застарелым переломом электрическая стимуляция также имела незначительный, но предполагаемый эффект через 3 месяца (ОР 2,05, 95% ДИ 0,99–4,24) по сравнению со стандартным лечением.
Имеются также низкокачественные данные, свидетельствующие о потенциальной пользе применения LIPUS по сравнению с электростимуляцией в повышении частоты заживления переломов через 6 месяцев при свежих переломах (ОР 0,76, 95% ДИ 0,58–1,01).
Экстракорпоральная ударно-волновая терапия
Экстракорпоральная ударно-волновая терапия использовалась для лечения застарелых и несращенных переломов, в том числе в челюстно-лицевой хирургии.
В процессе лечения аппликатор формирует ударные волны, которые представляют собой одиночные звуковые волны высокой амплитуды, генерируемые электрогидравлическими, электромагнитными или пьезоэлектрическими методами.
В экспериментах на животных эти ударные волны оказывают биологическое воздействие, образуя свободные радикалы и кислородные радикалы, что приводит к образованию ряда биологических факторов роста и ускорению репаративных процессов.
Zelle и соавт. провел систематический обзор влияния экстракорпоральной ударно-волновой терапии на лечение застарелых переломов и несращений. В 10 исследованиях, включающих 924 пациента, показатель эффективности составил 76% (ДИ 73–79%).
Авторы пришли к выводу, что экстракорпоральная ударно-волновая терапия может стимулировать процесс заживления при застарелых переломах костей и несращениях.
Поскольку исследования, включенные в анализ, предоставили только доказательства 4 уровня, для подтверждения эффективности метода нужны дополнительные данные.
Биологическая стимуляция регенерации костной ткани
Для реконструкции черепно-челюстно-лицевого скелета используют аутогенные костные трансплантаты, собираемые из локальных или отдаленных источников. В последнее время большую популярность приобрела аллогенная кость от другого человека, а также ксеногенные костные материалы от другого вида.
Поскольку при использовании аллогенных и ксеногенных материалов существует риск иммуногенных проблем, такие трансплантаты сначала подвергали замораживанию. Позднее были разработаны другие методы решения проблемы иммуногенности. Кроме того, появились синтетические костные материалы для стоматологии.
Для повышения эффективности лечения активно применяются стимуляторы регенерации костной ткани природного или синтетического происхождения. Многие из них фактически скопированы из живой природы — костные морфогенетические белки (ВМР).
Различные факторы роста широко используются для лечения костных дефектов и остеоиндукции. Некоторые, в том числе фактор роста эндотелия сосудов (VEGF), TGF-β, PDGF и BMP, такие как BMP-2, BMP-7 и IGF, присутствуют в матриксе здоровой кости и экспрессируются во время регенерации костной ткани.
Эти факторы регулируют васкуляризацию, вызывают пролиферацию и дифференцировку остеобластов и их предшественников, благодаря чему находят клиническое применение.
Локальные факторы регенерации костной ткани
Существуют локальные факторы, которые можно использовать для восстановления и регенерации кости. Они классифицируются по механизму биологического действия на остеогенные, остеокондуктивные, остеоиндуктивные факторы
Остеогенными факторами считают те, которые содержат жизнеспособные клетки (остеогенный предшественник) и способны к образованию кости. Это может быть аутологичный костный мозг либо аутологичная костная ткань.
Остеокондуктивные материалы выполняют функцию структурной основы для формирования новой кости. Среди них такие материалы, как сульфат кальция, фосфат кальция, аллотрансплантат, ксеногенные костные материалы и керамика.
Остеоиндуктивные материалы — это материалы, которые могут вызывать дифференцировку в костные клетки. Группа включается костные морфогенетические белки (BMP) и белки Wnt.
Факторы восстановления тканей играют важную роль в регенерации и заживлении ран в различных тканях и не являются специфичными для заживления или перелома костей.
Двумя наиболее важными факторами восстановления тканей, которые изучали в контексте заживления переломов, являются фактор роста фибробластов и фактор роста тромбоцитов.
Аутологичный костный мозг
Костный мозг из гребня подвздошной кости содержит клетки-предшественники, которые обладают как остеогенными, так и ангиогенными свойствами. Эти клетки являются самовосстанавливающимися и способны продуцировать такие факторы, как BMP и сосудистый эндотелиальный фактор роста (VEGF).
Эффект аспирата костного мозга может быть усилен путем центрифугирования для дальнейшего концентрирования числа клеток и путем объединения костного мозга с трансплантатами для обеспечения структурной поддержки.
Hernigou и соавт. использовали аутологичный костный мозг для лечения 60 пациентов с несращением переломов и достигли срастания костей у 53 из 60 участников исследования.
Авторы продемонстрировали корреляцию между количеством клеток-предшественников и скоростью заживления, определяемой объемом минерализованного каллуса через 4 месяца.
В то время как использование клеток костного мозга для заживления переломов является клинически эффективным и относительно дешевым, для совершенствования этого метода требуются дальнейшие работы как по забору, так и по подготовке клеток.
Аутологичная костная ткань
Для крупных дефектов многие хирурги предпочитают использовать аутологичный костный трансплантат, извлеченный из подвздошного гребня, вместо аутологичного костного мозга.
Исторически этот метод был связан с болью и различными осложнениями со стороны донорских участков (например, кровотечением и инфицированием раны).
Недавние отчеты показывают, что фактическая частота постоянных болей в месте забора костной ткани через 1 год после операции составляет Оцените статью