как выглядят клетки мозга
Нейроны и нейромедиаторы
Химические цепочки
Все чувства и эмоции, которые испытывают люди, возникают путем химических изменений в головном мозге. Прилив радости, который человек ощущает после получения положительной оценки, выигрыша в лотерею или при встрече с любимым, происходит вследствие сложных химических процессов в головном мозге. Мы можем испытывать огромное количество эмоций, например таких, как печаль, горе, тревога, страх, изумление, отвращение, экстаз, умиление. Если мозг дает телу команду на осуществление какого-либо действия, например, сесть, повернуться или бежать, это также обусловлено химическими процессами. «Химический язык» нашей нервной системы состоит из отдельных «слов», роль которых исполняют нейромедиаторы (их еще называют нейротрансмиттерами).
Любой нейрон может получать большое количество химических сообщений, как положительных, так и отрицательных («работай» или «стоп»), от других нейронов, которые его окружают. Эти сообщения могут конкурировать или «сотрудничать», между собой, заставляя нейрон отвечать специфическим образом. Поскольку все эти события происходят в течение очень короткого времени (считаные доли секунды), очевидно, что медиатор должен быть удален из синаптического пространства очень быстро, чтобы те же самые рецепторы могли работать снова и снова. И это удаление может происходить тремя способами. Молекулы нейромедиатора могут быть захвачены назад в то нервное окончание, из которого они были выделены, и этот процесс получил название «обратный захват» («reuptake»); нейромедиатор может быть разрушен специфическими ферментами, находящимися в готовности недалеко от рецепторов на поверхности нейрона; или активное вещество может просто рассеяться в окружающую область мозга, и быть разрушено там.
Изменение нейротрансмиссии с помощью лекарств
Рассмотрим, что происходит при изменении уровней нейромедиаторов мозга на примере трех из них (серотонин, дофамин и гамма-аминомасляная кислота (ГАМК).
Серотонин
Многие исследования показывают, что низкий уровень серотонина в головном мозге приводит к депрессии, импульсивным и агрессивным формам поведения, насилию, и даже самоубийствам. Лекарственные вещества под названием антидепрессанты создают блок на пути обратного захвата серотонина, тем самым несколько увеличивая время его нахождения в пространстве синапса. Как итог, в целом увеличивается количество серотонина, участвующего в передаче сигналов с нейрона на нейрон, и депрессия со временем проходит.
В последние годы ведутся бурные дискуссии вокруг психического расстройства, носящего название «синдром дефицита внимания с 
Наркотическое вещество, известное как «экстази» или МДМА, также изменяет уровень серотонина в мозге, но намного более радикально. Он заставляет выделяющие серотонин нейроны выплескивать все содержимое сразу, затапливая этим химикатом весь мозг, что, конечно, вызывает ощущение чрезвычайного счастья и гиперактивность (чрезмерную двигательную активность). Однако, за это приходится расплачиваться позже. После того как экстази израсходовал весь мозговой запас серотонина, включаются компенсаторные механизмы, быстро разрушающие избыток нейромедиатора в мозге. После того, как спустя несколько часов действие наркотика заканчивается, человек, вероятно, будет чувствовать себя подавленным. Этот период «депрессии» продлится до тех пор, пока мозг не сможет восполнить запасы и обеспечить нормальный уровень медиатора. Повторное использование на этом фоне экстази может привести к глубокой депрессии или другим проблемам, которые будут тянуться в течение долгого времени.
Дофамин
Ученые обнаружили, что люди с расстройством психики, известным как шизофрения, фактически чрезмерно чувствительны к дофамину в мозге. Как следствие, при лечении шизофрении используются лекарства, которые блокируют дофаминовые в головном мозге, таким образом, ограничивая воздействие этого нейромедиатора.
С другой стороны, вещества, известные как амфетамины, увеличивают уровень дофамина, заставляя нейроны его высвобождать, и препятствуя его обратному захвату. В некоторых странах врачи используют разумные дозы этих препаратов при лечении некоторых заболеваний, например, синдрома гиперактивности с дефицитом внимания. Тем не менее, иногда люди абсолютно необдуманно неправильно используют эти вещества, пытаясь обеспечить себе повышенный уровень бодрствования и способность решать любые задачи.
Гамма-аминомасляная кислота
Гамма-аминомасляная кислота, или ГАМК, является главным медиатором, чья роль заключается в передаче нейронам команды «стоп». Исследователи полагают, что определенные типы эпилепсии, которые характеризуются повторными припадками, затрагивающими сознание человека и его двигательную сферу, могут являться результатом снижения содержания ГАМК в головном мозге. Передающая система мозга, не имея адекватного «тормоза», входит в состояние перегрузки, когда десятки тысяч нейронов начинают сильно и одновременно посылать свои сигналы, что приводит к эпилептическому приступу. Ученые полагают, что за разрушение слишком большого количества ГАМК могут быть ответственны мозговые ферменты, в связи с чем появились лекарства, которые помогают остановить этот процесс. Время показало их эффективность в лечении не только эпилепсии, но и некоторых других нарушений работы мозга.
Гормоны
Химическое взаимодействие
Поражение мозга
Головной мозг человека – венец развития человеческой природы, позволяющий нам развиваться и преобразовывать собственную жизнь в соответствии с поставленными целями. Большинству функций организма отвечающих за нашу жизнедеятельность мы обязаны именно работе центральной нервной системы. Головной мозг человека невероятно сложный орган, который приводит к слаженной работе практически все системы в организме. не говоря уже о высшей нервной деятельности отвечающей за когнитивные навыки и мыслительные процессы. К сожалению, быстрый темп и далеко не самый здоровый образ жизни медленно подтачивают организм, истощая его резервы и компенсаторные механизмы. На сегодня в мире стоит острая проблема связанная не только с высокой заболеваемостью, но и инвалидизацией и даже смертностью от сердечнососудистых заболеваний. Среди таких заболеваний на первых местах находится органическое поражение головного мозга ишемического и геморрагического характера. Важно заметить, что несмотря на значительный перевес в структуре заболеваемости людей входящих в старшую возрастную группу, а именно от 45 лет и старше, органическое поражение головного мозга может произойти и у детей.
Краткий экскурс в анатомию центральной нервной системы
Головной мозг человека сложно устроенный орган, отвечающий за работу всего организма. В строении мозга прослеживается чёткая иерархичность, что позволяет эффективно работать всему организму. В составе центральной нервной системы можно выделить несколько основных частей:
Что такое поражение мозга?
Органическое поражение головного мозга – в первую очередь симптом какого-либо заболевания, проявляющийся нарушением или утратой ряда функций в результате патогенного воздействия какого-либо фактора на ткани головного мозга. Этиология поражения головного мозга может быть самой разнообразной и об этом речь пойдёт более подробно ниже в статье. Органическое поражение означает, что клетки головного мозга – нейроны подвергаются разнообразным воздействиям, которые приводят к формированию дистрофических процессов внутри нейронов и нарушают их функциональную активность. В самых серьёзных случаях нейроны попросту подвергаются сначала некробиозу, а затем и некрозу, т.е. гибнут. Гибель большого количества нейронов локализованных в едином анатомическом пространстве приводит к выпадению той или иной функции в организме пострадавшего человека, а выявление нарушенной функции даёт специалистам понять в каком именно участке головного мозга произошла катастрофа – это называется топической диагностикой. Симптомы органического поражения мозга у детей проявляются иначе, чем у взрослых, так как полноценная деятельность высшей нервной системы еще не сформирована. У детей может наблюдаться задержка в умственном, психическом и физическом развитии, нестабильное настроение и отклонения в поведении.
Патогенетические механизмы повреждения нейронов
К органическому повреждению головного мозга может привести целый ряд механизмов различной природы. Данное патологическое состояние могут спровоцировать как внешние, так и внутренние факторы и это необходимо учитывать, так как лечебные мероприятия в зависимости от патогенетического типа развития повреждения нейронов головного мозга будут кардинально отличаться.
Нарушение энергетического обеспечения
Самый распространённый патогенетический вариант поражения головного мозга связанный с дисбалансом между потребностью нейронов в энергии и её поступлением внутрь клетки. Энергетический дефицит может развиться из-за недостаточности:
Стоит отметить, что энергетический дефицит приводит к быстро прогрессирующему повреждению тканей головного мозга и уже через 5-7 минут в условиях отсутствия достаточной оксигенации нейроны начинают испытывать острую гипоксию и умирать. Поражение сосудов головного мозга имеет следующие симптомы:
Все вышеперечисленные симптомы являются признаками системного атеросклероза, от которого страдает большинство людей пожилого возраста. Атеросклероз приводит к формированию дисциркуляторной энцефалопатии.
Травматические повреждения
Травмы всегда связаны с механическим повреждением головного мозга и последующим развитием отёка, что приводит к возрастанию внутричерепного давления. Так как головной мозг находится в черепной коробке и буквально плавает в ликворе – внутримозговой жидкости, то последствия от ударов и ушибов приобретают серьёзный характер. Несмотря на то. Что ликвор выполняет защитную и амортизирующую роль, при развитии ушиба головного мозга происходит нарастание внутричерепного давления, так как физически жидкость не сжимаема. Клетки головного мозга подвергаются воздействию чрезмерного давления и начинают гибнуть. Ткани головного мозга занимают до 96% объёма черепной полости, что делает данный орган весьма чувствительным к перепадам внутричерепного давления.
Очень важно отметить, что довольно часто травмы сопровождаются внутренним кровоизлиянием, что может повлечь за собой формирование обширной гематомы и смещение головного мозга. Дислокация мозга приводит к вклиниванию его подкорковых структур в большое затылочное отверстие, что неминуемо приводит к гибели нейронов находящихся в ядрах сосудодвигательного и дыхательного центра, без которых жизнедеятельность пострадавшего невозможна.
Инфекционные
Повреждение мозга возможно спровоцировать не только физическими факторами. Но и биологическими. Такие состояния, как менингит, энцефалит, вентрикулит – могут значительно нарушить функциональную активность мозга.
Головной мозг может поражаться, как специфическими, так и неспецифическими инфекционными агентами, это важно учитывать при назначении лечения, так как схемы антибактериальной терапии будут различаться.
Врождённая патология
Аномалии развития головного мозга могут сформироваться на самых ранних этапах развития ребёнка. Первый триместр беременности для женщины и плода является самым опасным, так как организм беременной вместе с плодом незащищены от воздействия внешних факторов, а в момент закладывания и формирования органов могут сформироваться самые опасные аномалии и грубые патологии развития, например микро или анцефалия.
Токсическое повреждение
Не самый частый вариант поражения головного мозга, но тем не менее имеющий место быть. Повреждение головного мозга происходит, если химическое вещество обладает нейротоксическими свойствами и способно проникать через гематоэнцефалический барьер. Нейротоксический агенты приводит к органическим повреждениям в различных частях нервной клетки, чаще всего нейроны страдают от нарушения трансмембранной передачи питательных веществ и нарушении в синтезе нейромедиаторов. Токсические повреждения различной степени тяжести могут привести как к стойкой энцефалопатии, так и к полному выпадению некоторых функций пострадавшего от интоксикации человека. Наиболее часто грубое органическое поражение головного мозга вызывают такие вещества, как: мышьяк и продукты азотистого обмена, при чрезмерном накоплении последних в плазме крови.
Онкологические заболевания
Поражение головного мозга при онкологии может быть первичным. Когда опухоль развивается непосредственно из тканей головного мозга или же вторичным – при метастатическом занесении в головной мозг атипичных опухолевых клеток.
Виды поражений головного мозга
Поражение головного мозга может быть как очаговым, так и диссеминированным. Давайте разберёмся, что такое очаговое поражение головного мозга. Это состояние, при котором имеется чётко отграниченный единичный очаг с некротизированными тканями, т.е. это локальное поражение мозга. Такой вид повреждения часто формируется при остром нарушении мозгового кровообращения.
Диссеминированное или мультифокальное поражение головного мозга – вид повреждения, при котором обнаруживаются множественные разрозненные очаги повреждения тканей головного мозга. Мультифокальная форма встречается при инфекционных заболеваниях головного мозга, например при занесении инфекционного агента гематогенным путём в мозговое вещество или при онкологическом поражении.
Лечебная тактика
Лечение органических повреждений головного мозга может быть самым разнообразным и зависит от патогенетического механизма развития повреждения и непосредственной причины.
Лечение органического поражения головного мозга может быть хирургическим и консервативным. Например, развитие высокого внутричерепного давления, которое представляет угрозу жизнедеятельности можно лечить и хирургическим, и консервативным путём. Хирургическое лечение – наложение трепанационного отверстия для декомпрессии головного мозга применимо при формировании выраженной гематомы при травме или геморрагическом инсульте, а консервативная терапия возможна при умеренном увеличении внутричерепного давления без дислокации головного мозга. Для консервативной терапии применяют мочегонные препараты вызывающие форсированный диурез, позволяющие быстро ликвидировать отёки.
Лечение атеросклероза церебральных артерий также может быть как хирургическим, так и консервативным. Хирургическое – проведение ангиографии с установкой стентов расширяющих просвет артерий. Консервативное – антитромботическая терапия и коррекция дислепидемии.
Прямо в мозг: препятствия и способы их преодолеть
Введение наночастиц в носовую полость мыши для изучения транспорта веществ в мозг в обход гематоэнцефалического барьера.
рисунок автора статьи
Авторы
Редакторы
Статья на конкурс «Био/Мол/Текст»: В ходе работы мы выяснили механизм проникновения наночастиц из носовой полости в мозг, минуя гематоэнцефалический барьер (ГЭБ). Для этого были использованы наночастицы оксида марганца (Mn3O4), которые визуализировались при томографии. На данный момент описано несколько возможных путей транспорта веществ из носовой полости в мозг, но точный механизм еще не определен. Чтобы увидеть, как именно наночастицы проникают в мозг, проводились серии экспериментов по блокированию захвата/транспорта наночастиц в нейронах; проверялась и гипотеза транспорта по внеклеточному пространству. Актуальность данной работы — выявление путей доставки лекарственных препаратов и изучение проникновения вирусов в мозг в обход ГЭБ.
Конкурс «Био/Мол/Текст»-2020/2021

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.
Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Введение
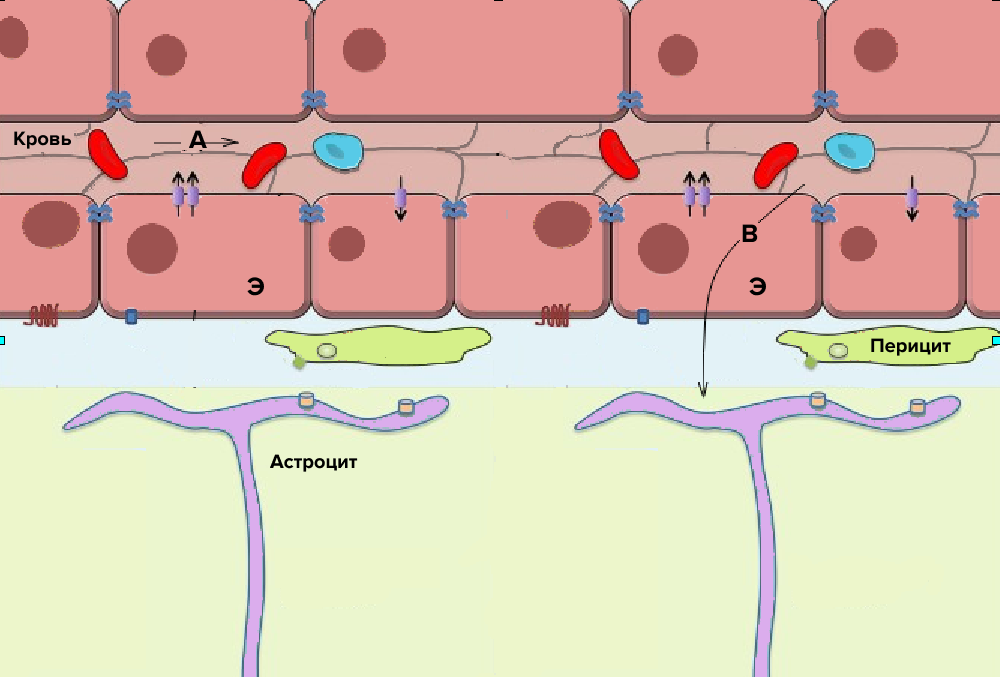
В организме человека существует специальная система защиты мозга от проникновения в него крупных молекул, в том числе инфекционных агентов — это гематоэнцефалический барьер (ГЭБ). Давайте подробнее рассмотрим его структуру (рис. 1). Первая линия защиты — плотный стой эндотелия капилляров, соединенных плотными контактами. В отличие от большинства капилляров тела, в них нет крупных щелей (пор) для прохождения некоторых белков плазмы [1]. Далее на пути к мозгу находятся перициты (клетки соединительной ткани) и астроциты (вспомогательные клетки в нервной ткани), которые механически не позволяют пройти молекулам крупнее определенного размера. Гематоэнцефалический барьер не пропускает вещества более 400–500 Да по массе, в зависимости от свойства вещества. (Для сравнения, сывороточный альбумин человека, самый распространенный белок в крови, имеет массу 65 000 Да). Также барьер непроницаем для ионов, но пропускает жирорастворимые вещества, воду, кислород, углекислый газ, некоторые обезболивающие и алкоголь (рис. 1).
Рисунок 1. Схема строения гематоэнцефалического барьера.
Э — клетки капилляров, соединенные плотными контактами; A — вещества, не проникающие через ГЭБ; B — вещества, проникающие через ГЭБ каким-либо способом, описанным ниже. Стрелками обозначены белковые системы транспорта веществ внутрь клетки и из нее.
рисунок автора статьи
Таким образом, долгое время считалось, что мозг полностью защищен от проникновения некоторых веществ из крови, пока не было обнаружено возможности прохода через ГЭБ. Такой способ доставки нужен прежде всего для доставки лекарств в нервную систему, поэтому было важно найти способы преодолеть барьер: ослабить клеточные контакты эндотелия (клеточного слоя) капилляров мозга, использовать системы транспорта веществ через мембрану капилляров или проникнуть в мозг с помощью эндоцитоза [2]. У данных способов есть свои недостатки, например, разрушение плотных контактов эндотелия приводило к местному накоплению веществ в мозге, повышению внутричерепного давления и требовало значительного времени на восстановление барьера [3]. Использование систем транспорта растворимых в воде метаболитов для доставки действующего вещества в мозг накладывает ограничения на само вещество. В данном случае оно должно либо имитировать «привычный» для данного белка-транспортера метаболит клетки, либо связываться с метаболитом для прохождения через мембрану [4]. Транспорт веществ путем эндоцитоза (захвата внешнего материала) клетками эндотелия тоже имеет свои недостатки — неспецифический эндоцитоз сведен к минимуму в капиллярах мозга, а специфический эндоцитоз часто включает в себя частичное пропускание вещества. Например, при доставке ионов железа посредством белка ферритином этот белок связывается с рецептором на эндотелии капилляра, проникает в клетку, высвобождает ионы железа для их дальнейшего транспорта в мозг, а потом удаляется из клетки обратно в просвет капилляра [5]. У всех перечисленных выше способов есть общий нюанс — вещество попадает в мозг через кровь, а значит, вещество распределяется равномерно по всему организму, поэтому нужно учитывать его системный эффект. Это накладывает дополнительные ограничения и увеличивает время испытания нового лекарства. В последние десятилетия ученые пытались преодолеть барьер и доставить лекарства с помощью наночастиц, введенных в кровь [6–8].
Наночастицы — собирательное название для группы веществ размером от 1 до 1000 нм. Они могут иметь различаться по форме и своим свойствам, в зависимости от пути преодоления ГЭБа. Это могут быть различные полимеры, натуральные или синтетические, или металлические частицы. Однако пока что наночастицы показывают не лучшие результаты в качестве транспортеров лекарств через барьер, если их вводить в кровь, а способ их проникновения через барьер — все еще спорный вопрос [9]. Как отметил Франческо Элдро, было потрачено много времени на изменение (модификацию) действующих веществ в составе лекарств для преодоления барьера, но гораздо меньше изучали способы их проникновения в мозг [10], [11].
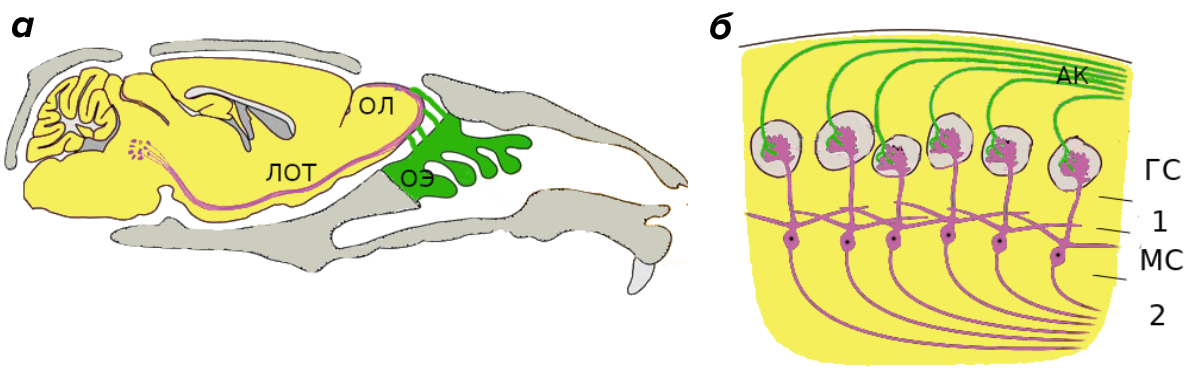
Существуют способы проникнуть в нервную систему, даже минуя стадию попадания в кровь. Конечно, можно просверлить отверстие в черепе и ввести вещество иглой через барьер — это довольно эффективный способ преодолеть ГЭБ. Единственный недостаток в том, что введенное вещество практически не распространяется по мозгу [12]. Но есть и гораздо менее инвазивный вариант — проникнуть в мозг через носовую полость в обход ГЭБа. Рассмотрим, почему этот способ вызывает особый интерес у ученых. Вспомним строение обонятельной системы позвоночных на примере мыши (рис. 2). В носовой полости есть специальный участок скопления рецепторных окончаний нейронов — обонятельный эпителий. От дендритов сигнал проходит через тело, транспортируется по аксону и передается митральной клетке, входящей в состав обонятельной луковицы; место передачи называется синапсом.
Рисунок 2. Строение обонятельной системы.
(a) — строение обонятельной системы мыши в разрезе. ОЭ — обонятельный эпителий, ОЛ — обонятельная луковица, ЛОТ — латеральный обонятельный тракт.
(б) — cтроение обонятельной луковицы мыши. АК) — аксоны обонятельных рецепторов, ГС — гломерулярный слой, МС — митральный слой, 1 и 2 — внешний и внутренний плексиформные слои обонятельной луковицы.
рисунок автора статьи
Тела митральных клеток образуют митральный слой, а аксоны этих клеток формируют латеральный обонятельный тракт. По нему передается информация о запахах в центры головного мозга, которые обрабатывают сигнал. Из-за «доступности» такого способа попадания в мозг, который вдобавок не требует серьезных ограничений по структуре и размерам веществ, данная тема требует более подробного анализа.
Данная работа посвящена изучению процесса проникновения наночастиц в головной мозг через носовую полость. Этот путь актуален не только с точки зрения доставки лекарственных препаратов, но и с точки зрения изучения процесса проникновения вирусов в головной мозг. У всех сейчас на слуху специфический симптом коронавирусной инфекции — потеря обоняния, что свидетельствует о возможности неспецифического проникновения любого вещества в нашу нервную систему.
Описание эксперимента и результаты
Для более точной визуализации транспорта веществ в мозг через носовую полость мы использовали наночастицы оксида марганца (Mn3O4, диаметр
34 нм). Введя их в одну ноздрю мыши, можно увидеть положение наночастиц при томографии (рис. 3).
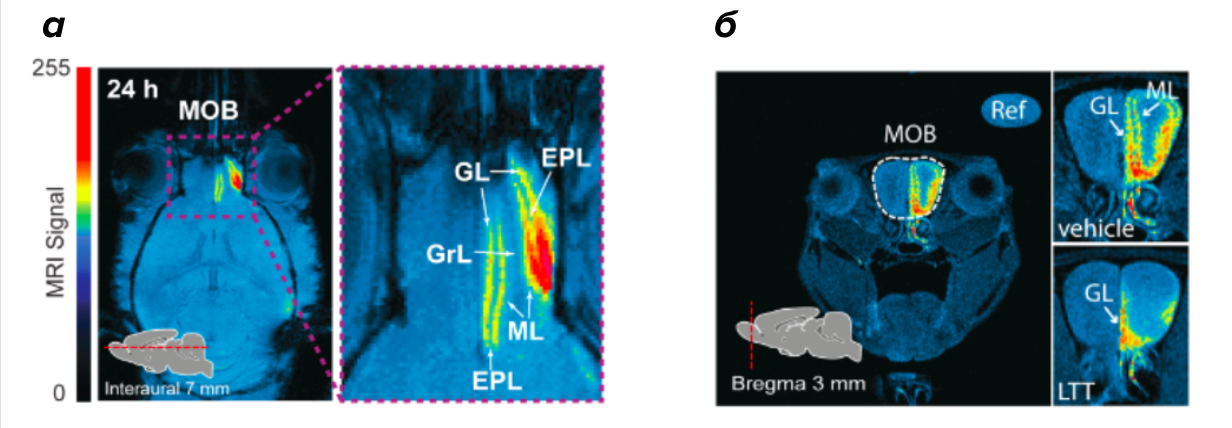
Рисунок 3. Томограмма обонятельной луковицы мыши.
(a) — распределение МРТ сигнала по слоям обонятельной луковицы (MOB): гломерулярному слою (GL), наружному плексиформному слою (EPL), слою митральных клеток (ML), слою зернистых клеток (GrL) спустя 24 часа после введения Mn3O4-наночастиц в правую ноздрю. Интенсивность сигнала выделена с помощью псевдоокрашивания (компьютер окрашивает изображение в различные цвета в зависимости от интенсивности МРТ-сигнала).
(б) — снимок в присутствии (LTT) и отсутствии (vehicle) ингибитора пресинаптической активности нейрона. Белыми стрелками показаны слои: гломерулярный слой (GL) и слой митральных клеток (ML).
рисунок автора статьи
В ходе работы было проанализировано влияние различных ингибиторов на захват и транспорт наночастиц в головной мозг мыши для ответа на основной вопрос: наночастицы проходят из носовой полости по нейронам или они попадают в нервную систему через внеклеточное пространство [13].
Чтобы проследить путь наночастиц из обонятельного эпителия в обонятельную луковицу, были использованы специфические и неспецифические ингибиторы эндоцитоза, а также вещества, разрушающие плотные контакты клеток обонятельного эпителия. Отличия между ингибиторами эндоцитоза в том, что специфические ингибиторы блокируют захват клетками определенного вещества, а неспецифические снижают общую способность клеток к эндоцитозу. Исходя из полученных данных, мы заключили, что частицы поглощаются клетками ольфакторного эпителия, а не проходят между ними. Также можно сделать вывод, что захват наночастиц происходит без сопряжения с каким-либо веществом, так как специфические ингибиторы эндоцитоза не влияли на уровень МРТ-сигнала.
Чтобы проследить дальнейший путь наночастиц, мы использовали ингибиторы аксонального транспорта (колхицин, лидокаин). Колхицин блокирует перемещение грузов от тела нейронов до синапса; лидокаин подавляет проведение импульсов в нейронах вследствие блокирования натриевых каналов (поэтому наночастицы, попав в нейрон, не могут передаваться дальше в синапс). Оба ингибитора достоверно повлияли на транспорт Mn3O4-наночастиц из носовой полости в мозг. Таким образом, мы показали, что Mn3O4-наночастицы проникают в обонятельную луковицу через аксон, а их транспорт зависит от активности нейрона.
Продолжая двигаться в мозг с наночастицами, мы попадаем во внешний слой обонятельной луковицы. Здесь наночастицы стоят перед выбором: либо идти через синапс в следующий нейрон и дальше транспортироваться по латеральному обонятельному тракту, либо перемещаться через межклеточное пространство.
Понять это возможно посредством влияния блокаторов. Ингибиторы пре- и постсинаптической активности нейронов влияют лишь на стадию транспорта наночастиц из обонятельной луковицы (MOB) в латеральный обонятельный тракт (LOT). Причем значительное влияние оказывают только ингибиторы пресинаптической активности — баклофен и LTT (левитриацетам). Такой эффект появляется из-за того, что наночастицы не работают как нейромедиаторы. Чтобы вызвать у нейрона постсинаптическую активность, вещество должно связаться с рецептором на поверхности нейрона и вызвать появление потенциала действия в нем (передать сигнал дальше по нервной цепочке). Наночастицы не могут связываться со специфическими рецепторами; они попадают в следующий нейрон за счет неспецифического эндоцитоза. Из-за этого ингибиторы постсинаптической активности практически никак не влияют на транспорт наночастиц из обонятельной луковицы в латеральный обонятельный тракт. Поэтому можем сделать вывод: наночастицы передаются транссинаптически по структурам головного мозга, отвечающим за обоняние в обход ГЭБ.
Обсуждение
Таким образом, на примере магнитных наночастиц мы показали, что возможен транспорт частиц из носа в мозг в обход ГЭБ внутри нейрональных клеток. Более того, процесс назального транспорта частиц зависит от активности нейронов. Так как данные наночастицы схожи по размерам и другим физическим свойствам с респираторными вирусами, можно предположить что транспорт вирусов в нервную систему возможен не только путем проникновения через ГЭБ [14]. Таким образом, найденный способ транспорта наночастиц в обход ГЭБ дает основу для исследования передачи вирусных заболеваний этим путем, а также для создания новых противовирусных препаратов. Особой актуальностью обладает исследование транспорта SARS-CoV-2, так как одним из симптомов коронавирусной инфекции является потеря вкуса и обоняния.
Заключение
Итогом работы стало подтверждение гипотезы о том, что наночастицы транспортируются через нейроны в головной мозг, а не через межклеточное пространство. Также мы можем сказать, что они не только захватываются обонятельными рецепторами, но и проходят через синапс в митральную клетку обонятельной луковицы, после чего по латеральному обонятельному тракту транспортируются в головной мозг. Понимание точного механизма транспорта веществ в обход ГЭБ может значительно упростить создание лекарственных препаратов против известных заболеваний — болезни Паркинсона и болезни Альцгеймера, а также поможет расширить представление о способах проникновения вирусов в нервную систему человека.