какая часть головного мозга отвечает за сон
Какая часть головного мозга отвечает за сон
История становления и современное состояние проблемы сна и бодрствования подробно изложены в целой серии монографий, опубликованных в последние годы. Мы кратко остановимся лишь на тех аспектах этой проблемы, которые имеют непосредственное отношение к патогенезу паркинсонизма.
Благодаря классическим опытам бельгийского нейрофизиолога Бремера, проведенным в 30-х гг. текущего столетия, было впервые доказано, что механизмы, поддерживающие бодрствование, расположены в стволе головного мозга. При пересечении у кошки ствола мозга на уровне среднего мозга наблюдалась ЭЭГ-картина постоянного сна, при пересечении же мозга на более низком уровне — на уровне первого шейного сегмента — констатировалось типичное чередование ЭЭГ-картины сна и бодрствования.
Наступление поведенческой и ЭЭГ-картины постоянного сна в первом эксперименте объясняли отсечением от полушарий стволовых структур, обеспечивающих бодрствование.
Эти структуры были окончательно идентифицированы в 1949 г. в результате исследований Моруцци и Мэгуна, которыми было показано, что раздражение ретикулярной формации ствола мозга закономерно вызывало пробуждение спящего животного с характерными изменениями на ЭЭГ.
В последующих экспериментах было доказано, что перерезка специфических лемнисковых систем ствола мозга при интактности ретикулярной формации не приводит к подобным изменениям поведения и ЭЭГ. Поведенческая и ЭЭГ-картина сна наступала только при разрушении ретикулярной формации, сконцентрированной в медиальных отделах ствола мозга. Активирующую ретикулярную систему называют также системой пробуждения (arousal system).
Электроэнцефалографическая реакция в виде угнетения медленных волн и появления быстрых низкоамплитудных колебаний с тех пор называется реакцией активации, или реакцией пробуждения (arousal reaction).
По современным представлениям, бодрствование является не однозначным, а сложно градуированным процессом, который может флюктуировать от состояния напряженной бдительности до расслабленного бодрствования, и обеспечивается активирующей восходящей системой, прослеживаемой на всем протяжении ствола мозга и гипоталамуса, с особым сгущением ее нейронов в понто-мезенцефальной области. Наступление естественного сна поначалу объясняли функциональной блокадой активирующих импульсаций с реципрокным облегчением синхронизирующих механизмов зрительного бугра.
Однако большая серия последующих работ привела к существенному изменению и усложнению вышеуказанной схемы.
Помимо таламуса было выявлено наличие еще двух синхронизирующих структур в каудальных отделах мозгового ствола, а также гипногенной системы, расположенной в базальных отделах переднего мозга. Раздражение головки хвостатого ядра приводит к появлению в коре мозга билатерально синхронных вспышек веретенообразных волн, сходных с «сонными веретенами», и поведенческой заторможенности. Этот эффект реализуется через передневентральное ядро таламуса.
Описаны и другие структуры мозга, принимающие участие в механизмах синхронизации. Таким образом, и активирующие, и сомногенные системы мозга представляют собой сложные комплексы мозговых образований, расположенных на разных уровнях мозга и объединенных общей задачей координированного управления базисными состояниями организма. В настоящее время сон рассматривается как сложно организованный активный процесс, состоящий из двух основных фаз — фазы, медленного и фазы быстрого сна.
Основным ЭЭГ-проявлением фазы медленного сна являются синхронизированные корковые потенциалы в виде «сонных веретен» и высокоамплитудных медленных дельта-волн. В зависимости от представленности тех или иных компонентов на ЭЭГ в фазе медленного сна выделяют четыре последовательно наступающие стадии: поверхностный сон (I стадия), легкий сон (стадия «сонных веретен», или II стадия), сон средней глубины (III стадия) и глубокий сон (IV стадия). Последние две стадии иногда называют дельта-сном. Дельта-сон завершает фазу медленного сна, за которой следует фаза быстрого сна.
Нейроны и нейромедиаторы
Химические цепочки
Все чувства и эмоции, которые испытывают люди, возникают путем химических изменений в головном мозге. Прилив радости, который человек ощущает после получения положительной оценки, выигрыша в лотерею или при встрече с любимым, происходит вследствие сложных химических процессов в головном мозге. Мы можем испытывать огромное количество эмоций, например таких, как печаль, горе, тревога, страх, изумление, отвращение, экстаз, умиление. Если мозг дает телу команду на осуществление какого-либо действия, например, сесть, повернуться или бежать, это также обусловлено химическими процессами. «Химический язык» нашей нервной системы состоит из отдельных «слов», роль которых исполняют нейромедиаторы (их еще называют нейротрансмиттерами).
Любой нейрон может получать большое количество химических сообщений, как положительных, так и отрицательных («работай» или «стоп»), от других нейронов, которые его окружают. Эти сообщения могут конкурировать или «сотрудничать», между собой, заставляя нейрон отвечать специфическим образом. Поскольку все эти события происходят в течение очень короткого времени (считаные доли секунды), очевидно, что медиатор должен быть удален из синаптического пространства очень быстро, чтобы те же самые рецепторы могли работать снова и снова. И это удаление может происходить тремя способами. Молекулы нейромедиатора могут быть захвачены назад в то нервное окончание, из которого они были выделены, и этот процесс получил название «обратный захват» («reuptake»); нейромедиатор может быть разрушен специфическими ферментами, находящимися в готовности недалеко от рецепторов на поверхности нейрона; или активное вещество может просто рассеяться в окружающую область мозга, и быть разрушено там.
Изменение нейротрансмиссии с помощью лекарств
Рассмотрим, что происходит при изменении уровней нейромедиаторов мозга на примере трех из них (серотонин, дофамин и гамма-аминомасляная кислота (ГАМК).
Серотонин
Многие исследования показывают, что низкий уровень серотонина в головном мозге приводит к депрессии, импульсивным и агрессивным формам поведения, насилию, и даже самоубийствам. Лекарственные вещества под названием антидепрессанты создают блок на пути обратного захвата серотонина, тем самым несколько увеличивая время его нахождения в пространстве синапса. Как итог, в целом увеличивается количество серотонина, участвующего в передаче сигналов с нейрона на нейрон, и депрессия со временем проходит.
В последние годы ведутся бурные дискуссии вокруг психического расстройства, носящего название «синдром дефицита внимания с 
Наркотическое вещество, известное как «экстази» или МДМА, также изменяет уровень серотонина в мозге, но намного более радикально. Он заставляет выделяющие серотонин нейроны выплескивать все содержимое сразу, затапливая этим химикатом весь мозг, что, конечно, вызывает ощущение чрезвычайного счастья и гиперактивность (чрезмерную двигательную активность). Однако, за это приходится расплачиваться позже. После того как экстази израсходовал весь мозговой запас серотонина, включаются компенсаторные механизмы, быстро разрушающие избыток нейромедиатора в мозге. После того, как спустя несколько часов действие наркотика заканчивается, человек, вероятно, будет чувствовать себя подавленным. Этот период «депрессии» продлится до тех пор, пока мозг не сможет восполнить запасы и обеспечить нормальный уровень медиатора. Повторное использование на этом фоне экстази может привести к глубокой депрессии или другим проблемам, которые будут тянуться в течение долгого времени.
Дофамин
Ученые обнаружили, что люди с расстройством психики, известным как шизофрения, фактически чрезмерно чувствительны к дофамину в мозге. Как следствие, при лечении шизофрении используются лекарства, которые блокируют дофаминовые в головном мозге, таким образом, ограничивая воздействие этого нейромедиатора.
С другой стороны, вещества, известные как амфетамины, увеличивают уровень дофамина, заставляя нейроны его высвобождать, и препятствуя его обратному захвату. В некоторых странах врачи используют разумные дозы этих препаратов при лечении некоторых заболеваний, например, синдрома гиперактивности с дефицитом внимания. Тем не менее, иногда люди абсолютно необдуманно неправильно используют эти вещества, пытаясь обеспечить себе повышенный уровень бодрствования и способность решать любые задачи.
Гамма-аминомасляная кислота
Гамма-аминомасляная кислота, или ГАМК, является главным медиатором, чья роль заключается в передаче нейронам команды «стоп». Исследователи полагают, что определенные типы эпилепсии, которые характеризуются повторными припадками, затрагивающими сознание человека и его двигательную сферу, могут являться результатом снижения содержания ГАМК в головном мозге. Передающая система мозга, не имея адекватного «тормоза», входит в состояние перегрузки, когда десятки тысяч нейронов начинают сильно и одновременно посылать свои сигналы, что приводит к эпилептическому приступу. Ученые полагают, что за разрушение слишком большого количества ГАМК могут быть ответственны мозговые ферменты, в связи с чем появились лекарства, которые помогают остановить этот процесс. Время показало их эффективность в лечении не только эпилепсии, но и некоторых других нарушений работы мозга.
Гормоны
Химическое взаимодействие
Проблемы с памятью
Забывчивость, нарушения внимания приписывают людям преклонного возраста. Однако проблемы с памятью возникают все чаще и у молодых. Причины этого явления разнообразны – от неправильного образа жизни и переутомления до серьезных нарушений в работе головного мозга и внутренних органов.
Причины ухудшения памяти в молодом возрасте
Нарушение памяти у пожилых людей обычно вызвано возрастными изменениями организма. Атеросклероз, микроинсульты, болезнь Альцгеймера – эти патологии негативно влияют на когнитивные функции.
Причины забывчивости в молодом возрасте иные, их можно разделить на 4 группы.
Нарушения в работе головного мозга – основная причина ухудшения памяти
За работу долговременной памяти отвечает кора головного мозга. Гиппокамп, который расположен в височных долях, запускает процессы перевода кратковременной информации в долговременную память. Существуют и другие центры памяти в мозге. Поэтому любые повреждения этого органа провоцируют развитие забывчивости, невнимательность.
Причины проблем с памятью у молодых людей:
После любых травм и болезней головного мозга необходимо постоянно наблюдаться у невролога. Это поможет своевременно выявить нарушения памяти и когнитивные расстройства.
Какие болезни внутренних органов негативно влияют на память
Нормальная работа головного мозга во многом зависит от слаженной работы всего организма. Многие дисфункции косвенно могут повлиять на концентрацию внимания, память.
Гормональный фон влияет на процесс запоминания. Тестостерон, вазопрессин, пролактин, эстроген помогают преобразовывать кратковременную память в долгосрочную. Окситоцин ухудшает процесс запоминания.
При болезнях почек ухудшается вербальная память. Когнитивные функции снижаются при увеличении уровня креатинина, снижения скорости клубочковой фильтрации. Исследование проводили на протяжении 5 лет ученые из США.
Неблагоприятное воздействие внешних факторов, образ жизни
Если возникают проблемы с памятью у молодых людей, причины часто связаны с неосознанным нарушением функций головного мозга. Но эти причины, в отличие от болезней, устранить проще. При изменении образа жизни забывчивость постепенно исчезнет.
Причины ухудшения памяти:
Курение разрушает мозг. Заядлые курильщики страдают от проблем с памятью, ухудшается способность к восприятию новой информации, логическое мышление. В равной степени опасно активное и пассивное курение, показатели памяти снижаются на 25-30%.
Ежедневное употребление 36 г чистого спирта приводит к раннему ухудшению памяти. Но и полный отказ от алкоголя негативно влияет на работу мозга. Безопасно употреблять до 4 бокалов красного сухого вина в неделю.
Наркотики – нейротоксичные вещества, нарушают процесс получения, обработки и отправления информации. Даже при однократном употреблении часто возникают необратимые разрушения в серотониновой системе мозга.
Сопутствующие симптомы
Забывчивость, неспособность запоминать и воспроизводить информацию – не единственные признаки плохой памяти.
При каких симптомах нужно обратиться к врачу:
Как решить проблемы с памятью
Если память часто подводит, необходимо посетить невропатолога. После осмотра, сбора анамнеза и первичной диагностики может потребоваться консультация терапевта, нейропсихолога, психотерапевта, онколога.
Нейромониторинг начинается с оценки неврологического статуса. Врач проверяет работу черепно-мозговых нервов, определяет амплитуду движения глазных яблок, симметричность языка и зубного оскала, оценивает мимические и произвольные движения.
Проводят оценку слуха, зрения, обоняния, рефлексов, речи. Для диагностики расстройств памяти используют тесты, которые показывают способность запоминать и воспроизводить новую информацию. Для выявления нарушения когнитивных функций врач назначает общий и биохимический анализ крови, исследование спинномозговой жидкости, ЭЭГ, МРТ и КТ головного мозга. На основании результатов диагностики подбирают методы лечения, лекарственные препараты.
Как все устроено: отделы мозга и за что они отвечают
Наш мозг — самый сложный, неизученный орган, который управляет всем организмом. Ученые не перестают изучать его строение, и сегодня мы рассмотрим основные функции различных мозговых структур.
Структура
Понятие конечного мозга объединяет оба полушария, при этом его также принято разделять на 4 доли — лобную, височную, теменную, затылочную.
Слаженная работа всех отделов направлена на работу высших психических функций — восприятия, внимания, памяти, мышления. Наша нервная система получает сигналы от органов чувств, а мозг обрабатывает их — слух, зрение, вкус, запах, чувство равновесия. Также он контролирует все жизненно важные процессы — дыхание, сердцебиение, метаболизм. Рассмотрим подробнее, где же происходит это волшебство.
Конечный мозг
Ниже приведены основные функции долей больших полушарий:
Задний мозг: мозжечок, мост
Этот отдел образуют мозжечок и варолиев мост, который находится над мозжечком и соединяет его со спинным мозгом. Здесь происходит регуляция нашего вестибулярного аппарата — это ощущение равновесия, а также координация движений. Он надежно защищен, поскольку повреждение этой зоны провоцирует шаткую, неустойчивую походку, ослабление мышц, даже тремор конечностей, в некоторых случаях — изменение почерка.
Средний
Этот отдел является частью двигательной системы и выполняет большое количество функций. Средний мозг контролирует наши движения и защитные реакции, например, в ответ на страх. Он отвечает за зрение, слух, поддерживает терморегуляцию, болевые ощущения, контролирует концентрацию внимания, биоритмы.
Промежуточный отдел
Этот отдел перерабатывает всю входящую информацию. Его основная функция — наша способность адаптироваться, приспосабливаться. Промежуточный мозг состоит из трех частей:
Продолговатый
Выполняет регуляцию систем: дыхательной, кровообращения, пищеварения. Благодаря ему у нас есть безусловные рефлексы, например, чихание, а также тонус мышц. Кроме того, там стимулируется выработка различных секретов — слюны, слез, ферментов ЖКТ.
Науке еще многое предстоит узнать об особенностях нашего самого главного органа. В наших же силах поддерживать его высокую работоспособность при помощи постоянных тренировок. Тренируйте высшие психические функции — внимание, память, мышление — на когнитивных тренажерах, чтобы работа всех отделов была продуктивной.
Сон и старение I: «Часы в мозге» и влияние генов на ритм жизни
Сон и старение I: «Часы в мозге» и влияние генов на ритм жизни
Эпифиз вырабатывает «гормон сна» мелатонин ночью, а солнечный свет тормозит его образование. Мелатонин — главный регулятор циркадных ритмов, управляющих распорядком дня человека.
Автор
Редакторы
Новая неделя, новый день, новый год. Время жизни разбито на отрывки разной длительности, и все эти отрывки повторяются. Каждые несколько часов нам хочется есть. Каждый вечер мы ложимся спать. Каждые четыре недели организм женщины вырабатывает яйцеклетку. Большинство процессов, происходящих с нашим телом, циклично, и одни циклы завязаны на другие. И хотя старение организма периодическим процессом не назовёшь (ведь никто не молодеет!), его ход напрямую зависит от биоритмов человека, в частности, от цикла сна и бодрствования. Доказательства этому находятся и на уровне поведения, и на уровне отдельных органов, клеток и генов.
Старение и долголетие
Цикл статей, задуманных в рамках спецпроекта «биомолекулы» для фонда «Наука за продление жизни».
В этом цикле рассмотрим общие проблемы старения клеток и организмов, научные подходы к долголетию и продлению здоровой жизни, связь сна и старения, питания и продолжительности жизни (обратимся к нутригеномике), расскажем про организмы с пренебрежимым старением, осветим темы (эпи)генетики старения и анабиоза.
Конечно, феномен старения настолько сложен, что пока рано говорить о радикальных успехах в борьбе с ним и даже о четком понимании его причин и механизмов. Но мы постараемся подобрать наиболее интересную и серьёзную информацию о нащупанных связях, модельных объектах, разрабатываемых и уже доступных технологиях коррекции возрастзависимых нарушений.
Краткое содержание спецпроекта освещено в видеоролике «Стареть или не стареть? // Всё как у зверей». Подробности же узнаете из наших статей.
Следите за обновлениями!
Часы в мозге
Как показывает практика, механизмы смены сна и бодрствования можно объяснить даже детям — «„Проснись!“ — „Усни. “ — „Проснись!“ — „Усни. “ — „Проснись!“» [1]. — Ред.
У дрозофил нашли подобие «гена сна», что описано в статье «Бессонные ночи дрозофилы» [2]. Чисто теоретически это может привести к тому, что потребностью во сне можно будет управлять, но вряд ли мы это когда-то увидим. — Ред.
Есть предположение, что изначально (много миллионов лет назад) циркадные ритмы помогали организмам не умирать от кислорода, которого в тот момент в атмосфере стало аномально много для тогдашних обитателей планеты — «Прообраз биологических часов» [3]. — Ред.
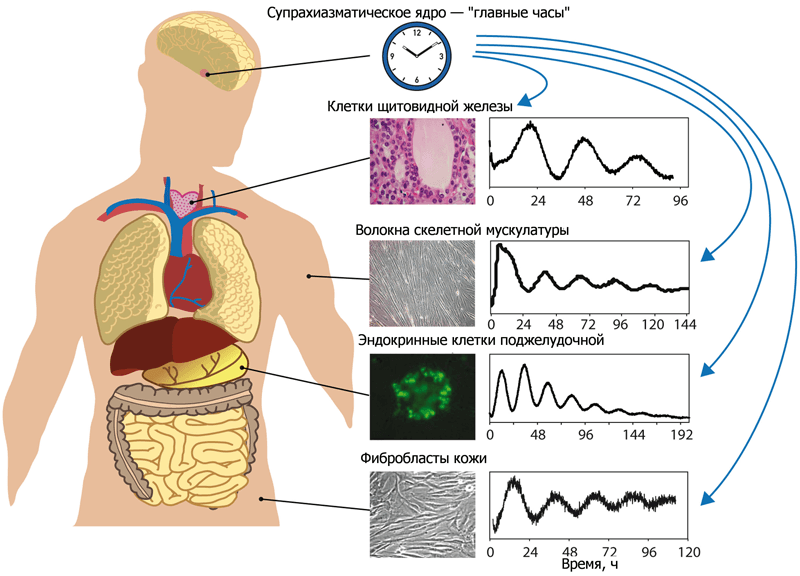
Рисунок 1. Влияние супрахиазматического ядра гипоталамуса на работу различных клеток организма. Функционирование клеток всех типов тканей подчиняется центральному ритму, который задаёт супрахиазматическое ядро гипоталамуса. Оно «следит» за тем, чтобы сигналы от нервной и эндокринной систем приходили к клеткам в одно и то же время — фактически, синхронизирует их. Кстати, то же можно сделать и вне организма: выращивая в культурах несколько образцов различных тканей человека, можно эти культуры синхронизировать, если имитировать сигналы SCN. Такая синхронизация активности культур различных типов клеток одного и того же человека представлена на графиках.
В ходе исследований посмертных срезов мозга здоровых пожилых людей выяснилось, что с возрастом нейроны SCN дегенерируют. Изменяется и структура LC. Кроме того, активность лобных долей коры значительно падает с возрастом (и степень снижения этой активности напрямую отражается на интеллекте), что показано в исследованиях фМРТ [4]. Всё это приводит к тому, что со временем у людей исчезают острые пики активности при бодрствовании. То есть пожилые, конечно, бодрствуют, но внимательность и скорость мышления у них не так хороши, как раньше. Вероятно, причина этого — постепенное ухудшение работы мозговых регуляторов сна и бодрствования.
У пожилых по сравнению с молодыми эффективность сна снижена. С этим может быть связана старческая сонливость, возникающая даже тогда, когда человек определённо выспался. Судя по всему, возрастное падение качества сна не вызвано какими-то конкретными патологиями, это просто часть обычного процесса старения. Впрочем, так ли неизбежно само старение, вопрос.
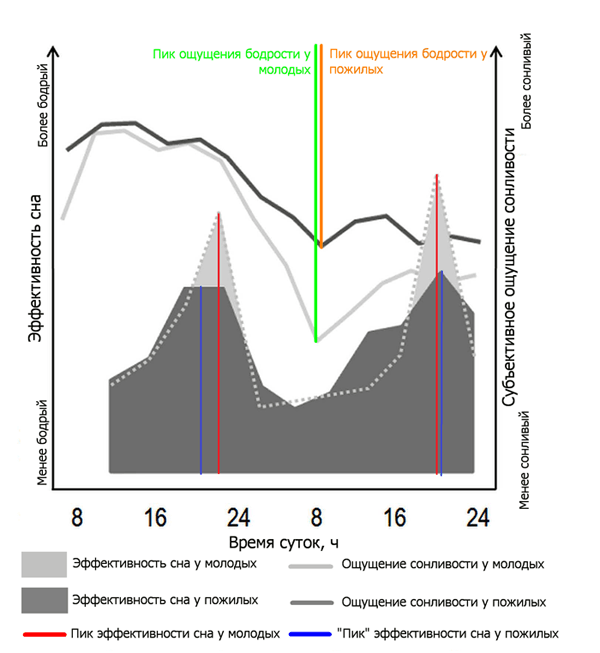
Кроме того, старые хуже переносят вынужденный пропуск сна. Это показали эксперименты, в ходе которых 12 мужчин возрастом 21–31 год и 11 мужчин возрастом 61–70 лет не спали 40 часов (рис. 2). У пожилых субъективное ощущение сонливости было сильнее, чем у молодых, да и внимание из-за недосыпа падало заметнее [5].
Другой эксперимент с такой же длительностью провели в 2005 году [6]. Его результаты тоже представлены на рисунке 2 (закрашенные серым области). В нём двум группам участников-мужчин (опять пожилым и молодым) нужно было в течение 40 часов то спать по 75 минут, то бодрствовать по 150 минут, притом делать это по расписанию. Такой искусственный режим должен был выявить, насколько сон у людей одной возрастной группы более эффективен, чем у испытуемых из другой группы. Нетрудно догадаться, что молодые во время эксперимента и после него чувствовали себя лучше, чем пожилые, потому что лучше высыпались.
Рисунок 2. Субъективное восприятие качества сна и бодрствования у молодых и пожилых мужчин во время 40-часового эксперимента по лишению сна [5], а также эффективность сна во время эксперимента с множеством эпизодов сна [6]. Пожилые раньше начинают чувствовать сонливость, и субъективно она проявляется сильнее (тёмно-серая линия). Молодые более устойчивы к депривации сна (светло-серая линия). Кроме того, субъективно сон молодых (светло-серые закрашенные области) более эффективен, чем сон пожилых (тёмно-серые закрашенные области).
«Гены циркадных ритмов» и старение
Работа любого органа — это, в конечном счёте, работа его генов. Наши «внутренние часы» — не исключение. В супрахиазматическом ядре экспрессируется ряд генов, малоактивных в других частях мозга и тела вообще. Среди таких генов BMAL1 (он же MOP3 и ARNT3), CLOCK и NPAS2 [7], [8]. Эти гены были выявлены в исследованиях с помощью нокаутных мышей — таких, которым методами генной инженерии нарушили работу одного или нескольких генов.
Как правило, продолжительность жизни у грызунов с одним или несколькими выключенными «генами периодичности» снижена. В частности, мыши с неработающим BMAL1 живут меньше своих собратьев. Под конец жизни у них проявляются все характерные признаки старения: их органы уменьшаются в размерах, теряется мышечная масса и подкожный жир, развивается старческая катаракта, повышается содержание активных форм кислорода в тканях [9]. При постоянной нехватке белков BMAL1 и CLOCK ухудшается память, снижается интеллект: животные хуже обучаются и быстрее забывают новую информацию [10].
BMAL1 и CLOCK действуют по-разному: если «выключить» работу гена CLOCK, не затрагивая BMAL1, жизнь мышей претерпевает менее глобальные изменения. Средний срок жизни грызунов без CLOCK на 15% короче, чем у животных дикого типа, а преждевременное старение проявляется у них только в изменении структуры кожи и развитии катаракты [11].
Вот один из примеров связи циркадных ритмов с обменом веществ в целом: «Найдена связь между обменом веществ и циркадным ритмом» [12].
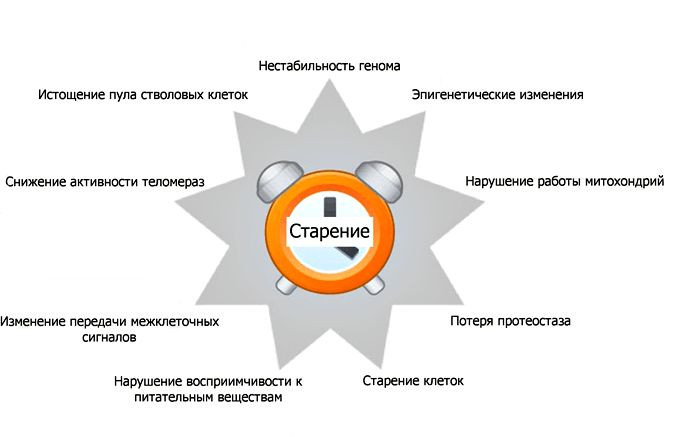
Рисунок 3. Примеры проявлений старения на клеточном уровне. Подробное объяснение этих проявлений дано ниже в тексте в виде нумерованного списка.
Исследования обычно проводятся на больших группах животных, и данные по этим животным усредняются. Но мы-то помним, что каждый организм имеет свой уникальный геном, и от того, как гены в его составе взаимодействуют между собой, зависит очень многое. У двух мышей может быть нарушена работа одного и того же CLOCK, но на уровне отдельных органов и организма в целом это нарушение проявится у них совершенно по-разному. Да даже если с вариантами генов всё в порядке, два организма не будут стариться одинаково. Дело в том, что роль в силе и характере изменений сна с возрастом играет и генотип конкретного организма. Это было подтверждено исследованиями на мышах [23], [24], в которых качество сна грызунов оценивали по элетроэнцефалограммам, а также смотрели, как с возрастом у этих грызунов ухудшается зрение.
У грызунов линии C57BL/6 чаще других с возрастом развивается катаракта, а значит, почти пропадает зрение. Видимо, поэтому под старость (в возрасте примерно год) эти сумеречные животные всё более активны в светлое время суток и всё менее активны в темноте. Кроме того, пожилые C57BL/6 бодрствуют дольше остальных, а AKR/J дольше всех спят. Больше всего времени в стадии REM-сна проводят мыши линии DBA/2J, а меньше всего — AKR/J. Если годовалым мышам этих трёх линий некоторое время мешать спать, а потом дать им возможность выспаться, то быстрее всех к своему обычному режиму возвращаются грызуны C57BL/6.
Сон и метаболизм
Мы выяснили, как нарушение работы «генов циркадных ритмов» влияет на состояние отдельных клеток. А как на них действует нарушения сна, столь частые в преклонном возрасте?
Хотя сон считается временем покоя, во время сна очищение нейронов от «отработанных» продуктов обмена веществ происходит быстрее, чем при бодрствовании [26]. Кстати, ночью очищается не только нервная система. Во время сна также усиливается или ослабевает экспрессия ряда генов. В тканях лёгких экспрессия 3% генов различается во сне и при бодрствовании. В тканях сердца таких «сон-зависимых» генов 6%. Во время сна содержание маркеров клеточного стресса в тканях лёгких, сердца и мозга снижено [27].
Возможно, одна из функций сна — избавление организма от отработанных метаболитов и общее восстановление клеток после стресса. Если это предположение окажется верным, оно сможет объяснить некоторые факты. Например, известно, что независимо от национальности у женщин 46–57 лет, имеющих частые жалобы на качество сна, особенно высок риск метаболического синдрома [28]. Впрочем, последнее может быть связано с тем, что в дополнительные часы бодрствования эти женщины едят [29]. А значит, они потребляют больше калорий в сутки, чем женщины без проблем со сном. В пользу этой гипотезы свидетельствует то, что экспериментальное нарушение сна не вызывало у крыс метаболического синдрома [30].
По данным эпидемиологических исследований, депривация (ограничение времени) сна повышает вероятность дислипидемии, диабета 2 типа и нетолерантности к глюкозе (таб. 1).
| Первый автор статьи, ссылка | Год | Число участников | Продолжительность исследования | Результаты |
|---|---|---|---|---|
| Chaput et al. [32] | 2007 | 740 | 3 года | Регулярный сон длительностью менее 6 часов вызывает нарушение толерантности к глюкозе. |
| Mallon et al. [33] | 2005 | 2663 | 12 лет | У мужчин частые пробуждения и короткий сон связаны с повышенной вероятностью диабета. |
| Nilsson et al. [34] | 2004 | 6599 | 14,8 ± 2,4 года | Нарушения сна повышают риск развития диабета. |
| Tuomilehto et al. [35] | 2008 | 2800 | 2 года | Слишком короткий (≤6 ч) или слишком длинный (≥8ч) сон повышают вероятность развития диабета 2 типа у женщин среднего возраста. У мужчин аналогичного эффекта не нашли. |
| Meisinger et al. [36] | 2005 | 8300 | 11 лет | У людей обоих полов сложности с поддержанием сна (частые просыпания и т.п.) повышают риск развития диабета 2 типа. |
| Hayashino et al. [37] | 2007 | 6509 | 6 лет | У взрослых без серьёзных проблем со здоровьем нарушения засыпания связаны с повышенным риском диабета. |
| Kawakami et al. [38] | 2004 | 2649 | 8 лет | Нарушения сна связаны с повышением риска диабета в 2-3 раза. |
| Choi et al. [39] | 2008 | 4222 | 1 год | И слишком короткий, и слишком длинный сон ассоциируются с повышенным риском метаболического синдрома. |
| Gangwisch et al. [40] | 2007 | 8992 | 10 лет | Кратковременный сон может быть важным фактором риска диабета. |
| Xu et al. [41] | 2010 | 10143 | 10 лет | Короткий ночной сон и частый дневной сон связаны с проявлением диабета. |
| Rafalson et al. [42] | 2010 | 1455 | 6 лет | Короткий ночной сон связан с нарушением содержания глюкозы в крови натощак, вызванным резистентностью к инсулину. |
| Yaggi et al. [43] | 2006 | 1709 | 18 лет | И слишком короткий, и слишком длинный сон повышают риск развития диабета. |
| Hall et al. [44] | 2008 | 1214 | Одномоментное исследование | Продолжительность сна связана со степенью риска метаболического синдрома. |
| Facco et al. [45] | 2010 | 189 | В течение беременности | Малая продолжительность сна связана с нарушением толерантности к глюкозе во время беременности. |
| Qui et al. [46] | 2010 | 1290 | В течение беременности | Гестационный диабет (диабет беременных) и нарушение толерантности к глюкозе чаще развиваются у тех, кто мало спит. |
Помимо нарушений метаболизма, ошибок репликации и повышенным по сравнению с нормой процентом гибнущих клеток [30], депривация сна может повлечь за собой негативные последствия для иммунной системы. У пациентов с постоянным недосыпом днём в крови повышается содержание маркеров воспаления — фактора некроза опухолей (TNF), интерлейкинов 1 и 6, а также кортизола [31], [47]. А ведь воспаление идёт рука об руку с повышенным риском множества заболеваний, начиная от инсульта и заканчивая болезнью Альцгеймера. Например, при последней клетки микроглии (это макрофаги в мозге) выделяют заметные количества интерлейкинов 12 и 23 — одних из важнейших сигналов воспаления. В норме этого, разумеется, не происходит, ведь ни болезни Альцгеймера, ни воспаления нет. Судя по всему, команду микроглии вырабатывать факторы воспаления даёт сам бета-амилоид. Далее, при болезни Альцгеймера астроциты (разновидность глиальных клеток, питают и поддерживают нейроны, направляют их рост у зародышей) становятся восприимчивыми к IL-12 и IL-23 (опять же, в норме такого не наблюдается.) Отложения бета-амилоида увеличиваются в размерах, клеток астроглии становится всё больше, а нейронов рядом с ними — всё меньше [48]. Если снизить выработку IL-12 и IL-23 в клетках глии, патология замедлит своё развитие.
Во взаимосвязях воспаления, выделения интерлейкинов и работы астроцитов при болезни Альцгеймера ещё предстоит разобраться, но уже сейчас ясно, что такие взаимосвязи существуют. На самом деле, подобных корреляций выявили уже немало. А о связи нарушений сна и различных заболеваний (нервных, и не только) будет отдельная статья.