какая система оценки антибиотикочувствительности используется в медицинской практике
Критерии для определения чувствительности и резистентности
Целью лабораторного исследования чувствительности бактерий к антибиотикам является идентификация возбудителей, вызывающих инфекционные заболевания, и установление их чувствительности или устойчивости к антибактериальным средствам, используемым по общепринятым схемам терапии [26]. Полученная информация может быть использована для выбора оптимального лекарственного средства в начале лечения, для контроля эффективности терапии или для установления чувствительности бактерий к антибиотикам внутри конкретной популяции микроорганизмов (например, внутригоспитальных штаммов) с целью выбора эффективного препарата для начала лечения. Эффективность терапии зависит как от проведенного курса, так и от состояния организма больного, в том числе его защитной реакции и фармакокинетики лекарственного вещества.
Лабораторные тесты определения чувствительности не могут дать исчерпывающей информации о чувствительности к антибиотику in vivo. Для того чтобы достаточно точно выбрать наиболее эффективный антибиотик для лечения инфекции, было использовано несколько различных критериев для решения вопроса об определении чувствительности или резистентности бактерий к доступным антибактериальным средствам:
Клиническая эффективность
Является наиболее достоверным тестом определения чувствительности чистой культуры микроорганизмов к исследуемому антибиотику [8].
Уровень антибиотика в сыворотке крови
Второй общепринятый метод определения чувствительности основан на сравнении концентрации, обеспечивающей подавление роста микроорганизмов и концентрации, создаваемой в сыворотке крови. Ингибирующую концентрацию исследуемого антибиотика определяют по одной или нескольким стандартным методикам и соотносят ее с уровнем в сыворотке крови, который достигается при применении обычно рекомендуемых доз и способов введения антибиотика. Так как точно определить концентрацию препарата в сыворотке крови трудно, то были предложены дополнительные меры предосторожности, чтобы в крови не создавались опасно высокие концентрации препарата. Так, часто стремятся к тому, чтобы минимальная подавляющая концентрация (МПК) составляла четвертую часть или меньше от среднего показателя концентрации в крови [8,13,26]. При воздействии на микроорганизмы, для которых МПК значительно ниже, чем концентрация в сыворотке крови, этот метод вполне удовлетворителен.
Изменение чувствительности у микроорганизмов одного вида
Третий метод определения критерия чувствительности основан на сравнении чувствительности микроорганизмов, выделенных от больного, и чувствительности всей популяции этого же вида микроорганизмов или близких микроорганизмов. В случае появления в популяции одного вида микроорганизмов, менее чувствительных к препарату, их можно отнести к группе сравнительно резистентных или абсолютно резистентных штаммов [8].
Когда «работает» не все: определение чувствительности к антибиотикам
Всемирная организация здравоохранения заявляет: «Устойчивость бактерий к антибиотикам возрастает до угрожающе высоких уровней во всем мире». В таких условиях даже «банальный» отит или тонзиллит может приобретать затяжное, осложненное течение, не говоря о риске в отношении потенциально летальных инфекций. Как выяснить какой препарат эффективен против «своей» патогенной флоры? И какой анализ выбрать?
«Классический» способ
Некоторые представители бактериальной флоры обладают поразительной способностью к мутациям. Бактерии, еще вчера чувствительные к простому пенициллину, сегодня – «не реагируют» на куда более «продвинутые» антибиотики.
Поэтому в современной медицине лечение бактериальных процессов без понимания особенностей возбудителя представляется «занятием» сомнительным и бесперспективным. В лучшем случае, воспаление просто «затихнет» на короткое время, а в худшем – разовьется до угрожающих жизни масштабов.
Особенно опасна такая ситуация в отношении хирургических больных, новорожденных и людей с ослабленным иммунитетом, а также тех, для кого прием антибиотиков стал нормой жизни.
Микробиологические способы идентификации возбудителей уже давно используются медициной всего мира, а современные анализаторы сделали этот процесс быстрее и эффективнее.
Так, посев на флору с определением чувствительности к антибиотикам позволяет не только «узнать» бактерии, но и проверить их чувствительность к стандартному (6-8) или расширенному (до 12) спектру антибиотиков.
В результате будет указан не только вид бактерий, но и их количество и реакция на препарат:
Правда у анализа есть и недостатки:
Новое поколение
Потребность медицины в быстром и качественном микробиологическом исследовании «подтолкнула» науку к созданию метода MALDI-TOF MC, удостоенного Нобелевской премии в 2002 году.
Метод основан на идентификации уникального белкового состава бактерий, представляющего собой своего рода «отпечаток пальца». Его точность достигает 98%. А в анализатор заложена информация более чем о 750 видах клинически значимых микроорганизмах, с возможностью «обновления базы данных».
Кроме того, примененеие идентификации MALDI-TOF MC в составе комплексных исследований позволяет проверить чувствительность микрофлоры к 18-20 препаратам, против максимально-возможных 12 у предыдущих «поколениях» посевов. В результате анализа теперь можно увидеть не только эффективность антибиотика, но и подобрать по протоколу минимальную действующую дозу препарата.
Метод полностью автоматизирован, что исключает влияние человеческого фактора на результат. А готовность исследования составляет максимум 4 дня.
2 +4=2
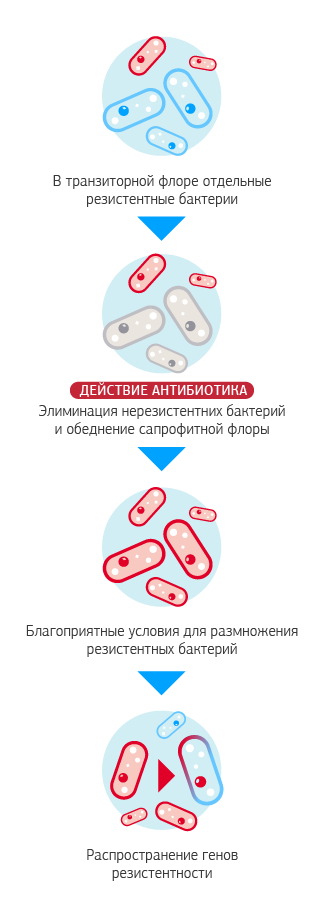
Два типа антибиотикорезистентности
В процессе природного отбора бактерии развили различные приспособительные механизмы. В науке их объединяют термином естественная резистентность.
Появление противомикробных препаратов отрыло новую страницу в истории человечества – развитие хирургии, увеличение рождаемости и продолжительности жизни. Для бактериального мира индустрия противомикробных препаратов открыла новый фронт борьбы за выживание, на котором победителями становятся лидеры развития приобретенной резистентности.
Естественная антибиотикорезистентность
Приобретенная антибиотикорезистентность
Приобретенная антибиотикорезистентность — свойство отдельных штаммов бактерий сохранять жизнеспособность при тех концентрациях антибиотиков, которые подавляют основную часть микробной популяции.
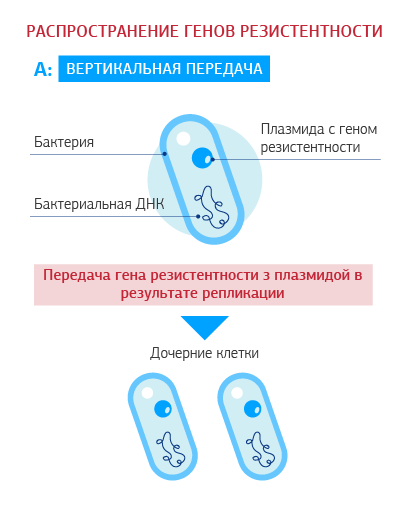
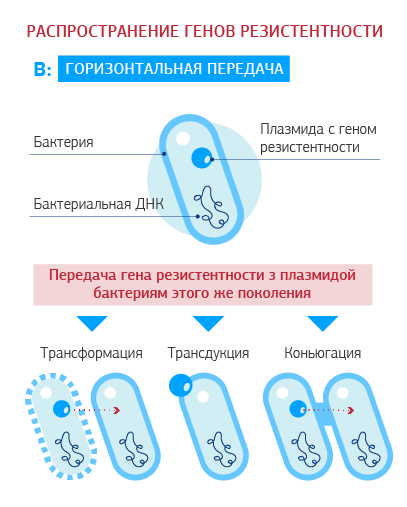
Как распространяется приобретенная резистентность?
Приобретенная антибиотикорезистентность развивается путем формирования мутаций (резистентный клон) или получения измененного генетического материала от других бактерий своего или другого вида (горизонтальное внутри- или межвидовое распространение). Гены резистентности расположены на мобильных элементах – плазмидах (отдельных от хромосомных молекулах ДНК, способных к автономной репликации) или на транспозонах (мобильных ДНК-последовательностях, способных перемещаться в геноме).
2+ 4 =2
Четыре основных механизма развития приобретенной антибиотикорезистентности
Автоматизация микробиологических исследований обеспечивает на только быструю видовую идентификацию широкого спектра возбудителей, но и одновременную оценку антибиотикочувствительности и маркеров резистентности.
Автоматизированный бакпосев в ДІЛА – это возможность определения всех доступных маркеров резистентности:
2+4= 2
Две составляющие эффективного лечения
Например, нечувствительность энтеробактерий к карбапенемам может быть обусловлена:
— снижением проницаемости мембраны и бета-лактамазами со слабой активностью по отношению к карбапенемам (маркери AmpC або CTX-M) – нет горизонтальной передачи генов резистентности, вероятность передачи резистентного клона другим пациентам низка, выживаемость таких бактерий низка.
— экспрессией истинных карбапенемаз (маркеры KPC, IMP, VIM, OXA) – закодированы в плазмидах, активная горизонтальная передача генов резистентности, часто мульти/панантибиотикорезистентны, вероятность передачи резистентного клона другим пациентам или медработникам высока.
МУ 3.5.1.3439-17 Оценка чувствительности к дезинфицирующим средствам микроорганизмов, циркулирующих в медицинских организациях
Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека
3.5.1. ЭПИДЕМИОЛОГИЯ. ДЕЗИНФЕКТОЛОГИЯ. ДЕЗИНФЕКЦИЯ
Оценка чувствительности к дезинфицирующим средствам микроорганизмов, циркулирующих
в медицинских организациях
Методические указания
МУ 3.5.1.3439—17
Оценка чувствительности к дезинфицирующим средствам микроорганизмов, циркулирующих в медицинских организациях: Методические указания.—М.: Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека, 2017.—16 с.
1. Разработаны Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека (Е. П. Игонина), Федеральным бюджетным учреждением науки «Научно-исследовательский институт дезинфектологии» Роспотребнадзора (Н. В. Шестопалов, В. Г. Акимкин, Л. С. Федорова, Н. Н. Левчук, А. С. Белова, А. А. Серов, А. Ю. Скопин), Федеральным бюджетным учреждением науки «Государственный научный центр прикладной микробиологии и биотехнологии» Роспотребнадзора (И. А. Дятлов, М. В. Храмов, И. П. Мицевич, В. Н. Герасимов, Е. В. Детушева П. В. Слукин), Федеральным бюджетным учреждением науки «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора (А. В. Тутельян), ГБУЗ г. Москвы ГКБ № 67 Департамента здравоохранения г. Москвы (О. Е. Орлова).
2. Утверждены Руководителем Федеральной службы по надзору в сфере защиты прав потребителей, Главным государственным санитарным врачом Российской Федерации А. Ю. Поповой 13 марта 2017 года.
© Роспотребнадзор, 2017
Руководитель Федеральной службы
по надзору в сфере защиты прав
потребителей и благополучия человека,
Главный государственный санитарный врач Российской Федерации
3.5.1. ЭПИДЕМИОЛОГИЯ. ДЕЗИНФЕКТОЛОГИЯ. ДЕЗИНФЕКЦИЯ
Оценка чувствительности к дезинфицирующим средствам микроорганизмов, циркулирующих
в медицинских организациях
Методические указания
МУ 3.5.1.3439—17
1. Область применения
1.1. Методические указания устанавливают порядок организации и осуществления оценки чувствительности микроорганизмов, циркулирующих в медицинских организациях, к дезинфицирующим средствам с целью выявления микроорганизмов, устойчивых к дезинфицирующим средствам (далее – ДС), организации и проведения мероприятий по выбору для применения эффективных дезинфицирующих средств.
1.2. Методические указания предназначены для специалистов бактериологических лабораторий, медицинских работников, эпидемиологов и других специалистов медицинских организаций, специалистов Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, иных организаций.
Обязательное проведение дезинфекционных мероприятий в медицинских организациях (далее – МО), наряду с медицинскими, организационными, санитарно-техническими и иными мероприятиями, является важным условием предупреждения возникновения и распространения инфекций, связанных с оказанием медицинской помощи (далее – ИСМП).
В формировании микробиологического пейзажа внутрибольничной среды играют роль более 300 вирусов, бактерий (в основном непатогенных и условно патогенных), грибов, простейших. Более 70 % всех ИСМП вызываются грамотрицательными бактериями.
Длительная циркуляция микроорганизмов в больничной среде приводит к формированию измененных штаммов, характеризующихся не только полиантибиотикорезистентностью (устойчивостью не менее чем к 5—6 антибиотикам), но и устойчивостью к дезинфицирующим средствам.
Своевременное выявление таких микроорганизмов, разработка и реализация адекватных мер реагирования является залогом высокой эффективности мер по предупреждению ИСМП.
Представленная методика определения чувствительности микроорганизмов к ДС при необходимости может быть использована в других организациях.
Все работы с микроорганизмами должны проводиться в соответствии с требованиями СП 1.3.2322—08 илиСП 1.3.3118—13.
3. Организация мероприятий по оценке чувствительности
к дезинфицирующим средствам микроорганизмов, циркулирующих в медицинских организациях
3.1. Мероприятия по оценке чувствительности к ДС микроорганизмов, циркулирующих в медицинских организациях, должны включать:
– эпидемиологический надзор за уровнем и распространенностью ИСМП;
– микробиологическую диагностику ИСМП;
– санитарно-бактериологические исследования объектов внутрибольничной среды;
– оценку чувствительности микроорганизмов к ДС;
– организацию и проведение мер по повышению эффективности дезинфекционных мероприятий.
3.2. Эпидемиологический надзор за уровнем и распространенностью ИСМП осуществляют на основании и в порядке, предусмотренном санитарно-эпидемиологическими нормами и правилами с учетом специфики медицинской организации.
3.3. Микробиологическая диагностика ИСМП и санитарно-бактериологические исследования проводятся в собственной лаборатории МО или привлеченной по договору с целью выявления микроорганизмов, циркулирующих в МО и (или) являющихся возбудителями ИСМП.
3.4. Оценка чувствительности микроорганизмов к дезинфицирующим средствам проводится в соответствии с настоящими методическими указаниями.
3.5. Меры по повышению эффективности дезинфекционных мероприятий включают ротацию ДС, использование ДС, обладающих иным механизмом действия на микробную клетку и/или более широким спектром антимикробного действия по сравнению с ранее применяемыми, а также другие меры.
3.6. Устойчивыми к дезинфицирующим средствам являются штаммы микроорганизмов, не погибающие от воздействия растворов ДС, примененных в режимах дезинфекции (концентрация, время воздействия (экспозиция), способ применения, норма расхода и т. д.), указанных в инструкциях по их применению.
3.7. Оценку чувствительности к ДС следует проводить в отношении микроорганизмов, циркулирующих в МО и являющихся возбудителями ИСМП, в особенности, обусловливающих эпидемические очаги с множественными случаями заболеваний и летальности, применительно к тем ДС, которые используются в МО более шести месяцев. Оценку чувствительности микроорганизмов к ДС необходимо проводить не реже одного раза в шесть месяцев по предварительно составленному графику или по эпидемиологическим показаниям.
3.8. Для диагностики возбудителей ИСМП микроорганизмы выделяют от больных из патологических локусов, выделений, биологических жидкостей.
Для выявления микроорганизмов на объектах окружающей среды (медицинские изделия, поверхности столов, поручни кроватей, дверные ручки, посуда, материал от больных и т. д.) отбирают смывы в палатах, операционных, перевязочных, манипуляционных, родовых залах, столовых, в других помещениях в соответствии с МУК 4.2.2942—11 «Методы санитарно-бактериологических исследований объектов окружающей среды, воздуха и контроля стерильности в лечебных организациях». Каждый последующий отбор проб целесообразно производить в одних и тех же точках.
3.9. Чувствительность микроорганизмов к ДС определяют с использованием тест-объектов, имитирующих те объекты внешней среды, с которых были взяты образцы.
3.10. Обработку тест-объектов проводят по режимам, указанным в Инструкции по применению конкретного ДС, соблюдая все рекомендации: концентрацию, время обеззараживания, способ обработки, норму расхода, температуру рабочего раствора, загрязненность объекта.
3.11. Перед оценкой чувствительности микроорганизма к ДС проводят предварительную идентификацию выделенного микроорганизма до вида любым доступным методом (изучение биохимических, антигенных, фаголитических и других свойств культуры, использование автоматических микробиологических анализаторов и т. д.).
4. Методы оценки чувствительности
к дезинфицирующим средствам микроорганизмов, циркулирующих в медицинских организациях
4.1. Оборудование, расходные материалы, реактивы
4.1.1. Средства измерений
Колбы мерные 2-100-2, 2-250-2, 2-1000-2 ГОСТ 1770—74
Пипетки градуированные 2-го класса точности вместимостью 1,0; 2,0; 5,0; 10 см 3 ГОСТ 29227—91
Цилиндры мерные 2-го класса точности
вместимостью 25 и 50 см 3 ГОСТ 1770—74
Термометр лабораторный шкальный, пределы измерения 0—55 °С ТУ 25-2021.003—88
Примечание. Допускается использование средств измерения с аналогичными или лучшими характеристиками.
4.1.2. Вспомогательные устройства и материалы
Шкаф сушильный стерилизационный, позволяющий поддерживать температуру (160 ± 5) °С ТУ 9452-010-00141798—02
Термостаты, позволяющие поддерживать рабочую температуру (28 ± 2) и (37 ± 2) °С ТУ 9452-002-00141798—97
Автоклав электрический ГОСТ 9586—75
Стерилизаторы паровые медицинские ГОСТ Р ЕН 13060—11,
Дистиллятор ТУ 4952-007-33142130—2000
Облучатель бактерицидный настенный ТУ 9444-015-03965956—08
Холодильник бытовой ГОСТ 26678—85
Микроскоп биологический с иммерсионной системой
Лупа с увеличением ´10 ГОСТ 25706—83
Пробирки типов П1, П2 ГОСТ 25336—82
Спиртовки лабораторные стеклянные ГОСТ 23932—90
Чашки биологические (Петри) ГОСТ 23932—90
Воронки конусные диаметром 40—45 мм ГОСТ 25336—82
Груша резиновая ТУ 9398-005-0576-9082—03
Марля медицинская ГОСТ 9412—77
Вата медицинская гигроскопическая ГОСТ 25556—81
Бумага фильтровальная лабораторная ГОСТ 12026—76
Тест-объекты из различных материалов
размером 5 ´ 5 см
Медицинские тест-изделия (пинцеты,
корнцанги, шпатели, резиновые трубки и др.)
Штативы для пробирок
Марлевые салфетки 5 ´ 5 см
Оптический стандарт мутности № 20, № 10
Перчатки медицинские ГОСТ 32337—13
Биохимические системы идентификации
микроорганизмов или бактериологические
автоматизированные анализаторы
Примечание. Допускается применение вспомогательных устройств и материалов с аналогичными или лучшими техническими характеристиками.
4.1.3. Реактивы и питательные среды
Агар микробиологический ГОСТ 17206—96
Вода дистиллированная ГОСТ 6709—90
Спирт этиловый ректификованный ГОСТ Р 51652—2000 или
натрий хлористый, хч ГОСТ 4233—77
Спирт этиловый технический ГОСТ 17299—78
Ацетон-спиртовая смесь 1 : 1
Водопроводная вода стерильная
Тиосульфатнатрия ГОСТ 27068—86
Сульфонол ТУ 2481-135-07510508—07
Пиросульфит (метабисульфит) натрия ГОСТ 11683—76
Инактивированная лошадиная сыворотка
Набор для окраски по Граму(раствор генциана фиолетового, раствор Люголя, раствор фуксина Циля) ТУ 9398-019-27428909—08
Питательные среды для культивирования
микроорганизмов
Примечание. Допускается использование других питательных сред и препаратов с аналогичными характеристиками.
4.2. Подготовка культуры микроорганизма
4.2.1. Посев и выращивание выделенного штамма микроорганизма
на соответствующей питательной среде
Микроорганизмы культивируют на следующих питательных средах:
– бактерии – на казеиновом бульоне, мясо-пептонном бульоне, казеиновом агаре, мясо-пептонном агаре или других питательных средах, предназначенных для культивирования определенных видов бактерий при температуре 37 °С в течение 18—24 ч;
– M. tuberculosis, нетуберкулезные микобактерии, выделенные от больных и из объектов непосредственно в данном учреждении – на среде Левенштейна-Йенсена, Финна 2 или аналогичной среде при температуре 37 °С в течение 7—28 суток;
4.2.2. Приготовление микробной взвеси
Для приготовления микробной взвеси культуру смывают с агара стерильной водопроводной водой или стерильным физиологическим раствором. Полученную взвесь фильтруют через стерильный ватно-марлевый фильтр и разводят стерильной водопроводной водой или стерильным физиологическим раствором до концентрации
4.3. Приготовление рабочих растворов дезинфицирующих средств
Рабочий раствор готовят с соблюдением мер предосторожности в соответствии с рекомендациями, изложенными в инструкции по применению конкретного средства.
Если дезинфицирующее средство представляет опасность при ингаляционном воздействии, растворы готовят в вытяжном шкафу или в отдельном помещении, оборудованном приточно-вытяжной вентиляцией, с защитой органов дыхания респираторами, кожи рук – резиновыми перчатками, глаз – защитными очками.
4.4. Приготовление нейтрализатора
Для нейтрализации действующего вещества (ДВ), которое может быть перенесено с материалом тест-объекта при его посеве в питательную среду, используют нейтрализатор – вещество, которое устраняет (нейтрализует) действие химического агента на микробную клетку, но не убивает и не задерживает рост тест-микроорганизма. В качестве нейтрализаторов для ДВ из различных химических групп применяют:
– для галоидактивных (хлор-, бром- и йодактивные) и кислородактивных (перекись водорода, ее комплексы с солями, надуксусная кислота, озон) – 0,1—1,0%-е растворы тиосульфата натрия;
– для четвертичных аммониевых солей (алкилдиметилбензиламмоний хлорид, дидецилдиметиламмоний хлорид и др.), аминов, производных гуанидина (полигексаметиленгуанидин гидрохлорид, хлоргексидин биглюконат и др.) – универсальный нейтрализатор, содержащий Твин 80 (3 %), сапонин (0,3—3 %), гистидин (0,1 %), цистеин (0,1 %);
– для альдегидов (глутаровый альдегид, глиоксаль, формальдегид, ортофталевый альдегид) – 1,0%-й раствор пиросульфита (метабисульфита) натрия или универсальный нейтрализатор (см. выше);
– для кислот – щелочи в эквивалентном количестве;
– для щелочей – кислоты в эквивалентном количестве;
– для композиционных средств – универсальный нейтрализатор (см. выше). Если в состав средства входят окислители, в нейтрализатор дополнительно вводят тиосульфат натрия (0,1—1,0 %).
4.5. Выбор тест-объекта, используемого для оценки чувствительности выделенного штамма микроорганизма
Выбор тест-объекта зависит от назначения ДС.
При определении чувствительности выделенного штамма микроорганизма к ДС, предназначенному для обеззараживания поверхностей в помещениях, в качестве тест-объекта используют различные материалы, например, линолеум, кафельную плитку, пластик, стекло, фаянс и др. (не менее 3 видов).
При определении чувствительности выделенного штамма микроорганизма к ДС, предназначенному для обеззараживания медицинских изделий, в качестве тест-объектов используют материалы, из которых изготовлены изделия (стекло, металлы, пластмассы, резины).
При определении чувствительности выделенного штамма микроорганизма к ДС универсального назначения следует выбирать для оценки чувствительности режимы обеззараживания объектов разными способами: способом протирания (например, поверхности) и погружения (например, медицинские изделия).
4.6. Оценка чувствительности выделенного штамма микроорганизма к дезинфицирующим средствам,
предназначенным для обеззараживания поверхностей
4.6.1. Постановка эксперимента
Исследования проводят в микробиологических лабораториях в отдельных боксированных помещениях или боксах биологической безопасности II класса.
При проведении исследований используют тест-объекты размером 5 ´ 5 см из различных материалов, но не менее 3 видов.
В качестве тест-микроорганизма используют микроорганизм, выделенный от больного или с поверхности объекта внутрибольничной среды. Эксперимент проводят после идентификации микроорганизма и проверки чистоты культуры.
Тест-объекты перед контаминацией микроорганизмом подвергают механической очистке – моют водой с мылом и щеткой, затем высушивают при комнатной температуре и автоклавируют. При использовании тест-объектов, не устойчивых к автоклавированию, допускается их обрабатывать фламбированием с помощью смоченного в спирте горящего ватного тампона.
Тест-объект помещают на дно стерильной чашки Петри и располагают на лабораторном столе в микробиологическом боксе или боксах биологической безопасности II класса на поддонах с салфетками, смоченными дезинфицирующим раствором. Пипеткой наносят на них 0,1 мл двумиллиардной микробной взвеси (площадь поверхности 25 см 2 ), равномерно распределяют ее по поверхности стерильным шпателем, не допуская стекания суспензии за пределы тест-объекта, затем подсушивают, приоткрыв чашку Петри (до полного высыхания) при температуре 18—22 °С и относительной влажности 40—60 %, после чего обрабатывают раствором ДС.
Обработку тест-объектов раствором ДС проводят способами протирания или орошения (в зависимости от рекомендаций, изложенных в инструкции по применению средства).
После окончания экспозиции чашки с тест-объектами заливают 10 мл раствора нейтрализатора, соответствующего данному ДС, и делают несколько круговых движений чашкой для лучшего смачивания тест-объекта. Через несколько минут стерильным пинцетом переворачивают тест-объект и повторяют круговые движения. После контакта нейтрализатора с тест-объектом в течение 10 мин снова делают несколько круговых движений чашкой, затем стерильным пинцетом удаляют тест-объект из чашки и сбрасывают его в емкость с дезинфицирующим раствором с целью дальнейшего обеззараживания.
Нейтрализатор из чашки Петри сеют (на 2—3 чашки по 0,1—0,2 мл в каждую) на твердые дифференциально-диагностические питательные среды либо заливают чашку с нейтрализатором растопленным и остуженным до 45 °С агаром. После застывания агара посевы помещают в термостат и культивируют при оптимальной температуре, необходимой для роста данного микроорганизма: для бактерий – при 37 °С до 48 ч; для микобактерий – при 37 °С в течение 21 суток; для грибов рода Candida– при 27 °С до 10 суток. Более длительные сроки культивирования микроорганизмов после воздействия растворов ДС рекомендуются для лучшего восстановления их жизнеспособности и снятия бактериостатического действия.
Контрольные тест-объекты обрабатывают так же, как и опытные, используя вместо дезинфицирующего средства стерильную водопроводную воду.
4.6.2. Учет и оценка результатов
Учет результатов проводят путем оценки остаточной обсемененности поверхностей после обработки раствором дезинфицирующего средства в выбранном режиме. После подсчета количества выросших на чашках Петри колоний рассчитывают плотность контаминации 25 см 2 поверхности и процент обеззараживания, принимая количество колоний, снятых с контрольных поверхностей, за 100 %. Процент обеззараживания рассчитывают по следующей формуле:
Х – процент обеззараживания;
Оп – количество микробных клеток на опытной поверхности;
К – количество микробных клеток на контрольной поверхности.
Пример расчета процента обеззараживания.
С 25 см 2 контрольной поверхности снято 148 000 микробных клеток, а с аналогичного вида опытной поверхности – 20 микробных клеток. Следовательно:
Если гибель микроорганизма на обработанных поверхностях составляет 99,99 % и более, выделенный госпитальный штамм считают чувствительным к действию ДС, если менее 99,99 % – считают устойчивым к данному ДС в исследуемом режиме применения.
Исходя из полученных результатов, выдают рекомендации по дальнейшему использованию ДС для дезинфекции в МО:
– при установлении чувствительности госпитального штамма микроорганизма к действию дезинфицирующего средства в каком-либо из рекомендованных в инструкции по применению средства режимов, средство в данном режиме (режимах) можно применять для обеззараживания поверхностей;
– в том случае, когда установлена устойчивость госпитального штамма микроорганизма к действию дезинфицирующего средства в испытанном режиме применения, данное дезинфицирующее средство следует заменить на другое.
4.7. Оценка чувствительности выделенного штамма микроорганизма к дезинфицирующим средствам, предназначенным для обеззараживания медицинских изделий
4.7.1. Постановка эксперимента
В качестве тест-изделий используют стерильные медицинские изделия из различных материалов (металл, резина, пластмасса, стекло). Перечень медицинских изделий из металл, взятых в эксперимент, должен включать инструменты, имеющие (например, корнцанг) и не имеющие замковых частей (например, пинцеты, шпатели).
В качестве тест-микроорганизма используют выделенный от больного или из объектов внутрибольничной среды штамм микроорганизма.
Изделия размещают в лотке (на поддоне) на лабораторном столе микробиологического бокса или бокса биологической безопасности IIкласса.
На поверхность тест-изделия (у замковых медицинских изделий – в область замка, а при наличии каналов и полостей – также в канал изделия) с помощью пипетки наносят по 0,1 мл одномиллиардной суспензии тест-микроорганизмов, содержащей 40 % инактивированной лошадиной сыворотки, для имитации органического загрязнения. Тест-изделия подсушивают до полного высыхания при температуре 18—22 °С и относительной влажности 40—60 %. Мелкие тест-изделия погружают в указанную взвесь тест-микроорганизма на 15 мин, затем их извлекают и подсушивают при тех же условиях (до полного высыхания). При испытании ДС, обладающих фиксирующими свойствами, количество добавляемой сыворотки составляет не 40, а 5 %, так как в инструкциях по применению таких средств в практических условиях рекомендовано перед дезинфекцией предварительно отмывать изделия от органических загрязнений.
Дезинфицирующие растворы готовят на стерильной водопроводной воде. После подсушивания контаминированные изделия полностью погружают в раствор испытываемого ДС, заполняя им все каналы и полости изделий, избегая образования воздушных пробок. Инструменты, имеющие замковые части, погружают раскрытыми, предварительно сделав ими в растворе ДС несколько рабочих движений для лучшего проникновения раствора в труднодоступные участки изделий в области замка. Толщина слоя раствора ДС над изделиями должна быть не менее 1 см. Параллельно для контроля изделия погружают в стерильную водопроводную воду.
После окончания дезинфекционной выдержки изделия извлекают из дезинфицирующего раствора и марлевой салфеткой размером 5 ´ 5 см, пропитанной нейтрализатором, с поверхности изделия делают смывы, затем салфетку помещают в пробирку с 10 мл того же нейтрализатора и встряхивают с бусами в течение 5—10 мин. Канал изделия промывают раствором нейтрализатора. Для оценки эффективности обеззараживания смывную жидкость с поверхности изделия и из канала засевают на соответствующие питательные среды. Мелкие изделия погружают в раствор нейтрализатора на 5 мин, а затем изделия переносят в пробирки с жидкой питательной средой.
Посевы выдерживают в термостате при температуре, оптимальной для роста тестируемого микроорганизма: для бактерий – при 37 °С до 48 ч; для микобактерий – при 37 °С в течение 21 суток; для грибов рода Candida – при 27 °С до 10 суток. Более длительные сроки культивирования микроорганизмов после воздействия растворов ДС рекомендуются для лучшего восстановления их жизнеспособности и снятия бактериостатического действия.
4.7.2. Учет и оценка результатов
Учет результатов проводят после инкубации посевов в термостате, отмечая наличие или отсутствие роста микроорганизма на питательных средах.
Если гибель тестируемого микроорганизма на изделиях составляет 100 % (отсутствие роста во всех пробах), выделенный госпитальный штамм микроорганизма считают чувствительным к действию дезинфицирующего средства, если менее 100 % (наличие роста в одной или более пробах) – считают устойчивым к данному дезинфицирующему средству в исследуемом режиме применения.
Исходя из полученных результатов, даются рекомендации по дальнейшему использованию дезинфицирующего средства для дезинфекции в МО:
– при установлении чувствительности госпитального штамма микроорганизма к действию ДС в каком-либо из рекомендованных в инструкции по применению средства режимов, средство в данном режиме (режимах) можно применять для обеззараживания медицинских изделий;
– в том случае, когда установлена устойчивость госпитального штамма микроорганизма к действию исследованного режима применения ДС, средство следует заменить на другое.
5. Оформление результатов исследований
Результаты оценки чувствительности выделенного штамма микроорганизма к действию ДС рекомендуется оформлять в виде протокола, в котором указываются следующие положения:
– название организации, проводившей оценку устойчивости ___________
– название выделенного штамма микроорганизма ____________________
– дата выделения штамма микроорганизма _________________________
– источник (объект) и место выделения ____________________________
– объект исследования __________________________________________
– название ДС, к которому определялась устойчивость _______________
– исследованный режим применения (концентрация ДС, экспозиция, норма расхода, способ обработки)
– результат оценки эффективности обеззараживания _________________
– дата проведения исследований __________________________________
Дезинфицирующее средство, к которому выявлена устойчивость микроорганизма, заменяется на другое, отличающееся механизмом действия на микробную клетку, действующее вещество которого относится к другой химической группе, после подтверждения чувствительности к нему данного штамма микроорганизма.
При возникновении трудностей по подбору эффективного дезинфицирующего средства или других проблем по оценке чувствительности выделенный устойчивый штамм микроорганизма, образец дезинфицирующего средства в количестве одной упаковки коммерческого препарата, к которому выявлена устойчивость выделенного штамма, и результаты оценки чувствительности штамма микроорганизма к дезинфицирующему средству рекомендуется передать в ФБУН НИИДезинфектологии Роспотребнадзора для дальнейшего исследования.
Устойчивые к дезинфицирующим средствам штаммы микроорганизмов депонируются в коллекции культур ФБУН НИИ Дезинфектологии Роспотребнадзора и в Государственной коллекции микроорганизмов «ГКПМ Оболенск».
6. Термины и определения
Антибиотикорезистентность – устойчивость возбудителей инфекции к действию одного или нескольких антибиотиков.
Действующее вещество (ДВ) – химическое соединение или биологический агент, обладающие дезинфицирующими свойствами и обеспечивающие целевую эффективность средств, приготовленных на их основе.
Дезинфицирующие средства (ДС) – средства, изделия, предназначенные для дезинфекции.
Инфекции, связанные с оказанием медицинской помощи (ИСМП) – случаи инфекции, связанные с оказанием любых видов медицинской помощи (в медицинских стационарных и амбулаторно-поликлинических, образовательных, санаторно-оздоровительных организациях, организациях социальной защиты населения; при оказании скорой медицинской помощи; помощи на дому и др.), а также случаи инфицирования медицинских работников в результате их профессиональной деятельности.
Инфекции, связанные с оказанием медицинской помощи (ИСМП) – случаи инфекции, связанные с оказанием любых видов медицинской помощи (в медицинских стационарных и амбулаторно-поликлинических, образовательных, санаторно-оздоровительных организациях, организациях социальной защиты населения; при оказании скорой медицинской помощи; помощи на дому и др.), а также случаи инфици-
рования медицинских работников в результате их профессиональной деятельности.
Нейтрализатор дезинфицирующего средства – вещество (смесь веществ), прекращающее действие дезинфицирующего средства.
Устойчивость (резистентность) – сопротивляемость организма (популяции, биоценоза) к воздействию различных факторов (яды, загрязнители, паразиты, болезни). В дезинфектологии – приобретенная устойчивость микроорганизмов к дезинфицирующим средствам.
7. Нормативные ссылки
1. Федеральный закон от 30.03.1999 № 52-ФЗ «О санитарно-эпидемиологическом благополучии населения».
2. ГОСТ Р 56994—16 «Дезинфектология и дезинфекционная деятельность. Термины и определения».
3. СанПиН 2.1.3.2630—10 «Санитарно-эпидемиологические требования к организациям, осуществляющим медицинскую деятельность».
4. СП 1.3.3118—13 «Безопасность работы с микроорганизмами I—II групп патогенности (опасности)».
5. СП 1.3.2322—08 «Безопасность работы с микроорганизмами III—IV групп патогенности (опасности) и возбудителями паразитарных болезней» (с дополнениями и изменениями).
6. СП 1.2.036—95 «Порядок учета, хранения, передачи и транспортирования микроорганизмов I—IV групп патогенности».
7. Национальная концепция профилактики инфекций, связанных с оказанием медицинской помощи (утв. Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации 06.11.2011).
8. Приказ Роспотребнадзора от 20.01.2014 № 34 «О создании Всероссийского научно-методического центра по неспецифической профилактике инфекционных болезней и мониторингу устойчивости биологических агентов к дезинфекционным средствам».
9. Р 4.2.2643—10 «Методы лабораторных исследований и испытаний дезинфекционных средств для оценки их эффективности и безопасности».
10. МУК 4.2.2942—11 «Методы санитарно-бактериологических исследований объектов окружающей среды, воздуха и контроля стерильности в лечебных организациях».