кальцинаты головного мозга у новорожденного
Лейкоэнцефалопатия c церебральной кальцификацией и кистами
Мальчик 10 лет, весом 23 кг, рожденный от неродственного союза (роды прошли без осложнений); жалуется на головные боли пульсирующего характера на протяжении 1 года, преимущественно в лобной и затылочной областях, почти непрерывные; боли усиливались при кашле и мешали пациенту спать и учиться. Мальчик был госпитализирован после обострения головной боли, что сопровождалось неоднократной рвотой и парциальными приступами в виде клонических подергиваний мышц левой половины лица. Объективное исследование не обнаружило отклонений от нормы.
Офтальмолог: не выявлено телеангиэктазий, экссудатов, ретинопатии, атрофии зрительного нерва или каких-либо других патологических признаков. Неврологическое исследование: ребенок в сознании, ориентирован, умеренно повышен мышечный тонус, оживленные глубокие сухожильные рефлексы, нерезко выраженный двусторонний положительный симптом Гордона, а также легкая ригидность мышц шеи и положительный симптом Кернига. Определяются мозжечковые симптомы: дисметрия (нарушение координации движений из-за утраты чувства расстояния, соразмерности и точности движений – прим.авт.), интенционный тремор, атактическая походка.
В анамнезе: туберкулезный лимфаденит в возрасте 2х лет, проводилось лечение противотуберкулезными препаратами.
Общий анализ крови, СОЭ, показатели функции почек и печени, уровни кальция, фосфата в плазме крови, щелочной фосфатазы, рентгенограмма грудной клетки и УЗИ органов брюшной полости были в пределах нормы.
Серологические тесты не подтвердили эхинококкоз, токсоплазмоз, цистицеркоз, криптококкоз, цитомегаловирусную и ВИЧ-инфекцию.
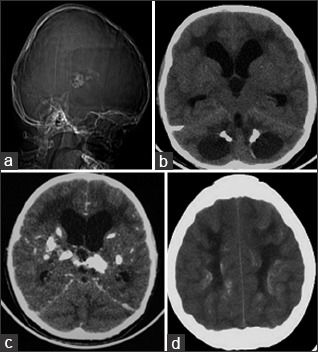
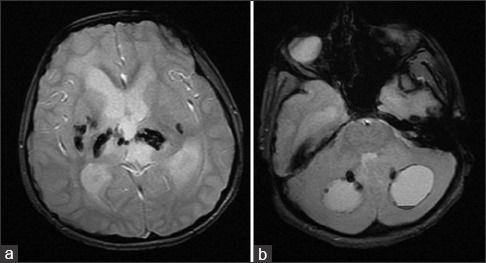
Компьютерная томография показала признаки лакунарного черепа (определялись группы круглых, овальных или пальцевидных вдавлений на внутренней поверхности свода черепа, разделенные ребристыми выростами нормальной костной ткани в самых толстых частях лобной, теменной и верхней затылочной костей – характерный признак внутриутробного повышения внутричерепного давления или нарушения костеобразования – прим.пер.), а также обширные области интракраниальных кальцинатов, которые распространялись билатерально на глубокия* ядра мозжечка, границу белого и серого вещества, таламусы, область базальных ядер и капсулы.
а: на топограмме, которая проводится для разметки сканирования, хорошо видны лакунарный череп и интракраниальные кальцинаты.
b: КТ без контрастного усиления показала двусторонние кальцинаты в зубчатом ядре мозжечка;
с: несимметричная двусторонняя обширная кальцификация в области базальных ядер и внутренней капсулы, таламусов и
d: границы серого и белого вещества
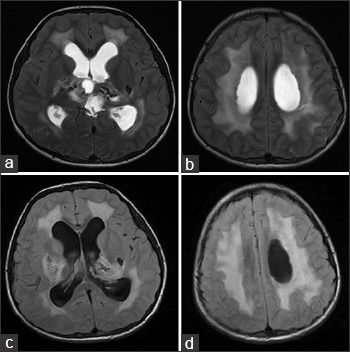
На МРТ головного мозга определялись обширные области гиперинтенсивного в Т2ВИ и FLAIR сигнала, которые затрагивали перивентрикулярные области белого вещества, оставляя интактными U-волокна и мозолистое тело с кистозными включениями и признаками обструктивной гидроцефалии. Обнаруженные ранее на КТ кальцинаты были гипоинтенсивны в Т2- и Т1ВИ и показывали «выпадение» МР-сигнала в GRE.
Клиническая и рентгенологическая картины были классическими для лейкоэнцефалопатии с кальцинатами и кистами (LCC, также называемая синдром Лабруна – прим.авт.), которая осложнилась развитием обструктивной гидроцефалии.
Нейрохирургическая команда рекомендовала установку вентрикуло-перитонеального шунта, но родственники пациента отказались от инвазивных процедур. Пациенту было назначено лечение вальпроевой кислотой и ацетазоламидом, которые давали симптоматический эффект.
Сочетание обширных церебральных кальцинатов, изменений белого вещества мозга и кист были описаны Labrune с соавт. в 1996 году под названием LCC. Это крайне редкое состояние, всего в литературе было описано около 10 случаев; оно встречается у детей и взрослых; время появления симптоматики до 59 лет. Классическая для этой патологии клиника прогрессирующего неврологического дефицита у ребенка предполагает огромный список дифференциальных диагнозов, однако существуют характерные рентгенологические признаки, которые позволяют поставить диагноз почти безошибочно.
При дифференциальной диагностике стоит помнить о таких паразитарных инфекциях, как эхинококкоз, нейроцистицеркоз, криптококкоз.
При нейроцистицеркозе имеются множественные кистозные включения с вариабельной* точечной кальцинацией; желатинозные псевдокисты и паренхиматозные кальцинаты описаны у ВИЧ-инфицированных больных при криптококкозе, однако результаты серологических исследований не подтверждали этих нозологий, тем более, для них не характерны проявления лейкоэнцефалопатии (поражения белого вещества).
У нашего пациента наблюдалось повышенное внутричерепное давление и связанный с кистой масс-эффект, которые являются основными проявлениями LCC.
Данные нейровизуализации тесно связаны с патогенезом. Типично заболевание проявляется двусторонними асимметричными кальцификатами в подкорковых ядрах и ядрах мозжечка, диффузным поражением белого вещества, множественными кистами разного размера с признаками накопления контраста в их стенках, и, изредка, кровотечением в кисты или паренхиму мозга. МР-ангиография обычно без отклонений от нормы, перфузионное исследование определяет гиперперфузию в стенках кист, что вместе с возможными кровотечениями наталкивает на мысль о сосудистых нарушениях.
МР-спектроскопия, которая была проведена в некоторых случаях LCC, не выявила лактата и показала снижение пиков холина и NAA в областях пораженного белого вещества; эти изменения соответствуют содержанию воды в областях лейкоэнцефалопатии, в то время как от демиелинизирующего процесса ожидается высокий уровень холина. Возможно, отек белого вещества мозга связан с нарушениями ГЭБ. При проведении МР-спектроскопии содержимого кист типичных метаболитов для паренхимы мозга в них выявлено не было. При гистологическом исследовании в большинстве случаев обнаруживались волокна Розенталя (также встречающиеся при болезни Александера). Эти волокна, связанные с мутациями в гене, кодирующем глиальный фибриллярный кислый белок. (GFAP) представляют собой цитоплазматические включения в астроцитах, которые содержат белок промежуточной нити GFAP и небольшие белки теплового шока. Накопление волокон Розенталя может препятствовать нормальной функции астроцитов.
Помимо волокон Розенталя, наиболее частыми находками являются бледность миелина, ангиоматозные изменения сосудов мозга, микрокальцинаты и отложения гемосидерина.
Этиология заболевания в настоящее время не ясна. Кроме мутаций в гене GFAP, сообщалось также о связи мутаций в гене SNORD118 с данной нозологией.
Для окончательного подтверждения диагноза может проводиться биопсия, однако в большинстве случаев от этой инвазивной процедуры бывает больше вреда, чем пользы. Потому диагностика и дифференциальная диагностика в большей мере опираются на данные нейровизуализации, на основании данных которой можно сразу отсеять несколько схожих генетически обусловленных патологий.
Так, болезнь Фара, синдром Стерджа-Вебера и MELAS могут обусловливать интракраниальные кальцификаты, но без лейкоэнцефалопатии и кист. Синдром Кокейна представляет собой внутричерепные кальцификаты и диффузную лейкоэнцефалопатию, но без кист. Болезнь Гиппель-Линдау приводит к кистам мозжечка, но без кальцификатов и лейкоэнцефалопатии. Болезнь Александера представляет собой лейкоэнцефалопатию и кисты, но без кальцификации. Метахроматическая лейкодистрофия и адренолейкодистрофия приводят к диффузному поражению белого вещества мозга без кист и кальцификации.
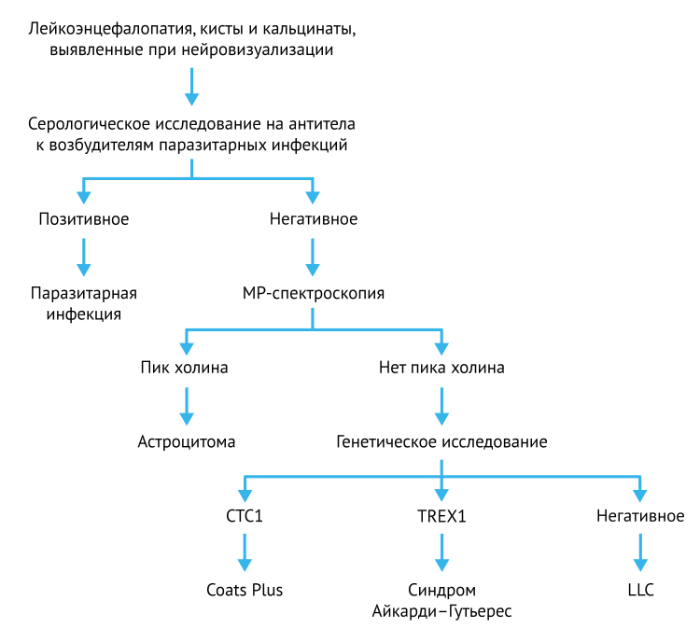
Только LCC, Coats Plus синдром, синдром Айкарди-Гутьера, внутричерепная паразитарная инфекция и некоторые астроцитомы могут проявляться лейкоэнцефалопатией, кальцификатами и кистами. Coats Plus является системным заболеванием, связанным с мутацией гена CTC1. О внутричерепной паразитарной инфекции следует говорить после серологического подтверждения. Синдром Айкарди-Гутьера связан с мутацией TREX1. Астроцитомы предполагают повышение пика холина при МР-спектроскопии.
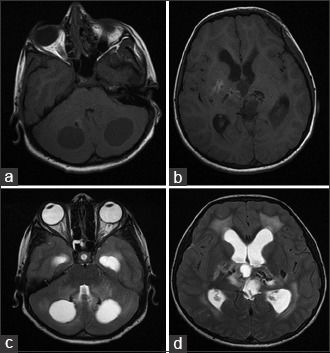
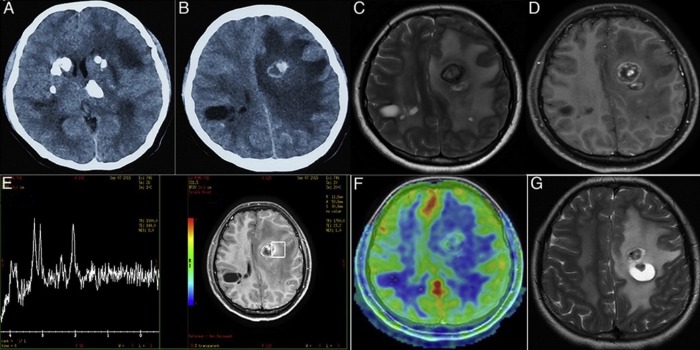
Аксиальные КТ-сканы (A, B) показывают двусторонние кальцинаты в области таламусов и хвостатых ядер, а также множественные кисты в обеих гемисферах мозга. Т2ВИ томограмма (С) показала диффузный патологический МР сигнал от белого вещества при сохранном сером веществе мозга. МРТ после введения контрастного препарата (D) показала, что киста в левой лобной доле демонстрирует неоднородное кольцевидное контрастное усиление.
МР-спектроскопия (E): с нижение пиков NAA и холина в областях измененного белого вещества. Перфузионная МРТ (F) показала гиперперфузию в стенке кисты. Т2ВИ через 5 месяцев после болезни (G): крупная киста левой лобной доли уменьшилась, а меньшая по размеру киста левой лобной доли, наоборот, увеличилась.
Miao Wang и соавт. предложили следующую схему диагностики для случаев сочетания поражения белого вещества с интрацеребральными кальцификатами и кистами.
Источники:
Лечение и реабилитация перинатальных поражений нервной системы у детей первых месяцев жизни
В последние десятилетия, в связи с достижениями новейших медицинских технологий (экстракорпоральное оплодотворение, пролонгирование патологической беременности, реанимация новорожденных), особую актуальность приобрела проблема повышения качества жизни де
В последние десятилетия, в связи с достижениями новейших медицинских технологий (экстракорпоральное оплодотворение, пролонгирование патологической беременности, реанимация новорожденных), особую актуальность приобрела проблема повышения качества жизни детей с перинатальной патологией нервной системы [1, 2, 3]. Существенные нарушения: вначале постнатальной адаптации, затем снижение возможности усвоения социального опыта и, как следствие, социальная дезадаптация ребенка — возникают у большинства детей с тяжелыми поражениями нервной системы. По данным ведущих неврологов [3], эти поражения обусловливают основную часть причин детской инвалидности. Кроме того, у детей с нетяжелыми формами перинатальной патологии в последующие годы нередко отмечаются проявления минимальных церебральных дисфункций, существенно затрудняющих их обучение и образование [2]. Поэтому проблемы своевременного лечения и адекватной реабилитации детей с перинатальными поражениями привлекают пристальное внимание врачей различных специальностей: педиатров, неврологов, ортопедов, реабилитологов и др., — а также специалистов по коррекционной педагогике.
Основные методологические принципы реабилитации детей при перинатальной патологии ЦНС, разработанные за последние 10–12 лет [4], могут также лежать в основе терапии этих состояний, задачи которой как в остром периоде, так и в ходе реабилитации, вторичной профилактики отсроченных проявлений заболевания по сути одни и те же. Тем не менее некоторые неврологи понимают под реабилитацией в детском возрасте абилитацию, т. е. создание возможностей для поступательного развития ребенка и коррекцию постепенно выявляющихся отклонений в развитии [3]. С учетом этого общая методология лечения и реабилитации при перинатальном поражении мозга базируется на следующих принципах.
На каждом из этапов оказания помощи больному новорожденному и грудному ребенку существуют свои ведущие задачи. Так, на первом этапе — в родильном зале, палате интенсивной терапии и отделении реанимации новорожденных — в соответствии с приказом МЗ РФ № 372 от 1995 г. прежде всего решаются задачи компенсации системных нарушений жизненно важных функций — дыхания, кровообращения, выделительной функции почек, энергетического баланса и общего метаболизма.
Медикаментозно-инструментальная терапия предполагает на этом этапе в первую очередь коррекцию кислотно-основного состояния, гипер- или гипогликемии, гиповолемии, артериальной гипотензии или гипертензии, сердечного выброса. По показаниям, с учетом данных мониторирования и лабораторных анализов, применяются осмотические и петлевые диуретики, антигеморрагические, противосудорожные средства (препарат первого выбора — фенобарбитал в стандартной дозе до 20 мг/кг массы тела в сутки). Применение на этом этапе антиоксидантов и ноотрофов (церебропротекторов — пирацетам, эссенциале, ГОМК) не всегда обосновано. Особая осторожность необходима при назначении вазоактивных препаратов: так, некоторые специалисты рекомендуют с 4-го дня жизни инстенон [3], тогда как другие говорят о возможных побочных действиях сосудистых средств [5]. Адекватное лечение в раннем неонатальном периоде (при создании максимально щадящих условий для ребенка и температурного комфорта) способствует адаптационным процессам саногенетической направленности и является основой последующей реабилитации.
Новорожденные не только с тяжелыми, но и со среднетяжелыми проявлениями перинатальной патологии ЦНС переводятся, как правило, в отделение «второго этапа» (отделение патологии новорожденных, отделение для недоношенных детей). Задачи этого этапа — дальнейшая оптимизация адаптационных процессов, лечение сопутствующих (как правило, инфекционно-воспалительных) заболеваний и начало собственно реабилитации, т. е. коррекции неврологических нарушений. Третий этап реабилитации — это специализированные стационары (отделение неврологии раннего возраста, центр реабилитации маловесных и недоношенных детей, центр коррекции), амбулаторные отделения реабилитации детских поликлиник (стационар-замещающие технологии). На всех этапах реабилитации перинатально пострадавших детей необходимо активное участие семьи больного ребенка; по показаниям, в конце первого — начале второго года жизни возможно привлечение специализированных детских дошкольных учреждений (группы коррекции в яслях и детских садах, центры коррекции). На втором и третьем этапах реабилитации используются практически одинаковые средства и методы, хотя выбор их зависит от индивидуального патокинеза болезни и эффективности коррекции на предыдущем этапе.
В практике большинства врачей фармакотерапия при перинатальных поражениях мозга занимает ведущее место, что далеко не всегда оправдано. В последнее десятилетие в условиях «фармацевтического бума» ежегодно появляются новые препараты, которые из области взрослой неврологии часто без достаточной проверки с позиций доказательной медицины попадают в арсенал средств, используемых неонатологом [5, 6, 7]. Назначая новорожденному лекарство, врач должен учитывать его возможные как ближайшие, так и отдаленные побочные эффекты (в том числе риск сенсибилизации), выбирать наименее травматичные пути введения лекарств: при необходимости проведения инъекций предусматривать обезболивание местными анестетиками типа пластыря ЕМLA или метаболитами [4, 6]. Во избежание ятрогений необходимо учитывать возможный синергизм или антагонизм фармакопрепаратов (не назначать более 3–4 лекарств одновременно), строго индивидуально выбирать дозировки (принцип минимизации, контроль индивидуальной фармакокинетики). Особая осторожность нужна при выборе алгоритма лечения глубоко недоношенных детей с экстремально низкой массой тела. Один из путей профилактики ятрогений в неонатологии — это использование гомеопатических препаратов [8], поскольку они содержат микродозы мягкодействующих растительных и минеральных веществ. Механизм действия этих препаратов не вполне ясен (возможны объяснения с позиций теории доминанты Ухтомского или теории биологического резонанса), тем не менее химическая эффективность некоторых из гомеопатических препаратов в неонатологии вполне доказана [4].
Фармакопрепараты, используемые в реабилитации как доношенных, так и недоношенных новорожденных, условно могут быть разделены на применяющиеся посиндромно (симптоматические) и средства преимущественно патогенетической коррекции, хотя некоторые препараты обладают и тем и другим воздействием. Рассмотрим их подробнее.
Медикаментозная реабилитация детей с перинатальными поражениями ЦНС — поздний неонатальный период, начало восстановительного периода
Преимущественно посиндромные (симптоматические) средства: противосудорожные: фенобарбитал, ГОМК, дроперидол, реланиум, вальпроаты — при некупируемых другими средствами судорогах и тщательном мониторинге функций печени и кроветворения; дегидратационные: диакарб (со 2–3-й недель жизни, у глубоконедоношенных — позднее), триампур, верошпирон, гомеопатические препараты (гелиборус, апис, магнезия фосфорика), сборы трав — отвары и настои; седативные (сульфат магния, сборы трав — отвары и настои, лечебные ванны, реланиум, радедорм, гомеопатические препараты — валерианахель, нервохель, вибуркол), эфирные масла, ароматерапия (анис, ромашка, лаванда); спазмолитики и прокинетики (при вегетативных нарушениях): но-шпа, церукал, риабал, мотилиум, гомеопатические препараты (нуксвомика, гомакорд, вибуркол, хапель).
Средства патогенетической направленности: нейропротекторы (ноотропы, ноотрофы, ингибиторы нейрального апоптоза) — пирацетам (ИСВ), кортексин, семакс, минисем, церебролизин, пантогам, глиатилин, глицин, аминокислотные композиты, стволовые клетки; вазоактивные препараты (нормализаторы общей и мозговой гемодинамики) назначаются при отсутствии угрозы кровотечений под контролем допплерографии: кавинтон, циннаризин, сермион, димефосфон, кверцетин, гомеопатические препараты (эскулюс композитум, траумель); модуляторы синаптической проводимости: мидокалм, дибазол; aнтиоксиданты и антигипоксанты: танакан, мексидол, токоферол, соевое масло, кудесан, димефосфон, биолан, актовегин; метаболиты и поливитаминные комплексы: глицин, биотредин, лимонтар, эссенциале, элькар, кудесан, корилип, кверцетин, бета-каротин, киндер биовиталь, поливит беби, церебрум композитум, мульти-табс, капли Береш Плюс.
Как следует из вышеизложенного, выбор препаратов ограничен и нужна поистине «снайперская» точность при их назначении, кроме того, необходим клинический и лабораторный неинвазивный контроль эффективности. Следует обратить внимание на возможность относительно нетравматичного введения препаратов — накожное (соевое масло), ингаляционные (эфирные масла при ароматерапии), ректальные суппозитории (многие гомеопатические средства). В неонатологии важно использование наиболее «чистых» препаратов, например целесообразен выбор из препаратов пирацетама лекарств, выпускаемых фирмой ИСВ (Бельгия, Швейцария). В перечне средств патогенетической направленности к ингибирующим нейральный апоптоз условно отнесены стволовые клетки (в строгом смысле это не фармакопрепарат), степень терапевтической эффективности которых еще нуждается в дальнейших исследованиях. В то же время от использования фетальных трансплантатов [3] следует решительно отказаться по соображениям общечеловеческой и медицинской этики.
Обеспечить минимизацию лекарственной терапии помогает раннее (начиная с первого этапа) включение в программу комплексной реабилитации немедикаментозных воздействий. На втором и третьем этапах реабилитации детей с перинатальной патологией эти методики должны быть признаны приоритетными [1]. Несомненно, в обеспечении успешной реабилитации важная роль принадлежит адекватному вскармливанию и оптимальной организации окружающей среды (лечебно-охранительный режим), но в настоящей статье эти вопросы не рассматриваются. Тем не менее некоторые аспекты организации выхаживания тяжелобольных детей (ограничение сенсорной нагрузки в остром периоде поражения мозга, температурный комфорт, ограничение электромагнитных воздействий, выхаживание на колышащихся матрасиках или на шерсти ягнят) могут быть отнесены к методам немедикаментозной реабилитации [1, 5, 6].
Перечислим средства немедикаментозного лечения и реабилитации, весьма условно разделив их на физические и психолого-педагогические, поскольку любое физическое воздействие на маленького ребенка предполагает обязательный психоэмоциональный контакт с ним.
Немедикаментозная реабилитация детей первого года жизни с перинатальными поражениями ЦНС
Физическая реабилитация: разнообразный лечебный массаж, лечебная гимнастика, лечение «положением» (укладки, туторы, «воротники» и т. д.), терапия по Войту; упражнения в воде и гидромассаж; сухая иммерсия (имитация невесомости); использование кроватки «Сатурн» (эффект невесомости + вибромассаж); физиотерапия (переменное магнитное поле, синусоидальные модулированные токи, электрофорез, парафинотерапия, лазеротерапия, свето- и цветотерапия).
Психолого-педагогическая коррекция и психоэстетотерапия: коррекционная (кондуктивная) педагогика; психотерапевтическая коррекция в диаде «мать–дитя» (контакт «кожа-к-коже», «кенгуру») и в целом в семье больного ребенка; музыкотерапия, эстетотерапия; тактильно-кинестетическая стимуляция.
Большинство из вышеперечисленных методик не являются новыми. В последние 3–5 лет к новым разработкам следует отнести методику мягкого вибромассажа в условиях невесомости (отечественная кроватка «Сатурн», ООО «Ритм», г. Екатеринбург), светотерапию и цветотерапию с помощью лампы линейного поляризованного видимого света «Биоптрон» («Цептер», Швейцария), тактильно-кинестетическую стимуляцию ладоней и пальцев, применяемую у детей с низкой и экстремально низкой массой тела [4]. В последние годы для недоношенных детей особенно рекомендуется сочетание двух-трех «мягких» методов физического воздействия с психоэмоциональной и психосенсорной коррекцией, что помогает моделировать эффект так называемых «сенсорных комнат», применяемых в реабилитации более старших пациентов [9].
Методика музыкотерапии для доношенных и недоношенных новорожденных детей, разработанная в клинике НЦЗД РАМН, включает как подбираемые индивидуально программы, записанные на магнитофон, так и пение кормящих матерей [4]. Матери обучаются комплексной мягкой психосенсорной стимуляции ребенка, напевают колыбельные и другие рекомендованные песни, учатся проведению мелоритмического воздействия (движение и тактильная стимуляция в сочетании с пением и чтением стихов) — элементам эвритмической терапии по Р. Штайнеру, который доказал благотворное влияние на организм ребенка ритмических движений под музыку [10].
В последние годы установлено, что начинать общение с ребенком необходимо еще в период внутриутробного онтогенеза; сегодня активно развивается перинатальная психология и перинатальная педагогика. Для детей с перинатальной патологией ЦНС раннее начало педагогической коррекции (элементы кондуктивной педагогики) является важнейшей составной частью реабилитации, поскольку мягкие сенсорные и эмоциональные воздействия — это немедикаментозные «ноотрофы» для развивающегося мозга [1, 4, 5, 6]. Ежедневное влияние родителей (прежде всего матери) направляется специалистом — психологом (педагогом), который формирует у родителей активную позицию по преодолению психоневрологических дефектов, обучает их разнообразным формам, приемам и средствам взаимодействия с ребенком и умению оценивать его реакции.
Целью ранней педагогической коррекционной работы является создание условий для поступательного психосоциального развития ребенка, для использования его индивидуального «потенциала компенсаций». На каждом возрастном этапе педагог решает определенные развивающие задачи: вначале это стимуляция интереса ребенка к окружающей среде, формирование исследовательского поведения, затем укрепление межанализаторных связей, расширение спектра сенсомоторных навыков и умений, повышение коммутативной активности, развитие и обогащение игровых и предметных действий, а также социальной активности ребенка [11].
В настоящей статье не затрагиваются некоторые специальные аспекты реабилитации (коррекция зрительных нарушений при ретинопатии недоношенных, нейросенсорной тугоухости, ортопедической патологии).
Использование широкого спектра немедикаментозных воздействий на втором и третьем этапах реабилитации больных детей позволяет (по данным клиники НЦЗД РАМН) уменьшить дозировки и длительность курсов фармакотерапии (по вазоактивным препаратам — на 15–20% и 3–3,5 дня; по мочегонным (диакарб) — на 20–30% и 2–3 дня; по седативным препаратам — на 30–40% и 4–5 дней). Эффективность комплексной реабилитации оценивалась в клинике по достижении детьми 1,5–2 лет. Функциональная компенсация неврологических и нейросенсорных нарушений имела место почти у всех детей со среднетяжелыми и легкими формами перинатальных поражений мозга и у 80% детей с тяжелыми (по оценке в периоде новорожденности) нарушениями. Кроме того, даже у детей, имевших в конце периода наблюдения инвалидность вследствие сенсорного или моторного дефекта, удавалось добиться некоторого смягчения моторных или сенсорных расстройств и соответственно несколько улучшить качество жизни.
Е. П. Бомбардирова, доктор медицинских наук, профессор
Г. В. Яцык, доктор медицинских наук, профессор
А. А. Степанов, кандидат медицинских наук
НЦЗД РАМН, Москва
По вопросам литературы обращайтесь в редакцию.