кальцинирование в головном мозге
Болезнь Фара
Болезнь Фара — идиопатическая симметричная кальцификация церебральных структур: подкорковых ганглиев, коры полушарий, мозжечка. Может протекать бессимптомно, клинически проявляется экстрапирамидными расстройствами (гиперкинезами, паркинсонизмом), мозжечковыми нарушениями, интеллектуальным снижением. Диагностируется по данным церебральной КТ при исключении вторичного характера кальцинированных очагов по результатам биохимических, ультразвуковых, ПЦР исследований. Лечение симптоматическое с применением средств, улучшающих тканевый обмен, цитопротекторов, препаратов леводопы, антиконвульсантов.
МКБ-10
Общие сведения
Болезнь Фара включает случаи первичного идиопатического отложения кальция в мозговых структурах, вторичные формы церебрального кальциноза в рамках данной патологии не рассматриваются. Первые подробные описания заболевания сделаны в 1930 году немецким невропатологом К.Т. Фаром. Болезнь Фара является редкой нозологией, распространённость составляет менее 1 случая на 1 млн. населения. Гендерные различия в заболеваемости выражаются соотношением мужчин и женщин 2:1. Патология проявляется в любом возрастном периоде, чаще в 30-60 лет. Прижизненно выявляется лишь в 1-2% случаев, что объясняется наличием бессимптомных вариантов течения, диагностикой заболевания под видом иных нейродегенеративных процессов (болезни Паркинсона, сенильной хореи).
Причины болезни Фара
Патогенез
Формирующие болезнь патогенетические механизмы окончательно не определены. Предполагаются генетически детерминированные сдвиги церебрального метаболизма, становящиеся причиной отложения в мозговых тканях избытков кальция. Выраженная кальцификация подкорковых образований становится причиной дезорганизации лобно-субкортикальной системы, регулирующей произвольные движения и обеспечивающей когнитивные функции (память, мышление, внимание).
Морфологически кальцификаты обнаруживаются симметрично в различных структурах: коре мозга, белом веществе, подкорковых ганглиях, внутренней капсуле, мозжечке, стенках мелких артерий, реже вен. Характерно наличие периваскулярных мелких кальциевых конгломератов. Наиболее массивная кальцификация выявляется в подкорковых отделах. Микроскопически кальцификаты отличаются типичной структурой, представленной нитями толщиной 140-400 мкм. Они зачастую содержат минеральные комплексы с включениями железа, меди, алюминия, фосфора, свинца, цинка, кобальта.
Классификация
В практической неврологии болезнь Фара подразделяется на две клинические формы, отличающиеся возрастом манифестации, типом преобладающей симптоматики:
Симптомы болезни Фара
В типичных случаях болезнь дебютирует появлением утомляемости, неуклюжести движений, шаткости ходьбы, изменений речи, непроизвольных двигательных актов или ночных мышечных спазмов. Основу клинических проявлений составляют экстрапирамидные нарушения. В молодом возрасте это различные гиперкинезы: атетоз — непроизвольные червеобразные движения в пальцах кистей, хореоатетоз — сочетание атетоза с быстрыми насильственными движениями в конечностях, торсионная дистония — тонические мышечные спазмы, придающие телу неестественные позы. У взрослых наблюдается вторичный паркинсонизм: амимия лица, брадикинезия, замедленные скованные движения, шаркающая походка, постуральный тремор.
Симптоматика паркинсонизма зачастую сочетается с мозжечковой атаксией (дискоординация, несоразмерность движений, нистагм), пирамидной недостаточностью (слабость в конечностях, повышенные сухожильные рефлексы, патологические стопные знаки). Возможна дизартрия, дисфагия, недержание мочи. Эпилептические пароксизмы более характерны для ювенильной формы заболевания, могут отмечаться у взрослых.
Сопровождающие болезнь Фара когнитивные нарушения характеризуются снижением памяти на текущие и прошлые события, замедленным мышлением, неустойчивым вниманием, угасанием способности к аналитической и синтетической интеллектуальной деятельности. Прогрессирование расстройств когнитивной сферы у детей приводит к олигофрении, во взрослом возрасте — к развитию корково-подкорковой деменции с элементами агнозии, апраксии, алексии. Однако часть больных ювенильной формой остаются интеллектуально сохранными.
Диагностика
Основным диагностическим методом, позволяющим неврологу достоверно установить наличие очагов кальциноза в мозговых тканях, является КТ головного мозга. Интенсивность очагов на томограммах отражает уровень концентрации кальция. МРТ головного мозга значительно хуже визуализирует кальцификаты, но позволяет оценить сопутствующие дегенеративные процессы. С целью подтверждения идиопатического характера патологии проводится целый ряд дополнительных обследований:
Диагноз болезнь Фара правомочен после исключения вторичного характера церебральной кальцификации, наблюдающейся при эндокринных (гипопаратиреоз, псевдогипопаратиреоз, гипотиреоз), сосудистых (атеросклероз, амилоидоз сосудов), инфекционных (краснуха, цистицеркоз, токсоплазмоз, цитомегалия) заболеваниях. Дифференциальная диагностика проводится также с болезнью Галлервордена-Шпатца, туберозным склерозом.
Лечение болезни Фара
Поскольку патогенез заболевания остаётся неясным, терапия имеет преимущественно симптоматический характер. С целью улучшения обменных процессов применяются стимуляторы тканевого метаболизма (ацетилкарнитин, глютаминовая кислота, комплекс L-цитруллин+малат, никотинамид), цитопротекторы (рибофлавин, янтарная кислота, мельдоний). При симптомах паркинсонизма предпочтительно назначение фармпрепаратов леводопы, при гиперкинезах — холинолитиков, бензодиазепинов. Наличие эпилептических приступов служит показанием к лечению современными антиконвульсантами (леветирацетамом). В комплексной терапии применяется лечебная физкультура, водолечение, когнитивные тренинги.
Прогноз и профилактика
Клинически проявленная болезнь Фара рассматривается как хроническое нейродегенеративное заболевание. Прогноз выздоровления неблагоприятный, однако, при должном уровне поддерживающей симптоматической терапии состояние пациентов длительное время остаётся удовлетворительным. Субклинический вариант не сказывается на здоровье и когнитивных способностях больного, может быть случайной находкой при проведении компьютерной томографии. Специфические меры, позволяющие предупредить развитие болезни, не разработаны.
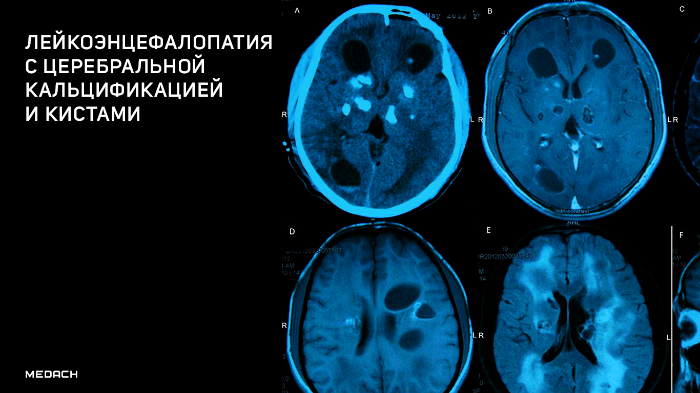
Лейкоэнцефалопатия c церебральной кальцификацией и кистами
Мальчик 10 лет, весом 23 кг, рожденный от неродственного союза (роды прошли без осложнений); жалуется на головные боли пульсирующего характера на протяжении 1 года, преимущественно в лобной и затылочной областях, почти непрерывные; боли усиливались при кашле и мешали пациенту спать и учиться. Мальчик был госпитализирован после обострения головной боли, что сопровождалось неоднократной рвотой и парциальными приступами в виде клонических подергиваний мышц левой половины лица. Объективное исследование не обнаружило отклонений от нормы.
Офтальмолог: не выявлено телеангиэктазий, экссудатов, ретинопатии, атрофии зрительного нерва или каких-либо других патологических признаков. Неврологическое исследование: ребенок в сознании, ориентирован, умеренно повышен мышечный тонус, оживленные глубокие сухожильные рефлексы, нерезко выраженный двусторонний положительный симптом Гордона, а также легкая ригидность мышц шеи и положительный симптом Кернига. Определяются мозжечковые симптомы: дисметрия (нарушение координации движений из-за утраты чувства расстояния, соразмерности и точности движений – прим.авт.), интенционный тремор, атактическая походка.
В анамнезе: туберкулезный лимфаденит в возрасте 2х лет, проводилось лечение противотуберкулезными препаратами.
Общий анализ крови, СОЭ, показатели функции почек и печени, уровни кальция, фосфата в плазме крови, щелочной фосфатазы, рентгенограмма грудной клетки и УЗИ органов брюшной полости были в пределах нормы.
Серологические тесты не подтвердили эхинококкоз, токсоплазмоз, цистицеркоз, криптококкоз, цитомегаловирусную и ВИЧ-инфекцию.
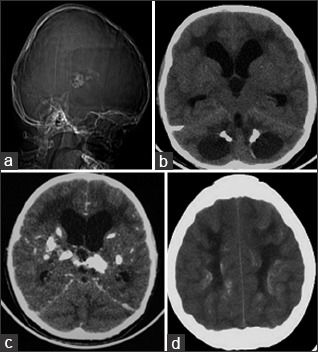
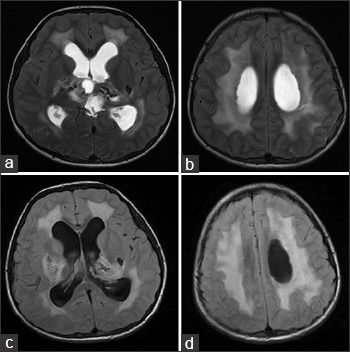
Компьютерная томография показала признаки лакунарного черепа (определялись группы круглых, овальных или пальцевидных вдавлений на внутренней поверхности свода черепа, разделенные ребристыми выростами нормальной костной ткани в самых толстых частях лобной, теменной и верхней затылочной костей – характерный признак внутриутробного повышения внутричерепного давления или нарушения костеобразования – прим.пер.), а также обширные области интракраниальных кальцинатов, которые распространялись билатерально на глубокия* ядра мозжечка, границу белого и серого вещества, таламусы, область базальных ядер и капсулы.
а: на топограмме, которая проводится для разметки сканирования, хорошо видны лакунарный череп и интракраниальные кальцинаты.
b: КТ без контрастного усиления показала двусторонние кальцинаты в зубчатом ядре мозжечка;
с: несимметричная двусторонняя обширная кальцификация в области базальных ядер и внутренней капсулы, таламусов и
d: границы серого и белого вещества
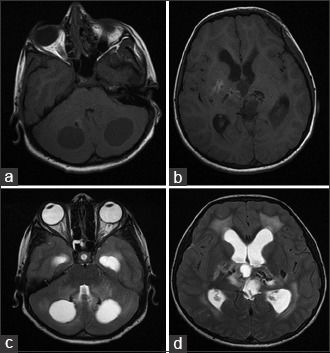
На МРТ головного мозга определялись обширные области гиперинтенсивного в Т2ВИ и FLAIR сигнала, которые затрагивали перивентрикулярные области белого вещества, оставляя интактными U-волокна и мозолистое тело с кистозными включениями и признаками обструктивной гидроцефалии. Обнаруженные ранее на КТ кальцинаты были гипоинтенсивны в Т2- и Т1ВИ и показывали «выпадение» МР-сигнала в GRE.
Клиническая и рентгенологическая картины были классическими для лейкоэнцефалопатии с кальцинатами и кистами (LCC, также называемая синдром Лабруна – прим.авт.), которая осложнилась развитием обструктивной гидроцефалии.
Нейрохирургическая команда рекомендовала установку вентрикуло-перитонеального шунта, но родственники пациента отказались от инвазивных процедур. Пациенту было назначено лечение вальпроевой кислотой и ацетазоламидом, которые давали симптоматический эффект.
Сочетание обширных церебральных кальцинатов, изменений белого вещества мозга и кист были описаны Labrune с соавт. в 1996 году под названием LCC. Это крайне редкое состояние, всего в литературе было описано около 10 случаев; оно встречается у детей и взрослых; время появления симптоматики до 59 лет. Классическая для этой патологии клиника прогрессирующего неврологического дефицита у ребенка предполагает огромный список дифференциальных диагнозов, однако существуют характерные рентгенологические признаки, которые позволяют поставить диагноз почти безошибочно.
При дифференциальной диагностике стоит помнить о таких паразитарных инфекциях, как эхинококкоз, нейроцистицеркоз, криптококкоз.
При нейроцистицеркозе имеются множественные кистозные включения с вариабельной* точечной кальцинацией; желатинозные псевдокисты и паренхиматозные кальцинаты описаны у ВИЧ-инфицированных больных при криптококкозе, однако результаты серологических исследований не подтверждали этих нозологий, тем более, для них не характерны проявления лейкоэнцефалопатии (поражения белого вещества).
У нашего пациента наблюдалось повышенное внутричерепное давление и связанный с кистой масс-эффект, которые являются основными проявлениями LCC.
Данные нейровизуализации тесно связаны с патогенезом. Типично заболевание проявляется двусторонними асимметричными кальцификатами в подкорковых ядрах и ядрах мозжечка, диффузным поражением белого вещества, множественными кистами разного размера с признаками накопления контраста в их стенках, и, изредка, кровотечением в кисты или паренхиму мозга. МР-ангиография обычно без отклонений от нормы, перфузионное исследование определяет гиперперфузию в стенках кист, что вместе с возможными кровотечениями наталкивает на мысль о сосудистых нарушениях.
МР-спектроскопия, которая была проведена в некоторых случаях LCC, не выявила лактата и показала снижение пиков холина и NAA в областях пораженного белого вещества; эти изменения соответствуют содержанию воды в областях лейкоэнцефалопатии, в то время как от демиелинизирующего процесса ожидается высокий уровень холина. Возможно, отек белого вещества мозга связан с нарушениями ГЭБ. При проведении МР-спектроскопии содержимого кист типичных метаболитов для паренхимы мозга в них выявлено не было. При гистологическом исследовании в большинстве случаев обнаруживались волокна Розенталя (также встречающиеся при болезни Александера). Эти волокна, связанные с мутациями в гене, кодирующем глиальный фибриллярный кислый белок. (GFAP) представляют собой цитоплазматические включения в астроцитах, которые содержат белок промежуточной нити GFAP и небольшие белки теплового шока. Накопление волокон Розенталя может препятствовать нормальной функции астроцитов.
Помимо волокон Розенталя, наиболее частыми находками являются бледность миелина, ангиоматозные изменения сосудов мозга, микрокальцинаты и отложения гемосидерина.
Этиология заболевания в настоящее время не ясна. Кроме мутаций в гене GFAP, сообщалось также о связи мутаций в гене SNORD118 с данной нозологией.
Для окончательного подтверждения диагноза может проводиться биопсия, однако в большинстве случаев от этой инвазивной процедуры бывает больше вреда, чем пользы. Потому диагностика и дифференциальная диагностика в большей мере опираются на данные нейровизуализации, на основании данных которой можно сразу отсеять несколько схожих генетически обусловленных патологий.
Так, болезнь Фара, синдром Стерджа-Вебера и MELAS могут обусловливать интракраниальные кальцификаты, но без лейкоэнцефалопатии и кист. Синдром Кокейна представляет собой внутричерепные кальцификаты и диффузную лейкоэнцефалопатию, но без кист. Болезнь Гиппель-Линдау приводит к кистам мозжечка, но без кальцификатов и лейкоэнцефалопатии. Болезнь Александера представляет собой лейкоэнцефалопатию и кисты, но без кальцификации. Метахроматическая лейкодистрофия и адренолейкодистрофия приводят к диффузному поражению белого вещества мозга без кист и кальцификации.
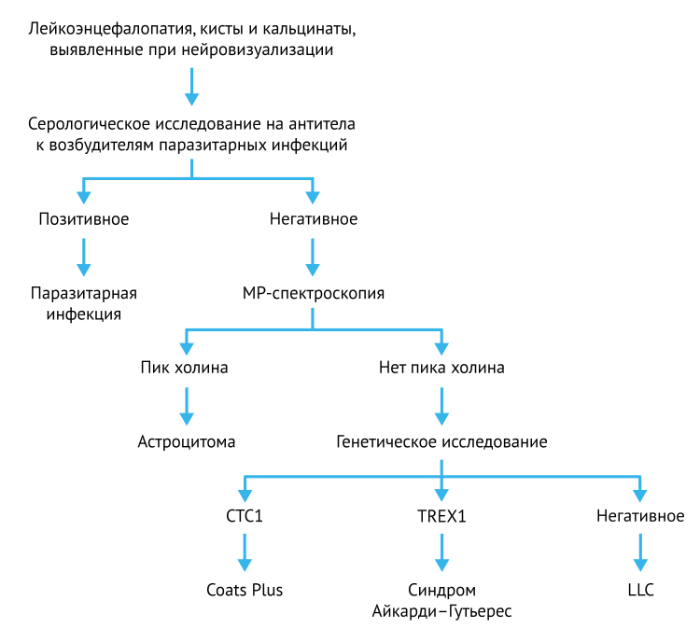
Только LCC, Coats Plus синдром, синдром Айкарди-Гутьера, внутричерепная паразитарная инфекция и некоторые астроцитомы могут проявляться лейкоэнцефалопатией, кальцификатами и кистами. Coats Plus является системным заболеванием, связанным с мутацией гена CTC1. О внутричерепной паразитарной инфекции следует говорить после серологического подтверждения. Синдром Айкарди-Гутьера связан с мутацией TREX1. Астроцитомы предполагают повышение пика холина при МР-спектроскопии.
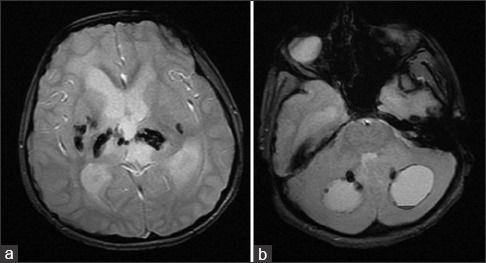
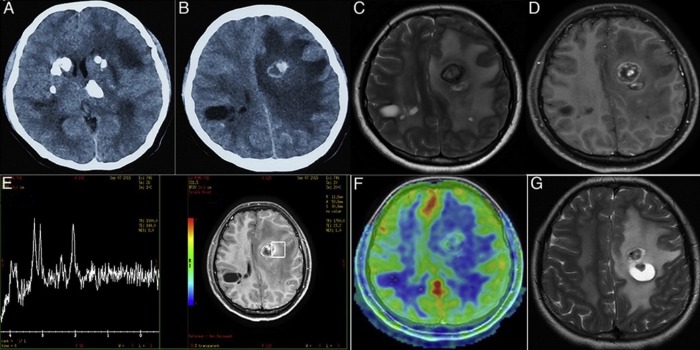
Аксиальные КТ-сканы (A, B) показывают двусторонние кальцинаты в области таламусов и хвостатых ядер, а также множественные кисты в обеих гемисферах мозга. Т2ВИ томограмма (С) показала диффузный патологический МР сигнал от белого вещества при сохранном сером веществе мозга. МРТ после введения контрастного препарата (D) показала, что киста в левой лобной доле демонстрирует неоднородное кольцевидное контрастное усиление.
МР-спектроскопия (E): с нижение пиков NAA и холина в областях измененного белого вещества. Перфузионная МРТ (F) показала гиперперфузию в стенке кисты. Т2ВИ через 5 месяцев после болезни (G): крупная киста левой лобной доли уменьшилась, а меньшая по размеру киста левой лобной доли, наоборот, увеличилась.
Miao Wang и соавт. предложили следующую схему диагностики для случаев сочетания поражения белого вещества с интрацеребральными кальцификатами и кистами.
Источники:
Физиологические интеркраниальные обызвествления
Физиологическая интеркраниальная кальцификация очень распространена, и данная тема хорошо изучена в последние десятилетия. И нтеркраниальная кальцификация связана со старением головного мозга.
Наиболее частая локализация физиологического обызвествления:
Встречается у 2/3 взрослого населения. Количество кальцификации увеличивается с возрастом. Кальцинаты более 1 см в диаметре и обызвествление у детей моложе 9 лет наводят на мысли об новообразовании.
Хабенулярная комиссура играет центральную роль в регуляции лимбической системы. У 15% взрослого населения в виде криволинейного паттерна кальцификации, расположенный кпереди от шишковидного тела, размером не больше нескольких миллиметров.
Очень частая находка у пациентов в возрасте до 40 лет. Обызвествления сосудистых сплетений III и IV желудочков наблюдаются редко.
Кальцификаты в базальных ганглиях — это обычно случайная находка, которая встречается с частотой
1% (диапазон 0.3-1.5%) и чаще встречается у пациентов в пожилом возрасте. Кальцификаты в базальных ганглиях до 30 лет связывают с заболевания метаболического генеза.
Кальцификация выше перечисленных анатомических элементов встречается в 10% случаев у пожилого населения.
Кальцификация каменисто-клиновидной связки связана с возрастной дегенерацией и визуализируется в виде ламинарного или узелкового паттерна.
Кальцификация верхнего сагиттального синуса связана с возрастной дегенерацией и визуализируется в виде ламинарного или узелкового паттерна.
Кальцинирование в головном мозге
Процессы, протекающие в головном мозге, вероятно, относятся к самым сложным для изучения. Патологические изменения, происходящие в его структурах, являются наиболее труднодиагностируемыми, несмотря на наличие современного оборудования и обширных познаний врачей в данной области. Болезнь Фара относится к редким и малоизученным заболеваниям, которые затрагивают преимущественно базальные ганглии, мозжечок и полушария головного мозга.
Болезнь Фара – идиопатическая неатеросклеротическая симметричная интрацеребральная кальцификация коры полушарий, базальных ганглиев и зубчатых ядер мозжечка, связанная с отложением солей кальция и железа в стенках мелких артерий и артериол, а также в вещество головного мозга. Морфологически кальцификаты обнаруживаются симметрично в различных структурах: коре мозга, белом веществе, подкорковых ганглиях, внутренней капсуле, мозжечке, стенках мелких артерий, реже вен [1].
Характерно наличие периваскулярных мелких кальциевых конгломератов. Наиболее массивная кальцификация выявляется в подкорковых отделах. Микроскопически кальцификаты отличаются типичной структурой, представленной нитями толщиной 140–400 мкм [2].
Впервые синдром (или болезнь) Фара был диагностирован в конце 1930 г. немецким врачом-неврологом Карлом Теодором Фаром. Это редкое дегенеративное заболевание, его распространенность составляет, как было сказано ранее, порядка 1 случая на 1 млн населения. При этом мужчины болеют приблизительно в 2 раза чаще.
Разнообразие симптоматики данного заболевания объясняет сложность постановки диагноза. Клинически болезнь может протекать как совершенно бессимптомно, так и с яркими экстрапирамидными нарушениями в виде мышечной ригидности, тремора, судорог, схожими с таковыми при болезни Паркинсона [3, 4]. Для больных характерны гиперкинезы, головокружения, шаркающая походка. Именно схожесть с другими распространенными заболеваниями затрудняет своевременное выявление данной патологии [5, 6].
На современном этапе развития системы здравоохранения с увеличением доступности компьютерной томографии в рутинной неврологической практике диагностика феррокальциноза постепенно увеличивается, однако, по литературным данным, в большинстве случаев обнаружение кальцинатов является находкой, а не диагностической необходимостью.
Этиология болезни Фара установлена не до конца. Возможными причинами считают гормональные нарушения при патологии щитовидной и паращитовидной желез, что ведет к дисбалансу ионов кальция и фосфора: чаще всего – первичный или вторичный гиперпаратиреоз, реже – псевдогиперпаратиреоз при продукции паратгормона опухолевой тканью (при бронхогенном раке, раке молочной железы); при локализации опухоли в костной ткани (множественная миелома, метастазы в кости). Еще одним из механизмов возникновения предполагают дыхательный алкалоз, компенсируемый фосфатной буферной системой: внутриклеточная концентрация фосфатов увеличивается, в то время как в плазме крови возникают относительная гиперкальциемия и абсолютная гипофосфатемия [7, 8].
Указывается, что гипоксия мозга при гипертонической болезни и атеросклерозе церебральных артерий может приводить к локальному увеличению концентрации ионов кальция в веществе мозга и вызывать петрификацию нейронов базальных ганглиев, но, по мнению авторов, данная гипотеза является исключительно теоретической, а на практике – безосновательной.
Также предполагают возможность генетического характера патологии с локализацией нарушений в четырнадцатой (локус 14q13), второй (локус 2q37) хромосомах, хромосомном участке q21.1-q11.23 восьмой хромосомы. Были установлены варианты, когда болезнь наследовалась аутосомно-доминантным и Х-сцепленным путем [9]. Важно отметить, что имели также место и случаи, в которых семейный характер патологии не прослеживался.
Имеется описание дебюта болезни Фара у пациентки на фоне пневмонии, вызванной SARS-CoV-2 (COVID-19) [10].
Диагностировать болезнь Фара позволяет проведение биохимического анализа крови. Производятся определение электролитов крови: кальция, фосфора, железа, натрия; определение уровня паратгормона; ПЦР-исследования для выявления токсоплазмы, цитомегаловируса и других инфекционных агентов, способных вызывать воспалительные изменения тканей мозга с образованием кальцификатов.
Ключевое значение в диагностике болезни Фара имеют инструментальные методы исследования – УЗИ щитовидной и паращитовидных желез, компьютерная томография и рентгенография.
Лечение заболевания проводят только симптоматически. При симптомах паркинсонизма назначают предшественники дофамина (леводопу), при гиперкинезах – холинолитики (циклодол), в случае эпилептических состояний – барбитураты (фенобарбитал) и бензодиазепины (феназепам, лоразепам, клоназепам). С целью улучшения обменных процессов применяют стимуляторы тканевого метаболизма (глютаминовую кислоту, никотинамид), цитопротекторы (рибофлавин, янтарную кислоту).
В работе нами был проанализирован случай диагностики болезни Фара по результатам аутопсии. Пациентка женского пола М., 1949 года рождения, поступила в ГБУЗ СГКБ № 1 им. Н.И. Пирогова с жалобами на общую слабость, головокружение, мышечные спазмы, тошноту, рвоту, повышенную температуру. При поступлении состояние средней тяжести. При осмотре кожные покровы бледные, видимые слизистые физиологической окраски, зев гиперемирован. Дыхание везикулярное, ЧДД – 12 в минуту, ЧСС – 79 в минуту, пульс ритмичный, АД – 135/75 мм рт. ст., температура 37,4°C. Пациент в сознании, на контакт идет, внимание рассеянное, лицо симметричное, походка неуверенная, наблюдается тремор верхних конечностей. В отделении проведено обследование в полном объеме.
Результаты анализов на ВИЧ, гепатиты B и C отрицательны. В общем анализе крови отклонений от нормы не выявлено. В ходе биохимического анализа крови обнаружены следующие изменения: гипергликемия (глюкоза – 9,2 ммоль/л), гиперкальциемия (кальций – 3,1 ммоль/л), гипокалиемия (калий – 3,2 ммоль/л).
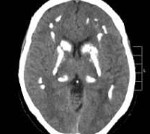
Компьютерная томография головного мозга: геморрагический инсульт в области базальных ядер справа и слева, двусторонняя симметричная кальцификация базальных ганглиев, таламусов, зубчатых ядер и белого вещества больших полушарий.
Макроскопическая картина центральной нервной системы по результатам аутопсии
Кости свода и основания черепа целые. Твердая мозговая оболочка не напряжена, гладкая, сероватая. Мягкая мозговая оболочка отечная, полнокровная. Полушария мозга симметричны. Мозг весом 1410 г. Борозды незначительно углублены. Сосуды основания мозга с единичными атеросклеротическими бляшками на интиме, стенозирующими просвет до 20%. В области базальных ядер головного мозга справа – участок дрябловатой ткани мозга диаметром 1 см с единичными кровоизлияниями диаметром до 1 мм. Выражено полнокровие мелких сосудов. Желудочки мозга незначительно расширены, эпендима гладкая, в просвете прозрачный ликвор. На миндалинах мозжечка следы давления краев большого затылочного отверстия. Во всех других отделах анатомический рисунок строения вещества головного мозга хорошо выражен, с четкой границей и обычным соотношением серого и белого вещества. Ткань мозга на разрезе влажная, блестящая; в области базальных ядер – издает характерный хруст – звон.
Гистологическое исследование головного мозга
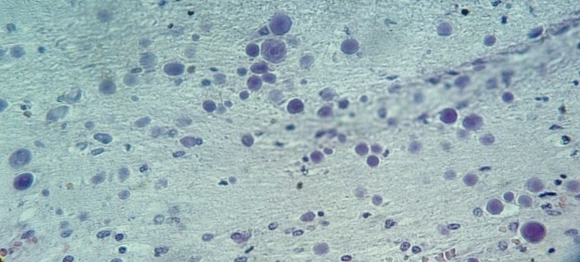
В микропрепарате коры головного мозга – многочисленные зернистые шары (рис. 1).
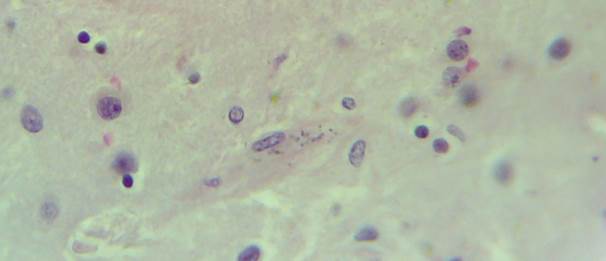
В микропрепаратах базальных ганглиев – неравномерное кровенаполнение, диапедезные кровоизлияния вокруг сосудов (рис. 2А), умеренный периваскулярный и перицеллюлярный отек (рис. 2А-Б).
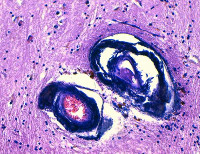
Стенки сосудов деформированные (рис. 3А), со множественными консолидированными (рис. 3А) и пылевидными (рис. 3Б) кальцинатами в виде концентрических преимущественно равномерно распределенных колец между адвентицией, средней оболочкой и пограничной мембраной глии.
Рис. 1. Препарат коры головного мозга пациента женского пола, страдавшего болезнью Фара, умершего от геморрагического инсульта. Многочисленные зернистые шары. Окраска гематоксилин-эозином. Увеличение х200
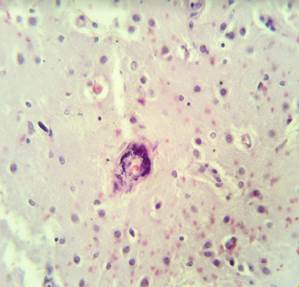
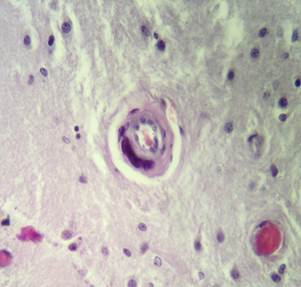
Рис. 2. Препарат базальных ядер пациента женского пола, страдавшего болезнью Фара, умершего от геморрагического инсульта. А – диапедезные кровоизлияния вокруг кальцинированных сосудов с деформированной стенкой, умеренный перицеллюлярный отек. Б – кальцинированный сосуд, умеренный перицеллюлярный и периваскулярный отек. Окраска гематоксилин-эозином. Увеличение х200
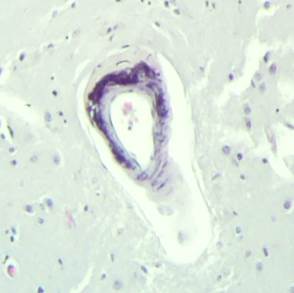
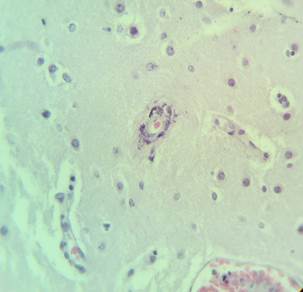
Рис. 3. Препарат базальных ядер пациента женского пола, страдавшего болезнью Фара, умершего от геморрагического инсульта. А – консолидированные кальцинаты в стенке сосуда, выраженный периваскулярный отек. Б – пылевидные кальцинаты в стенке сосуда, умеренный перицеллюлярный и периваскулярный отек. Окраска гематоксилин-эозином. Увеличение х200
Кальцинаты обнаружены в артериях мелкого и среднего калибра, а также в единичных венах (рис. 4А-Б). В веществе мозга и перинейронально имеются кальцинаты в форме различных по размерам глыбок округлой формы (рис. 4Б – крупные кальцинаты, рис. 5 – пылевидные кальцинаты в веществе мозга). Отдельные нейроны кальцинированы.
Со стороны сердечно-сосудистой системы определена концентрическая гипертрофия миокарда (масса сердца 360 г, толщина стенки левого желудочка 1,7 см, правого – 0,4 см, гистологически – гипертрофия мышечных волокон, диффузное разрастание мелких полос соединительной ткани), атеросклероз аорты и ее ветвей, стенозирующий атеросклероз коронарных артерий (III стадия, 3-я степень, стеноз до 30% правой и левой коронарных артерий).
В правом надпочечнике макроскопически определяется округлое образование диаметром 1,2 см, на разрезе равномерного желтовато-оранжевого цвета, гистологически – светлоклеточная аденома надпочечника.
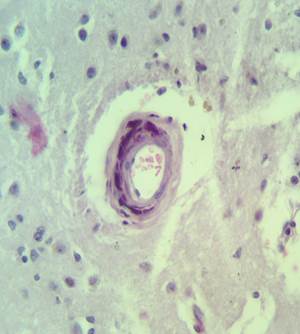
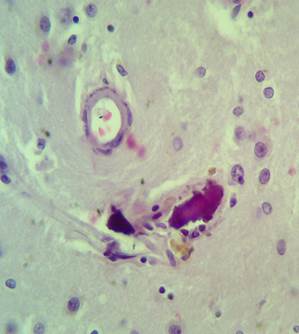
Рис. 4. Препарат базальных ядер пациента женского пола, страдавшего болезнью Фара, умершего от геморрагического инсульта. А – консолидированные и пылевидные кальцинаты в стенке сосуда, выраженный периваскулярный и умеренный перицеллюлярный отек. Б – пылевидные кальцинаты в стенке сосуда, крупный перинейрональный кальцинат, слабый перицеллюлярный и периваскулярный отек. Окраска гематоксилин-эозином. Увеличение х250
Рис. 5. Препарат базальных ядер пациента женского пола, страдавшего болезнью Фара, умершего от геморрагического инсульта. Пылевидные кальцинаты в веществе головного мозга. Окраска – гематоксилин-эозином. Увеличение х400
При анализе данного клинического случая мы склонны считать болезнь Фара и артериальную гипертензию важнейшими сочетанными нозологическими единицами, безусловно повлиявшими на танатогенез. Повышение давления в кальцинированных сосудах мелкого калибра, не обладающих должной эластичностью, приводит к развитию очаговых кровоизлияний.
В связи с разнообразной неспецифической неврологической симптоматикой, а часто и полным отсутствием каких-либо проявлений болезнь Фара остается одним из малоизученных нейродегенеративных заболеваний.
Разработанные и в целом доступные методы диагностики позволяют выявлять феррокальциноз пациентов, однако ограниченность серьезных генетических и лабораторных методов диагностики, низкая приверженность к назначению компьютерной томографии пациентам без клиники острого нарушения мозгового кровообращения объясняют позднюю выявляемость данной патологии; наличие специфической макроскопической и микроскопической картины обусловливает выявление болезни Фара почти исключительно по данным аутопсии.