кальцинированные сосуды головного мозга у грудничка
Лечение и реабилитация перинатальных поражений нервной системы у детей первых месяцев жизни
В последние десятилетия, в связи с достижениями новейших медицинских технологий (экстракорпоральное оплодотворение, пролонгирование патологической беременности, реанимация новорожденных), особую актуальность приобрела проблема повышения качества жизни де
В последние десятилетия, в связи с достижениями новейших медицинских технологий (экстракорпоральное оплодотворение, пролонгирование патологической беременности, реанимация новорожденных), особую актуальность приобрела проблема повышения качества жизни детей с перинатальной патологией нервной системы [1, 2, 3]. Существенные нарушения: вначале постнатальной адаптации, затем снижение возможности усвоения социального опыта и, как следствие, социальная дезадаптация ребенка — возникают у большинства детей с тяжелыми поражениями нервной системы. По данным ведущих неврологов [3], эти поражения обусловливают основную часть причин детской инвалидности. Кроме того, у детей с нетяжелыми формами перинатальной патологии в последующие годы нередко отмечаются проявления минимальных церебральных дисфункций, существенно затрудняющих их обучение и образование [2]. Поэтому проблемы своевременного лечения и адекватной реабилитации детей с перинатальными поражениями привлекают пристальное внимание врачей различных специальностей: педиатров, неврологов, ортопедов, реабилитологов и др., — а также специалистов по коррекционной педагогике.
Основные методологические принципы реабилитации детей при перинатальной патологии ЦНС, разработанные за последние 10–12 лет [4], могут также лежать в основе терапии этих состояний, задачи которой как в остром периоде, так и в ходе реабилитации, вторичной профилактики отсроченных проявлений заболевания по сути одни и те же. Тем не менее некоторые неврологи понимают под реабилитацией в детском возрасте абилитацию, т. е. создание возможностей для поступательного развития ребенка и коррекцию постепенно выявляющихся отклонений в развитии [3]. С учетом этого общая методология лечения и реабилитации при перинатальном поражении мозга базируется на следующих принципах.
На каждом из этапов оказания помощи больному новорожденному и грудному ребенку существуют свои ведущие задачи. Так, на первом этапе — в родильном зале, палате интенсивной терапии и отделении реанимации новорожденных — в соответствии с приказом МЗ РФ № 372 от 1995 г. прежде всего решаются задачи компенсации системных нарушений жизненно важных функций — дыхания, кровообращения, выделительной функции почек, энергетического баланса и общего метаболизма.
Медикаментозно-инструментальная терапия предполагает на этом этапе в первую очередь коррекцию кислотно-основного состояния, гипер- или гипогликемии, гиповолемии, артериальной гипотензии или гипертензии, сердечного выброса. По показаниям, с учетом данных мониторирования и лабораторных анализов, применяются осмотические и петлевые диуретики, антигеморрагические, противосудорожные средства (препарат первого выбора — фенобарбитал в стандартной дозе до 20 мг/кг массы тела в сутки). Применение на этом этапе антиоксидантов и ноотрофов (церебропротекторов — пирацетам, эссенциале, ГОМК) не всегда обосновано. Особая осторожность необходима при назначении вазоактивных препаратов: так, некоторые специалисты рекомендуют с 4-го дня жизни инстенон [3], тогда как другие говорят о возможных побочных действиях сосудистых средств [5]. Адекватное лечение в раннем неонатальном периоде (при создании максимально щадящих условий для ребенка и температурного комфорта) способствует адаптационным процессам саногенетической направленности и является основой последующей реабилитации.
Новорожденные не только с тяжелыми, но и со среднетяжелыми проявлениями перинатальной патологии ЦНС переводятся, как правило, в отделение «второго этапа» (отделение патологии новорожденных, отделение для недоношенных детей). Задачи этого этапа — дальнейшая оптимизация адаптационных процессов, лечение сопутствующих (как правило, инфекционно-воспалительных) заболеваний и начало собственно реабилитации, т. е. коррекции неврологических нарушений. Третий этап реабилитации — это специализированные стационары (отделение неврологии раннего возраста, центр реабилитации маловесных и недоношенных детей, центр коррекции), амбулаторные отделения реабилитации детских поликлиник (стационар-замещающие технологии). На всех этапах реабилитации перинатально пострадавших детей необходимо активное участие семьи больного ребенка; по показаниям, в конце первого — начале второго года жизни возможно привлечение специализированных детских дошкольных учреждений (группы коррекции в яслях и детских садах, центры коррекции). На втором и третьем этапах реабилитации используются практически одинаковые средства и методы, хотя выбор их зависит от индивидуального патокинеза болезни и эффективности коррекции на предыдущем этапе.
В практике большинства врачей фармакотерапия при перинатальных поражениях мозга занимает ведущее место, что далеко не всегда оправдано. В последнее десятилетие в условиях «фармацевтического бума» ежегодно появляются новые препараты, которые из области взрослой неврологии часто без достаточной проверки с позиций доказательной медицины попадают в арсенал средств, используемых неонатологом [5, 6, 7]. Назначая новорожденному лекарство, врач должен учитывать его возможные как ближайшие, так и отдаленные побочные эффекты (в том числе риск сенсибилизации), выбирать наименее травматичные пути введения лекарств: при необходимости проведения инъекций предусматривать обезболивание местными анестетиками типа пластыря ЕМLA или метаболитами [4, 6]. Во избежание ятрогений необходимо учитывать возможный синергизм или антагонизм фармакопрепаратов (не назначать более 3–4 лекарств одновременно), строго индивидуально выбирать дозировки (принцип минимизации, контроль индивидуальной фармакокинетики). Особая осторожность нужна при выборе алгоритма лечения глубоко недоношенных детей с экстремально низкой массой тела. Один из путей профилактики ятрогений в неонатологии — это использование гомеопатических препаратов [8], поскольку они содержат микродозы мягкодействующих растительных и минеральных веществ. Механизм действия этих препаратов не вполне ясен (возможны объяснения с позиций теории доминанты Ухтомского или теории биологического резонанса), тем не менее химическая эффективность некоторых из гомеопатических препаратов в неонатологии вполне доказана [4].
Фармакопрепараты, используемые в реабилитации как доношенных, так и недоношенных новорожденных, условно могут быть разделены на применяющиеся посиндромно (симптоматические) и средства преимущественно патогенетической коррекции, хотя некоторые препараты обладают и тем и другим воздействием. Рассмотрим их подробнее.
Медикаментозная реабилитация детей с перинатальными поражениями ЦНС — поздний неонатальный период, начало восстановительного периода
Преимущественно посиндромные (симптоматические) средства: противосудорожные: фенобарбитал, ГОМК, дроперидол, реланиум, вальпроаты — при некупируемых другими средствами судорогах и тщательном мониторинге функций печени и кроветворения; дегидратационные: диакарб (со 2–3-й недель жизни, у глубоконедоношенных — позднее), триампур, верошпирон, гомеопатические препараты (гелиборус, апис, магнезия фосфорика), сборы трав — отвары и настои; седативные (сульфат магния, сборы трав — отвары и настои, лечебные ванны, реланиум, радедорм, гомеопатические препараты — валерианахель, нервохель, вибуркол), эфирные масла, ароматерапия (анис, ромашка, лаванда); спазмолитики и прокинетики (при вегетативных нарушениях): но-шпа, церукал, риабал, мотилиум, гомеопатические препараты (нуксвомика, гомакорд, вибуркол, хапель).
Средства патогенетической направленности: нейропротекторы (ноотропы, ноотрофы, ингибиторы нейрального апоптоза) — пирацетам (ИСВ), кортексин, семакс, минисем, церебролизин, пантогам, глиатилин, глицин, аминокислотные композиты, стволовые клетки; вазоактивные препараты (нормализаторы общей и мозговой гемодинамики) назначаются при отсутствии угрозы кровотечений под контролем допплерографии: кавинтон, циннаризин, сермион, димефосфон, кверцетин, гомеопатические препараты (эскулюс композитум, траумель); модуляторы синаптической проводимости: мидокалм, дибазол; aнтиоксиданты и антигипоксанты: танакан, мексидол, токоферол, соевое масло, кудесан, димефосфон, биолан, актовегин; метаболиты и поливитаминные комплексы: глицин, биотредин, лимонтар, эссенциале, элькар, кудесан, корилип, кверцетин, бета-каротин, киндер биовиталь, поливит беби, церебрум композитум, мульти-табс, капли Береш Плюс.
Как следует из вышеизложенного, выбор препаратов ограничен и нужна поистине «снайперская» точность при их назначении, кроме того, необходим клинический и лабораторный неинвазивный контроль эффективности. Следует обратить внимание на возможность относительно нетравматичного введения препаратов — накожное (соевое масло), ингаляционные (эфирные масла при ароматерапии), ректальные суппозитории (многие гомеопатические средства). В неонатологии важно использование наиболее «чистых» препаратов, например целесообразен выбор из препаратов пирацетама лекарств, выпускаемых фирмой ИСВ (Бельгия, Швейцария). В перечне средств патогенетической направленности к ингибирующим нейральный апоптоз условно отнесены стволовые клетки (в строгом смысле это не фармакопрепарат), степень терапевтической эффективности которых еще нуждается в дальнейших исследованиях. В то же время от использования фетальных трансплантатов [3] следует решительно отказаться по соображениям общечеловеческой и медицинской этики.
Обеспечить минимизацию лекарственной терапии помогает раннее (начиная с первого этапа) включение в программу комплексной реабилитации немедикаментозных воздействий. На втором и третьем этапах реабилитации детей с перинатальной патологией эти методики должны быть признаны приоритетными [1]. Несомненно, в обеспечении успешной реабилитации важная роль принадлежит адекватному вскармливанию и оптимальной организации окружающей среды (лечебно-охранительный режим), но в настоящей статье эти вопросы не рассматриваются. Тем не менее некоторые аспекты организации выхаживания тяжелобольных детей (ограничение сенсорной нагрузки в остром периоде поражения мозга, температурный комфорт, ограничение электромагнитных воздействий, выхаживание на колышащихся матрасиках или на шерсти ягнят) могут быть отнесены к методам немедикаментозной реабилитации [1, 5, 6].
Перечислим средства немедикаментозного лечения и реабилитации, весьма условно разделив их на физические и психолого-педагогические, поскольку любое физическое воздействие на маленького ребенка предполагает обязательный психоэмоциональный контакт с ним.
Немедикаментозная реабилитация детей первого года жизни с перинатальными поражениями ЦНС
Физическая реабилитация: разнообразный лечебный массаж, лечебная гимнастика, лечение «положением» (укладки, туторы, «воротники» и т. д.), терапия по Войту; упражнения в воде и гидромассаж; сухая иммерсия (имитация невесомости); использование кроватки «Сатурн» (эффект невесомости + вибромассаж); физиотерапия (переменное магнитное поле, синусоидальные модулированные токи, электрофорез, парафинотерапия, лазеротерапия, свето- и цветотерапия).
Психолого-педагогическая коррекция и психоэстетотерапия: коррекционная (кондуктивная) педагогика; психотерапевтическая коррекция в диаде «мать–дитя» (контакт «кожа-к-коже», «кенгуру») и в целом в семье больного ребенка; музыкотерапия, эстетотерапия; тактильно-кинестетическая стимуляция.
Большинство из вышеперечисленных методик не являются новыми. В последние 3–5 лет к новым разработкам следует отнести методику мягкого вибромассажа в условиях невесомости (отечественная кроватка «Сатурн», ООО «Ритм», г. Екатеринбург), светотерапию и цветотерапию с помощью лампы линейного поляризованного видимого света «Биоптрон» («Цептер», Швейцария), тактильно-кинестетическую стимуляцию ладоней и пальцев, применяемую у детей с низкой и экстремально низкой массой тела [4]. В последние годы для недоношенных детей особенно рекомендуется сочетание двух-трех «мягких» методов физического воздействия с психоэмоциональной и психосенсорной коррекцией, что помогает моделировать эффект так называемых «сенсорных комнат», применяемых в реабилитации более старших пациентов [9].
Методика музыкотерапии для доношенных и недоношенных новорожденных детей, разработанная в клинике НЦЗД РАМН, включает как подбираемые индивидуально программы, записанные на магнитофон, так и пение кормящих матерей [4]. Матери обучаются комплексной мягкой психосенсорной стимуляции ребенка, напевают колыбельные и другие рекомендованные песни, учатся проведению мелоритмического воздействия (движение и тактильная стимуляция в сочетании с пением и чтением стихов) — элементам эвритмической терапии по Р. Штайнеру, который доказал благотворное влияние на организм ребенка ритмических движений под музыку [10].
В последние годы установлено, что начинать общение с ребенком необходимо еще в период внутриутробного онтогенеза; сегодня активно развивается перинатальная психология и перинатальная педагогика. Для детей с перинатальной патологией ЦНС раннее начало педагогической коррекции (элементы кондуктивной педагогики) является важнейшей составной частью реабилитации, поскольку мягкие сенсорные и эмоциональные воздействия — это немедикаментозные «ноотрофы» для развивающегося мозга [1, 4, 5, 6]. Ежедневное влияние родителей (прежде всего матери) направляется специалистом — психологом (педагогом), который формирует у родителей активную позицию по преодолению психоневрологических дефектов, обучает их разнообразным формам, приемам и средствам взаимодействия с ребенком и умению оценивать его реакции.
Целью ранней педагогической коррекционной работы является создание условий для поступательного психосоциального развития ребенка, для использования его индивидуального «потенциала компенсаций». На каждом возрастном этапе педагог решает определенные развивающие задачи: вначале это стимуляция интереса ребенка к окружающей среде, формирование исследовательского поведения, затем укрепление межанализаторных связей, расширение спектра сенсомоторных навыков и умений, повышение коммутативной активности, развитие и обогащение игровых и предметных действий, а также социальной активности ребенка [11].
В настоящей статье не затрагиваются некоторые специальные аспекты реабилитации (коррекция зрительных нарушений при ретинопатии недоношенных, нейросенсорной тугоухости, ортопедической патологии).
Использование широкого спектра немедикаментозных воздействий на втором и третьем этапах реабилитации больных детей позволяет (по данным клиники НЦЗД РАМН) уменьшить дозировки и длительность курсов фармакотерапии (по вазоактивным препаратам — на 15–20% и 3–3,5 дня; по мочегонным (диакарб) — на 20–30% и 2–3 дня; по седативным препаратам — на 30–40% и 4–5 дней). Эффективность комплексной реабилитации оценивалась в клинике по достижении детьми 1,5–2 лет. Функциональная компенсация неврологических и нейросенсорных нарушений имела место почти у всех детей со среднетяжелыми и легкими формами перинатальных поражений мозга и у 80% детей с тяжелыми (по оценке в периоде новорожденности) нарушениями. Кроме того, даже у детей, имевших в конце периода наблюдения инвалидность вследствие сенсорного или моторного дефекта, удавалось добиться некоторого смягчения моторных или сенсорных расстройств и соответственно несколько улучшить качество жизни.
Е. П. Бомбардирова, доктор медицинских наук, профессор
Г. В. Яцык, доктор медицинских наук, профессор
А. А. Степанов, кандидат медицинских наук
НЦЗД РАМН, Москва
По вопросам литературы обращайтесь в редакцию.
Кальцинированные сосуды головного мозга у грудничка
Процессы, протекающие в головном мозге, вероятно, относятся к самым сложным для изучения. Патологические изменения, происходящие в его структурах, являются наиболее труднодиагностируемыми, несмотря на наличие современного оборудования и обширных познаний врачей в данной области. Болезнь Фара относится к редким и малоизученным заболеваниям, которые затрагивают преимущественно базальные ганглии, мозжечок и полушария головного мозга.
Болезнь Фара – идиопатическая неатеросклеротическая симметричная интрацеребральная кальцификация коры полушарий, базальных ганглиев и зубчатых ядер мозжечка, связанная с отложением солей кальция и железа в стенках мелких артерий и артериол, а также в вещество головного мозга. Морфологически кальцификаты обнаруживаются симметрично в различных структурах: коре мозга, белом веществе, подкорковых ганглиях, внутренней капсуле, мозжечке, стенках мелких артерий, реже вен [1].
Характерно наличие периваскулярных мелких кальциевых конгломератов. Наиболее массивная кальцификация выявляется в подкорковых отделах. Микроскопически кальцификаты отличаются типичной структурой, представленной нитями толщиной 140–400 мкм [2].
Впервые синдром (или болезнь) Фара был диагностирован в конце 1930 г. немецким врачом-неврологом Карлом Теодором Фаром. Это редкое дегенеративное заболевание, его распространенность составляет, как было сказано ранее, порядка 1 случая на 1 млн населения. При этом мужчины болеют приблизительно в 2 раза чаще.
Разнообразие симптоматики данного заболевания объясняет сложность постановки диагноза. Клинически болезнь может протекать как совершенно бессимптомно, так и с яркими экстрапирамидными нарушениями в виде мышечной ригидности, тремора, судорог, схожими с таковыми при болезни Паркинсона [3, 4]. Для больных характерны гиперкинезы, головокружения, шаркающая походка. Именно схожесть с другими распространенными заболеваниями затрудняет своевременное выявление данной патологии [5, 6].
На современном этапе развития системы здравоохранения с увеличением доступности компьютерной томографии в рутинной неврологической практике диагностика феррокальциноза постепенно увеличивается, однако, по литературным данным, в большинстве случаев обнаружение кальцинатов является находкой, а не диагностической необходимостью.
Этиология болезни Фара установлена не до конца. Возможными причинами считают гормональные нарушения при патологии щитовидной и паращитовидной желез, что ведет к дисбалансу ионов кальция и фосфора: чаще всего – первичный или вторичный гиперпаратиреоз, реже – псевдогиперпаратиреоз при продукции паратгормона опухолевой тканью (при бронхогенном раке, раке молочной железы); при локализации опухоли в костной ткани (множественная миелома, метастазы в кости). Еще одним из механизмов возникновения предполагают дыхательный алкалоз, компенсируемый фосфатной буферной системой: внутриклеточная концентрация фосфатов увеличивается, в то время как в плазме крови возникают относительная гиперкальциемия и абсолютная гипофосфатемия [7, 8].
Указывается, что гипоксия мозга при гипертонической болезни и атеросклерозе церебральных артерий может приводить к локальному увеличению концентрации ионов кальция в веществе мозга и вызывать петрификацию нейронов базальных ганглиев, но, по мнению авторов, данная гипотеза является исключительно теоретической, а на практике – безосновательной.
Также предполагают возможность генетического характера патологии с локализацией нарушений в четырнадцатой (локус 14q13), второй (локус 2q37) хромосомах, хромосомном участке q21.1-q11.23 восьмой хромосомы. Были установлены варианты, когда болезнь наследовалась аутосомно-доминантным и Х-сцепленным путем [9]. Важно отметить, что имели также место и случаи, в которых семейный характер патологии не прослеживался.
Имеется описание дебюта болезни Фара у пациентки на фоне пневмонии, вызванной SARS-CoV-2 (COVID-19) [10].
Диагностировать болезнь Фара позволяет проведение биохимического анализа крови. Производятся определение электролитов крови: кальция, фосфора, железа, натрия; определение уровня паратгормона; ПЦР-исследования для выявления токсоплазмы, цитомегаловируса и других инфекционных агентов, способных вызывать воспалительные изменения тканей мозга с образованием кальцификатов.
Ключевое значение в диагностике болезни Фара имеют инструментальные методы исследования – УЗИ щитовидной и паращитовидных желез, компьютерная томография и рентгенография.
Лечение заболевания проводят только симптоматически. При симптомах паркинсонизма назначают предшественники дофамина (леводопу), при гиперкинезах – холинолитики (циклодол), в случае эпилептических состояний – барбитураты (фенобарбитал) и бензодиазепины (феназепам, лоразепам, клоназепам). С целью улучшения обменных процессов применяют стимуляторы тканевого метаболизма (глютаминовую кислоту, никотинамид), цитопротекторы (рибофлавин, янтарную кислоту).
В работе нами был проанализирован случай диагностики болезни Фара по результатам аутопсии. Пациентка женского пола М., 1949 года рождения, поступила в ГБУЗ СГКБ № 1 им. Н.И. Пирогова с жалобами на общую слабость, головокружение, мышечные спазмы, тошноту, рвоту, повышенную температуру. При поступлении состояние средней тяжести. При осмотре кожные покровы бледные, видимые слизистые физиологической окраски, зев гиперемирован. Дыхание везикулярное, ЧДД – 12 в минуту, ЧСС – 79 в минуту, пульс ритмичный, АД – 135/75 мм рт. ст., температура 37,4°C. Пациент в сознании, на контакт идет, внимание рассеянное, лицо симметричное, походка неуверенная, наблюдается тремор верхних конечностей. В отделении проведено обследование в полном объеме.
Результаты анализов на ВИЧ, гепатиты B и C отрицательны. В общем анализе крови отклонений от нормы не выявлено. В ходе биохимического анализа крови обнаружены следующие изменения: гипергликемия (глюкоза – 9,2 ммоль/л), гиперкальциемия (кальций – 3,1 ммоль/л), гипокалиемия (калий – 3,2 ммоль/л).
Компьютерная томография головного мозга: геморрагический инсульт в области базальных ядер справа и слева, двусторонняя симметричная кальцификация базальных ганглиев, таламусов, зубчатых ядер и белого вещества больших полушарий.
Макроскопическая картина центральной нервной системы по результатам аутопсии
Кости свода и основания черепа целые. Твердая мозговая оболочка не напряжена, гладкая, сероватая. Мягкая мозговая оболочка отечная, полнокровная. Полушария мозга симметричны. Мозг весом 1410 г. Борозды незначительно углублены. Сосуды основания мозга с единичными атеросклеротическими бляшками на интиме, стенозирующими просвет до 20%. В области базальных ядер головного мозга справа – участок дрябловатой ткани мозга диаметром 1 см с единичными кровоизлияниями диаметром до 1 мм. Выражено полнокровие мелких сосудов. Желудочки мозга незначительно расширены, эпендима гладкая, в просвете прозрачный ликвор. На миндалинах мозжечка следы давления краев большого затылочного отверстия. Во всех других отделах анатомический рисунок строения вещества головного мозга хорошо выражен, с четкой границей и обычным соотношением серого и белого вещества. Ткань мозга на разрезе влажная, блестящая; в области базальных ядер – издает характерный хруст – звон.
Гистологическое исследование головного мозга
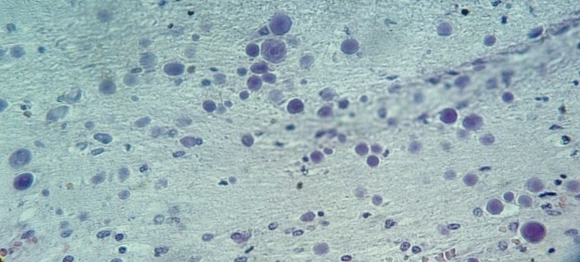
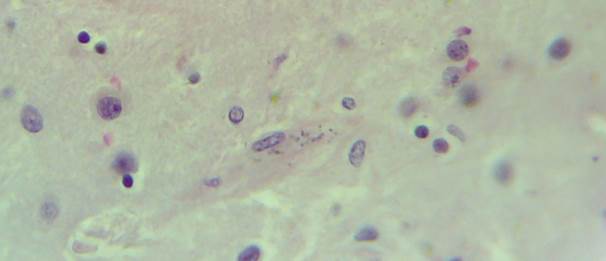
В микропрепарате коры головного мозга – многочисленные зернистые шары (рис. 1).
В микропрепаратах базальных ганглиев – неравномерное кровенаполнение, диапедезные кровоизлияния вокруг сосудов (рис. 2А), умеренный периваскулярный и перицеллюлярный отек (рис. 2А-Б).
Стенки сосудов деформированные (рис. 3А), со множественными консолидированными (рис. 3А) и пылевидными (рис. 3Б) кальцинатами в виде концентрических преимущественно равномерно распределенных колец между адвентицией, средней оболочкой и пограничной мембраной глии.
Рис. 1. Препарат коры головного мозга пациента женского пола, страдавшего болезнью Фара, умершего от геморрагического инсульта. Многочисленные зернистые шары. Окраска гематоксилин-эозином. Увеличение х200
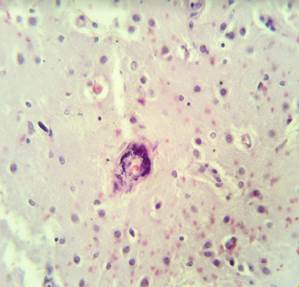
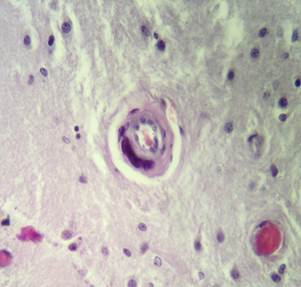
Рис. 2. Препарат базальных ядер пациента женского пола, страдавшего болезнью Фара, умершего от геморрагического инсульта. А – диапедезные кровоизлияния вокруг кальцинированных сосудов с деформированной стенкой, умеренный перицеллюлярный отек. Б – кальцинированный сосуд, умеренный перицеллюлярный и периваскулярный отек. Окраска гематоксилин-эозином. Увеличение х200
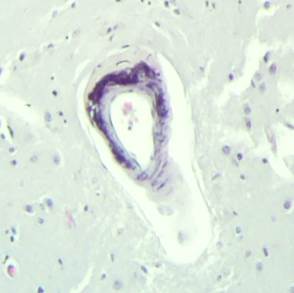
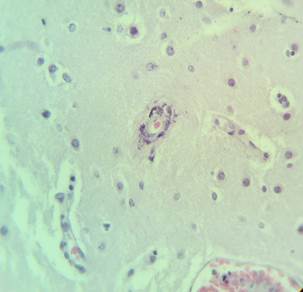
Рис. 3. Препарат базальных ядер пациента женского пола, страдавшего болезнью Фара, умершего от геморрагического инсульта. А – консолидированные кальцинаты в стенке сосуда, выраженный периваскулярный отек. Б – пылевидные кальцинаты в стенке сосуда, умеренный перицеллюлярный и периваскулярный отек. Окраска гематоксилин-эозином. Увеличение х200
Кальцинаты обнаружены в артериях мелкого и среднего калибра, а также в единичных венах (рис. 4А-Б). В веществе мозга и перинейронально имеются кальцинаты в форме различных по размерам глыбок округлой формы (рис. 4Б – крупные кальцинаты, рис. 5 – пылевидные кальцинаты в веществе мозга). Отдельные нейроны кальцинированы.
Со стороны сердечно-сосудистой системы определена концентрическая гипертрофия миокарда (масса сердца 360 г, толщина стенки левого желудочка 1,7 см, правого – 0,4 см, гистологически – гипертрофия мышечных волокон, диффузное разрастание мелких полос соединительной ткани), атеросклероз аорты и ее ветвей, стенозирующий атеросклероз коронарных артерий (III стадия, 3-я степень, стеноз до 30% правой и левой коронарных артерий).
В правом надпочечнике макроскопически определяется округлое образование диаметром 1,2 см, на разрезе равномерного желтовато-оранжевого цвета, гистологически – светлоклеточная аденома надпочечника.
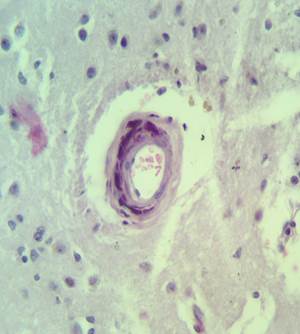
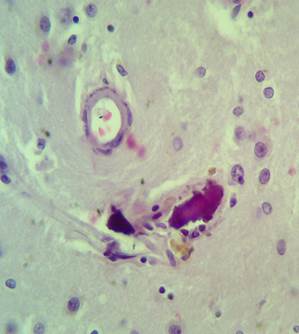
Рис. 4. Препарат базальных ядер пациента женского пола, страдавшего болезнью Фара, умершего от геморрагического инсульта. А – консолидированные и пылевидные кальцинаты в стенке сосуда, выраженный периваскулярный и умеренный перицеллюлярный отек. Б – пылевидные кальцинаты в стенке сосуда, крупный перинейрональный кальцинат, слабый перицеллюлярный и периваскулярный отек. Окраска гематоксилин-эозином. Увеличение х250
Рис. 5. Препарат базальных ядер пациента женского пола, страдавшего болезнью Фара, умершего от геморрагического инсульта. Пылевидные кальцинаты в веществе головного мозга. Окраска – гематоксилин-эозином. Увеличение х400
При анализе данного клинического случая мы склонны считать болезнь Фара и артериальную гипертензию важнейшими сочетанными нозологическими единицами, безусловно повлиявшими на танатогенез. Повышение давления в кальцинированных сосудах мелкого калибра, не обладающих должной эластичностью, приводит к развитию очаговых кровоизлияний.
В связи с разнообразной неспецифической неврологической симптоматикой, а часто и полным отсутствием каких-либо проявлений болезнь Фара остается одним из малоизученных нейродегенеративных заболеваний.
Разработанные и в целом доступные методы диагностики позволяют выявлять феррокальциноз пациентов, однако ограниченность серьезных генетических и лабораторных методов диагностики, низкая приверженность к назначению компьютерной томографии пациентам без клиники острого нарушения мозгового кровообращения объясняют позднюю выявляемость данной патологии; наличие специфической макроскопической и микроскопической картины обусловливает выявление болезни Фара почти исключительно по данным аутопсии.