кальций в мозге человека отложение
Архив
Головной мозг защищен от влияния различных токсических факторов гематоэнцефалическим барьером. Исключением остаются базальные ганглии, чувствительные к нарушениям обмена минералов, которые вызывают ряд заболеваний. Примерами являются накопление меди при болезни Вильсона, железа — при болезни Галленвордена-Шпатца, органической ртути — при болезни Минамата и марганца — при токсическом паркинсонизме. Кальцификация базальных ганглиев и других подкорковых ядер лежит в основе большой клинической проблемы, связанной со многими неврологическими нарушениями. Данная статья является коротким обзором актуальных знаний по этому “нейрорадиологическому” заболеванию.
В 1850 году Delacour впервые описал сосудистые кальцификаты в базальных ганглиях 56-летнего мужчины с клиническими признаками ригидности мышц нижних конечностей и тремора. Он умер от острого заболевания, проявлявшегося тяжелой диареей, гипотензией и комой. Патоморфологическое исследование засвидетельствовало наличие двусторонней кальцификации головного мозга и склероза. Bamberger в 1855 году описал гистопатологические изменения в виде кальцификации мелких мозговых сосудов у женщины с задержкой психического развития и судорогами. В 1930 году Fahr описывает 81-летнего пациента с длительной деменцией, госпитализированного с лихорадкой, кашлем, пролежнями, “обездвиживанием без паралича”, умершего через 3 дня. На вскрытии кора выглядела уплотненной, гранулярной, желудочки были заполнены серозной жидкостью, к тому же имела место кальцификация полукружного центра и стриатума. Имя данного ученого ассоциировалось со всеми формами двусторонней кальцификации базальных ганглиев и других отделов головного мозга, несмотря на тот факт, что не он первый описал указанную патологию. Так, Fritzsche впервые зафиксировал рентгенологические признаки последнего в 1935 году. Существует множество терминов (около 35) вышеописанной болезни, что создает ощутимую путаницу (табл. 1).
| Год | Описательный термин |
|---|---|
| 1939 | Симметричная церебральная кальцификация |
| 1951 | Кальцификация полосатого тела и зубчатых ядер |
| 1954 | “Идиопатическая” кальцификация мозговых капилляров |
| 1957 | Симметричная (или семейная) кальцификация базальных ганглиев |
| 1960 | Семейная идиопатическая кальцификация головного мозга |
| 1961 | Идиопатическая неатеросклеротическая кальцификация мозговых сосудов |
| 1964 | Семейная двусторонняя сосудистая кальцификация ЦНС |
| 1968 | Кальцификация стриопаллидозубчатой системы |
| 1969 | Идиопатический семейный цереброваскулярный феррокальциноз |
| 1976 | Симметричная кальцификация стволовых ганглиев |
| 1982 | Синдром Фара |
| 1983 | Прогрессирующий идиопатический стриопаллидозубчатый кальциноз |
| 1985 | Симметричный внутричерепной прогрессирующий псевдокальциноз |
| 1997 | Идиопатическая кальцификация базальных ганглиев |
Несмотря на массовое использование, термин “болезнь Фара” является неверным, поскольку кальцификаты при этом формируются преимущественно в зубчатых ядрах и базальных ганглиях. Наиболее адекватным остается термин “двусторонний стриопаллидозубчатый кальциноз” (ДСПЗК).
Патоморфологические исследования свидетельствуют, что кальций является главным элементом, предопределяющим рентгенологические признаки заболевания. В образцах тканей выявляются также следы мукополисахаридов, алюминия, мышьяка, кобальта, меди, молибдена, железа, свинца, марганца, магния, фосфора, серебра и цинка. Кальций и другие минералы откладываются в стенках капилляров, артериол, мелких вен и периваскулярных пространствах. Имеются сообщения о нейрональной дегенерации и глиозе вокруг указанных отложений. Электронная микроскопия свидетельствует о наличии минеральных элементов в перицитах.
Хотя патологический процесс при ДСПЗК в деталях не изучен, предполагается, что гиперинтенсивность на МРТ в Т2-режиме отражает медленно-прогрессирующий метаболический или воспалительный процесс ткани головного мозга, впоследствии подвергающийся кальцификации с клиническими проявлениями. Также считается, что накопление железа и кальция является реакцией на внесосудистое отложение комплексов кислых мукополисахаридов — щелочного белка. Результаты МРТ позволяют предполагать, что нарушения со стороны сосудистой мембраны приводят к выходу плазмы за пределы кровеносного русла с последующим поражением нейропиля и отложением минералов.
Точные причины накопления кальция именно в базальных ганглиях не известны, при этом в данных структурах аккумулируются многие другие неминеральные вещества, например билирубин при ядерной желтухе новорожденных и МРТР, а также монооксид углерода при токсическом паркинсонизме.
3. КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ
ДСПЗК представляет собой редкое заболевание. Клиническую диагностику осложняет целый ряд факторов. Симптомы, упоминающиеся в литературе, базируются на единичных клинических сообщениях. Их анализ в сочетании с данными регистров засвидетельствовал, что из 99 лиц с явными накоплениями кальция у 67 лиц в возрасте 47 ± 15 лет присутствовала симптоматика, а 32 пациента в возрасте 32 ± 20 лет являлись бессимптомными. Соотношение больных мужчин и женщин составляет 2 : 1. К наиболее распространенным проявлениям ДСПЗК относятся двигательные нарушения (55%), половина которых представлена паркинсонизмом, в остальных случаях наблюдаются гиперкинезы (хорея, тремор, дистония, атетоз, орофациальная дискинезия). Когнитивные расстройства являются вторым по распространенности синдромом, за ним следуют мозжечковые симптомы и нарушения речи. Нередко наблюдается сочетание различных клинических единиц, например гипокинезий, когнитивных нарушений и церебеллярных симптомов. Другие неврологические микросимптомы включают пирамидные нарушения, психиатрические расстройства, нарушения походки и чувствительности, а также боль.
4. НЕЙРОФИЗИОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ
ЭЭГ, исследование невральной проводимости и зрительные вызванные потенциалы при ДСПЗК, как правило, нормальные. Стволовые слуховые вызванные потенциалы демонстрируют незначительные отклонения, например, межпиковую латентность между волнами I и V и усиленную латентность волны V. Соматосенсорные потенциалы, как правило, без изменений.
5. НЕЙРОРАДИОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ
До начала эры КТ инструментальные исследования при данном заболевании включали рентгенографию черепа либо аутопсию. Благодаря появлению томографии количество таких наблюдений резко возросло. В случае ДСПЗК более чувствительным диагностическим методом является КТ, чем МРТ. При анализе большого количества снимков (19 080 в 3 исследованиях) оказалось, что частота кальцификации базальных ганглиев колеблется в диапазоне 6–7,49 на 1000 лиц. Большинство таких изменений весьма незначительны и ограничиваются бледным шаром, в других зонах мозга они наблюдаются редко. В целом, чаще всего поражаются базальные ганглии, зубчатое ядро, таламус и полукружный центр. Специфических изменений, типичных для конкретной подгруппы в популяции больных, не выявлено. В одном из исследований содержание кальция измерялось с помощью КТ у 31 больного, при этом разности между полушариями не отмечалось. Средняя общая площадь кальцификации составляла в базальных ганглиях 1,39 ± 0,28 см 2 ; таламусе — 0,26 ± 0,05 см 2 ; зубчатом ядре — 1,02 ± 0,35 см 2 ; полукружном центре — 0,64 ± 0,22 см 2 (в целом — 3,16 ± 0,64 см 2 ). Также не было обнаружено каких-либо отличий в степени кальцификации между группами симптомных и бессимптомных пациентов, молодых больных и лиц постарше.
Однофотонная эмиссионная компьютерная томография с меченым изотопом засвидетельствовала двусторонний дефицит кровоснабжения в базальных ганглиях и коре больших полушарий при ДСПЗК. Позитронно-эмиссионная томография с флуородопой не засвидетельствовала достоверной разности между больными лицами и группой контроля.
Клинические проявления болезни могут широко варьировать. Диагноз подтверждается нейровизуализационными методиками после исключения нарушений обмена кальция и пороков развития. Несмотря на широкую доступность КТ или МРТ и частые случайные находки отложений кальция в подкорковых ядрах у бессимптомных пациентов, ДСПЗК остается редким заболеванием. Если паркинсонизм сочетается с деменцией и мозжечковыми симптомами, то КТ головного мозга остается важнейшим диагностическим инструментом, поскольку вышеописанное заболевание часто сопровождается вышеупомянутыми нарушениями. Главной проблемой в дифференциальной диагностике остается гипопаратиреоз. Определение кальция и паратгормона сыворотки помогает отличить гипопаратиреоз от ДСПЗК, если при томографии визуализируется двусторонняя кальцификация стриопаллидозубчатых структур. Другие возможные причины подобных изменений ткани головного мозга представлены в таблице 2.
| СТРИОПАЛЛИДОЗУБЧАТЫЙ КАЛЬЦИНОЗ | |
|---|---|
| Первичный | Аутосомно-доминантный Семейный Спорадический |
| Вторичный | |
| Эндокринный | Гипопаратиреоз Псевдогипопаратиреоз Псевдо-псевдогипопаратиреоз Гиперпаратиреоз |
| Врожденный | Синдром Кокейна Синдром микроцефалии, демиелинизации и стриопаллидозубчатой кальцификации |
| Ревматологический | Системная красная волчанка |
| Токсический | Плюмбизм |
| ДВУСТОРОННИЙ СТРИОПАЛЛИДАРНЫЙ КАЛЬЦИНОЗ (“КАЛЬЦИНОЗ БАЗАЛЬНЫХ ГАНГЛИЕВ”) | |
| Физиологический | У лиц старше 50 лет |
| Врожденный | Ангиоматозная мальформация с аневризмой галеновой вены Синдром Дауна Синдром Кирнза-Сейри |
| Дегенеративный | Диффузная церебральная микроангиопатия Гиперкинетический мутизм Болезнь Коутса |
| Генетический | Недостаточность биотинидазы Недостаточность карбоангидразы II (остеопетроз, почечный тубулярный ацидоз и кальцификация базальных ганглиев) Синдром COFS с семейной транслокацией 1;16 Липомембранозная поликистозная остеодисплазия Тапеторетинальная дегенерация |
| Инфекционный | СПИД Активная инфекция, вызванная вирусом Эпштейна-Барра Менингоэнцефалит Паротитный энцефалит |
| Метаболический | Недостаточность дигидроптеридинредуктазы Синдром MELAS Постгипоксические и постишемические состояния |
| Неопластический | Острая лимфоцитарная лейкемия |
| Физический | Лучевая терапия |
| Токсический | Отравление монооксидом углерода |
| ДВУСТОРОННЯЯ КАЛЬЦИФИКАЦИЯ МОЗЖЕЧКА | |
| Первичная | Идиопатическая |
| Вторичная | |
| Инфекционная | Сифилис |
| Сосудистая | Гематома |
Перечисленные заболевания сопровождаются также рядом других неврологических симптомов. Минимальный возраст, в котором отрицательные результаты КТ позволяют с уверенностью исключить ДСПЗК, неизвестен. В одном из исследований данной патологии было засвидетельствовано снижение уровня кальция в ликворе, при нормальных его показателях в сыворотке, при этом уровни фосфора и альбумина в сыворотке и ликворе также находились в пределах нормы.
Селективное удаление скоплений кальция без влияния на его уровень в других тканях является неосуществимой целью с любой точки зрения. Терапия специфическими нейротропными блокаторами кальциевых каналов (нимодипин) оказалась безуспешной. Снижение 25-ОН витамина D3 при нормальных уровнях 1,25(ОН)2 витамина D3 позволило заподозрить врожденные нарушения его метаболизма с аутосомным типом наследования у троих пациентов с двигательными нарушениями и наличием стриопаллидозубчатых кальцинатов. С целью оптимизации лечебных подходов данный факт требует последующего выяснения. Одному из больных назначение динатриевого этидроната принесло симптоматическое улучшение, однако степень кальцификации при этом не уменьшилась, поэтому данный метод лечения требует дальнейших контролированных исследований с участием большего числа лиц.
Принимая во внимание наличие, как минимум, 35 различных терминов (некоторые из них перечислены в таблице 1), лучше избегать определения “болезнь Фара”. Поскольку целый ряд расстройств сопровождается двусторонней кальцификацией подкорковых структур, лучше использовать термин, отражающий анатомическую локализацию, например “стриопаллидозубчатый”, “стриопаллидарный” или “мозжечковый кальциноз”. В таких очагах присутствуют не только кальций, но и другие химические элементы, однако именно он визуализируется при томографии, что и предопределяет суть термина “кальциноз”. Вышеописанные скопления не связаны с единым хромосомным локусом. Geshwind et al. открыли аутосомно-доминантную сцепленную с 14 хромосомой форму заболевания с неврологическими нарушениями в одной большой семье. Brodaty et al. отрицали наличие такого локуса при отсутствии неврологических, когнитивных и психиатрических симптомов. Кроме того, взаимосвязь гипотиреоза с локусом 11-й хромосомы, псевдогипопаратиреоза — 20-й, а синдрома Дауна — 21-й исключает возможность того, что за накопление кальция и других минералов в головном мозге отвечает всего один ген.
Подготовил Юрий Матвиенко
Причины и лечение кальцификации
Кальций – макроэлемент, участвующий в обменных процессах, является строительным материалом для крепких костей и зубов. Избыточное поступление минерала на фоне нарушения усвоения приводит к его отложению в мягких тканях, внутренних органах и кровеносных сосудах. Такой патологический процесс получил название кальциноз. Кальцификация продолжительное время может протекать бессимптомно и привести к необратимым последствиям в организме.
Классификация кальцификации
Кальцификация – патологический процесс, для которого характерно отложение кальция. В зависимости от локализации макроэлемент может накапливаться и поражать:
В зависимости от этиологии кальцификация бывает 3 типов:
Также кальциноз может быть системным, поражая все органы человека или местным, с локализацией в одном органе или системе.
Причины кальцификации
Отложение кальция в мягких тканях, внутренних органах происходит в результате нарушения метаболизма, что приводит к нарушению усвоения важного макроэлемента для человеческого организма. Чаще всего, сбои в обменных процессах вызваны эндокринными патологиями, болезнями почек инфекционного и аутоиммунного характера, нарушением выработки ферментов при печеночных патологиях и заболеваний поджелудочной железы.
К нарушению обмена кальция может привести недостаточное поступление магния и избыток витамина Д, которые принимают непосредственное участие в усвоении организмом макроэлемента.
Кальцификация отдельного органа может развиваться при образовании кист, опухолей доброкачественного и злокачественного характера, дистрофии тканей.
Процесс образования кальциевых конгломератов также затрагивает соединительную и хрящевую ткань, атеросклеротические бляшки, погибшие паразитирующие микроорганизмы, импланты.
Признаки кальцификации
На начальных этапах распознать патологию крайне сложно в связи с ее бессимптомным течением. Однако некоторые виды имеют достаточно выраженную клиническую картину.
При системном виде кальциноза или при поражении кожных покровов, суставов, эпидермис покрывается небольшими пузырьками, изменения структуры и окраса не наблюдается. По мере прогрессирования патологии кальциевые конгломераты разрастаются и становятся более плотными на ощупь, изменяют свой окрас. Возможно образование свищей.
Известковые отложения в ходе плановых осмотров специалистами или при инструментальном исследовании могут обнаруживаться на зубах, костях, сосудах, мышечных и нервных волокнах. Скопление макроэлемента на тканях органов приводит к нарушению их функционирования.
При поражении сердечной мышцы и сосудистой системы, у больного появляется болевой синдром в грудине, руке, шее, спине, который сохраняется продолжительное время. Также происходит нарушение кровотока, что приводит к скачкам артериального давления, появлению чувства холода в конечностях.
При поражении почек нарастают симптомы интоксикации, нарушается диурез, кожные покровы становятся сухими, вялыми. При кальцификации органов пищеварительного тракта, нарушается их работа, что приводит к возникновению тошноты, рвоты, чувства тяжести в абдоминальной области, запоров.
При поражении и скоплении большого количества кальция в головном мозге больной испытывает частые приступы головной боли и головокружения, скачки внутричерепного давления, нарушение координации движения, ухудшение памяти, проблемы со зрением и слухом. По мере прогрессирования болезни возможны обмороки.
Вместе с этим кальциноз приводит к снижению работоспособности, постоянной вялости и усталости, слабости, снижению массы тела.
Диагностика
Для подтверждения диагноза используется рентгенологическая диагностика. Данный метод позволяет определить характер и размер отложений, а также степень поражения органа, в котором локализуется кальциевый конгломерат. В качестве дополнительных методов исследования назначается:
Для выявления причины кальцификации тканей назначаются дополнительные исследования, в виде общеклинического и биохимического анализа крови. Последний способ позволяет определить уровень кальция, фосфора и магния в крови. При нарушении функций почек назначается общеклинический и бактериологический анализ мочи для оценки работоспособности почек.
Для исключения злокачественного характера новообразований в пораженном органе назначается биопсия тканей. Данный метод предполагает забор биологического материала и его исследования под микроскопом в лабораторных условиях. Биопсия помогает также дифференцировать доброкачественное и злокачественное новообразование.
Лечение
Для лечения кальциноза назначается терапевтический курс, который поможет справиться с заболеванием-первопричиной. Так, если к избыточному отложению кальция привело воспаление инфекционной природы, назначаются антибактериальные препараты.
При нарушении усвоения кальция назначаются медикаменты, содержащие магний, который является антагонистом кальция. Достаточное поступление магния с продуктами питания и медикаментозными препаратами позволяет растворить конгломераты и вывести избыток кальция из организма. В ходе лечения важно принимать диуретики, которые помогут ускорить процесс выведения макроэлемента.
В процессе усвоения кальция принимает участие витамин Д, избыточное поступление которого также отрицательно сказывается на состоянии организма. Поэтому в ходе лечения необходимо соблюдать специальную диету, которая исключает употребление в большом количестве продуктов питания, богатых кальцием и витамином Д. К таким относят рыбу жирных сортов, листовую зелень, молочные продукты, яичный желток, орехи.
При неэффективности консервативных методов лечения, а также образовании конгломератов больших размеров назначается их оперативное удаление. Выбор метода хирургического вмешательства проводится в зависимости от размеров скоплений кальция, а также их локализации.
Кальциноз в период беременности
Отложение кальция во время вынашивания ребенка чаще всего диагностируется в конце третьего триместра гестационного периода. С медицинской точки зрения такой процесс допустим и связан с видоизменением плаценты.
Если кальцификация диагностируется на более ранних сроках, это может привести к преждевременному созреванию плаценты. Как правило, кальциноз у беременных связан с употреблением большого количества продуктов, богатых кальцием, инфекционными процессами и метаболическими нарушениями.
Избыток макроэлемента в организме беременной женщины также опасен, как и его недостаток. Может стать причиной травм ребенка и матери в период родоразрешения.
Профилактика
Чтобы предупредить кальцификацию мягких тканей и внутренних органов следует особое внимание уделить правильному питанию. Важно обеспечить достаточное поступление всех минералов и витаминов в организм, чтобы предупредить развитие патологий различной этиологии.
Также людям с врожденными и приобретенными заболеваниями сердечно-сосудистой системы, почек, эндокринными патологиями важно регулярно проходить плановые осмотры у специалистов, что поможет своевременно предупредить развитие осложнений.
Лечение различных заболеваний стоит проводить только под контролем специалиста и в соответствии с его рекомендациями. Некоторые группы лекарственных препаратов, в том числе для снижения уровня холестерина в крови, артериального давления, а также антибактериальные и гормональные средства могут привести к повышению уровня кальция в организме и нарушению его обмена.
Для предупреждения кальциноза следует вести активный образ жизни, который помогает восстановить нормальный метаболизм, отказаться от употребления алкогольных напитков и табакокурения.
Кальцификация тканей – патологический процесс, связанный с высокой концентрацией кальция в организме. Поражает сердечно-сосудистую, нервную, опорно-двигательную, пищеварительную и мочевыделительную системы. Для предупреждения болезни необходимо правильно питаться и вести здоровый образ жизни. В качестве терапии назначается курс медикаментозных препаратов для устранения причины патологического процесса и нормализации уровня кальция и магния в крови.
Эксперт статьи:
Татаринов Олег Петрович
Врач высшей категории, врач невролог, физиотерапевт, специалист УВТ, ведущий специалист сети «Здоровье Плюс»
Медицинский опыт более 40 лет
Кальций в мозге человека отложение
Процессы, протекающие в головном мозге, вероятно, относятся к самым сложным для изучения. Патологические изменения, происходящие в его структурах, являются наиболее труднодиагностируемыми, несмотря на наличие современного оборудования и обширных познаний врачей в данной области. Болезнь Фара относится к редким и малоизученным заболеваниям, которые затрагивают преимущественно базальные ганглии, мозжечок и полушария головного мозга.
Болезнь Фара – идиопатическая неатеросклеротическая симметричная интрацеребральная кальцификация коры полушарий, базальных ганглиев и зубчатых ядер мозжечка, связанная с отложением солей кальция и железа в стенках мелких артерий и артериол, а также в вещество головного мозга. Морфологически кальцификаты обнаруживаются симметрично в различных структурах: коре мозга, белом веществе, подкорковых ганглиях, внутренней капсуле, мозжечке, стенках мелких артерий, реже вен [1].
Характерно наличие периваскулярных мелких кальциевых конгломератов. Наиболее массивная кальцификация выявляется в подкорковых отделах. Микроскопически кальцификаты отличаются типичной структурой, представленной нитями толщиной 140–400 мкм [2].
Впервые синдром (или болезнь) Фара был диагностирован в конце 1930 г. немецким врачом-неврологом Карлом Теодором Фаром. Это редкое дегенеративное заболевание, его распространенность составляет, как было сказано ранее, порядка 1 случая на 1 млн населения. При этом мужчины болеют приблизительно в 2 раза чаще.
Разнообразие симптоматики данного заболевания объясняет сложность постановки диагноза. Клинически болезнь может протекать как совершенно бессимптомно, так и с яркими экстрапирамидными нарушениями в виде мышечной ригидности, тремора, судорог, схожими с таковыми при болезни Паркинсона [3, 4]. Для больных характерны гиперкинезы, головокружения, шаркающая походка. Именно схожесть с другими распространенными заболеваниями затрудняет своевременное выявление данной патологии [5, 6].
На современном этапе развития системы здравоохранения с увеличением доступности компьютерной томографии в рутинной неврологической практике диагностика феррокальциноза постепенно увеличивается, однако, по литературным данным, в большинстве случаев обнаружение кальцинатов является находкой, а не диагностической необходимостью.
Этиология болезни Фара установлена не до конца. Возможными причинами считают гормональные нарушения при патологии щитовидной и паращитовидной желез, что ведет к дисбалансу ионов кальция и фосфора: чаще всего – первичный или вторичный гиперпаратиреоз, реже – псевдогиперпаратиреоз при продукции паратгормона опухолевой тканью (при бронхогенном раке, раке молочной железы); при локализации опухоли в костной ткани (множественная миелома, метастазы в кости). Еще одним из механизмов возникновения предполагают дыхательный алкалоз, компенсируемый фосфатной буферной системой: внутриклеточная концентрация фосфатов увеличивается, в то время как в плазме крови возникают относительная гиперкальциемия и абсолютная гипофосфатемия [7, 8].
Указывается, что гипоксия мозга при гипертонической болезни и атеросклерозе церебральных артерий может приводить к локальному увеличению концентрации ионов кальция в веществе мозга и вызывать петрификацию нейронов базальных ганглиев, но, по мнению авторов, данная гипотеза является исключительно теоретической, а на практике – безосновательной.
Также предполагают возможность генетического характера патологии с локализацией нарушений в четырнадцатой (локус 14q13), второй (локус 2q37) хромосомах, хромосомном участке q21.1-q11.23 восьмой хромосомы. Были установлены варианты, когда болезнь наследовалась аутосомно-доминантным и Х-сцепленным путем [9]. Важно отметить, что имели также место и случаи, в которых семейный характер патологии не прослеживался.
Имеется описание дебюта болезни Фара у пациентки на фоне пневмонии, вызванной SARS-CoV-2 (COVID-19) [10].
Диагностировать болезнь Фара позволяет проведение биохимического анализа крови. Производятся определение электролитов крови: кальция, фосфора, железа, натрия; определение уровня паратгормона; ПЦР-исследования для выявления токсоплазмы, цитомегаловируса и других инфекционных агентов, способных вызывать воспалительные изменения тканей мозга с образованием кальцификатов.
Ключевое значение в диагностике болезни Фара имеют инструментальные методы исследования – УЗИ щитовидной и паращитовидных желез, компьютерная томография и рентгенография.
Лечение заболевания проводят только симптоматически. При симптомах паркинсонизма назначают предшественники дофамина (леводопу), при гиперкинезах – холинолитики (циклодол), в случае эпилептических состояний – барбитураты (фенобарбитал) и бензодиазепины (феназепам, лоразепам, клоназепам). С целью улучшения обменных процессов применяют стимуляторы тканевого метаболизма (глютаминовую кислоту, никотинамид), цитопротекторы (рибофлавин, янтарную кислоту).
В работе нами был проанализирован случай диагностики болезни Фара по результатам аутопсии. Пациентка женского пола М., 1949 года рождения, поступила в ГБУЗ СГКБ № 1 им. Н.И. Пирогова с жалобами на общую слабость, головокружение, мышечные спазмы, тошноту, рвоту, повышенную температуру. При поступлении состояние средней тяжести. При осмотре кожные покровы бледные, видимые слизистые физиологической окраски, зев гиперемирован. Дыхание везикулярное, ЧДД – 12 в минуту, ЧСС – 79 в минуту, пульс ритмичный, АД – 135/75 мм рт. ст., температура 37,4°C. Пациент в сознании, на контакт идет, внимание рассеянное, лицо симметричное, походка неуверенная, наблюдается тремор верхних конечностей. В отделении проведено обследование в полном объеме.
Результаты анализов на ВИЧ, гепатиты B и C отрицательны. В общем анализе крови отклонений от нормы не выявлено. В ходе биохимического анализа крови обнаружены следующие изменения: гипергликемия (глюкоза – 9,2 ммоль/л), гиперкальциемия (кальций – 3,1 ммоль/л), гипокалиемия (калий – 3,2 ммоль/л).
Компьютерная томография головного мозга: геморрагический инсульт в области базальных ядер справа и слева, двусторонняя симметричная кальцификация базальных ганглиев, таламусов, зубчатых ядер и белого вещества больших полушарий.
Макроскопическая картина центральной нервной системы по результатам аутопсии
Кости свода и основания черепа целые. Твердая мозговая оболочка не напряжена, гладкая, сероватая. Мягкая мозговая оболочка отечная, полнокровная. Полушария мозга симметричны. Мозг весом 1410 г. Борозды незначительно углублены. Сосуды основания мозга с единичными атеросклеротическими бляшками на интиме, стенозирующими просвет до 20%. В области базальных ядер головного мозга справа – участок дрябловатой ткани мозга диаметром 1 см с единичными кровоизлияниями диаметром до 1 мм. Выражено полнокровие мелких сосудов. Желудочки мозга незначительно расширены, эпендима гладкая, в просвете прозрачный ликвор. На миндалинах мозжечка следы давления краев большого затылочного отверстия. Во всех других отделах анатомический рисунок строения вещества головного мозга хорошо выражен, с четкой границей и обычным соотношением серого и белого вещества. Ткань мозга на разрезе влажная, блестящая; в области базальных ядер – издает характерный хруст – звон.
Гистологическое исследование головного мозга
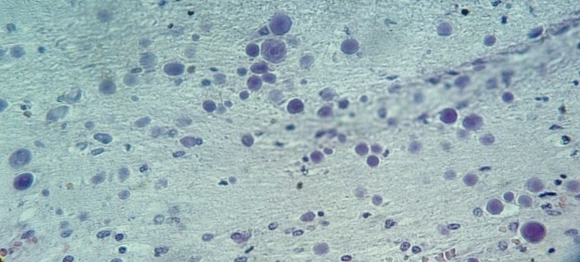
В микропрепарате коры головного мозга – многочисленные зернистые шары (рис. 1).
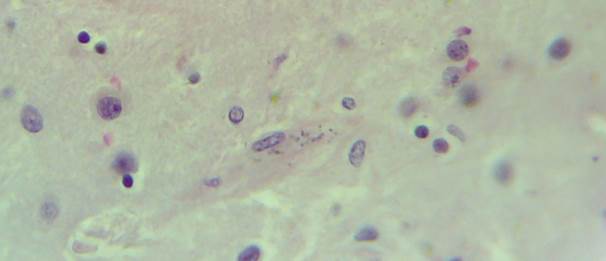
В микропрепаратах базальных ганглиев – неравномерное кровенаполнение, диапедезные кровоизлияния вокруг сосудов (рис. 2А), умеренный периваскулярный и перицеллюлярный отек (рис. 2А-Б).
Стенки сосудов деформированные (рис. 3А), со множественными консолидированными (рис. 3А) и пылевидными (рис. 3Б) кальцинатами в виде концентрических преимущественно равномерно распределенных колец между адвентицией, средней оболочкой и пограничной мембраной глии.
Рис. 1. Препарат коры головного мозга пациента женского пола, страдавшего болезнью Фара, умершего от геморрагического инсульта. Многочисленные зернистые шары. Окраска гематоксилин-эозином. Увеличение х200
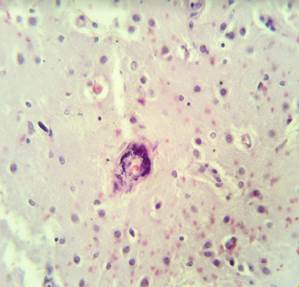
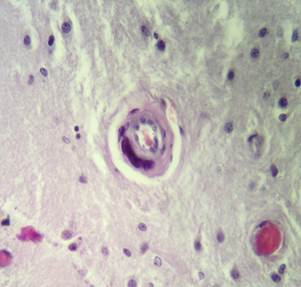
Рис. 2. Препарат базальных ядер пациента женского пола, страдавшего болезнью Фара, умершего от геморрагического инсульта. А – диапедезные кровоизлияния вокруг кальцинированных сосудов с деформированной стенкой, умеренный перицеллюлярный отек. Б – кальцинированный сосуд, умеренный перицеллюлярный и периваскулярный отек. Окраска гематоксилин-эозином. Увеличение х200
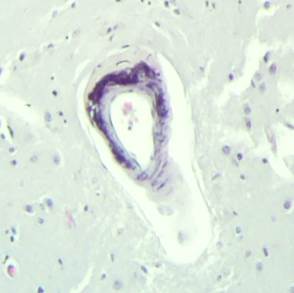
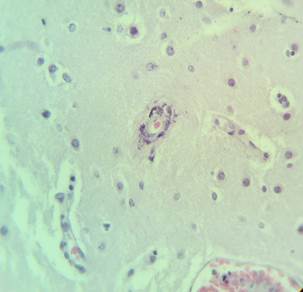
Рис. 3. Препарат базальных ядер пациента женского пола, страдавшего болезнью Фара, умершего от геморрагического инсульта. А – консолидированные кальцинаты в стенке сосуда, выраженный периваскулярный отек. Б – пылевидные кальцинаты в стенке сосуда, умеренный перицеллюлярный и периваскулярный отек. Окраска гематоксилин-эозином. Увеличение х200
Кальцинаты обнаружены в артериях мелкого и среднего калибра, а также в единичных венах (рис. 4А-Б). В веществе мозга и перинейронально имеются кальцинаты в форме различных по размерам глыбок округлой формы (рис. 4Б – крупные кальцинаты, рис. 5 – пылевидные кальцинаты в веществе мозга). Отдельные нейроны кальцинированы.
Со стороны сердечно-сосудистой системы определена концентрическая гипертрофия миокарда (масса сердца 360 г, толщина стенки левого желудочка 1,7 см, правого – 0,4 см, гистологически – гипертрофия мышечных волокон, диффузное разрастание мелких полос соединительной ткани), атеросклероз аорты и ее ветвей, стенозирующий атеросклероз коронарных артерий (III стадия, 3-я степень, стеноз до 30% правой и левой коронарных артерий).
В правом надпочечнике макроскопически определяется округлое образование диаметром 1,2 см, на разрезе равномерного желтовато-оранжевого цвета, гистологически – светлоклеточная аденома надпочечника.
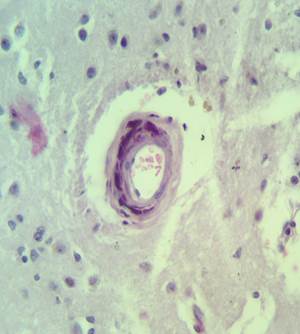
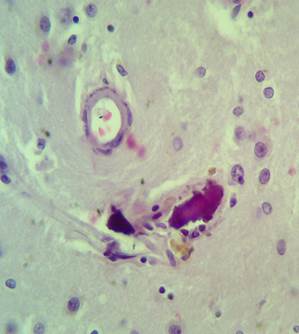
Рис. 4. Препарат базальных ядер пациента женского пола, страдавшего болезнью Фара, умершего от геморрагического инсульта. А – консолидированные и пылевидные кальцинаты в стенке сосуда, выраженный периваскулярный и умеренный перицеллюлярный отек. Б – пылевидные кальцинаты в стенке сосуда, крупный перинейрональный кальцинат, слабый перицеллюлярный и периваскулярный отек. Окраска гематоксилин-эозином. Увеличение х250
Рис. 5. Препарат базальных ядер пациента женского пола, страдавшего болезнью Фара, умершего от геморрагического инсульта. Пылевидные кальцинаты в веществе головного мозга. Окраска – гематоксилин-эозином. Увеличение х400
При анализе данного клинического случая мы склонны считать болезнь Фара и артериальную гипертензию важнейшими сочетанными нозологическими единицами, безусловно повлиявшими на танатогенез. Повышение давления в кальцинированных сосудах мелкого калибра, не обладающих должной эластичностью, приводит к развитию очаговых кровоизлияний.
В связи с разнообразной неспецифической неврологической симптоматикой, а часто и полным отсутствием каких-либо проявлений болезнь Фара остается одним из малоизученных нейродегенеративных заболеваний.
Разработанные и в целом доступные методы диагностики позволяют выявлять феррокальциноз пациентов, однако ограниченность серьезных генетических и лабораторных методов диагностики, низкая приверженность к назначению компьютерной томографии пациентам без клиники острого нарушения мозгового кровообращения объясняют позднюю выявляемость данной патологии; наличие специфической макроскопической и микроскопической картины обусловливает выявление болезни Фара почти исключительно по данным аутопсии.