клинические рекомендации трансплантация костного мозга
Трансплантация костного мозга и стволовых клеток
Общие принципы
ОБЩАЯ ИНФОРМАЦИЯ О СТВОЛОВЫХ КРОВЕТВОРНЫХ КЛЕТКАХ
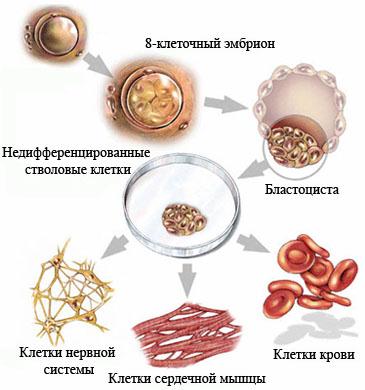
Недифференцированная стволовая клетка, происходящая из бластоцисты, является родоначальницей всех клеток организма, в том числе и стволовой кроветворной клетки (СКК).
Основными свойствами стволовой кроветворной клетки являются возможность дифференцироваться в направлении любого из ростков кроветворения и способность к самоподдержанию.
 Колонии стволовых кроветворных клеток (электронная микроскопия) | 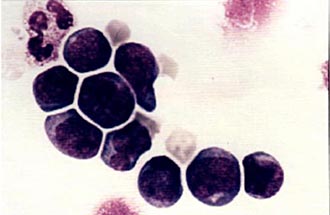 Мононуклеарная фракция, обогащенная клетками CD34, окрашена по Маю-Грюнвальду с докраской по Гимзе. Стволовые клетки, несущие маркер CD34, внешне напоминают малые и средние лимфоциты. |
ИСТОРИЧЕСКАЯ СПРАВКА
Первые работы, посвященные терапевтическому использованию костного мозга, были выполнены в последней декаде XIX века, независимо друг от друга Brown-Sequard, d»Arsonval, Fraser, Billings и Hamilton, которые применяли экстракт костного мозга животных для лечения больных различными видами анемий. Несмотря на положительный эффект, отмеченный всеми авторами, в течение последующих пятидесяти лет использование данной методики носило спорадический характер и не выходило за рамки клинического эксперимента до 1937 года когда Schretzenmayr впервые произвел парентеральное (внутримышечное) введение костного мозга, а в 1939 году Osgood выполнил первое внутривенное введение костного мозга.
Результаты экспериментальных исследований привели клиницистов к идее использования ТКМ при заболеваниях, связанных с поражением костного мозга (лейкозы, апластическая анемия), а также при радиационных воздействиях и проведении химиотерапии, однако основные теоретические и практические проблемы проведения ТКМ удалось преодолеть в 60-е годы. С этого времени ТКМ является одним из методов лечения различных заболеваний крови и иммунной системы.
ВИДЫ ТРАНСПЛАНТАЦИИ КОСТНОГО МОЗГА
Разновидностью АллоТКМ является сингенная ТКМ (трансплантация от однояйцевого близнеца).
ПОКАЗАНИЯ К ТРАНСПЛАНТАЦИИ КОСТНОГО МОЗГА
С развитием появлением колониестимулирующих факторов и развитием технологий клеточной сепарации с 70-х годов для получения гемопоэтических клеток крови вмести костного мозга стали использовать стволовые клетки периферической крови.
Применение клеточных сепараторов значительно упростило проведение процедуры получения стволовых клеток крови, уменьшило число осложнений связанных с дачей наркоза и травматическим повреждения костной ткани.
Еще одним потенциальным источником СКК является пуповинная кровь, основным преимуществом которой является меньшая иммуногенность, однако малое количество стволовых клеток в материале ограничивает ее применение и используется преимущественно в педиатрии или у пациентов с массой тела до 50 кг.
Методика проведения миелотрансплантации различается в зависимости от ее вида (аллогенная или аутологичная), нозологической формы заболевания и ряда других факторов.
ПРАКТИЧЕСКИЕ АСПЕКТЫ МИЕЛОТРАНСПЛАНТАЦИИ
ОПРЕДЕЛЕНИЕ ПОКАЗАНИЙ И ПРОТИВОПОКАЗАНИЙ
Наиболее частыми показаниями к ТКМ/ТСКК являются онкогематологические и гематологические заболевания (лейкозы, злокачественные лимфомы, апластическая анемия, врожденные иммунодефициты и нарушения метаболизма).
Чаше всего ТКМ или ТСКК проводится во время полной ремиссии (ПР), частичной ремиссии (ЧР) или при рецидиве опухоли, чувствительном к химиотерапии. При первичной резистентности к цитостатической терапии результаты ТКМ резко ухудшаются, поэтому в этих случаях операция выполняется относительно редко.
ВЫБОР ДОНОРА
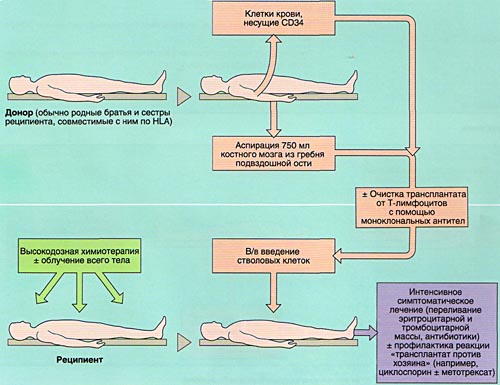
Совместимость костного мозга определяет результаты АллоТКМ. Родственными донорами считаются совместимые по системе HLA братья или сестры реципиента (сибсы). Родители и дети гаплоидентичны (имеют одну общую хромосому из каждой пары, т. е. совпадают между собой на 50%) и не могут быть донорами аллогенного костного мозга. Совместимые сибсы имеются лишь у 20-25% больных, в связи с чем в последние 10 лет активно внедряется АллоТКМ от неродственных HLA-идентичных доноров или частично совместимых родственных доноров.
МОБИЛИЗАЦИЯ, ОБРАБОТКА И ИНФУЗИЯ СТВОЛОВЫХ КРОВЕТВОРНЫХ КЛЕТОК
 А) |  Б) |
А) специальный сосуд (дюар) с жидким азотом для транспортировки контейнеров с костным мозгом
Б) извлеченный из сосуда контейнер с костным мозгом
Инфузия аллогенного, размороженного аутологичного костного мозга или СКК периферической крови проводится внутривенно, капельно после предварительного введения антигистаминных препаратов для предотвращения аллергических реакций.
ИММУНОСУПРЕССИВНАЯ ТЕРАПИЯ (КОНДИЦИОНИРОВАНИЕ)
ПРОФИЛАКТИКА И ЛЕЧЕНИЕ ОСЛОЖНЕНИЙ ПЕРИОДА ЦИТОПЕНИИ
Вскоре после окончания кондиционирования и введения СКК у больного развивается аплазия костного мозга (период отсутствия костного мозгового кроветворения), которая проявляется практически полным отсутствием клеток крови (панцитопенией) и продолжается в среднем 4 недели. Этот период опасен развитием тяжелых осложнений (инфекции, кровоточивость и т.д.).
Основную опасность в периоде цитопении представляют инфекционные осложнения, поэтому их профилактика, своевременное и адекватное лечение являются необходимым условием успешной ТКМ.
Также по показаниям проводится переливание компонентов крови (эритроцитарная масса, тромбомасса, плазма).
Приживление костного мозга или СКК периферической крови констатируют по результатам анализа костного мозга. Вскоре количество нейтрофилов достигает > 0,5*109/л, а тромбоцитов > 20>
Пересадка аутологичных гемопоэтических клеток костного мозга при тяжёлом течении рассеянного склероза
В последние 10-20 лет с появлением иммуномодулирующих препаратов в большинстве случаев удаётся значительно снизить частоту обострений рассеянного склероза (РС), что приводит к замедлению нарастания инвалидизации. Однако в ряде случаев как иммуномодулирующие, так и иммуносупрессивные препараты оказываются неэффективными. Приведены литературные данные по применению трансплантации аутологичных гемопоэтических стволовых клеток при РС и клинический случай успешного использования этого метода у пациента с тяжёлым течением РС, не отвечающего на применение иммуномодуляторов и введение митоксантрона. Ключевые слова: рассеянный склероз, иммуномодуляторы, митоскантрон, трансплантация, аутологичные гемопоэтичные клетки
Т. Е. Шмидт (1), Н. И. Базий (2), Н. Н. Яхно (1), К. Ю. Казанцев (1), П. А. Коваленко (3), С. В. Шаманский (3), А. Ю. Емельянова (1)
1- Кафедра нервных болезней Первого МГМУ им. И. М, Сеченова, 2- Клиническая б-ца №1 УДП РФ, 3 – ГВКГ им. Н. Н. Бурденко
В последние 10-20 лет с появлением иммуномодулирующих препаратов в большинстве случаев удаётся значительно снизить частоту обострений рассеянного склероза (РС), что приводит к замедлению нарастания инвалидизации. Однако в ряде случаев как иммуномодулирующие, так и иммуносупрессивные препараты оказываются неэффективными. Приведены литературные данные по применению трансплантации аутологичных гемопоэтических стволовых клеток при РС и клинический случай успешного использования этого метода у пациента с тяжёлым течением РС, не отвечающего на применение иммуномодуляторов и введение митоксантрона.
Ключевые слова: рассеянный склероз, иммуномодуляторы, митоскантрон, трансплантация, аутологичные гемопоэтичные клетки
Начиная с 90-х годов прошлого столетия, с введением в повседневную врачебную практику иммуномодулирующих препаратов, в большом числе случаев ремиттирующего рассеянного склероза (РРС) удаётся достичь значительного снижения частоты обострений. Это, в свою очередь, приводит к замедлению нарастания необратимого неврологического дефицита и инвалидизации пациентов. К сожалению, на сегодняшний день предсказать эффективность применения того или иного иммуномодулятора у конкретного больного невозможно. При РРС с частыми и тяжёлыми обострениями, в случае безуспешности лечения иммуномодулирующими препаратами, а также при вторичном прогрессировании заболевания применяют иммуносупрессоры и цитостатики. Одним из методов лечения РС является и пересадка аутологичных гемопоэтических клеток костного мозга. Экспериментальные данные на животных с индуцированным аутоиммунным энцефаломиелитом в качестве модели рассеянного склероза, продемонстрировали, что глубокая и длительная иммуносупрессия (высокие дозы цитостатиков, тотальное облучение лимфоцитов) с последующей трансплантацией стволовых кроветворных клеток может остановить прогрессирование заболевания. Клиническое применение метода трансплантации стволовых кроветворных клеток при РС началось в 1995 году одновременно в США и Европе. В России первая операция трансплантации стволовых кроветворных клеток периферической крови при PC по протоколу Европейской группы трансплантации костного мозга была проведена на кафедре гематологии и клинической иммунологии, совместно с кафедрой нервных болезней Военно-Медицинской Академии под руководством проф. А. А. Новика в 1999 году. В настоящее время в России действует несколько крупных медицинских исследовательских центров, занимающихся трансплантацией стволовых клеток крови при РС. Среди них: ГВКГ им. Бурденко, Москва; ВМА, Санкт-Петербург; НМХЦ им. Пирогова, Москва; ГМУ им. акад. И. П. Павлова, Санкт-Петербург; Калининский региональный центр, Самара; Институт клинической иммунологии, Новосибирск; Свердловский областной гематологический центр, Екатеринбург.
Пересадка стволовых клеток состоит из нескольких этапов. 1 – мобилизация и забор гемопоэтических стволовых клеток костного мозга пациента. На этом этапе проводится введение больших доз циклофосфамида (4 г/м2) с целью усиления выхода гемопоэтических стволовых клеток (ГСК) (CD34+-клеток) из костного мозга в периферическую кровь. Другим обязательным компонентом данного этапа является использование гранулоцитарного-колониестимулирующего фактора (Г-КСФ) для стимуляции гранулоцитопоэза и увеличения количества ГСК в периферической крови. Затем с помощью лейкоцитафереза выделяют мононуклеарную фракцию крови, обогащенную CD34+-клетками. 2 этап – криоконсервация (добавление к лейкоконцентрату криопротекторов, которые необходимы для защиты клеток от разрушения при замораживании) и хранение полученного трансплантата. Замораживание клеток требует специального оборудования для программированного понижения температуры. Затем замороженный трансплантат переносится в пары жидкого азота, где и хранится до момента использования. 3 этап – кондиционирование, то есть собственно высокодозная иммуносупрессия, которая преследует цель уничтожить существующие иммунокомпетентные клетки пациента и подготовить костно-мозговой плацдарм для последующего приживления трансплантата. Кондиционирование представляет собой комбинацию цитостатических препаратов, которые вводятся пациенту в достаточно большой дозе. В Европейских протоколах для кондиционирования принята программа ВЕАМ: кармустин (БикНу, BCNU), этопозид, арабинозида цитозин (цитарабин, цитозар), мелфалан (алкеран). Инфузия размороженного трансплантата осуществляется через 48 часов после введения последней дозы цитостатика для того, чтобы не повредить трансплантат. На второй и третий день после инфузии трансплантата вводится антитимоцитарный глобуллин (АТГ) для уничтожения остающихся лимфоцитов пациента и тех лимфоцитов, которые контаминируют инфузируемый трансплантат.
Приводим клинический случай успешного применения этого метода у пациента с тяжёлым течением РС, не отвечающим на иммуномодулирующую и иммунносупрессивную терапию.
Пациент З., 18 лет, поступил в клинику нервных болезней им. А. Я. Кожевникова Первого МГМУ им. И. М. Сеченова в августе 2010 года с жалобами: на выраженное пошатывание при ходьбе, дрожание в руках, слабость в руках и ногах, изменение речи, неудержание мочи.
Перенесенные заболевания: детские инфекции, ОРВИ, удаление кисты копчика. Отрубевидный лишай, пролапс митрального клапана.
Вредные привычки отрицает. Наследственный анамнез: по заболеваниям нервной системы не отягощен.
Результаты лабораторных и инструментальных методов исследования.
Общий анализ крови, биохимический анализ крови, ревмопробы, анализ мочи – без отклонений от нормы.
Вызванные потенциалы: грубое многоочаговое поражение ЦНС: ствола головного мозга, обоих зрительных путей, быстропроводящих волокон с рук на стволовом и верхнешейном уровне, быстропроводящих волокон с ног.
Нейроофтальмологическое обследование: острота зрения: V OD=0, 7 c cyl+1, 0D=0, 9-1, 0 V OS=0, 7 c cyl+1, 0D=0, 9-1, 0; на глазном дне: OU – побледнение височных половин дисков зрительных нервов, частичная атрофия дисков зрительных нервов.
МРТ головного мозга: атрофия белого вещества. Расширение боковых желудочков и арахноидальных пространств. Резко истончено мозолистое тело. Множественные гиперинтенсивные в Т2 ВИ очаговые изменения белого вещества гемисфер большого мозга, при относительной сохранности гемисфер мозжечка. Очаговые изменения мозолистого тела, ствола. По сравнению с данными от предыдущего исследования от сентября 2009 года имеется отрицательная динамика: увеличение числа очагов, атрофия белого вещества.
За время нахождения в клинике, 12-го и 13-го сентября, у пациента отмечались единичные генерализованные судорожные припадки. В связи с появлением эпилептических приступов пациенту была проведена ЭЭГ: помимо диффузных изменений электрической активности, очаговой эпилептической активности не выявлено. Был назначен финлепсин в дозе 200 мг/сут, после чего приступы больше не возникали.
В течение 5 дней (с 24-го сентября) проводилась пульс-терапия метипредом в дозе 1000 мг/сут с последующим кратковременным курсом перорального приема преднизолона в дозе 80-60-40-20 мг в течение 8 дней. Во время курса гормональной терапии отмечалась кратковременная положительная динамика в виде некоторого уменьшения выраженности атаксии и нарастания силы в руках и ногах. Однако после отмены преднизолона мозжечковая симптоматика и слабость в конечностях вновь наросли.
Учитывая отсутствие значимого эффекта от гормональной терапии было принято решение о проведении лечения Митоксантроном 20 мг в/в 1 раз в 3 месяца. Первое введение было проведено в клинике. Побочных реакций не отмечалось. Неврологический статус при выписке из клиники без динамики – EDSS 6. 5 баллов.
Однако в дальнейшем состояние пациента продолжало ухудшаться – к декабрю 2010 года наросла слабость в конечностях, стала невозможной ходьба даже с поддержкой.
Принимая во внимание неэффективность иммуномодулирующей терапии и продолжающееся нарастание инвалидизации на фоне иммуносупрессивной терапии пациенту, была дана рекомендация обращения в госпиталь им. Н. Н. Бурденко для решения вопроса о целесообразности проведения аутологичной трансплантации гемопоэтических клеток.
При поступлении в Главный военный клинический госпиталь им. Н. Н. Бурденко в конце декабря 2010 года пациент самостоятельно не передвигался и мог обслуживать себя только в пределах кровати из-за выраженного спастического тетрапареза и атаксии, с трудом самостоятельно принимал пищу. Вследствие грубого маятникообразного нистагма не мог читать, работать с компьютером. Балл EDSS в то время составлял – 8, 5 баллов. Учитывая быстрое нарастание инвалидизации пациента до тяжёлой степени и неэффективность проводимой ранее терапии, было принято решение о проведении пересадки аутологичных гемопоэтических клеток костного мозга.
В феврале 2012 года амбулаторно осмотрен в клинике нервных болезней: сила в конечностях – 4, 5 балла, высокие сухожильные рефлексы, 2-сторонний симптом Бабинского. Ведущей была мозжечковая симптоматика: атаксия при ходьбе (ходит с палочкой), горизонтальный нистагм, интенция при выполнении координаторных проб, скандированная речь. Тазовых нарушений нет. EDSS 5, 5
В дальнейшем пациент регулярно – 2 раза в год осматривался неврологом и ежегодно выполнял МРТ головного мозга с внутривенным контрастированием. При МРТ: перивентрикулярно, в зоне лучистых венцов и семиовальных центров определяются множественные очаги повышенного сигнала в Т2 режиме, размерами от 2 мм до 10 мм без признаков перифокального отёка и объёмного воздействия. После внутривенного введения контрастного вещества его накопления в выявленных очагах не отмечается. Субарахноидальное пространство больших полушарий и мозжечка умеренно расширено. Отрицательной динамики относительно предыдущих исследований от 2011 г., 2012, 2014, 2015, 2018 нет.
Таким образом, через 7 лет после проведения аутологичной трансплантации гемопоэтических стволовых клеток у пациента сохраняется достигнутое улучшение состояния, что подтверждается и стабильной нейровизуализационной картиной.
Обсуждение
У представленного пациента заболевание началось в 11-летнем возрасте с появления глазодвигательных нарушений, что является относительным плохим прогностическим признаком. Действительно, несмотря на то, что диагноз РС был поставлен практически сразу же после появления неврологической симптоматики, и была начата иммуномодулирующая терапия интерферонами бета, у пациента отмечались частые обострения, требовавшие применения кортикостероидов, которые не давали заметного эффекта.. Нельзя исключить вероятность того, что в данном случае демиелинизация была представлена 3 или 4 типом.
Пересадка аутологичных гемопоэтичных стволовых клеток костного мозга также рассматривается как один из методов лечения РС, особенно при его агрессивном течении.
Теоретически полное уничтожение аутоагрессивных Т- и В-клеток и замена их новыми приведёт к созданию «новой» иммунной системы гемопоэтичными клетками и может вызвать длительную или даже постоянную ремиссию.
В 2000 году Европейской ассоциацией по трансплантации костного мозга (ЕВМТ) были разработаны показания к трансплантации гемопоэтических стволовых клеток для пациентов с РС. Она может применяться у пациентов в возрасте от 18- 55 лет, при любой форме течения РС, с длительностью достоверного диагноза не менее 1 года и инвалидизацией по шкале EDSS 3. 0- 6. 5 баллов. При этом необходимыми условиями являются: : 1- нарастание инвалидизации по меньшей мере в течение 6 месяцев более чем на 1, 5 балла по ЕDSS ( если до этого было 3. 0-5. 0 баллов) или более чем на 1 балл по EDSS (если до этого было более 5, 5 баллов) ; 2- подтвержденная клиническая активность по данным МРТ за предыдущий год; 3-неэффективность предшествующей иммуномодулирующей терапии; 4-подписание пациентом информированного согласия. В нашем случае степень инвалидизации на момент решения о проведении этой процедуры превышала рекомендуемую и оценивалась в 8, 5 баллов по шкале EDSS. Однако, учитывая быстрое нарастание неврологической симптоматики – за 3 месяца балл инвалидизации возрос с 6, 0 до 8, 5 – было решено провести трансплантацию как «операцию спасения».
Противопоказаниями к проведению трансплантации стволовых клеток при РС являются: беременность, тяжелые сопутствующие заболевания, частые инфекции, тотальное облучение лимфатических узлов или общее облучение организма в анамнезе, лечение иммуносупрессорами за 3 месяца до трансплантации, применение копаксона, интерферонов бета, внутривенного иммуноглобулина за 1 месяц до трансплантации, обострение РС за 1 месяц до начала процедуры трансплантации.
Побочные эффекты трансплантации гемопоэтических стволовых клеток главным образом связаны с проводимой иммуносупрессивной терапией. Их частота зависит от конкретного режима иммуносупрессии и значительно выше при режимах кондиционирования высокой интенсивности. Наиболее серьезным побочным эффектом является возникновение оппортунистических инфекций в связи с полным или частичным подавлением иммунной системы пациента. К наиболее часто встречающимся оппортунистическим инфекциям относятся пневмококковая и гемофильная пневмония, энтерит, ассоциированный с Clostridium difficile, реже инфицирование вирусами Varicella-zoster и вирусом гепатита, сепсис. При использовании тотального облучения организма в качестве режима иммуносупрессии часто возникают миелодиспластические синдромы, лимфопролиферативные заболевания, другие онкологические процессы, выше риск развития оппортунистических инфекций. Наиболее частыми побочными эффектами, возникающими на разных этапах процедуры трансплантации, являются транзиторная лихорадка, аллопеция, транзиторное нарастание неврологического дефицита.
К 2019 году в мире было проведено более 5000 подобных процедур больным с РС. Анализ этих случаев показал, что через 3 года у 63% из них отмечается стабилизация или улучшение состояния. Приобретение достаточного опыта в проведении клеточной трансплантации привело к значительному снижению частоты смертельных исходов, связанных с высокодозной химиотерапией: если в 2004 году летальность при выполнении этой процедуры составляла 6-8%, то в настоящее она не превышает 0, 4%. В значительной степени этот риск зависит от источника стволовых клеток (пересадка аллогенных стволовых клеток от донора с аналогичным HLA- антигеном сопровождается 20-30% летальностью), режима химиотерапии, возраста пациента и наличия сопутствующих заболеваний.
Как уже отмечалось, теоретической предпосылкой проведения пересадки стволовых клеток является полное удаление из организма больного аутоагрессивных Т-лимфоцитов, инициирующих воспалительные изменения в ЦНС, и замена их на «здоровые» клетки. Исходя из этого, лучшие результаты могут быть достигнуты на ранних этапах РС, когда воспалительные изменения в значительной степени преобладают над нейродегенеративными, и аксоны ещё не подверглись необратимым изменениям. Клинические данные противоречивы. Имеется описание более 500 больных РС, подвергшихся пересадке стволовых клеток. 3х-летнее наблюдение за частью из них показало, что при проведении подобной процедуры больным с лёгкой и средней степенью инвалидизации (до 6 баллов по шкале EDSS) дальнейшего прогрессирования заболевания не происходит, тогда как у пациентов с тяжёлой инвалидизацией отмечалось ухудшение состояния. Однако, в другом исследовании показано, что у 74% больных с первично-прогрессирующим РС, при котором преобладают процессы нейродегенерации, не было прогрессирования заболевания в течение последующих 3 лет наблюдения. Авторы полагают, что кандидатами для пересадки стволовых клеток могут быть больные РС с быстрым прогрессированием (не менее 1 балла в год) и сохраняющие способность ходить хотя бы несколько метров с помощью.
Помимо этого, технические трудности, узкие рамки критериев отбора для подобной процедуры, токсичность иммуносупрессии являются причиной того, что в настоящее время большинство специалистов склонны рассматривать пересадку стволовых клеток как «операцию отчаяния», к которой следует прибегать лишь при неэффективности других методов терапии. Наблюдение за представленным пациентом показало, что даже в случае значительной инвалидизации, в отсутствие явных признаков активности воспалительного процесса применение этой процедуры позволяет достичь значительного улучшения состояния. Как долго будет сохраняться полученный положительный эффект покажет планируемое динамическое наблюдение за больным.
La Nassa G., Littera R., Cocco E. Et al. Allogenic hematopoietic stem cell transplantation in patients affected by large granular lymphocyte leukemia and multiple sclerosis/ Ann. Hematol., 2004, v.83, p. 403-405
Saccardi R., Mancardi G., Solari A. Et al. Autologous HSCT for severe progressive multiple sclerosis in a multicenter trial: impact on disease activity and quality of life/ Blood, 2005, v.105, p. 2601-2607
Высокодозная химиотерапия и трансплантация костного мозга у взрослых больных
Трансплантация стволовых гемопоэтических клеток нашла применение в различных областях онкологии.
Эти клетки используются после высокодозной химиотерапии для снижения длительности депрессии (угнетения) костного мозга и сокращения риска инфекционных осложнений и кровотечений.
Стволовые клетки для трансплантации получают как от самого пациента (аутологичная трансплантация), так и от иммунологически совместимого родственного или неродственного донора (аллогенная трансплантация). Непосредственным источником стволовых гемопоэтических стволовых клеток может быть костный мозг, периферическая или пуповинная кровь.
Одним из наиболее частых показаний для применения стволовых клеток в онкологии является уменьшении длительности периода угнетения кроветворения после противоопухолевой терапии.
Применение современных противоопухолевых препаратов позволяет излечить или продлить жизнь значительному количеству больных со злокачественными новообразованиями.
Однако в ряде случаев проведение стандартной химиотерапии не приводит к длительному противоопухолевому эффекту, что связано с исходной или приобретенной резистентностью (устойчивостью) опухоли к цитостатикам.
Одним из путей ее преодоления является увеличение дозы препаратов. Это увеличивает проникновение противоопухолевых препаратов в раковую клетку и позволяет преодолеть устойчивость к химиотерапии.
Резкое увеличение дозы препаратов приводит к значительному повреждению кроветворных клеток костного мозга и выключению функции кроветворения на много месяцев, что требует применения методик защиты кроветворения.
Основным методом, позволяющим преодолеть токсичность химиотерапии на кроветворение, является трансплантация кроветворной ткани. При этом стволовые клетки, полученные от донора или у самого больного, вводят после окончания химиотерапии, когда препараты полностью вывелись из организма или разрушились, что позволяет быстро восстановить кроветворение.
При пересадке аллогенного костного мозга возможно длительное приживление трансплантата только при совпадении донора и реципиента по антигенам главного комплекса гистосовместимости (иммунологической совместимости).
В противном случае развивается выраженная иммунологическая реакция «трансплантат против хозяина» (РТПХ), способная привести к гибели больного.
Наименьшее количество осложнений встречается у совместимых сибсов (родных братьев и сестер).
В то же время сибсы имеют вероятность совпасть иммунологически только в 25% случаев, что указывает на серьезную проблему подбора доноров для пересадки костного мозга. Последние годы отмечены крупные успехи в подборе неродственных доноров.
Следует отметить, что даже полная совместимость не дает абсолютной гарантии отсутствия развития РТПХ, и до 25% больных погибает от осложнений, связанных с трансплантацией.
Важно иметь в виду, что РТПХ способна оказывать и лечебное действие, когда иммунная система донора начинает распознавать опухолевые клетки хозяина и бороться с ними, т.е. проявляется реакция трансплантат против опухоли (РТПО).
При ряде заболеваний (хронический миелолейкоз, острый нелимфобластный лейкоз и др.) наличие этой реакции в значительной степени определяет общий успех лечения.
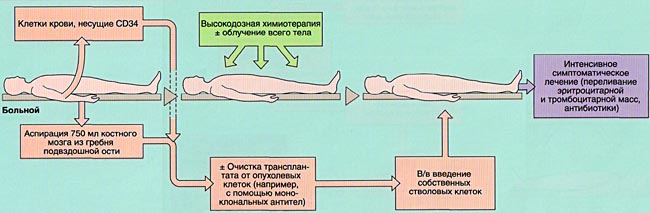
Трансплантация аутологичной (своей собственной) гемопоэтической ткани позволяет избежать возникновения РТПХ и технических сложностей, связанных с подбором донора. С другой стороны, аутологичная трансплантация не сопровождается РТПО и несет чисто вспомогательную функцию поддержки кроветворения после высокодозной химиотерапии.
В настоящее время имеется возможность сохранять собственные кроветворные клетки в жизнеспособном состоянии при низких температурах (замораживании) в течение длительного периода времени.
Долгие годы основным источником стволовых кроветворных клеток был костный мозг. Метод его получения состоит в многократных пункциях плоских костей (в основном тазовых) и получении 1-1,5 литров костно-мозговой взвеси. Такая процедура требует, как правило, общего обезболивания (наркоза).
Нужно отметить, что при опухолевом и лучевом поражении костей таза забор костного мозга может оказаться неудачным.
Костный мозг не является единственным источником кроветворных клеток.
Во взрослом организме небольшая часть стволовых клеток, как и зрелые клетки, выходит в периферическое сосудистое русло. Эти стволовые клетки способны восстанавливать полноценное кроветворение после повреждения его химиотерапией и облучением. Современная аппаратура (сепараторы крови) позволяет эффективно собирать клетки кроветворения из периферической крови даже при их низком содержании. При этом необходимость наркоза отпадает.
В условиях нормального кроветворения для получения достаточного количества стволовых клеток необходимо, как правило, 6 процедур. При каждой такой процедуре обрабатывается 10-12 литров крови.
Проблема низкого количества клеток кроветворения в периферической крови оставалась главным ограничением при использовании данного вида трансплантата. Затем было показано, что после однократного введения некоторых противоопухолевых препаратов (циклофосфамид, этопозид, фторурацил) отмечается значительное увеличение числа стволовых клеток в периферической крови. К недостаткам данного метода относятся: снижение числа лейкоцитов и тромбоцитов, значительные различия в сроках начала роста содержания стволовых клеток в периферической крови у различных больных.
Введение некоторых гемопоэтических факторов роста (нейпоген, лейкомакс и др.) вызывает значительно увеличение поступления клеток кроветворения из костного мозга в периферическую кровь.
Применение аллогенной трансплантации костного мозга
В настоящее время основными показаниями для аллогенной трансплантации стволовых клеток являются
Изучаются возможности применения данного метода у больных
Острые нелимфобластные лейкозы (ОНЛЛ)
Применение стандартной химиотерапии в первой полной ремиссии позволяет добиться длительной выживаемости в 25-35% случаев по сравнению с 45-60% при использовании аллогенной трансплантации стволовых клеток. Применение трансплантации во второй ремиссии сопровождается длительной ремиссией лишь в 20-30% случаев.
Использование аллогенной трансплантации стволовых клеток с первично резистентным (устойчивым к лечению) течением ОНЛЛ позволяет добиться длительной ремиссии в 10-20% случаев.
Острые лимфобластные лейкозы (олл)
Проведение аллогенной трансплантации стволовых клеток в первой полной ремиссии у пациентов с неблагоприятными прогностическими факторами (возраст старше 60 лет, высокий лейкоцитоз и т.д.) позволяет достичь длительной безрецидивной выживаемости в 40-60% случаев.
При отсутствии неблагоприятных факторов аллогенная трансплантация стволовых клеток обычно рекомендуется во второй полной ремиссии.
Хронический миелолейкоз
ХМЛ характеризуется несколькими фазами развития. В ранней (хронической) фазе, длящейся несколько лет, состояние больного может сохраняться относительно удовлетворительным. В фазе акселерации (обострения) в течение нескольких месяцев нарастают гематологические изменения (увеличение числа лейкоцитов, малокровие), и она переходит в фатальную (смертельную) фазу бластного криза.
Стандартные методы лечения могут вызывать длительные ремиссии у части больных, однако единственным излечивающим методом лечения в настоящее время является аллогенная трансплантация стволовых клеток. Эффективность ее зависит от возраста больного, фазы заболевания, периода времени от момента диагноза до трансплантации. Множественные курсы предшествующего лечения значительно улучшают результаты высокодозной химиотерапии и трансплантации.
Наилучшие шансы на достижение длительной ремиссии имеют молодые больные, получившие трансплантацию в хронической фазе в течение 1 года от момента диагноза. Длительная выживаемость у них составляет 75-80% по сравнению с 10-20% у больных, которым трансплантация выполнена в фазе аскселерации.
Миелодиспластический синдром
Аллогенная трансплантация стволовых клеток является единственным методом, излечивающим больных МДС. Применение этого метода позволяет добиться длительной выживаемости в 30-50% случаев. Эти результаты зависят от возраста больных, длительности заболевания и количества опухолевых клеток в костном мозге перед трансплантацией.
Аллогенная минитрансплантация
Аллогенная минитрансплантация, или трансплантация после миелоаблативных (не разрушающих костномозговое кроветворение) режимов получила распространение лишь недавно. Ее применение связано с выявлением лечебной роли РТПО и появлением новых препаратов (флударабин, антитимоцитарный иммуноглобулин), вызывающих глубокую депрессию (угнетение) иммунной системы, но не вызывающих глубокой цитопении (снижение числа клеток крови).
Применение их в комбинации с умеренными дозами бусульфана или мелфалана позволяет эффективно пересаживать донорский костный мозг. При этом РТПО полностью сохраняется. Следует отметить, что эффективность этого метода зависит от массы остаточной опухоли, которая должна быть по возможности минимальной.
Предварительные результаты применения данной методики свидетельствуют о высокой эффективности минитрансплантации при значительно меньшей токсичности в сравнении с классическим методом.
Применение аутологичной трансплантации костного мозга
Основной ролью аутологичной трансплантации костного мозга является восстановление кроветворения после химиотерапии, что позволяет многократно увеличивать разовые дозы некоторых противоопухолевых препаратов. Это дает возможность усиливать противоопухолевый эффект и достигать более высокой безрецидивной выживаемости в сравнении с результатами стандартной химиотерапии.
Наиболее часто данный метод применяется при лечении больных с прогностически неблагоприятными вариантами течения неходжкинских лимфом (лимфосарком), болезни Ходжкина (лимфогранулематоза), множественной миеломы, рака молочной железы, рака яичка и пр.
Неходжкинские лимфомы (нхл)
Применение стандартной химиотерапии у больных с НХЛ высокой и промежуточной степени злокачественности позволяет достичь 40-60% полных ремиссий. Однако у 20-30% больных этой группы отмечаются рецидивы (возврат) болезни. Применение высокодозной химиотерапии в сочетании с аутологичной трансплантацией костного мозга дало возможность значительно улучшить показатели длительной выживаемости у таких больных.
Болезнь ходжкина
У 10-30% больных с распространенными стадиями болезни Ходжкина первичная химиотерапия оказывается неэффективной, а у 40% пациентов возникает рецидив заболевания. Результаты лечения больных, малочувствительных к первичной химиотерапии и с первым ранним рецидивом (в течение первого года), неудовлетворительные.
Применение других схем стандартной химиотерапии позволяет достичь полных ремиссий не более чем у 40-45% больных, однако при этом ремиссии бывают короткими, а выживаемость низкая.
Применение высокодозной химиотерапии в сочетании с аутологичной трансплантацией стволовых клеток позволяет почти в 2 раза увеличить частоту полных ремиссий, а значит, и надежду на увеличение выживаемости.
Множественная миелома
По данным Европейской организации по аутологичным трансплантациям костного мозга, безрецидивная и общая выживаемость 5500 больных множественной миеломой, получавших высокодозную химиотерапию в сочетании с аутологичной трансплантацией стволовых клеток, составила соответственно 28 и 48 месяцев, что превышает результаты стандартной химиотерапии.
Наилучший прогноз (исход) имеют больные моложе 60 лет с I-II стадиями заболевания и уровнем бета-2 микроглобулина менее 4.
Использование высокодозной химиотерапии при других опухолях (рак молочной железы, яичка и др.) находится на этапе изучения. При этом получены обнадеживающие результаты.
Таким образом, высокодозная химиотерапия с трансплантацией аутологичных или аллогенных стволовых кроветворных клеток за последние годы стала эффективным методом лечения многих опухолей. Прогресс в биологии и иммунологии клеток кроветворения позволяет надеяться на еще более эффективное применение этого метода в будущем, в том числе и при распространенных новообразованиях, резистентных (устойчивых) к химиотерапии.
Мероприятия 2022 года
Архив мероприятий
Противораковое общество РОССИИ создано по инициативе ученых-онкологов и главных врачей онкологических диспансеров, представляющих более 50 регионов России, с целью претворения в жизнь программы профилактики рака в России