клостридии тетании влияние на мозг
Клостридия клостридии волк: С. difficile vs С. scindens
Клостридия клостридии волк: С. difficile vs С. scindens
Автор
Редактор
Тело человека населено триллионами микроорганизмов, совокупность которых называют микробиомом. Микробиом выполняет множество важных функций — от синтеза витаминов до расщепления сложных компонентов пищи. «Здоровая» микрофлора постоянно конкурирует за ограниченные питательные ресурсы с патогенными микроорганизмами, тем самым подавляя их рост. Однако из-за приема антибиотиков или других причин нормальный состав микробиома может нарушаться, и тогда патогены получают возможность размножаться неконтролируемо, вызывая болезни. Один из таких патогенов — бактерия Clostridium difficile, возбудитель псевдомембранозного колита. Борьба с С. difficile осложняется ее устойчивостью к большинству известных антибиотиков. Но недавно было показано, что рост С. difficile можно успешно подавлять не лекарствами, а при помощи родственного ему вида — С. scindens. Это открытие послужит основой для создания «умных» лекарств-пробиотиков: эффективных против С. difficile, но безопасных для полезной микрофлоры.
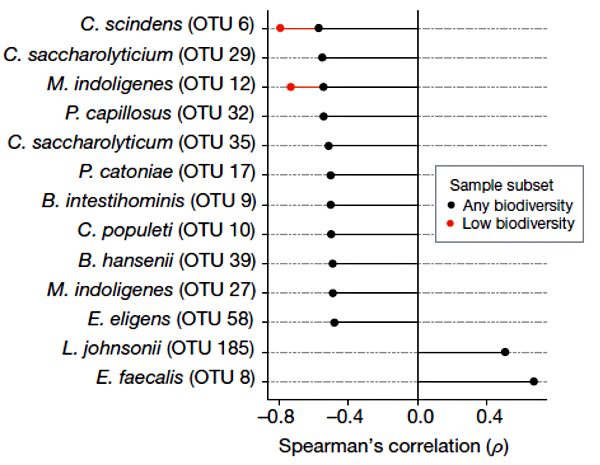
Рисунок 1. Корреляция между присутствием конкретных бактериальных таксонов в микробиоме и устойчивостью к заражению C. difficile [3].
Антибиотики эффективны в борьбе со множеством смертельных заболеваний, но вместе с тем они наносят существенный урон микробиому человека. После курса антибиотиков человек, как правило, более подвержен заражению различными патогенами. Clostridium difficile — грамположительная подвижная бактерия, основной возбудитель острых внутрибольничных кишечных инфекций. За последние 15 лет число смертельных случаев, обусловленных размножением С. difficile, возросло по меньшей мере в 10 раз, особенно среди пожилых и ослабленных людей [1]. Борьба с С. difficile осложняется тем, что при неблагоприятных условиях этот вид образует споры, выдерживающие действие антибиотиков. Такая особенность позволяет бактериям повторно колонизировать кишечник спустя несколько недель и даже месяцев после окончания лечения.
Недавно было показано, что трансплантация микробиомов здоровых доноров вылечивает тяжелые инфекции C. difficile [2]. Однако оставалось неизвестным, какие именно члены микробиома восстанавливают устойчивость организма к инфекции C. difficile и какими механизмами. И вот наконец вышла статья, которая проливает свет на довольно необычный механизм межвидовых взаимодействий в микробиоме [3].
О мышах и людях
C. difficile — не только человеческая беда, но и мышиная. Для начала микробиомы мышей пробовали травить разными антибиотиками и смотрели, как от этого меняется восприимчивость к C. difficile. В целом антибиотики не столько уменьшают суммарное число бактерий в кишечнике, сколько существенно нарушают расстановку сил — соотношение разных таксономических групп. Оказалось, что восприимчивость к C. difficile четко коррелирует с общим снижением видового разнообразия микробима. Удалось выделить горстку из 11 условных видов (операционных таксономических единиц), ассоциированных с устойчивостью к заражению C. difficile (рис. 1). Многие из них оказались тоже клостридиями (кластер Clostridium XIVa). Ученые обратили внимание на один таксон, присутствие которого сильнее всего коррелировало с резистентностью к C. difficile, даже у животных с экстремально низким видовым разнообразием микробиома. Героем оказался Clostridium scindens.
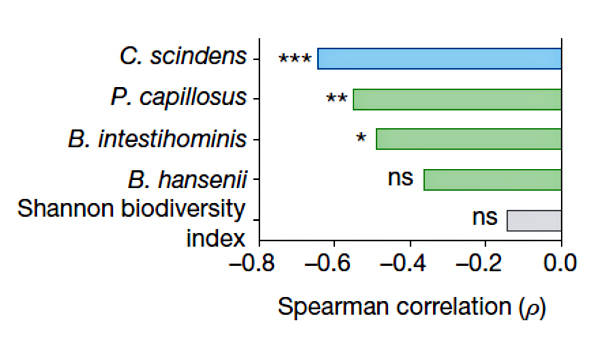
Рисунок 2. Корреляция между приживлением видов-кандидатов в микробиоме и устойчивостью к C. difficile [3].
Но то у мышей. Как же обстоят дела у человека? Для определения видов, связанных с устойчивостью к инфекции C. difficile, исследовали микробиомы пациентов, перенесших аллогеную трансплантацию гемопоэтических стволовых клеток. Большинство из них проходило химиотерапию и/или лучевую терапию одновременно с курсом антибиотиков во время трансплантации. Ослабленный иммунитет и снижение видового разнообразия микробиома делают этих пациентов легкой мишенью для C. difficile. У человека удалось найти два основных вида, с которыми не уживались C. difficile. Наиболее сильным ингибитором оказался C. scindens, как и у мышей. Как будто бы победа?
Для проверки ингибирующего эффекта C. scindens вместе с несколькими другими перспективными бактериями запустили в кишечники животных, недавно принимавших антибиотики (рис. 2). Оказалось, что такая микробная трансплантация существенно облегчила течение инфекции, вызванной C. difficile, а также положительно сказалась на снижении смертности и увеличении массы тела по сравнению с контролем. Наиболее заметную устойчивость к C. difficile обеспечивал, как и ожидалось, C. scindens. Приживление трасплантированных бактерий в микробиоме отслеживали по наличию гена соответствующей 16S рРНК. Устойчивость к C. difficile росла прямо пропорционально обилию C. scindens. То есть улучшение приживаемости C. scindens может повысить защиту против C. difficile. Примечательно, что такая аккуратная замена плохой клостридии на очень похожую, но хорошую, не нарушает существующий в микробиоме баланс (ни качественный, ни количественный). Своеобразная антидотная терапия, только на уровне микробиома. Все это открывает искрящиеся горизонты для разработки безопасных лекарств против C. difficile. Но как именно C. scindens противостоит C. difficile?
Механизм ингибирующего действия
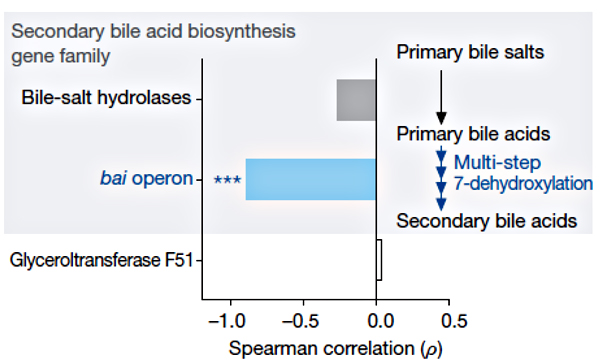
Рисунок 3. Корреляция между устойчивостью к C. difficile и наличием семейств генов, необходимых для синтеза вторичных желчных кислот [3].
Известно, что некоторые вторичные желчные кислоты могут ухудшать рост C. difficile in vitro [4]. У очень большого числа микробиомных бактерий есть ген bsh, кодирующий гидролазу желчных кислот. Однако у редкой бактерии (ужасно малой доли микробиомных организмов) есть все гены, необходимые для осуществления полного пути биосинтеза желчных кислот. Редкой бактерией, конечно же, оказалась C. scindens, обладающая критическим для синтеза вторичных желчных кислот геном 7α-гидроксистероид-дегидрогеназы (рис. 3). Именно на этой уникальной биохимической особенности и зиждется защитный механизм C. scindens против C. difficile. Внедрение C. scindens в микробиом животных, восприимчивых к C. difficile, восстанавливает необходимый уровень и соотношение вторичных желчных кислот: дезоксихолевой (DCA) и литохолевой (LCA). Обе эти кислоты подавляют рост C. difficile пропорционально своей концентрации. Примечательно, что C. scindens повышает количество вторичных желчных кислот до физиологического уровня и препятствует росту C. difficile даже у животных, прошедших курс антибиотикотерапии. Этот механизм консервативен — реализуется как в микробиоме мыши, так и в микробиоме человека.
Терапевтические перспективы
* — О черных делишках кишечных микробов-диверсантов, сокращающих пул желчных кислот и стимулирующих развитие атеросклероза, читайте в статье «Не доверяйте рекламе, или потенциальная связь метаболизма и развития атеросклероза» [6] — Ред.
Клостридии. Всегда рядом, всегда начеку
Ботулизм, столбняк, газовая гангрена… Об этих заболеваниях наслышаны если не все, то очень многие люди. Но если от столбняка существуют вакцины, например АКДС (адсорбированная коклюшно-дифтерийно-столбнячная сыворотка), то от псевдомембранозного колита, некротического энтерита, ботулизма или газовой гангрены таких вакцин нет. А вызываются все эти заболевания бактериями рода Clostridium.
Одним из наиболее распространенных видов клостридий является Clostridium difficile. Ее высевают из почвы, воды (в том числе и морской). Благодаря возможности образовывать эндоспоры (покрываться оболочкой и переживать неблагоприятный период в состоянии своеобразной «спячки») этот вид может длительно, до двух месяцев, сохраняться во внешней среде. Более того, в состоянии эндоспоры клостридия диффициле выдерживает даже кипячение. Чувствительность к антибиотикам у Clostridium difficile от природы очень низкая, поэтому лечение посредством антибиотикотерапии зачастую терпит фиаско.
Clostridium difficile входит в нормофлору (является представителем нормального микробного состава) желудочно-кишечного тракта, обитая преимущественно в толстом кишечнике. Хотя отдельные его представители встречаются и во рту, и в тонком отделе кишечника, и во влагалище у женщин. Чаще всего Clostridium difficile обнаруживается в кишечнике новорожденных (около половины младенцев), а из детей старше 2 лет и взрослых каждый 10 является обладателем этой бактерии.
Clostridium difficile вызывает такие заболевания как псевдомембранозный колит и антибиотикоассоциированные диареи. Патогенные (болезнетворные) свойства этой клостридии обусловлены выделением токсинов А и В, а также белка, угнетающего перистальтику (сократительную функцию) кишечника.
Антибиотикодиссоциированные диареи (сокращенно – ААД) могут вызываться не только клостридией дифициле, а и множеством других микроорганизмов (сальмонеллами, кандидами, клостридией перфрингенс, золотистым стафилококком, клебсиеллой). Этот вид диарей является наиболее частой внутрибольничной инфекцией и связана такая тенденция с тем, что в больницах, во-первых, концентрируется большая масса больных и здоровых людей. А во-вторых, здесь используется множество антибиотиков и дезинфицирующих средств, которые способствуют образованию генераций (поколений) микроорганизмов, устойчивых к антибиотикам. Поэтому в мире ежегодно регистрируется около миллиона случаев ААД. Возникновение антибиотикоассоциированных диарей связано с тем, что антимикробные препараты подавляют как патогенную, так и нормальную микрофлору. Даже однократный прием антибиотиков широкого спектра действия может послужить причиной развития ААД.

Несмотря на это, дети младенческого возраста практически не болеют антибиотикоассоциированными диареями, вызываемыми клостридией диффициле. Связано это с тем, что дети получают с материнским молоком достаточно иммунных факторов, которые могут сдерживать размножение Clostridium difficile. Более того, в младенческом организме нет такого количества сопутствующей условно-патогенной микрофлоры, которая ослабляет иммунитет.
Антибиотикозависимые диареи могут иметь разную симптоматику и течение: от легкой диареи до тяжелейшего псевдомембранозного энтероколита (ПМК). Последний чаще всего вызывается именно клостридией диффициле.
В процессе течения заболевания отмечаются следующие симптомы:
При отсутствии лечения количество смертельных случаев составляет до 30 %.
Характерная особенность болезней, вызванных Clostridium difficile, является то, что около четверти случаев через время повторяются (рецидив заболевания). Причиной этого явления становятся споры клостридий, которые переживают период лечения, либо повторное заражение. Как правило, после лечения больные выздоравливают, или чувствуют себя значительно лучше, но спустя несколько дней (от 3 до 7) развивается рецидив.
Еще одна клостридия, которая может вызывать такие болезни желудочно-кишечного тракта, как пищевые токсикоинфекции и некротический энтерит, — Clostridium perfringens.
Некротический энтерит характеризуется формированием язв и эрозий и деструктивными (разрушающими) изменениями в слизистой оболочке. Первым симптомом заболевания является возникновение участков геморрагического некроза в начальных отделах тощей кишки. Эти участки имеют красный цвет. Наблюдается также сужение просвета кишечника в месте воспаления, за счет отечности стенки. Происходит тромбоз (закупорка) мелких кровеносных сосудов (артериол). У больного отмечаются озноб и лихорадка, рвота и кровавый пенистый понос.
Clostridium perfringens производит ферменты, расщепляющие белки (протеиназа), коллаген (коллагеназа), гиалуроновую кислоту (гиалуронидаза).

Профилактика заболеваний, причиной которых являются клостридии, в первую очередь заключается в соблюдении санитарно-гигиенических норм и правил: мытье и ошпаривание овощей и фруктов; длительная термическая обработка. Но немаловажным является также нормализация микрофлоры и укрепление иммунитета. Причем, как в процессе лечения, так и в процессе предупреждения этих болезней. Ограниченное и строго подконтрольное врачам применение антибиотиков, отказ от самолечения также очень важны для профилактики возникновения АДД и других болезней, связанных с клостридиями.
Нарушения кишечной микробиоты при расстройствах аутистического спектра: новые горизонты в поиске патогенетических подходов к терапии. Часть 1. Особенности кишечной микробиоты при расстройствах аутистического спектра
Полный текст:
Аннотация
Ключевые слова
Введение
Несмотря на большую распространенность и увеличение заболеваемости расстройствами аутистического спектра (РАС), не существует официально одобренных методов лечения ключевых симптомов аутизма, что, вероятно, связано с дефицитом сведений об этиологии и патогенезе этой весьма гетерогенной группы расстройств. При этом в последние десятилетия в большом количестве исследований выявлена ассоциация между дисбиозом кишечника и поведенческими симптомами у пациентов с РАС и другими нейропсихическими расстройствами.
Значительная доля детей и взрослых с аутизмом испытывают гастроинтестинальные (ГИ) проблемы (запор, диарея, хроническая абдоминальная боль и др.), сопутствующие психопатологическим симптомам [1] и коррелирующие с тяжестью РАС [2]. B.O. McElhanon и соавт. в результате проведенного метаанализа сделали вывод о трехкратном статистически значимом увеличении риска ГИ-симптомов у детей с РАС по сравнению со здоровыми детьми [1]. Согласно другим исследованиям, около 40% пациентов с РАС имеют ГИ-жалобы [3].
Гипотетически нарушения микробиоценоза кишечника, ассоциированные с ГИ-проблемами, у детей с генетической предрасположенностью к РАС могут усиливать проявления аутистического фенотипа или тяжесть поведенческих симптомов [4]. Согласно ряду исследований, у детей с сочетанием РАС и ГИ-расстройств отмечаются более тяжелые тревога, раздражительность и социальная изоляция по сравнению с детьми с РАС без ГИ-расстройств [5]. В исследовании CHARGE (Childhood Autism Risks from Genetics and Environment) частота ГИ-нарушений была ассоциирована с более выраженным аутистическим поведением, измеренным с помощью Aberrant Behaviour Checklist. С другой стороны, тяжесть аутизма, измеренная с помощью Autism Treatment Evaluation Checklist (ATEC), коррелировала с индексом более тяжелых ГИ-нарушений [1]. Таким образом, тяжесть поведенческих симптомов ассоциирована с риском возникновения ГИ-проблем и наоборот [6], но причинно-следственная связь в исследованиях такого типа остается не изученной.
ГИ-симптомы могут быть частично связаны с дисбиозом микробиоты кишечника (МК) [7]. При
этом нельзя исключить, что МК оказывает влияние как на функционирование желудочно-кишечного тракта (ЖКТ), так и на нейробиологическое состояние (собственно симптомы аутизма) за счет нескольких механизмов, в частности продуцируемых микроорганизмами метаболитов, модулирующих работу центральной нервной системы [8]. Гипотеза о роли МК в патогенезе аутизма поддерживается исследованиями, в которых показано, что манифестация аутизма часто сопровождается ГИ-жалобами и ей предшествует использование антибиотиков: многие дети с РАС часто проходят антибиотикотерапию в течение первых 3 лет жизни, что, предположительно, дестабилизирует их МК и открывает возможности для конкурентных потенциальных патогенов вносить вклад в тяжесть РАС [9][10]. Кроме того, показано, что пероральный прием ванкомицина приводит к улучшению симптомов [11].
Ряд исследователей сфокусировались на изменениях в МК как на факторе риска для индивидуумов, генетически предрасположенных к РАС; считается, что эти изменения в МК повышают риск развития РАС, влияя на иммунную систему и обмен веществ [12].
Данный обзор литературы, включающий три сообщения, посвящен оценке современного состояния исследований о роли МК в этиологии и патогенезе РАС, а первая его часть — анализу опубликованных данных об особенностях состава МК у пациентов с РАС. Кишечный микробиом детей с аутизмом отличается от такового у нейротипичных сиблингов и здоровых детей. Кроме того, различия выявлены между собственно аутизмом и другими РАС, которые не соответствуют полным диагностическим критериям аутизма (первазивное расстройство развития без дополнительных уточнений) [13].
Согласно первым исследованиям, МК при РАС характеризуется увеличенным количеством микрофлоры и сниженным микробным разнообразием; авторы предполагали, что комбинация этих факторов может привести к чрезмерному росту патогенных бактерий, способствуя выраженности симптомов аутизма [14]. Однако в дальнейших исследованиях получены не столь однозначные результаты.
При сравнении микробного разнообразия МК детей с РАС и здорового контроля в ряде исследований сообщают о его повышении при РАС [15][16], в других — о снижении микробного разнообразия в кишечнике при аутизме [17][18]. Наконец, согласно другим исследованиям, значимых различий в разнообразии кишечной микрофлоры между пациентами с РАС и здоровым контролем не отмечается [19][20].
Обнаружено, что у детей с РАС и их сиблингов по сравнению со здоровыми детьми более распространены микроорганизмы родов Lactobacillus, Clostridium, Desulfovibrio, Caloramator, Alistipes, Sarcina, Akkermansia, семейств Sutterellaceae и Enterobacteriaceae [12][15][21].
Клостридии
Согласно данным F. Mangiola и соавт., качественный состав образцов фекалий у детей с аутизмом характеризуется большим количеством Clostridium spp. (в 10 раз больше, чем у здорового контроля) [22]. В серии случаев, описанной S.M. Finegold и соавт., проведен сравнительный анализ МК у 13 детей с аутизмом и таковой у 9 детей без заболевания: у детей с аутизмом выявлены большие численность и разнообразие видов клостридий, чем в контроле [23]. Повышенный уровень клостридий был также обнаружен у пациентов с РАС в нескольких исследованиях с использованием методов 16S rRNA пиросеквенирования [3][24][25][26][27] и ПЦР в режиме реального времени: уровень 3 кластеров клостридий (I, XI и XIVab) и одного специфического вида клостридий (Clostridium bolteae) был статистически значимо выше при РАС [28].
Дальнейшие исследования с использованием ПЦР в режиме реального времени также сообщают о повышении уровня клостридий кластера I при РАС [29]. При использовании флюоресцентной in situ гибридизации обнаружено увеличение уровня Clostridium histolyticum в фекалиях пациентов с РАС по сравнению со здоровым контролем, при этом здоровые сиблинги детей с РАС также имели более высокие уровни Clostridium histolyticum, чем здоровый контроль [30].
Обилие Clostridium perfringens в фекалиях у детей с аутизмом также было подтверждено несколькими исследованиями [25, 28, 30]. В исследовании F. Strati и соавт. показано, что ГИ-проблемы у детей с РАС ассоциированы с высоким содержанием клостридий [31]. B.L. Williams и соавт. обнаружили, что увеличение уровня бактерий порядка Clostridiales в значительной степени объясняется увеличением количества микроорганизмов из семейств, входящих в данный порядок: Lachnospiraceae и Ruminococcaceae [32]. Согласно исследованию D.R. Rose и соавт., уровни Lachnospiraceae и Ruminococcaceae увеличены у детей с РАС с ГИ-симптомами по сравнению с детьми контрольной группы с похожими симптомами [5]. J. Pulikkan и соавт. также в их работе отмечают повышение содержания бактерий семейства Ruminococcaceae [19], в то время как S. Liu и соавт. обнаружили, что уровень Ruminococcaceae при РАС значимо снижен [33].
Возможная роль Clostridium spp. в этиопатогенезе аутизма была впервые предложена в 1998 г. Ellen Bolte, матерью ребенка с регрессивным аутизмом, которая отметила начало поведенческих изменений после повторных курсов антибиотиков и последовавшей за этим хронической диареи [34][35]. Наблюдая аналогичные случаи, она в общих чертах обрисовала возможность подострой хронической клостридиальной кишечной инфекции, которая может лежать в основе патогенеза аутизма у отдельных пациентов [34].
В пользу гипотезы о том, что изменение кишечного микробиоценоза с превалированием титра клостридий является потенциальным фактором риска развития РАС, свидетельствуют результаты исследования, в котором дети с регрессивным аутизмом получали 6-недельный пероральный курс ванкомицина (к которому чувствительны клостридии), что привело к значительному улучшению как
нейроповеденческих, так и желудочно-кишечных симптомов [36]. Авторы предположили, что изменение состава облигатной микрофлоры кишечника при РАС сопровождается колонизацией бактериями, продуцирующими нейротоксины. И это может отчасти способствовать развитию симптомов аутизма. Однако улучшение по окончании лечения, подтвержденное использованием многочисленных оценок до и после терапии, было кратковременным, что, вероятно, связано с устойчивостью к ванкомицину спор клостридий, которые по окончании курса лечения в условиях снижения колонизационной резистентности кишечника прорастали в вегетативную форму, продуцирующую токсины, с последующим развитием симптоматики [35][37].
Клостридии способны продуцировать некоторые метаболиты, такие как фенолы, дериваты p-крезола и индола, потенциально токсичные для человека [38]; эти метаболиты были обнаружены в образцах фекалий детей с первазивным расстройством развития без дополнительных уточнений (вариант РАС) и в еще больших количествах в образцах детей с аутизмом [25].
Недавний обзор постулирует роль глифосата — распространенного в окружающей среде пестицида в патогенезе аутизма за счет его влияния на рост токсин-продуцирующих Clostridium spp. [39]. И действительно, известно, что Clostridium perfringens и Clostridium botulinum высокоустойчивы к глифосату, в отличие от других представителей МК, таких как бифидобактерии и лактобактерии. Таким образом, уровень глифосата может оказывать вредоносное влияние на ось кишечник–мозг и способствовать патогенезу аутизма через изменение микробиома и продукцию клостридиальных токсинов [39].
Другие бактерии
В целом ряде исследований показано, что при РАС также более распространены виды Desulfovibrio [16][21][29]. Более того, отмечена сильная корреляция Desulfovibrio spp. с тяжестью проявлений аутизма [29]. Микроорганизмы вида Desulfovibrio — анаэробные палочки, устойчивые к распространенным антибиотикам, таким как цефалоспорины. У детей с аутизмом чаще в анамнезе отмечаются инфекции среднего уха, в связи с которыми они получали большее количество антибиотиков, чем дети из групп контроля [40], что может приводить к чрезмерному росту Desulfovibrio spp., продуцирующих пропионовую кислоту [21] и другие важные метаболиты (например, липополисахариды), потенциально вовлеченные в патогенез РАС.
Представители филов Firmicutes, Bacteroidetes и Proteobacteria были наиболее распространенными во всех исследованиях, хотя данные об их качественных и количественных соотношениях при РАС также значительно варьируют. Повышенное количество Bacteroidetes обнаружено у детей с РАС в 5 исследованиях [13, 16, 20, 25, 41]. По данным некоторых исследований, у детей с РАС отмечено значимое повышение соотношения Firmicutes/ Bacteroidetes в связи со снижением Bacteroidetes [19][31][32], в других же исследованиях показано отсутствие различий по уровням Bacteroidetes и Firmicutes между РАС и нормой [26, 42].
S.M. Finegold и соавт. [16] выявили сниженные уровни содержания представителей фила Firmicutes и относительно высокую распространенность Bacteroidetes, продуцирующих короткоцепочечные жирные кислоты, в частности пропионовую кислоту, и благодаря этому способных влиять на ЦНС и поведение при аутизме, т.к. пропионовая кислота проникает через гематоэнцефалический барьер и может оказывать влияние на нейрональную ткань [16]. М. De Angelis и соавт. продемонстрировали, что распространенность Firmicutes снижена в фекальных образцах детей с аутизмом по сравнению со здоровыми детьми, но этих различий не было получено между образцами детей с другими типами РАС (первазивным расстройством развития без дополнительных уточнений) и здоровых детей [12].
У детей с РАС зарегистрирована также большая численность бактерий рода Sutterella [43][44], в частности подтверждено наличие Sutterella spp. у более чем 50% детей с РАС и их полное отсутствие у контрольных детей. Микроорганизмы рода Sutterella были идентифицированы также при воспалительных заболеваниях кишечника, но в дальнейшем и у здоровых людей [45]. В настоящее время остается непонятным, являются ли они непатогенными представителями МК или же могут проявлять патогенность при определенных условиях. В двух других исследованиях обнаружено, что Sutterella spp. менее распространены при РАС [18][46].
Бактерии Sutterella spp. связаны с метаболизмом слизистой оболочки, и данные об их ассоциации с РАС были подтверждены другими микробиологическими исследованиями кала у детей с РАС [44]. Однако в нескольких случаях различия не были статистически значимыми между пациентами с аутизмом и их сиблингами. Поскольку имеется большое количество множественных семейных случаев РАС, была выдвинута гипотеза о том, что дети с аутизмом могут передавать свою фекальную микробиоту своим сиблингам и другим тесно контактирующим сверстникам, что приводит к развитию аутизма у предрасположенных детей [16]. Об этом также могут свидетельствовать результаты S.V. Gondalia и соавт. [47], которые показали отсутствие клинически значимых различий в характеристиках МК между детьми, страдающими аутизмом, и их нейротипическими сиблингами.
В трех исследованиях сообщалось, что уровень лактобацилл был значительно выше при РАС [19][29][31]. Особенно примечательно 32-кратное превышение Lactobacillus spp. у детей с РАС по сравнению со здоровыми детьми, полученное в исследовании J. Pulikkan и соавт. [19].
Имеются весьма многочисленные данные о снижении при аутизме уровней бактерий рода Bifidobacterium [16][24][25], которые могут оказывать защитное действие благодаря своим противовоспалительным свойствам. Но в двух работах сообщалось о значимом увеличении Bifidobacterium spp. [19][27]. Лактобациллы и бифидобактерии обычно используются в пробиотических добавках. Поэтому применение пробиотиков может способствовать увеличению числа этих бактерий. Однако использовались ли пробиотики пациентами в начале исследования, в соответствующих публикациях не уточняется.
В нескольких исследованиях сообщалось о снижении уровней Prevotella spp. при РАС, а также бактерий рода Coprococcus и семейства Veillonellaceae, ответственных за переваривание и ферментацию углеводов [17][18][31][42]. Низкая распространенность Prevotella spp. — комменсального микроорганизма, участвующего в метаболизме сахаридов и в биосинтезе витаминов, обнаружена также в слюнных пробах людей с РАС [40]. Поскольку считается, что у пациентов с аутизмом нарушено усвоение углеводов, восстановление относительного дефицита Prevotella spp. может иметь терапевтический потенциал для симптомов РАС [40]. При этом J. Plaza-Díaz и соавт. [27] выявили значительное повышение уровня Prevotella spp. при РАС.
L. Wang и соавт. [48] обнаружили снижение распространенности Akkermansia muciniphila у пациентов с РАС относительно контроля. A. muciniphila является муцин-деградирующей бактерией, обычно присутствующей в больших количествах в здоровом кишечнике. Таким образом, ее отсутствие может способствовать изменению барьерной функции слизи. И наоборот, сообщалось также о повышенных уровнях бактерий рода Akkermansia при РАС [15]. J. Plaza-Díaz и соавт. [49] на основании комплексного обследования 48 детей в возрасте 2–6 лет с РАС и их 57 здоровых сверстников с применением метагеномного подхода и использованием платформы секвенирования следующего поколения выявили, что Actinobacteria, Proteobacteria на уровне фила, а Bacilli, Erysipelotrichia и Gammaproteobacteria на классовом уровне были обнаружены в более высоких концентрациях у детей с РАС.
Перспективным методом комплексного изучения пациентов с РАС является анализ метагенома, основанный на построении метагеномных сигнатур, который позволяет оценить функциональные изменения в МК и нейромодулирующий потенциал МК человека [50]. Одним из передовых исследований с применением данного метода является работа группы российских ученых. По результатам метагеномного анализа с применением разработанного ими биоинформатического алгоритма были выявлены статистически значимые различия в таксономическом и генном составе МК детей с РАС относительно группы нейротипичных детей. Показано пониженное содержание родов Barnesiella и Parabacteroides, видов Alistipes putredinis, Bacteroides intestinihominis, Eubacterium rectale, Parabacteroides distasonis и Ruminococcus lactaris, а также увеличение представленности бактерий вида Bacteroides stercoris [50].
Другие микроорганизмы
Обсуждение
Как можно видеть из приведенных выше результатов многочисленных исследований, несмотря на большое количество публикаций по дисбиозу МК при РАС, до сих пор нет единого мнения относительно точного состава микробиома кишечника, специфичного для людей с РАС, не говоря уже о том, что некоторые исследования описывают прямо противоположные результаты [15].
Причиной противоречий может быть отсутствие однородности с точки зрения демографических характеристик, диеты, фармакологического лечения участников, географической области исследований, сопутствующих заболеваний, тяжести поведенческих и ГИ-симптомов среди включенных пациентов, а также методологии исследований. Например, микробиота фекалий молодых людей содержит пропорционально меньше бактерий, принадлежащих филу Bacteroidetes, по сравнению с пожилыми людьми [52], и профиль микробиома может варьировать в зависимости от участка ЖКТ, из которого была взята проба [28]. Следовательно, для правильного сравнения и оценки результатов необходимы исследования с однородными группами пациентов. По той же причине — большой разнородности в подходах к исследованию данной темы — в настоящее время практически нет метаанализов, которые бы позволили обобщить имеющиеся данные.
Наличие ГИ-симптомов является важным вмешивающимся фактором при изучении МК и РАС, т.к. желудочно-кишечные нарушения сами по себе, независимо от биологических механизмов, из-за кишечного дискомфорта могут влиять на поведение детей с РАС [53].
Очевидна необходимость исследований каузальности взаимоотношений МК и поведенческих нарушений, т.к. на настоящий момент существуют преимущественно гипотезы. Для этого, вероятно, необходимы не кросс-секционные исследования, а исследования с проспективным дизайном, оценкой МК с момента новорожденности до возникновения симптомов РАС, а также исследования с интервенцией с длительным динамическим наблюдением состава МК и оценкой в динамике психопатологического состояния пациента.
Огромным препятствием на пути к пониманию проблемы служит также то, что РАС не является заболеванием с единым механизмом патогенеза, это спектр, целая группа психических расстройств, имеющих разные молекулярные механизмы патогенеза. Поэтому гипотетически в разных случаях РАС роль МК в формировании психопатологических расстройств может быть принципиально различной: от минимальной и клинически незначимой (как результат особых пищевых предпочтений пациента) до максимальной патогенетически значимой (когда манифестация симптомов является преимущественным результатом тяжелого кишечного дисбиоза при наличии определенной генетической предрасположенности к психическому расстройству).
Вероятно, до тех пор, пока не будут преодолены современные трудности в классификации психических расстройств (пока не произойдет перехода от описательного подхода с опорой на внешние фенотипические признаки к подходу на основе патогенеза и с опорой на молекулярные механизмы развития заболевания), вопрос, каким образом гомогенизировать выборки в исследованиях РАС, останется актуальным. Но в то же время перехода к патогенетической классификации не произойдет, пока не будет получено достаточное количество данных о различных факторах этиологии и патогенеза.
Этот замкнутый круг в настоящее время может быть преодолен благодаря использованию исследовательского подхода с описанием максимального количества данных о пациентах, включенных в исследование, в том числе с применением новых технологий: методов секвенирования нового поколения, метаболомики с интегрированием данных транскриптомики и протеомики, а также тщательным психопатологическим описанием участников исследования стандартизированными валидизированными методами. Кроме того, учитывая большую роль в развитии РАС нарушений индивидуального развития организма на каком-либо этапе онтогенеза, очевидной становится необходимость обследования пар мать пациента–пациент для оценки возможного вклада факторов, влияющих на внутриутробное развитие плода. Причем оптимальным при этом был бы проспективный динамический дизайн исследований, в котором наблюдения проводятся с самых ранних этапов онтогенеза. Это могут быть либо исследования больших выборок из общей популяции, либо прицельные исследования семей, в которых уже есть пациенты с РАС. Подобный подход поможет более детально изучить некоторые дополнительные механизмы развития аутизма. Так, согласно одной из теорий, трансплацентарное поступление избытка некоторых аутоантител матери класса IgG к плоду ведет к патологической «перенастройке» его иммунной системы (по механизмам материнского иммунного импринтинга) [54][55]. Иммунные сдвиги у беременной женщины, проявляющиеся изменениями продукции аутоантител и цитокинов, могут быть вызваны разными факторами среды, в том числе микроэкологическими нарушениями пищеварительного и вагинального тракта, инфекциями и др. [54][55]. Трудности, связанные с большими объемами данных в таких исследованиях, трудозатратностью и высокой стоимостью методов исследования, могут быть преодолены в междисциплинарном подходе с привлечением исследователей из разных научных сфер и географических регионов.
Заключение
Таким образом, представляется актуальным дальнейшее изучение особенностей МК при РАС, поскольку имеющиеся к настоящему времени данные говорят о возможной этиопатогенетической роли кишечного дисбиоза в развитии симптомов аутизма. При этом большое количество противоречий в имеющихся к настоящему времени данных, гетерогенность состояний, включенных в понятие РАС, многофакторность этиологии этих состояний требуют обширных исследований со сложным дизайном и максимальной стандартизацией оценок как биологических показателей, так и психопатологических симптомов.
Список литературы
1. McElhanon B.O., McCracken C., Karpen S., Sharp W.G. Gastrointestinal symptoms in autism spectrum disorder: a meta-analysis. Pediatrics. 2014; 133(5): 872–83. https://doi.org/10.1542/peds.2013-3995
2. Chaidez V., Hansen R.L., Hertz-Picciotto I. Gastrointestinal problems in children with autism, developmental delays or typical development. J. Autism Dev. Disord. 2014; 44(5): 1117–27. https://doi.org/10.1007/s10803-013-1973-x
3. Wang M., Wan J., Rong H., He F., Wang H., Zhou J., et al. Alterations in gut glutamate metabolism associated with changes in gut microbiota composition in children with autism spectrum disorder. mSystems. 2019; 4(1): e00321-18. https://doi.org/10.1128/mSystems.00321-18
4. De Theije C.G., Wu J., da Silva S.L., Kamphuis P.J., Garssen J., Korte S.M. Pathways underlying the gut-to-brain connection in autism spectrum disorders as future targets for disease management. Eur. J. Pharmacol. 2011; 668(Suppl. 1): S70–80. https://doi.org/10.1016/j.ejphar.2011.07.013
5. Rose D.R., Yang H., Serena G., Sturgeon C., Ma B., Careaga M., et al. Differential immune responses and microbiota profiles in children with autism spectrum disorders and co-morbid gastrointestinal symptoms. Brain Behav. Immun. 2018; 70: 354–68. https://doi.org/10.1016/j.bbi.2018.03.025
6. Adams J.B., Audhya T., McDonough-Means S., Rubin R.A., Quig D., Geis E., et al. Nutritional and metabolic status of children with autism vs. neurotypical children, and the association with autism severity. Nutr. Metab. (Lond.). 2011; 8(1): 34. https://doi.org/10.1186/1743-7075-8-34
7. Krajmalnik-Brown R., Lozupone C., Kang D.W., Adams J.B. Gut bacteria in children with autism spectrum disorders: challenges and promise of studying how a complex community influences a complex disease. Microb. Ecol. Health Dis. 2015; 26: 26914. https://doi.org/10.3402/mehd.v26.26914
8. Hsiao E.Y., McBride S.W., Hsien S., Sharon G., Hyde E.R., McCue T., et al. Microbiota modulate behavioral and physiological abnormalities associated with neurodevelopment disorders. Cell. 2013; 155(7): 1451–63. https://doi.org/10.1016/j.cell.2013.11.024
9. Niehus R., Lord C. Early medical history of children with autism spectrum disorders. J. Dev. Behav. Pediatr. 2006; 27(2): S120–7. https://doi.org/10.1097/00004703-200604002-00010
10. Willing B.P., Russell S.L., Finlay B.B. Shifting the balance: antibiotic effects on host-microbiota mutualism. Nat. Rev. Microbiol. 2011; 9(4): 233–43. https://doi.org/10.1038/nrmicro2536
11. Sekirov I., Russell S.L., Antunes C.M., Finlay B.B. Gut microbiomes in health and disease. Physiol. Rev. 2010; 90(3): 859–904. https://doi.org/10.1152/physrev.00045.2009
12. De Angelis M., Francavilla R., Piccolo M., De Giacomo A., Gobbetti M. Autism spectrum disorders and intestinal microbiota. Gut Microbes. 2015; 6(3): 207–13. https://doi.org/10.1080/19490976.2015.1035855
13. Coretti L., Paparo L., Riccio M.P., Amato F., Cuomo M., Natale A., et al. Gut microbiota features in young children with autism spectrum disorders. Front. Microbiol. 2018; 9: 3146. https://doi.org/10.3389/fmicb.2018.03146
14. Dethlefsen L., Huse S., Sogin M.L., Relman D.A. The pervasive effects of an antibiotic on the human gut microbiota, as revealed by deep 16S rRNA sequencing. PLoS Biol. 2008; 6(11): e280. https://doi.org/10.1371/journal.pbio.0060280
15. Fattorusso A., Di Genova L., Dell’Isola G., Mencaroni E., Esposito S. Autism spectrum disorders and the gut microbiota. Nutrients. 2019; 11(3): 521. https://doi.org/10.3390/nu11030521
16. Finegold S.M., Dowd S.E., Gontcharova V., Liu C., Henley K.E., Wolcott R.D., et al. Pyrosequencing study of fecal microflora of autistic and control children. Anaerobe. 2010; 16(4): 444–53. https://doi.org/10.1016/j.anaerobe.2010.06.008
17. Kang D.W., Ilhan Z.E., Isern N.G., Hoyt D.W., Howsmon D.P., Shaffer M., et al. Differences in fecal microbial metabolites and microbiota of children with autism spectrum disorders. Anaerobe. 2018; 49: 121–31. https://doi.org/10.1016/j.anaerobe.2017.12.007
18. Kang D.W., Park J.G., Ilhan Z.E., Wallstrom G., LaBaer J., Adams J.B., et al. Reduced incidence of Prevotella and other fermenters in intestinal microflora of autistic children. PLoS One. 2013; 8(7): e68322. https://doi.org/10.1371/journal.pone.0068322
19. Pulikkan J., Maji A., Dhakan D.B., Saxena R., Mohan B., Anto M.M., et al. Gut microbial dysbiosis in Indian children with autism spectrum disorders. Microb. Ecol. 2018; 76(4): 1102–14. https://doi.org/10.1007/s00248-018-1176-2
20. Son J.S., Zheng L.J., Rowehl L.M., Tian X., Zhang Y., Zhu W., et al. Comparison of fecal microbiota in children with autism spectrum disorders and neurotypical siblings in the Simons Simplex collection. PLoS One. 2015; 10(10): e0137725. https://doi.org/10.1371/journal.pone.0137725
21. Finegold S.M. Desulfovibrio species are potentially important in regressive autism. Med. Hypotheses. 2011; 77(2): 270–4. https://doi.org/10.1016/j.mehy.2011.04.032
22. Mangiola F., Ianiro G., Franceschi F., et al. Gut microbiota in autism and mood disorders. World J Gastroenterol. 2016; (22): 361–368. https://doi.org/10.3748/wjg.v22.i1.361
23. Finegold S.M., Molitoris D., Song Y., Liu C., Vaisanen M.L., Bolte E., et al. Gastrointestinal microflora studies in late-onset autism. Clin. Infect. Dis. 2002; 35(Suppl. 1): S6–16. https://doi.org/10.1086/341914
24. Berding K., Donovan S.M. Diet can impact microbiota composition in children with autism spectrum disorder. Front. Neurosci. 2018; 12: 515. https://doi.org/10.3389/fnins.2018.00515
25. De Angelis M., Piccolo M., Vannini L., Siragusa S., De Giacomo A., Serrazzanetti D.I., et al. Fecal microbiota and metabolome of children with autism and pervasive developmental disorder not otherwise specified. PLoS One. 2013; 8(10): e76993. https://doi.org/10.1371/journal.pone.0076993
26. Ma B., Liang J., Dai M., Wang J., Luo J., Zhang Z., et al. Altered gut microbiota in Сhinese children with autism spectrum disorders. Front. Cell Infect. Microbiol. 2019; 9: 40. https://doi.org/10.3389/fcimb.2019.00040
27. Plaza-Diaz J., Gomez-Fernandez A., Chueca N., Torre-Aguilar M.J., Gil A., Perez-Navero J.L., et al. Autism spectrum disorder (ASD) with and without mental regression is associated with changes in the fecal microbiota. Nutrients. 2019; 11(2): e337. https://doi.org/10.3390/nu11020337
28. Song Y., Liu C., Finegold S.M. Real-time PCR quantitation of clostridia in feces of autistic children. Appl. Environ. Microbiol. 2004; 70(11): 6459–65. https://doi.org/10.1128/AEM.70.11.6459-6465.2004
29. Tomova A., Husarova V., Lakatosova S., Bakos J., Vlkova B., Babinska K., et al. Gastrointestinal microbiota in children with autism in Slovakia. Physiol. Behav. 2015; 138: 179–87. https://doi.org/10.1016/j.physbeh.2014.10.033
30. Parracho H.M., Bingham M.O., Gibson G.R., McCartney A.L. Differences between the gut microflora of children with autistic spectrum disorders and that of healthy children. J. Med. Microbiol. 2005; 54(Pt. 10): 987–91. https://doi.org/10.1099/jmm.0.46101-0
31. Strati F., Cavalieri D., Albanese D., De Felice C., Donati C., Hayek J., et al. New evidences on the altered gut microbiota in autism spectrum disorders. Microbiome. 2017; 5(1): 24. https://doi.org/10.1186/s40168-017-0242-1
32. Williams B.L., Hornig M., Buie T., Bauman M.L., Cho Paik M., Wick I., et al. Impaired carbohydrate digestion and transport and mucosal dysbiosis in the intestines of children with autism and gastrointestinal disturbances. PLoS One. 2011; 6(9): e24585. https://doi.org/10.1371/journal.pone.0024585
33. Liu S., Li E., Sun Z., Fu D., Duan G., Jiang M., et al. Altered gut microbiota and short chain fatty acids in Chinese children with autism spectrum disorder. Sci. Rep. 2019; 9(1): 287. https://doi.org/10.1038/s41598-018-36430-z
34. Bolte E.R. Autism and Clostridium tetani. Med. Hypotheses. 1998; 51(2): 133–44. https://doi.org/10.1016/S0306-9877(98)90107-4
35. Ding H.T., Taur Y., Walkup J.T. Gut microbiota and autism: key concepts and findings. J. Autism Dev. Disord. 2017; 47(2): 480–9. https://doi.org/10.1007/s10803-016-2960-9
36. Sandler R.H., Finegold S.M., Bolte E.R., Buchanan C.P., Maxwell A.P., Väisänen M.L., et al. Short-term benefit from oral vancomycin treatment of regressive-onset autism. J. Child Neurol. 2000; 15(7): 429–35. https://doi.org/10.1177/088307380001500701
37. Yang Y., Tian J., Yang B. Targeting gut microbiome: A novel and potential therapy for autism. Life Sci. 2018; 194: 111–9. https://doi.org/10.1016/j.lfs.2017.12.027
38. Finegold S.M. Therapy and epidemiology of autism — clostridial spores as key elements. Med. Hypotheses. 2008; 70(3): 508–11. https://doi.org/10.1016/j.mehy.2007.07.019
39. Argou-Cardozo I., Zeidán-Chuliá F. Clostridium bacteria and autism spectrum conditions: a systematic review and hypothetical contribution of environmental glyphosate levels. Med. Sci. (Basel). 2018; 6(2): 29. https://doi.org/10.3390/medsci6020029
40. Qiao Y., Wu M., Feng Y., Zhou Z., Chen L., Chen F. Alterations of oral microbiota distinguish children with autism spectrum disorders from healthy controls. Sci. Rep. 2018; 8(1): 1597. https://doi.org/10.1038/s41598-018-19982-y
41. Zhang M., Ma W., Zhang J., He Y., Wang J. Analysis of gut microbiota profiles and microbe-disease associations in children with autism spectrum disorders in China. Sci. Rep. 2018; 8(1): 13981. https://doi.org/10.1038/s41598-018-32219-2
42. Li N., Yang J., Zhang J., Liang C., Wang Y., Chen B., et al. Correlation of gut microbiome between ASD children and mothers and potential biomarkers for risk assessment. Genomics Proteomics Bioinformatics. 2019; 17(1): 26–38. https://doi.org/10.1016/j.gpb.2019.01.002
43. Cryan J.F., Dinan T.G. Mind-altering microorganisms: The impact of the gut microbiota on brain and behaviour. Nat. Rev. Neurosci. 2012; 13(10): 701–12. https://doi.org/10.1038/nrn3346
44. Williams B.L., Hornig M., Parekh T., Lipkin W.I. Application of novel PCR-based methods for detection, quantification, and phylogenetic characterization of Sutterella species in intestinal biopsy samples from children with autism and gastrointestinal disturbances. mBio. 2012; 3(1): e00261-11. https://doi.org/10.1128/mBio.00261-11
45. Hiippala K., Kainulainen V., Kalliomäki M., Arkkila P., Satokari R. Mucosal prevalence and interactions with the epithelium indicate commensalism of Sutterella spp. Front. Microbiol. 2016; 7: 1706. https://doi.org/10.3389/fmicb.2016.01706
46. Luna R.A., Oezguen N., Balderas M., Venkatachalam A., Runge J.K., Versalovic J., et al. Distinct microbiome-neuroimmune signatures correlate with functional abdominal pain in children with autism spectrum disorder. Cell. Mol. Gastroenterol. Hepatol. 2016; 3(2): 218–30. https://doi.org/10.1016/j.jcmgh.2016.11.008
47. Gondalia S.V., Palombo E.A., Knowles S.R., Cox S.B., Meyer D., Austin D.W. Molecular characterisation of gastrointestinal microbiota of children with autism (with and without gastrointestinal dysfunction) and their neurotypical siblings. Autism Res. 2012; 5(6): 419–27. https://doi.org/10.1002/aur.1253
48. Wang L., Christophersen C.T., Sorich M.J., Gerber J.P., Angley M.T., Conlon M.A. Low relative abundances of the mucolytic bacterium Akkermansia muciniphila and Bifidobacterium spp. in feces of children with autism. Appl. Environ. Microbiol. 2011; 77(18): 6718–21. https://doi.org/10.1128/AEM.05212-11
49. Plaza-Díaz J., Gómez-Fernández A., Chueca N., Torre-Aguilar M.J., Gil Á., Perez-Navero J.L., et al. Autism Spectrum Disorder (ASD) with and without mental regression is associated with changes in the fecal microbiota. Nutrients. 2019; 11(2): 337. https://doi.org/10.3390/nu11020337
50. Averina O.V., Kovtun A.S., Polyakova S.I., Savilova A.M., Rebrikov D.V., Danilenko V.N., et al. The bacterial neurometabolic signature of the gut microbiota of young children with autism spectrum disorders. J. Med. Microbiol. 2020; 69(4): 558–71. https://doi.org/10.1099/jmm.0.001178
51. Iovene M.R., Bombace F., Maresca R., Sapone A., Iardino P., Picardi A., et al. Intestinal dysbiosis and yeast isolation in stool of subjects with autism spectrum disorders. Mycopathologia. 2017; 182(3-4): 349–63. https://doi.org/10.1007/s11046-016-0068-6
52. Claesson M.J., Cusack S., O’Sullivan O., Greene-Diniz R., de Weerd H., Flannery E., et al. Composition, variability, and temporal stability of the intestinal microbiota of the elderly. Proc. Natl. Acad. Sci. USA. 2011; 108(Suppl. 1): 4586–91. https://doi.org/10.1073/pnas.1000097107
53. Bezawada N., Phang T.H., Hold G.L., Hansen R. Autism spectrum disorder and the gut microbiota in children: a systematic review. Ann. Nutr. Metab. 2020; 76(1): 1–14. https://doi.org/10.1159/000505363
54. Полетаев А.Б., Шендеров Б.А. Аутизм и аутоиммунитет: генетика или эпигенетика? Клиническая патофизиология. 2016; 22(4): 17–25.
55. Poletaev A.B., Shenderov B.A. Autism: Genetics or Epigenetics? ARC Journals of Immunology and Vaccines. 2016; 1(2): 1–7.
Об авторах
Благонравова Анна Сергеевна — д.м.н., доц., проректор по научной работе, проф. каф. эпидемиологии, микробиологии и доказательной медицины
Жиляева Татьяна Владимировна — к.м.н., доц. каф. психиатрии
Квашнина Дарья Валерьевна — к.м.н., старший преподаватель каф. эпидемиологии, микробиологии и доказательной медицины