компьютерная томография мозга кт сущность метода в психофизиологии
Нейронауки для всех. Методы: компьютерная томография
Мы уже опубликовали четыре материала, рассказывающие самые основы нейронаук. Но ни одна наука не может существовать без инструментов, которыми она получает знания. К медицинским и биологическим наукам (к коим относятся нейронауки) это справедливо вдвойне. Поэтому параллельно с общим курсом «нейрофизиологии для чайников» мы будем вести еще две серии рассказов: о методах нейронаук и о нейроанатомии, каждой из сотен деталей мозга, имеющих свою функцию и название. Сегодня мы поговорим об одном из способов узнать, что творится у нас в голове, не вскрывая черепную коробку: компьютерной томографии.
Компьютерная томография (КТ) – это не нарушающее целости тела послойное измерение плотности объекта рентгеновскими лучами с последующей математической обработкой полученных данных и построением трехмерной картины объекта.
Термин «томография», или с греческого τομή — сечение + γράφω — изображать, обозначает метод получения изображения сечений тела. При этом могут быть использованы различные способы физического воздействия на эти объекты, в том числе — рентгеновские лучи. В литературе под термином «компьютерная томография» или «компьютерная аксиальная томография» (КАТ) принято обозначать метод получения изображений сечений тела именно с применением рентгеновского излучения.
Рис. 1. Компьютерно-томографическое изображение зкзотических фруктов
Как говорит один из ведущих специалистов страны в области лучевой диагностики Григорий Кармазановский, «компьютерная томография – основа мощи современной рентгенологии». Но разберемся подробнее, в чем же заключается столь уважаемый медиками метод?
Принцип работы
В общем виде метод КТ основан на технике последовательного, сканирующего просвечивания тонким рентгеновским лучом объекта исследования (например, головы) с дальнейшей регистрацией не поглощенной части пучка, который проходит через объект под разными углами. После этого идет специфическая двумерная сортировка и «расфасовка» коэффициентов поглощения лучей в тканях, а затем — математическое восстановление полученного слоя. По этой модели выстраивается картина распределения коэффициентов в пространстве и с помощью компьютера преобразуется в изображение на экране, доступное визуальному и количественному анализу.
Проще говоря, три базовые идеи КТ в том, чтобы:
— просветить слои тела узким пучком рентгеновских лучей,
— зафиксировать и перевести в «цифру» те моменты, когда луч, проходя сквозь тело и поглощаясь тканями, ослабевает,
— провести математическую и визуальную реконструкцию цифрового изображения объекта по различным проекциям луча.
Рис. 2. Четыре поколения компьютерных томографов.
Рис. 3. Схема важнейших компонентов компьютерного томографа. Коллиматор – устройство для получения параллельных пучков лучей. Для КТ может представлять собой отверстия в свинцовой пластине.
Чем КТ отличается от обычной рентгенографии?
Фундаментальное отличие КТ от рентгенографии в том, что томографическое изображение непосредственно не связано с принятым излучением, а представляет собой результат точных измерений и вычислений данных там, где рентгеновское излучение при приеме детектором ослабляется. Причем, это относится только к выбранному слою.
Картина анатомического сечения органа не имеет теней, содержащихся в других слоях и не зависит от наличия или порядка чередования тканей с различной плотностью. Так же отличительно то, что метод позволяет различать ткани, даже незначительно отличающиеся между собой по поглощающей способности, что, несомненно, связано с возможностью диагностики онкологии.
Рис. 4. Слева – КТ головы, справа – рентгенограмма. Salamon G., Huang Y. P. Computed tomography of the brain: atlas of normal anatomy. – Springer Science & Business Media, 2012
История создания
История компьютерной томографии начинается в 1895 году, когда Вильгельм Конрад Рентген открыл новый вид лучей, которое позже назвали рентгеновским излучением. В 1917 году Иоганн Радон, австрийский математик, создал интегральное преобразование (сейчас оно называется преобразование Радона), легшее в основу математического обеспечения работы томографов.
Рис 4. Иоганн Радон
Рис 5. Двумерное преобразование Радона.
В данном случае R(s,α) есть интеграл от f(x,y) вдоль прямой AA ‘
В 1963-1964 годах Аллан Кормак опубликовал несколько своих работ посвященных технике расчета распределения поглощения рентгеновских лучей в теле человека, но в тот момент научное сообщество не обратило должного внимания на эти факты. В 1972 году он совместно с Годфри Хаунсфилдом — инженером из EMI (Electric and Music Industries — крупнейшая британская звукозаписывающая компания) — сконструировал EMI-сканер, первый компьютерный рентгеновский томограф. В 1971 году провели первые успешные клинические испытания прибора (публично об этом объявили в 1972 году). За разработку компьютерной томографии Годфри Хаунсфилд и Аллан Кормак удостоились Нобелевской премии по физиологии и медицине в 1979 году. В 1989 году появилась спиральная КТ — совмещающая в себе непрерывное вращение источника рентгеновских лучей вокруг стола и непрерывного движения стола с пациентом вперед вдоль продольной оси. Через 10 лет появилась многослойная КТ — в окружности томографа расположились несколько рядов детекторов, разработчики создали новую геометрическую форму пучка. Сегодня существует огромное количество разновидностей КТ — многосрезовые (от самого распространенного 16-срезового до 320-срезового сканирования), КТ с двумя источниками излучения, КТ с рентгеноконтрастным усилением.
Контрастное усиление лежит в основе КТ-ангиографии, позволяя получить подробное трехмерное изображение сосудов. Почему это так важно? Трехмерное изображение позволяет планировать хирургические операции индивидуально для каждого пациента, снижая риск осложнений. Также 3D-реконструкции используют, анализируя вовлеченность сосудов в опухолевый процесс.
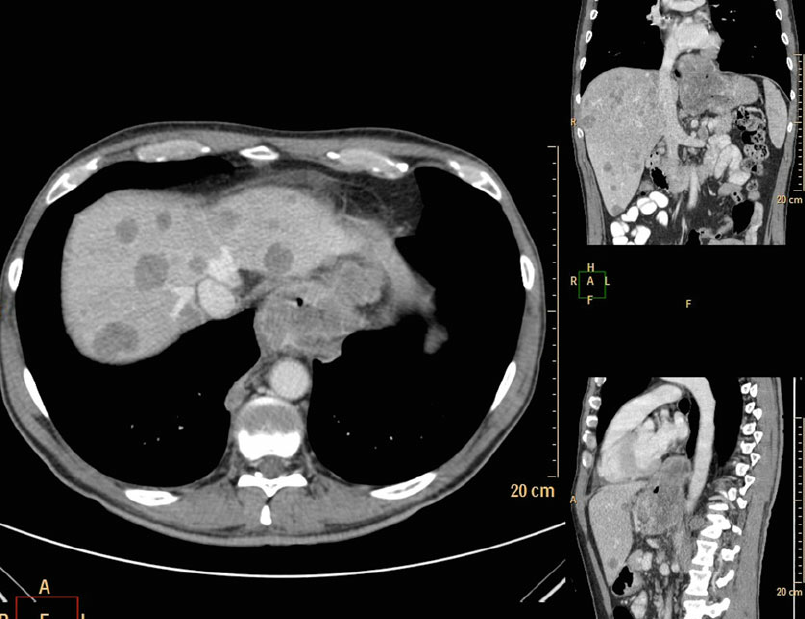
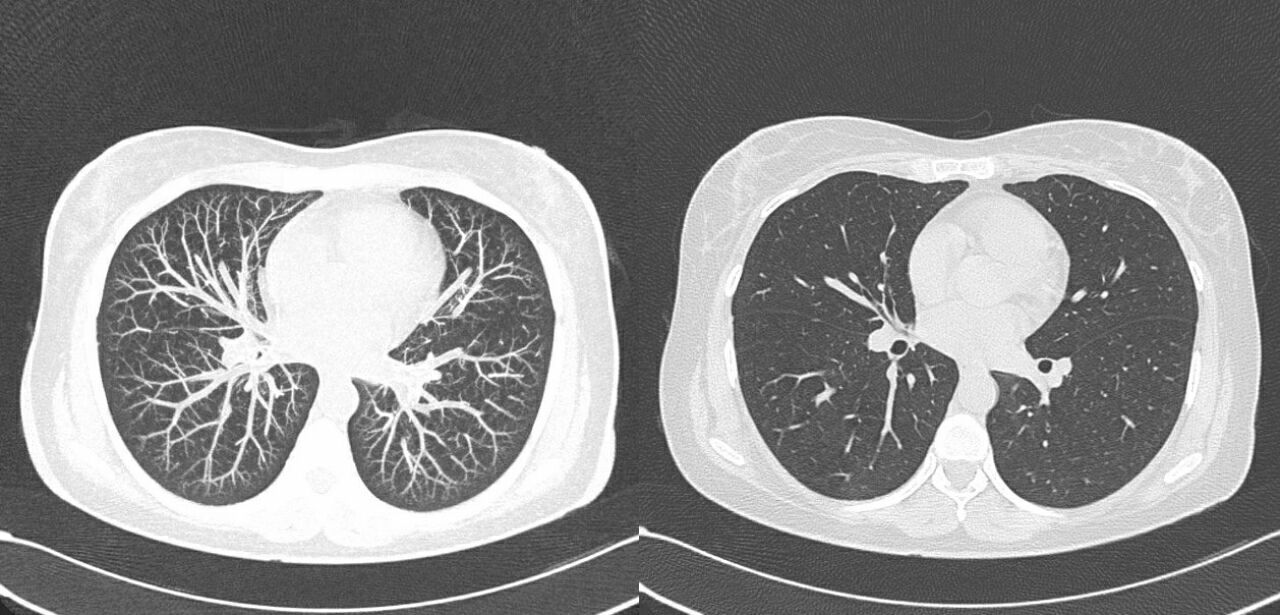
Первые томографы предназначались только для исследования головного мозга. Однако быстрое развитие вычислительной техники позволило к 1976 году создать томограф для исследования всего тела. Сегодня КТ используют и как метод первичной диагностики, и как уточняющую методику при заболеваниях головного мозга, позвоночника, легких и средостения, печени, почек, поджелудочной железы, надпочечников, аорты и легочной артерии, сердца и ряда других органов и крупных сосудов.
Более того, использование внутривенных или пероральных контрастных препаратов (как правило, содержащих йод) позволяет точнее дифференцировать ткани и органы друг от друга. Кроме этого, метод КТ используется в качестве дополнительного визуализационного инструмента при позитронной эмиссионной томографии (так называемый комплекс ПЭТ-КТ).
Рис. 6 Слева – КТ-ангиография сосудов и шеи, справа — многослойный спиральный компьютерный томограф Aquilion 64 (Toshiba).
Литература:
1. Kalender W. A. Computed tomography: fundamentals, system technology, image quality, applications. – John Wiley & Sons, 2011.
2. Компьютерная томография – основа мощи современной рентгенологии. Г.Г. Кармазановский. Медицинская визуализация 2005г №6 с.139
3. Учебник. Компьютерная томография мозга, Н.В. Верещагин, 2002 г.
5. Salamon G., Huang Y. P. Computed tomography of the brain: atlas of normal anatomy. – Springer Science & Business Media, 2012.
Основы компьютерной томографии
В 1886 году, на следующий год после открытия Вильгельмом Рентгеном «икс-лучей», знаменитый изобретатель Томас Эдисон публично заявил, что намерен получить первый рентгеновский снимок «живого мозга». Однако уже через несколько недель работы великому ученому пришлось признать свою неудачу — ему так и не удалось создать технологию, позволяющую рентгеновским лучам «заглянуть внутрь» плотной структуры костей черепа, сохранив данные о мягкой ткани мозга. Такой возможности человечеству пришлось подождать до конца следующего века, пока в 1972 году не был предложен метод компьютерной томографии.
Сегодня компьютерная томография считается сравнительно простым, доступным и повсеместно используемым диагностическим методом.
Принцип получения изображений
Компьютерная томография базируется на рентгеновском излучении и его детектировании. Это особый вид электромагнитного излучения, которое способно проходить через непрозрачные для обычного света среды. Нужно помнить, что это излучение:
Итак, у нас есть излучатель (рентген-трубка) и детекторы. Наша задача — получить визуальное отображение аксиальных «срезов» тела пациента. Как нам нужно направить луч?
Линию, по которой проходит рентген-излучение от излучателя к детектору, как правило называют осью х, линию, которая проходит, проще говоря, от «право» к «лево» для пациента — осью у, а линию «верх-низ» пациента, то есть толщину среза — осью z.
Рисунок 1 | Направление рентгеновского луча в компьютерном томографе.
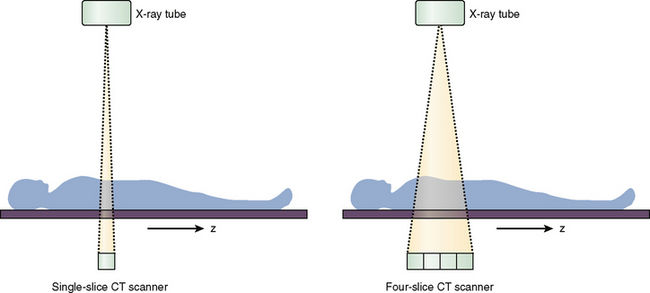
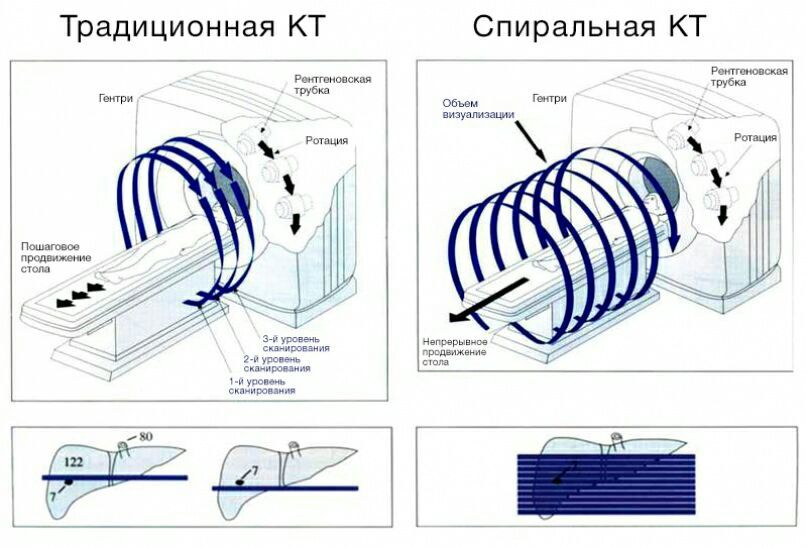
В современном компьютерном томографе рентгеновская трубка совершает спиральное вращение вокруг тела пациента в аксиальной плоскости, постоянно генерируя излучение. Если точнее, трубка вращается по кругу, и одновременно с этим непрерывно смещается вперед или назад стол с пациентом.
В традиционных пошаговых томографах происходит цикл «вращение — шаг стола — вращение».
Рисунок 2 | Принцип работы спирального и пошагового томографов. Основным недостатком пошаговых томографов является то, что при небольшом размере образования и разной глубине вдоха пациента образование может быть «пропущено».
При этом пучок излучения сформирован в виде тонкого веера — широкий по оси у, узкий по оси z. Проходя сквозь тело пациента, рентгеновское излучение ослабляется соответственно плотности ткани, через которую оно прошло, затем попадает на детекторы и регистрируется.
Детекторы в современных КТ-аппаратах расположены в несколько рядов, причем наружный ряд шире, чем внутренний. Это позволяет многократно регистрировать излучение от каждого среза, получая более точные данные и сокращая время исследования. В наиболее распространенных на сегодня типах томографов может быть от 4 или 16 до 320 рядов детекторов, как в представленном фирмой Toshiba в 2007 году AQUILION ONE. Когда Вы слышите термин «16-срезовый КТ», имеется ввиду именно количество рядов детекторов. Детекторы могут быть расположены дугой напротив излучателя и вращаться одновременно с трубкой (томографы 3-го поколения), а могут быть неподвижными и занимать всю окружность, в то время как вращается только рентгеновская трубка (4-е поколение томографов).
А дальше начинается именно то, за что Аллан Кормак и Годфри Хаунсфилд получили Нобелевскую премию в 1979 году: на основе имеющихся данных о том:
Для реконструкции используются данные от каждого луча, который проходил через выбранное поле обзора от трубки до детектора. Коэффициент ослабления для каждой точки изображения рассчитывают с помощью усреднения значений ослабления для всех лучей, пересекающих эту точку. Полученные таким образом данные называют исходными, или «сырыми». Эти необработанные данные уже представляют изображения срезов, отображенные в оттенках серой шкалы, однако нуждаются в дальнейшей обработке.
Шкала Хаунсфилда
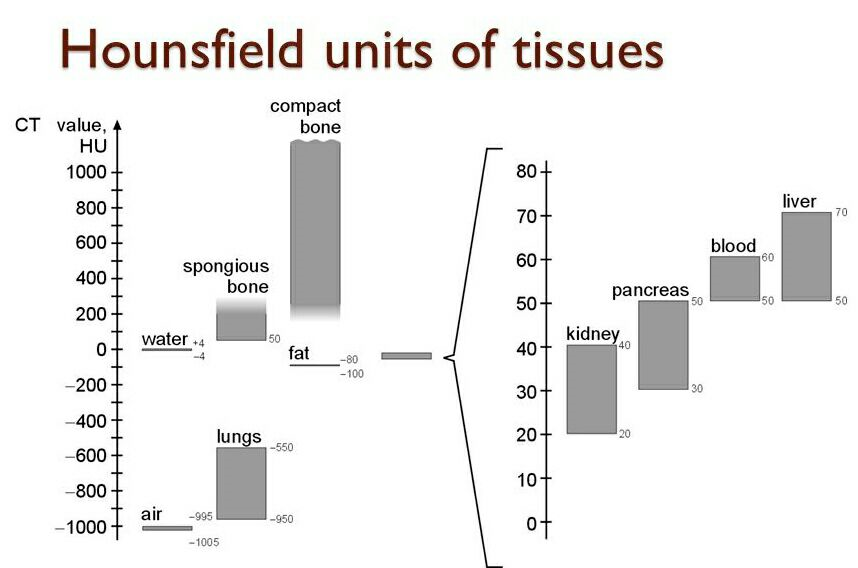
Во время реконструкции изображения каждому пикселю приписывается числовое значение, выраженное в единицах ослабления, или единицах Хаунсфилда, которое определяется тем, насколько ослабляется луч, проходя через данный воксель (единицу объема) — проще говоря, эта шкала показывает примерную плотность вещества.
Само изображение среза, каким мы увидим его на экране, получается благодаря тому, что каждый пиксель будет отображен каким-то оттенком серого в зависимости от плотности вокселя и настроек окна. Шкала Хаунсфилда начинается со значения –1000 HU (hounsfield unit) для воздуха, значение 0 HU задано для воды, жир занимает значения от –120 до –90 HU, нормальная ткань печени — 60–70 HU, кровь — 50–60, костная ткань — 250 и выше. Верхний предел шкалы колеблется от +1000 до более чем +3000 для разных томографов. Программы-просмотрщики КТ-изображений всегда имеют возможность вычислить среднюю плотность выделенной области, ведь отличить разницу в 10–15 HU «на глаз» трудно, но разница эта может быть значима, например, для диагностики жирового гепатоза, степени накопления новообразованием контраста и т. д.
Рисунок 3 | Шкала Хаунсфилд.
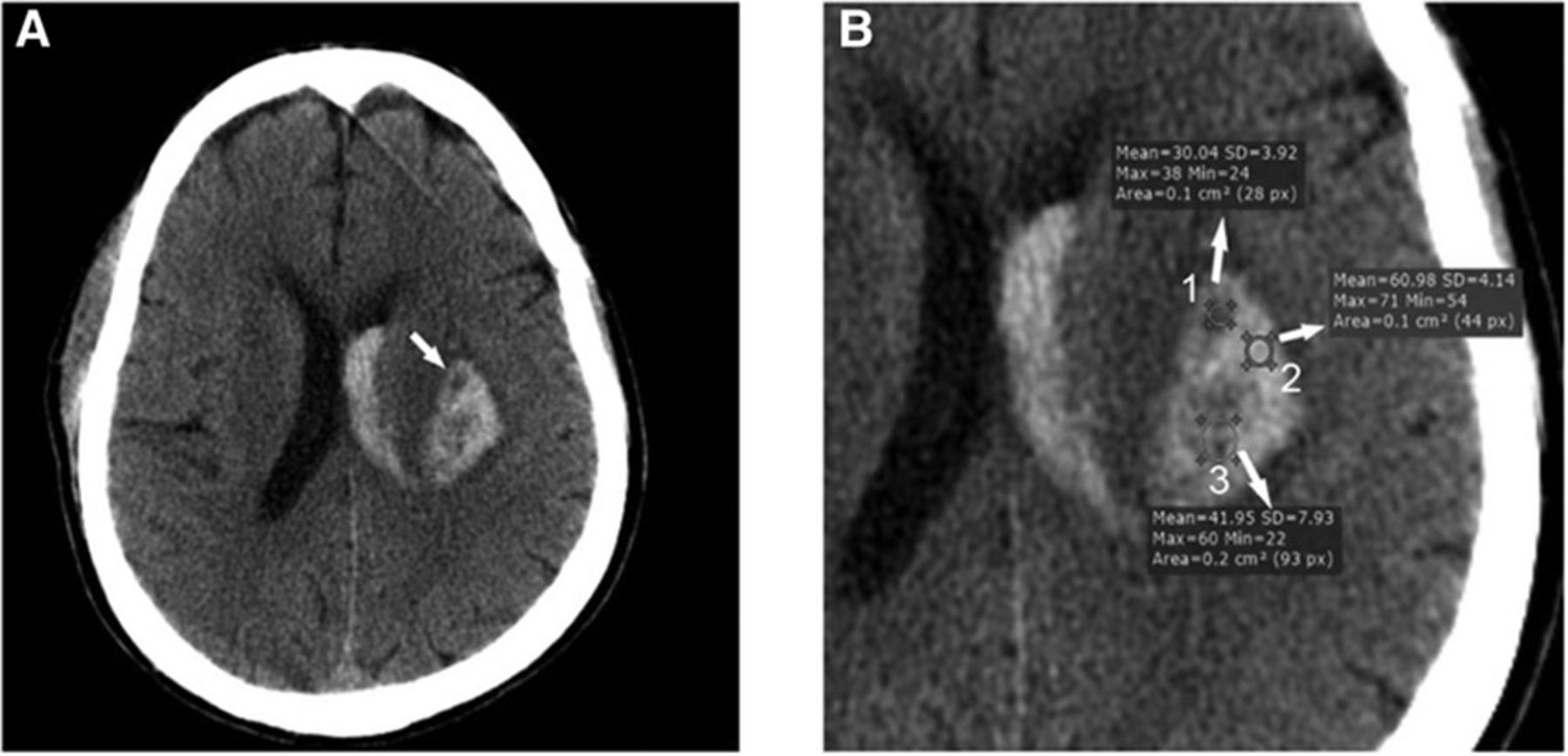
Рисунок 4 | Измерение плотности внутримозговой гематомы: область под номером 2 имеет типичную для крови плотность 60 HU. Область сниженной плотности под номером 1 представляет собой проявление симптома «черной дыры», область под номером 3 представлена как пример неправильного проведения денситометрии (выделенная область интереса гетерогенна, поэтому полученные показатели усреднены).
Функция «окон»
Для визуальной оценки КТ-изображений важны настройки окна. Дело в том, что человеческий глаз не способен различить несколько тысяч оттенков серого, и, чтобы различить близкие по значению плотности, но все же разные структуры, изображение рассматривают в определенном окне. Например, ширина костного окна — 2000 HU, уровень — 500 HU. Это значит, что структуры плотностью 500 HU отобразятся на экране в виде средне-серого цвета, значениям 500 HU до –500 HU будут присвоены оттенки от средне- до очень темно-серого, а структуры плотностью ниже –500 будут отображены слишком темными, чтобы четко их дифференцировать. Структуры плотность выше 1500 HU будут, соответственно, слишком светлыми.
Рисунок 5 | КТ-сканы мозга в «мозговом» (слева) и «костном» (справа) окнах.
Обработка данных
Но вернемся к полученным в результате первичной алгебраической обработки данным. Если перевести «сырые» данные в изображения, то они получатся нерезкими и с размытыми контурами, поэтому для дальнейшей обработки применяют математическую фильтрацию с усилением контуров (конволюцию).
Кернель, или ядро конволюции заложено в протоколе исследования и обработки данных, однако радиолог может менять его по своему усмотрению, задав более «жесткий» или «мягкий» кернель. Например, для сред с высоким естественным контрастом (ткань легкого, костные структуры) применяют жесткий кернель, для органов брюшной полости (низкий естественный контраст) — мягкий. Есть возможность применить разный кернель конволюции к одному и тому же массиву сырых данных, например, после сканирования головы пациента с подозрением на черепно-мозговую травму создать одну серию изображений с жестким кернелем для четкой визуализации костей черепа, а вторую — с мягким кернелем, на ней будут хорошо визуализированы ткани мозга и мозговых оболочек. Каждая серия анализируется радиологом отдельно.
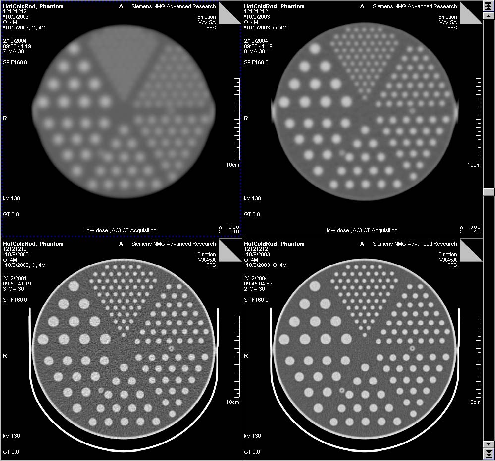
Рисунок 6 | КТ-сканы «фантома» (объекта с внутренней структурой разных плотностей, который используется для проверки и калибровки томографа) с разным кернелем конволюции и силой тока: слева вверху — «мягкий» кернель AC05s, справа вверху — AC10s, внизу слева — стандартный кернель B40s с низкой силой тока 30 mAs, внизу справа — стандартные кернель и сила тока 140 mAs.
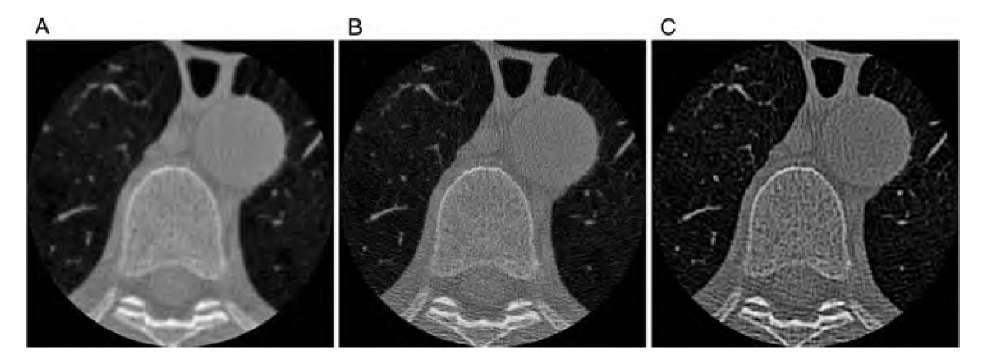
Рисунок 7 | КТ-сканы грудного отдела позвоночника с применением «стандартного» (А), «костного» (В) и «легочного» (С) кернеля конволюции.
Еще один важный параметр реконструкции изображения — толщина среза. Его минимальное значение определено параметрами сканирования (проще говоря, толщиной луча). Тонкие срезы используются там, где нужно визуализировать множество мелких контрастных структур — например, при томографии височной кости. Однако чем тоньше срезы, тем больше время сканирования и лучевая нагрузка на пациента.
Для дальнейшей удобной работы с полученными после первичной обработки исходными данными в КТ применяют инструменты постпроцессинга. Наиболее частые — это мультипланарная реконструкция (MPR), позволяющая из аксиальных сканов построить коронарные и саггитальные изображения.
Проекция максимальной интенсивности (MIP) строится таким образом: для каждой координаты XY представлен только пиксель с наивысшим номером Хаунсфилда вдоль оси z, так что в одном двумерном изображении наблюдаются все самые плотные структуры в данном объеме. MIP используют для визуализации костных структур или контрастированных сосудов.
Рисунок 8 | Аксиальный КТ-скан (слева), корональная (вверху) и саггитальная (внизу) мультипланарные реконструкции.
Рисунок 9 | Использование MIP для просмотра ангиографии сосудов легких.
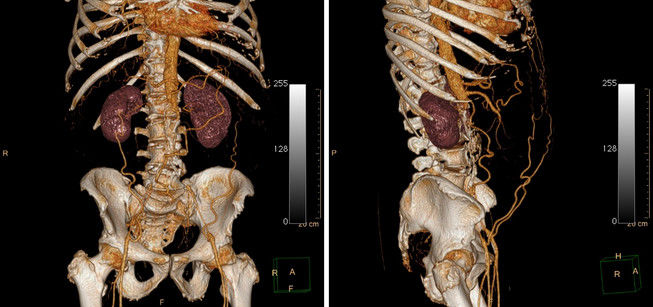
Другой метод — 3D-рендеринг, позволяющий восстановить из исходных данных, подходящих по определенный критерий (чаще всего это также структуры наивысшей плотности — кости и кровь, содержащая контрастное вещество) трехмерную модель. Работая на станции, радиолог может рассматривать модель со всех сторон и «отрезать» лишние фрагменты изображений. Одним из видов 3D рендеринга является виртуальная эндоскопия — технология, позволяющая вывести в трехмерном изображении полый орган (чаще всего проводят виртуальные колоноскопию и бронхоскопию). Это исследование не заменяет реальной скопической процедуры, но может предоставить дополнительные данные или помочь в планировании реальной процедуры.
Рисунок 10 | 3D-реконструкция КТ органов брюшной полости и малого таза.
4D-рендеринг широко используется в основном для КТ-исследования сердца. Для этой технологии необходим томограф с возможностью синхронизировать сканирование и сердечный ритм пациента; используются томографы 4-го поколения либо мультисрезовые томографы с количеством детекторов от 64 и выше. Сканирование проводится в разные фазы сердечного цикла, затем из полученных изображений строится последовательность 3D-моделей, по очереди соединенных в «фильм», позволяющий отследить изменения во время сердечного цикла.
Использование контрастных веществ
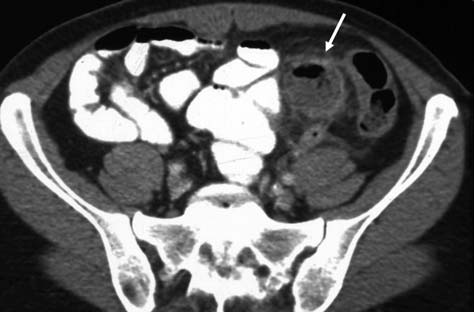
Для большинства исследований в КТ используют контрастные вещества (КВ) — вещества, содержащие йод и повышающие значения плотности среды, в которой находятся. В настоящее время выделяют ионные и неионные, мономерные и димерные йодсодержащие рентгеноконтрастные средства. Ионные КВ имеют повышенную осмолярность и в настоящее время не рекомендованы для парентерального контрастирования из-за высокой частоты побочных эффектов. Ионные КС могут быть использованы для перорального контрастирования, сиалографии (контрастирования слюнных желез) и т.д.
Рисунок 11 | КТ-сканы органов брюшной полости с пероральным контрастированием кишечника (стрелкой показан дивертикул стенки кишечника).
Существуют различные методики КТ-исследования с помощью контрастного препарата.
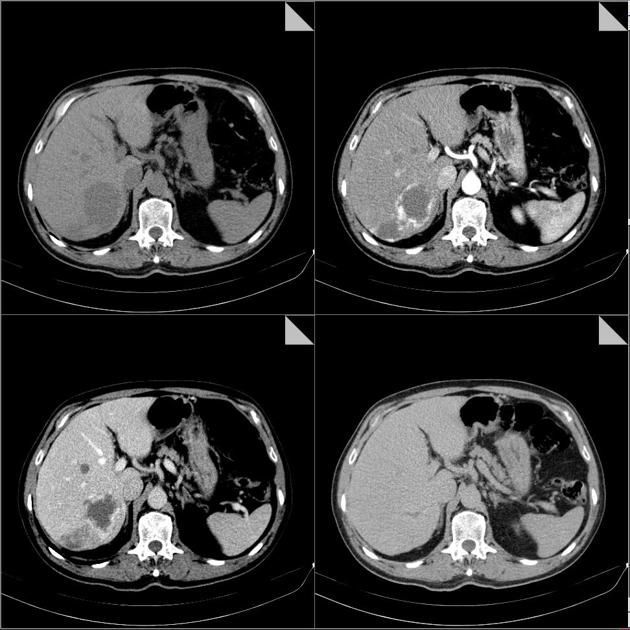
«Классическая» многофазная КТ предполагает введение сравнительно большого (обычно от 70 до 120 мл) контрастного средства со скоростью 3–4 мл/с. За этим следует несколько сканирований нужной области в определенные моменты времени — фазы. Например, исследование печени при подозрении на новообразование чаще выполняется в нативную (бесконтрастную), артериальную (контрастное вещество преимущественно в артериях, 15–40 с от начала введения), портовенозную (КВ в системе портальной вены и печеночных венах, 55–60 с) и отсроченную, или паренхиматозную (несколько минут после введения КВ) фазы. Полученные изображения позволяют не только оценить анатомию сосудов органа, но и дифференцировать найденные образования по характеру накопления КВ.
Рисунок 12 | Трехфазная контрастная КТ пациента с гигантской гемангиомой печени: нативная (бесконтрастная) фаза вверху слева; вверху справа — артериальная фаза; внизу слева — портовенозная фаза; внизу справа — отсроченная (5 мин).
Образование активно накапливает контраст и в артериальную фазу «светится» интенсивнее остальной паренхимы, а в венозную и отсроченную фазы контраст «вымывается» и образование выглядит менее плотным или таким же по плотности, как и остальная паренхима? Вероятно, это гиперваскулярная опухоль или метастаз. Не накапливает контраст (или накапливает в пределах 10 HU) и выглядит гиподенсным во всех фазах? Скорее всего, это киста.
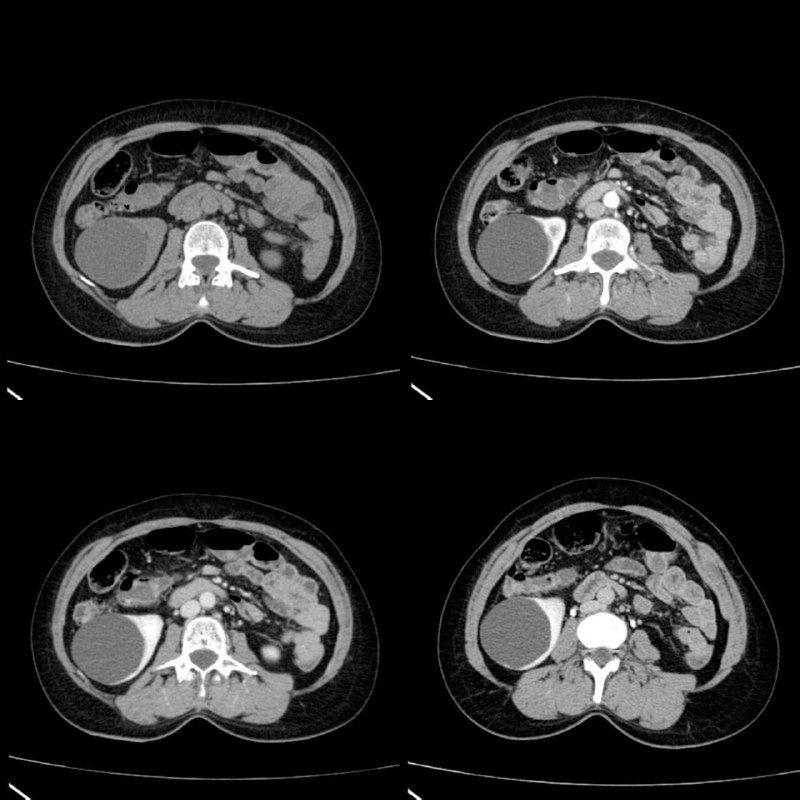
Рисунок 13 | Трехфазная контрастная КТ пациента с простой кистой почки: нативная фаза — вверху слева; вверху справа — кортикальная почечная фаза; внизу слева — паренхиматозная фаза; внизу справа — экскреторная.
Учитывая накопление КВ в определенных фазах, характер этого накопления, а также размеры, расположение и структуру образования, рентгенолог делает предположение о характере образования. Внутривенное контрастирование используется также для проведения КТ-ангиографии.
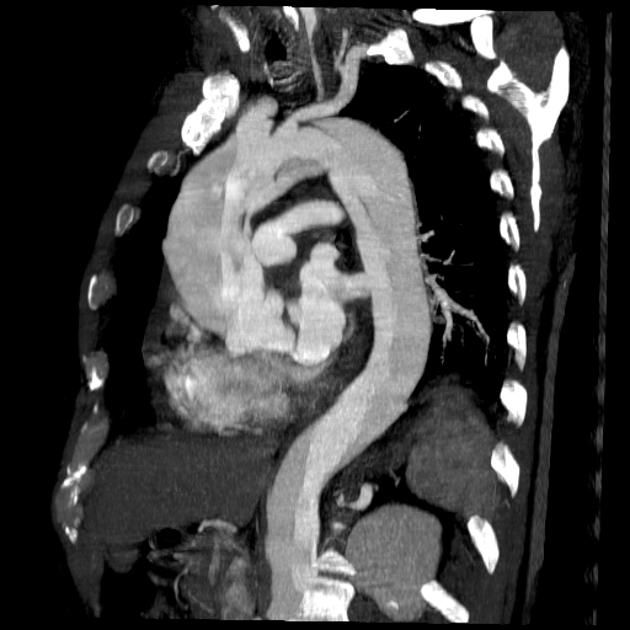
Рисунок 14 | КТ-аортография у пациента с диссекцией аорты.
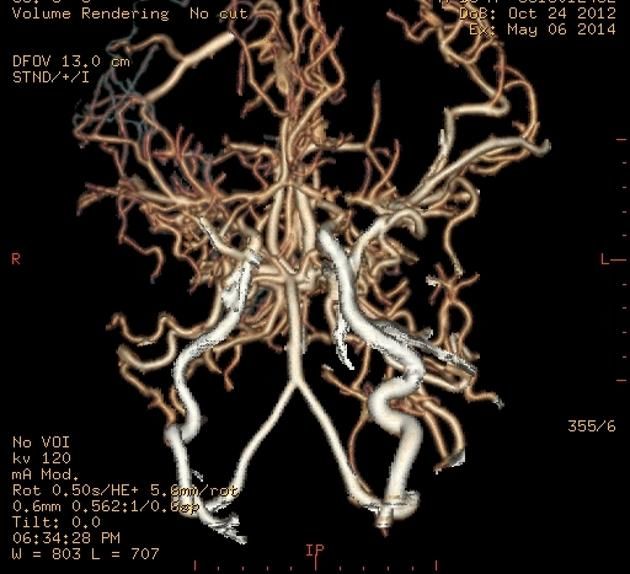
Рисунок 15 | КТ-ангиография артерий головного мозга у пациента с болезнью МояМоя (3D-реконструкция).
Перфузионная КТ используется чаще всего для диагностики нарушений мозгового кровообращения и нарушений перфузии миокарда, а также для оценки раннего ответа на химиотерапию. Эта методика позволяет отграничить зону некроза от пенумбры — зоны обратимой ишемии. Перфузионная КТ может быть выполнена на любом мультиспиральном компьютерном томографе, однако, чем больше он имеет детекторов, тем большую зону можно охватить при сканировании. Начальным этапом выполнения перфузионной КТ является нативное сканирование для исключения геморрагии, а также для выявления иной патологии головного мозга. Перфузионная КТ выполняется после внутривенного болюсного введения 40–50 мл контрастного препарата и 2030 мл физиологического раствора со скоростью 5 мл/с. После внутривенного болюсного введения контрастного препарата выполняются многократные сканирования на одном или нескольких уровнях, следующие друг за другом с минимальными промежутками времени или при непрерывной работе рентгеновской трубки. Общая длительность перфузионного исследования составляет около 1 минуты. Для получения графика контрастного усиления (зависимость плотности в единицах Хаунсфилда от времени) для каждого воксела в зоне интереса необходимо зарегистрировать множественные фазы и находить зоны, где скорость кровотока и времени транзита контрастного препарата не соответствуют объему кровотока, что и будет показателем обратимой ишемии.
Правила чтения томограмм
Можно выделить несколько основных факторов, затрудняющих чтение томограммы:
О последних поговорим подробнее.
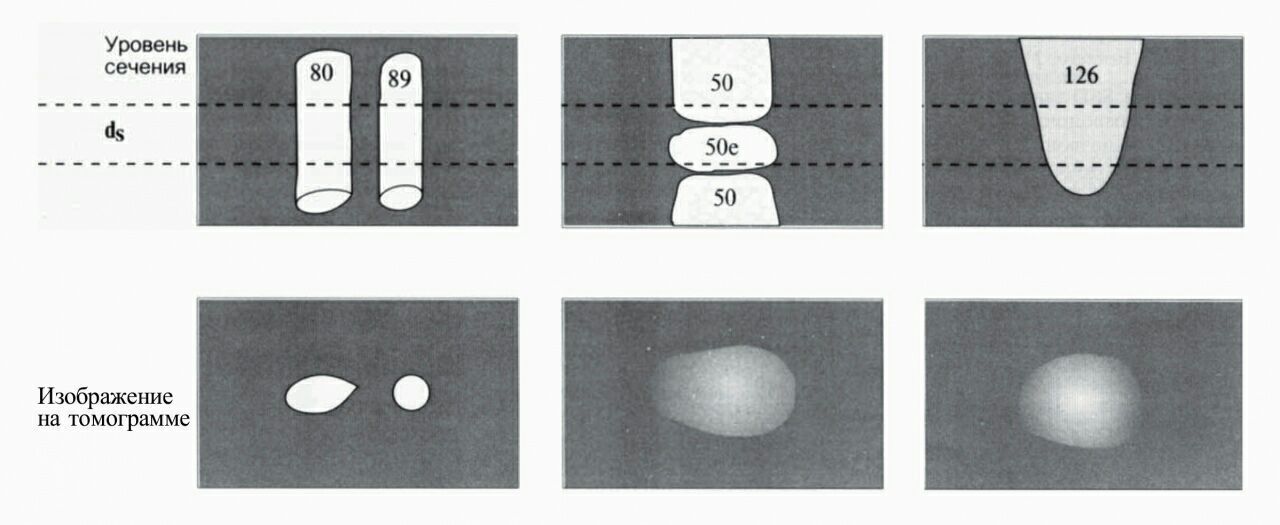
Один срез на экране представляет собой плоскостное изображение, построенное из пикселей. Однако нужно помнить, что одному пикселю на экране соответствует трехмерный воксель в реальной жизни и толщина этого вокселя соответствует толщине среза.
Допустим, в срез попала структура, которая на всей толщине среза имеет приблизительно одинаковую ширину, например, сосуд. В данном случае проблем не возникает, и структура будет иметь на сканах четкие контуры.
Но что, если срез пришелся на край позвонка? В воксель попала часть позвонка и часть межпозвоночного диска. Они имеют разную плотность и немного разные размеры. Полученные от вокселей данные суммировались, и в результате на скане появляется структура с нечеткими контурами, плотность которой представляется средней между плотностью позвонка и диска.
Еще один пример: округлой формы образование или лимфоузел. При сканировании в срез попадает часть лимфоузла, остальное — окружающая жировая клетчатка. На скане мы увидим нечеткую округлую структуру, а если захотим измерить ее плотность, значения будут средними между реальной плотностью узла и плотностью жира.
Если структура имеет коническую форму и сужается «в срезе», она также будет иметь нечеткие контуры. Примером может служить размытость контуров почки в области полюсов на томограммах. Такая же размытость появится, если, например, сосуд «делает поворот» в срезе.
Рисунок 16 | Эффеты частного объема.
Исходя из сказанного, можно дать несколько советов врачу или студенту, который осмелился открыть диск с КТ-исследованием пациента (или сесть за рабочую станцию радиолога) и проанализировать его самостоятельно:
А потому — главное правило: оценивайте изменения комплексно. Отмечайте не только изменение плотности, но и форму, объем, структуру органа; положение, форму, распространенность, контуры и структуру найденного образования и паттерн контрастного накопления. Сопоставляйте обнаруженные изменения с данными анамнеза и лабораторных исследований пациента. И помните, что любой метод имеет ограничения.
Источники: