Молекула является мельчайшей частицей чего
Атом и молекула – что это и отличия
Мельчайшие частицы – атом и молекула, об этом знают многие люди, но не все могут рассказать подробно, что же это такое. Также сложно, не имея специальных знаний, объяснить, в чем состоят отличия между этими структурами. Из различных исторических источников известно, что про эти структурные единицы знали еще древнегреческие ученые. Так философ Демокрит одним из первых высказал предположение о том, что все известная людям материя состоит из крошечных по своим размерам, неделимых человеческому глазу частиц. Их он назвал атомами. Современные ученые подтвердили эту теорию и установили опытным путем, что вещества состоят из атомов и молекул. Для того чтобы установить разницу межу этими структурными единицами, необходимо сначала дать им определение, а затем сравнить, чтобы определить, в чем состоят различия.
Определение понятий
На первых этапах изучения считалось, что атом и молекула – элементы неделимые. Более глубокие исследования и всесторонние изучения позволили опровергнуть это мнение. Сегодня этими терминами обозначают самостоятельные элементы, которые образуют все, что окружает человека.
Атомом называют мельчайшую структурную единицу, составляющую любое вещество.
Молекулой принято считать элементарную частицу, из которых состоят все окружающие людей вещества, материи и компоненты.
Сравнение
После приведенных определений можно приступить к сравнению элементарных структурных единиц вещества. Атом является наименьшей ее составляющей. Он имеет собственную массу и размер. Основная задача – определение, какими свойствами будет обладать то или иное химическое вещество.
Нужно учитывать, что атом не является конечным элементом. Он в свою очередь делится на ядро и электроны, которые совершают движение по орбите, расположенной вокруг ядра. Подобное строение и определяет, какими свойствами будет обладать то или иное вещество. Особенностью атома является то, что его невозможно увидеть вне компонента, в свободном состоянии. Все атомы имеют тесные связи между собой, которые и образуют молекулу. Происходит это благодаря электрическим зарядам частиц, из которых состоят атомы.
Молекула — это единица, составляющая вещество. В состав молекул входят атомы. Разное их количество определяет свойства. Атомы внутри молекулы имеют межатомные связи. Каждая молекула состоит из атомных ядер и внутренних электронов. Они совершают движение по своим орбитам. В состав входят также внешние валентные электроны. В разных молекулах находится разное количество атомов. Это свойство и определяет разнообразие химических веществ и компонентов. Молекула имеет сложную архитектурную постройку. Так у каждого атома свое место внутри молекулы. Количеством атомов в ней определяются свойства – химические реакции и превращения. Имеющиеся свойства влияет порядок и конфигурация соединения всех атомов. Атомная постройка, которая образует молекулу, может быть жесткой. Также бывают и исключения. Особенность мельчайшей единицы – постоянное движение. Атомы никогда не останавливаются, они продолжают колебание на положенном ему месте в молекуле, чтобы удержать равновесие.
Выводы
Атомы и молекулы – структурные единицы, образующие любое вещество. Атомы образуют молекулу. В составе атома присутствуют еще более мелкие элементы — ядро и электроны, которые движутся по своим орбитам вокруг ядра. Молекулы состоят из атомов (одного или нескольких).
Атом имеет электрический заряд (положительный или отрицательный) а молекула по этому показателю полностью нейтральная. Только молекула в веществе обладает способностью к самостоятельному существованию.
Является ли молекула мельчайшей частицей вещества: современные представления о «кирпичиках» материи
Все окружающие нас вещества являются дискретными, то есть состоят из отдельных маленьких «кирпичиков». Большинству людей известны два типа этих «кирпичиков»: молекулы и атомы. Является ли молекула мельчайшей частицей вещества? Этот вопрос рассматривается в статье.
Вопрос о структуре материи
Прежде чем переходить к ответу на вопрос о том, является ли молекула мельчайшей частицей вещества и почему, если да или нет, полезно рассмотреть появление самой концепции о дискретности материи.

Современные достижения науки во многом обязаны учениям древнегреческих философов. Не является исключением и вопрос о структуре окружающей нас материи. Многие источники свидетельствуют, что Демокрит, наблюдая за искрами, которые возникают, если потереть мехом янтарь, предположил существование элементарных частиц, которые образуют материю. Впоследствии он развил свое учение, которое сейчас принято называть атомистическим. Само слово «атом» с древнегреческого переводится как «неделимый».
Здесь важно подчеркнуть две особенности: во-первых, Демокрит не самостоятельно додумался о существовании атомов, многие идеи этого учения принадлежат его наставнику; во-вторых, имеются исторические свидетельства, что еще в XV веке в Индии существовало похожее учение о дискретности вещества, то есть за 1000 лет до рождения Демокрита!
Атомное учение о строении материи не было воспринято в Античное время (известно, что знаменитый древнегреческий философ Аристотель отвергал эту концепцию), а в Средние века вопрос о строении вещества даже не ставился, поскольку в это время наука практически не развивалась. Вспомнили об атоме только в Новое время, тогда же и появилось понятие «молекула».
«Появление» молекулы
Известный итальянский физик Амедео Авогадро в XVIII веке, изучая поведение газов, пришел к выводу, что они состоят не из атомов, а из более крупных образований, для которых он использовал название «молекула». Этот термин с латинского языка можно перевести как «маленькая масса», то есть частичка, образующая вещество. Исходя из значения самого названия, можно ответить положительно на вопрос о том, является ли молекула мельчайшей частицей вещества. Однако это будет неверно! Здесь любопытно провести аналогию с названием «атом», ведь он также не является «неделимым».
Современные представления о молекулах
Согласно современному определению, молекула – это электрически нейтральная и стабильная группа по крайней мере двух атомов, которые соединены между собой сильными химическими связями (ковалентными, ионными). К этому определению важно добавить свойство молекул объединяться в массивные тела за счет слабых сил (вандерваальсовые взаимодействия, водородные связи).
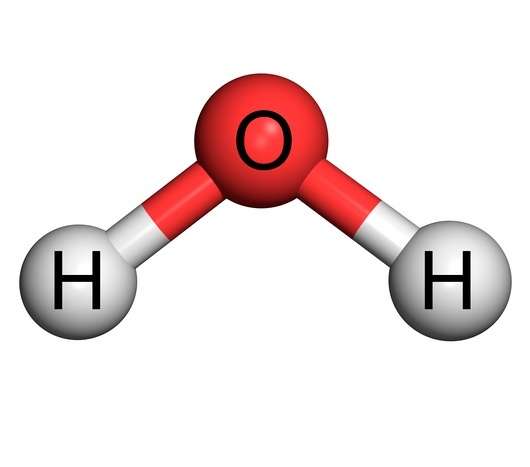
Примерами молекул является вода (H2O), кислород (O2), молекула белка, ДНК и многие другие. Раньше говорили также об одноатомных молекулах (благородные газы), однако сейчас это понятие практически не используется, поскольку одноатомная молекула является простым атомом.
Также под понятие «молекула» не попадают кристаллические и аморфные структуры. Например, в случае металлического кристалла не принято говорить о молекуле. Главным образом этим понятием оперируют в биологии и органической химии, когда говорят о белках, жирах и углеводах.
Молекула – это не мельчайшая частица вещества!
Почему не является молекула мельчайшей частицей вещества? Потому что она состоит из атомов, поэтому атом – это мельчайшая единица материи. Например, вода в виде жидкости состоит из молекул H2O, но ведь сама молекула состоит из одного атома кислорода и двух атомов водорода.
В природе много примеров веществ, которые не образованы молекулами. По сути таковыми являются многие твердые материалы неорганической химии: металлические (сталь), ковалентные (алмаз), ионные (поваренная соль) кристаллы.
В свою очередь, большинство жидкостей (вода, спирт, бензин) и газов (углекислый газ, метан) – это молекулярные структуры, то есть мельчайшим их «кирпичиком» является соответствующая молекула.
Любопытно, но на многих форумах люди отвечают положительно на вопрос о том, является ли молекула мельчайшей частицей вещества. Почему? В этом ответе делается ссылка на тот факт, что молекула сохраняет свойства конкретного вещества, если его разделить на эти «кирпичики». Этот ответ является неправильным, поскольку свойства объемной материи во многом зависят не только от молекул (если таковые в ней имеются), которые ее составляют, но и от взаимодействия между ними. Например, отдельная молекула воды не обладает теми же физическими свойствами, которые будет проявлять моль молекул воды. Более того, при уменьшении геометрических размеров системы большую роль начинают играть квантовые эффекты.
Является ли атом настоящей мельчайшей единицей материи?
После того как был разобран вопрос о том, что действительно молекулы – это мельчайшие частицы, но они не являются самыми маленькими структурными единицами материи, интересно заметить, что атому хотя и принадлежит роль самой крохотной частицы материи, все же он не является «неделимым».
Многие люди знают, что атомы состоят из протонов, нейтронов и электронов. Некоторые также знают, что протоны или нейтроны, в свою очередь, состоят из кварков. Тогда получается кварк – элементарная частица материи?
Ответ на этот вопрос не может быть однозначным. Так, ученым известны элементарные частицы класса лептонов, самой маленькой из которых является нейтрино, однако нейтрино не образует материи. К лептонам также относится и электрон, его энергия намного меньше энергии любого кварка, поэтому в энергетическом плане он может считаться элементарной частицей вещества. Тем не менее вопрос усложняется существованием некоторых современных физических теорий (например, теории суперструн), в которых выдвигаются гипотезы о существовании еще более мелких «кирпичиков» материи.
МОЛЕКУЛА
Смотреть что такое «МОЛЕКУЛА» в других словарях:
молекула — ы, ж. molecule f. Мельчайшая частица вещества, обладающая всеми его химическим свойствами, способная существовать самостоятельно. БАС 1. Молекюль. Веселитский 26. Молекула и молекюль. Михельсон 1865. Молекюла. Так называется безконечная… … Исторический словарь галлицизмов русского языка
МОЛЕКУЛА — (новолат. molecule, уменьшит. от лат. moles масса), наименьшая ч ца в ва, обладающая его осн. хим. св вами и состоящая из атомов, соединённых между собой химическими связями. Число атомов в М. составляет от двух (Н2, О2, HF, KCl) до сотен и тысяч … Физическая энциклопедия
МОЛЕКУЛА — (уменьшительная форма от лат. moles – масса) наименьшая частица химического соединения; состоит из системы атомов, с помощью химических средств может распадаться на отдельные атомы. Молекулы благородных газов, гелия и т. д. одноатомны; сложнейшие … Философская энциклопедия
молекула — эксимер, генонема, эписома, хромосома, микрочастица, макромолекула Словарь русских синонимов. молекула сущ., кол во синонимов: 10 • биомолекула (1) • … Словарь синонимов
МОЛЕКУЛА — МОЛЕКУЛА, наименьшая частица вещества, обладающая его основными химическими свойствами. Состоит из атомов, расположенных в пространстве в определенном порядке и соединенных химическими связями. Состав и расположение атомов отражены в химической… … Современная энциклопедия
МОЛЕКУЛА — (новолат. molecula уменьшит. от лат. moles масса), микрочастица, образованная из атомов и способная к самостоятельному существованию. Имеет постоянный состав входящих в нее атомных ядер и фиксированное Число электронов и обладает совокупностью… … Большой Энциклопедический словарь
МОЛЕКУЛА — МОЛЕКУЛА, молекулы, жен. (от лат. moles масса) (ест.). Мельчайшая частица вещества, способная существовать самостоятельно и обладающая всеми свойствами данного вещества. Молекулы состоят из атомов. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
МОЛЕКУЛА — МОЛЕКУЛА, ы, жен. Мельчайшая частица вещества, обладающая всеми его химическими свойствами. М. состоит из атомов. | прил. молекулярный, ая, ое. Молекулярная масса. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
Молекула — или частица система или группа атомов … Энциклопедия Брокгауза и Ефрона
МОЛЕКУЛА — [франц. molecule от лат. moles масса ] наименьшая частица данного вещества, обладающая его основными хим. свойствами, способная к самостоятельному существованию и состоящая из одинаковых или различных атомов, соединенных в одно целое хим. связями … Геологическая энциклопедия
Молекула
Особенности строения молекул определяют физические свойства вещества, состоящего из этих молекул.
Содержание
История становления понятия
На международном съезде химиков в г. Карлсруе (Германия) в 1860 году были приняты определения понятий молекулы и атома. Молекула — наименьшая частица химического вещества, обладающая всеми его химическими свойствами.
Классическая теория химического строения
В классической теории химического строения молекула рассматривается как наименьшая стабильная частица вещества, обладающая всеми его химическими свойствами.
Молекула данного вещества имеет постоянный состав, то есть одинаковое количество атомов, объединённых химическими связями, при этом химическая индивидуальность молекулы определяется именно совокупностью и конфигурацией химических связей, то есть валентными взаимодействиями между входящими в её состав атомами, обеспечивающими её стабильность и основные свойства в достаточно широком диапазоне внешних условий. Невалентные взаимодействия (например, водородные связи), которые зачастую могут существенно влиять на свойства молекул и вещества, образуемого ими, в качества критерия индивидуальности молекулы не учитываются.
Центральным положением классической теории является положение о химической связи, при этом допускается наличие не только двухцентровых связей, объединяющих пары атомов, но и наличие многоцентровых (обычно трёхцентровых, иногда — четырёхцентровых) связей с «мостиковыми» атомами — как, например, мостиковых атомов водорода в боранах, природа химической связи в классической теории не рассматривается — учитываются лишь такие интегральные характеристики, как валентные углы, диэдральные углы (углы между плоскостями, образованными тройками ядер), длины связей и их энергии.
Таким образом, молекула в классической теории представляется динамической системой, в которой атомы рассматриваются как материальные точки и в которой атомы и связанные группы атомов могут совершать механические вращательные и колебательные движения относительно некоторой равновесной ядерной конфигурации, соответствующей минимуму энергии молекулы и рассматривается как система гармонических осцилляторов.
Молекула состоит из атомов, а если точнее, то из атомных ядер, окруженных определенным числом внутренних электронов, и внешних валентных электронов, образующих химические связи. Внутренние электроны атомов обычно не участвуют в образовании химических связей. Состав и строение молекул вещества не зависят от способа его получения.
Атомы объединяются в молекуле в большинстве случаев с помощью химических связей. Как правило, такая связь образуется одной, двумя или тремя парами электронов, находящихся в совместном владении двух атомов, образуя общее электронное облако, форма которого описывается типом гибридизации. Молекула может иметь положительно и отрицательно заряженные атомы (ионы).
Состав молекулы передается химическими формулами. Эмпирическая формула устанавливается на основе атомного соотношения элементов вещества и молекулярной массы.
Геометрическая структура молекулы определяется равновесным расположением атомных ядер. Энергия взаимодействия атомов зависит от расстояния между ядрами. На очень больших расстояниях эта энергия равна нулю. Если при сближении атомов образуется химическая связь, то атомы сильно притягиваются друг к другу (слабое притяжение наблюдается и без образования химической связи), при дальнейшем сближении начинают действовать электростатические силы отталкивания атомных ядер. Препятствием к сильному сближению атомов является также невозможность совмещения их внутренних электронных оболочек.
Каждому атому в определенном валентном состоянии в молекуле можно приписать определенный атомный, или ковалентный радиус (в случае ионной связи — ионный радиус), который характеризует размеры электронной оболочки атома (иона) образующего химическую связь в молекуле. Размер молекулы, то есть размер её электронной оболочки, является величиной до известной степени условным. Существует вероятность (хотя и очень малая) найти электроны молекулы и на большем расстоянии от её атомного ядра. Практические размеры молекулы определяются равновесным расстоянием, на которое они могут быть сближены при плотной упаковке молекул в молекулярном кристалле и в жидкости. На больших расстояниях молекулы притягиваются друг к другу, на меньших — отталкиваются. Размеры молекулы можно найти с помощью рентгеноструктурного анализа молекулярных кристаллов. Порядок величины этих размеров может быть определен из коэффициентов диффузии, теплопроводности и вязкости газов и с плотности вещества в конденсированном состоянии. Расстояние, на которое могут сблизиться валентно не связанные атомы одного и того же или разных молекул, может быть охарактеризована средними значениями так называемых ван дер ваальсовых радиусов (Ǻ).
Радиус Ван-дер-Ваальса существенно превышает ковалентный. Зная величины ван дер ваальсовых, ковалентных и ионных радиусов, можно построить наглядные модели молекул, которые бы отражали форму и размеры их электронных оболочек.
Ковалентные химические связи в молекуле расположены под определенными углами, которые зависят от состояния гибридизации атомных орбиталей. Так, для молекул насыщенных органических соединений характерно тетраэдральное (четырехгранное) расположение связей, образуемых атомом углерода, для молекул с двойной связью (С = С) — плоское расположение атомов углерода, для молекул соединений с тройной связью (С º С) — линейное расположение связей. Таким образом, многоатомная молекула имеет определенную конфигурацию в пространстве, то есть определенную геометрию расположения связей, которая не может быть изменена без их разрыва. Молекула характеризуется той или иной симметрией расположения атомов. Если молекула не имеет плоскости и центра симметрии, то она может существовать в двух конфигурациях, которые представляют собой зеркальные отражения друг друга (зеркальные антиподы, или стереоизомеры). Все важнейшие биологические функциональные вещества в живой природе существуют в форме одного определенного стереоизомера.
Молекулы, содержащие единичные связи, или сигма-связи, могут существовать в различных конформациях, возникающих при поворотах атомных групп вокруг единичных связей. Важные особенности макромолекул синтетических и биологических полимеров определяются именно их конформационными свойствами.
Квантохимическая теория химического строения
В квантохимической теории химического строения основными параметрами, определяющими индивидуальность молекулы, является её электронная и пространственная (стереохимическая) конфигурации. При этом в качестве электронной конфигурации, определяющей свойства молекулы принимается конфигурация с наинизшей энергией, то есть основное энергетическое состояние.
Представление структуры молекул
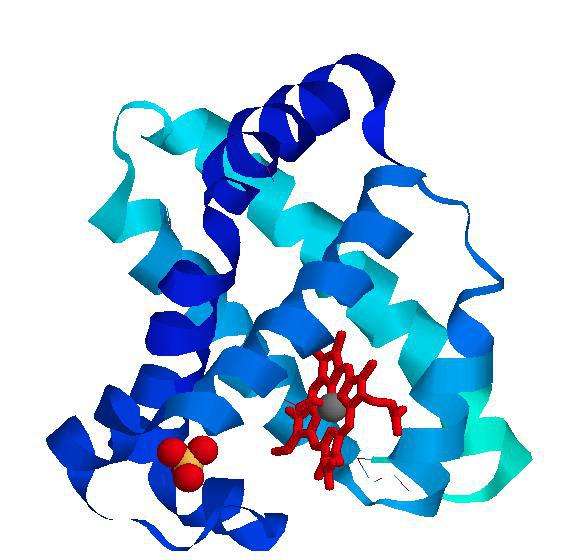
Молекулы состоят из электронов и атомных ядер, расположение последних в молекуле передаёт структурная формула (для передачи состава используется т. н. брутто-формула). Молекулы белков и некоторых искусственно синтезированных соединений могут содержать сотни тысяч атомов. Отдельно рассматриваются макромолекулы полимеров.
Взаимодействие атомов в молекуле
Природа химических связей в молекуле оставалась загадкой до создания квантовой механики — классическая физика не могла объяснить насыщаемость и направленность валентных связей. Основы теории химической связи были созданы в 1927 году Гайтлером и Лондоном на примере простейшей молекулы Н2. Позже, теория и методы расчетов были значительно усовершенствованы.
Химические связи в молекулах подавляющего большинства органических соединений является ковалентными. Среди неорганических соединений существуют ионные и донорно-акцепторные связи, которые реализуются в результате обобществления пары электронов атома. Энергия образования молекулы из атомов во многих рядах подобных соединений приближенно аддитивна. То есть можно считать, что энергия молекулы — это сумма энергий её связей, имеющих постоянные значения в таких рядах.
Аддитивность энергии молекулы выполняется не всегда. Примером нарушения аддитивности являются плоские молекулы органических соединений с так называемыми сопряженными связями, то есть с кратными связями, которые чередуются с единичными. В таких случаях валентные электроны, определяющие кратность связей, так называемые p-электроны, становятся общими для всей системы сопряженных связей, делокализованимы. Такая делокализация электронов приводит к стабилизации молекулы. Выравнивание электронной плотности вследствие коллективизации p-электронов по связям выражается в укорочении двойных связей и удлинение одинарных. В правильном шестиугольнике межуглеродных связей бензола все связи одинаковы и имеют длину, среднюю между длиной одинарной и двойной связи. Сопряжение связей ярко проявляется в молекулярных спектрах.
Современная квантовомеханическая теория химических связей учитывает частичную делокализации не только p-, но и s-электронов, которая наблюдается в любых молекулах.
В подавляющем большинстве случаев суммарный спин валентных электронов в молекуле равна нулю, то есть спины электронов попарно насыщены. Молекулы, содержащие неспаренные электроны — свободные радикалы (например, атомный водород Н, метил ·CH3), обычно неустойчивы, поскольку при их реакции друг с другом происходит значительное снижение энергии вследствие образования ковалентных связей.
Межмолекулярное взаимодействие
Межмолекулярное взаимодействие — взаимодействие между электрически нейтральными молекулами в пространстве. В зависимости от полярности молекул характер межмолекулярного взаимодействия разный. Природа последнего оставалась неясной до создания квантовой механики.
Ориентационный тип межмолекулярного взаимодействия возникает между двумя полярными молекулами, то есть, такими, которые имеют собственный дипольный момент. Взаимодействие дипольных моментов и определяет результирующую силу — притяжения или отталкивания. В случае, если дипольные моменты молекул размещаются на одной линии, взаимодействие молекул будет интенсивней.
Индукционный тип межмолекулярного взаимодействия возникает между одной полярной и одной неполярной молекулами. При этом типе взаимодействия полярная молекула поляризует неполярную молекулу так, что заряд неполярной молекулы, противоположный действующему на неё заряда полярной молекулы, смещается до последнего: в общем, положительный заряд смещается по направлению электрического поля, которое создает полярная молекула, а отрицательный — против. Это обусловливает поляризацию неполярной молекулы, то есть явления смещения связанной электронной оболочки относительно центра положительного заряда.
Дисперсионный тип межмолекулярного взаимодействия возникает между двумя неполярными молекулами. В общем, дипольные моменты неполярных молекул равны нулю, однако в определенный момент времени, есть вероятность распределения электронов по всему объёму молекулы неравномерно. Вследствие этого возникает мгновенный дипольный момент. При этом, мгновенный диполь или поляризует соседние неполярные молекулы, или взаимодействует с мгновенным диполем другой нейтральной молекулы.
Электрические и оптические свойства молекул
Поведение вещества в электрическом поле определяется основными электрическими характеристиками молекул — постоянным дипольным моментом и поляризуемостью.
Дипольный момент означает несовпадение «центров тяжести» положительных и отрицательных зарядов в молекуле (электрическую асимметрию молекулы). То есть молекулы, имеющие центр симметрии, например H2, лишены постоянного дипольного момента, и наоборот.
Поляризуемость — это способность электронной оболочки любой молекулы перемещаться под действием электрического поля, в результате чего в молекуле образуется наведенный дипольный момент. Значение дипольного момента и поляризуемости находят экспериментально с помощью измерения диэлектрической проницаемости.
Оптические свойства вещества характеризуют его поведение в переменном электрическом поле световой волны и определяются поляризуемостью молекулы этого вещества. С поляризуемостью непосредственно связаны преломление и рассеяние света, оптическая активность и другие явления, изучаемые молекулярной оптикой.
Магнитные свойства молекул
Молекулы и макромолекулы подавляющего большинства химических соединений является диамагнитными. Магнитная восприимчивость молекул (χ) для отдельных органических соединений может быть выражена как сумма значений χ для отдельных связей.
Молекулы, имеющие постоянный магнитный момент, является парамагнитными. К таковым относятся молекулы с нечетным количеством электронов на внешней оболочке (например, NO и любые свободные радикалы), молекулы, содержащие атомы с незаполненными внутренними оболочками (переходные металлы и т. д.). Магнитная восприимчивость парамагнитных веществ зависит от температуры, поскольку тепловое движение препятствует ориентации магнитных моментов в магнитном поле.
Спектры и строение молекул
Электрические, оптические, магнитные и другие свойства молекул связаны с волновыми функциями и энергиями различных состояний молекул. Информацию о состояниях молекул и вероятности перехода между ними дают молекулярные спектры.
Частоты колебаний в спектрах определяются массами атомов, их расположением и динамикой межатомных взаимодействий. Частоты в спектрах зависят от моментов инерции молекул, определение которых с спектроскопических данных позволяет получить точные значения межатомных расстояний в молекуле. Общее число линий и полос в колебательном спектре молекулы зависит от её симметрии.
Электронные переходы в молекулах характеризуют структуру их электронных оболочек и состояние химических связей. Спектры молекул, которые имеют большее количество связей, характеризуются длинноволновыми полосами поглощения, попадающими в видимую область. Вещества, которые построены из таких молекул, характеризуются окраской; к таким веществам относятся все органические красители.
Молекулы в химии, физике и биологии
Понятия молекулы является основным для химии, и большей частью сведений о строении и функциональность молекул наука обязана химическим исследованиям. Химия определяет строение молекул на основе химических реакций и, наоборот, на основе строения молекулы, определяет каким будет ход реакций.
Строению и свойствам молекулы определяются физические явления, которые изучаются молекулярной физикой. В физике понятия молекулы используется для объяснения свойств газов, жидкостей и твердых тел. Подвижностью молекул определяется способность вещества к диффузии, её вязкость, теплопроводность и т. д.. Первое прямое экспериментальное доказательство существования молекул было получено французским физиком Ж. Перреном в 1906 году при изучении броуновского движения.
Поскольку все живые организмы существуют на основе тонко сбалансированной химической и нехимической взаимодействия между молекулами, изучение строения и свойств молекул имеет фундаментальное значение для биологии и естествознания в целом.
Развитие биологии, химии и молекулярной физики привели к возникновению молекулярной биологии, которая исследует основные явления жизни, исходя из строения и свойств биологически функциональных молекул.