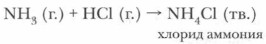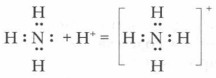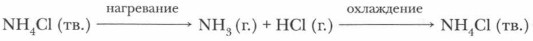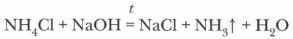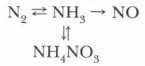Молекулы водорода сходны с молекулами аммиака чем
СРОЧНО ОТДАМ 35 БАЛЛОВ!! Молекулы водорода сходны с молекулами аммиака _______. 1 цветом 2 способностью проявлять химические св
А) Ca+o2= 2Cao
Cao+h2o=Ca(oh)2
Ca(oh)2+2hcl=cacl2+2h20
Cacl2+h2so4=Caso4+2hcl
б) fe2o3+3hcl=2fecl3+3h20
Fecl3+naoh=fe(oh)3+ nacl
2fe(oh)3= Fe2o3+ 3h20
Fe2o3+3h2so4=fe2(so4)3+ 3h20
Кислота – это сложное вещество, в молекуле которого имеется один или несколько атомов водорода и кислотный остаток.
Свойства кислот определяются тем, что они способны заменять в своих молекулах атомы водорода на атомы металлов. Например:
Давайте на примере серной кислоты рассмотрим ее образование из кислотного оксида SO3, а затем реакцию серной кислоты с магнием. Валентности всех элементов, участвующих в реакции, нам известны, поэтому напишем соединения в виде структурных формул:
Эти примеры позволяют легко проследить связь между кислотным оксидом SO3, кислотой H2SO4 и солью MgSO4. Одно «рождается» из другого, причем атом серы и атомы кислорода переходят из соединения одного класса (кислотный оксид) в соединения других классов (кислота, соль).
Кислоты классифицируют по таким признакам: а) по наличию или отсутствию кислорода в молекуле и б) по числу атомов водорода.
По первому признаку кислоты делятся на кислородсодержащие ибескислородные (табл. 8-1).
Таблица 8-1. Классификация кислот по составу.
H2SO4 серная кислота
H2SO3 сернистая кислота
HNO3 азотная кислота
H3PO4 фосфорная кислота
H2CO3 угольная кислота
H2SiO3 кремниевая кислота
HF фтороводородная кислота
HCl хлороводородная кислота (соляная кислота)
HBr бромоводородная кислота
HI иодоводородная кислота
H2S сероводородная кислота
По количеству атомов водорода, способных замещаться на металл, все кислоты делятся на одноосновные (с одним атомом водорода), двухосновные(с 2 атомами Н) и трехосновные (с 3 атомами Н), как показано в табл. 8-2:
Таблица 8-2. Классификация кислот по числу атомов водорода.
Свойства аммиака – химические и физические
Нитрид водорода с формулой NH3 называется аммиаком. Это лёгкий (легче воздуха) газ с резким запахом. Строение молекулы определяет физические и химические свойства аммиака.
Строение
Молекула аммиака состоит из одного атома азота и трёх атомов водорода. Связи между атомами водорода и азота ковалентные. Молекула аммиака имеет форму тригональной пирамиды.
На 2р-орбитали азота находится три свободных электрона. С ними вступают в гибридизацию три атома водорода, образуя тип гибридизации sp3.
Рис. 1. Строение молекулы аммиака.
Если один атом водорода заменить углеводородным радикалом (CnHm), получится новое органическое вещество – амин. Замещаться может не только один атом водорода, но и все три. В зависимости от количества замещённых атомов различают три вида аминов:
К молекуле аммиака могут присоединиться С2Н4, С6Н4, (С2Н4)2 и другие вещества, содержащие несколько атомов углерода и водорода.
Рис. 2. Образование аминов.
У аммиака и аминов остаётся свободной пара электронов азота, поэтому свойства двух веществ схожи.
Физические
Основные физические свойства аммиака:
В природе аммиак выделяется при гниении и разложении органических веществ, содержащих азот (белки, мочевина).
Химические
Основные химические свойства описаны в таблице.
Взаимодействие
Продукты реакции
Уравнение
Горит с образованием азота или взаимодействует с кислородом в присутствии катализатора (платины), образуя оксид азота
– 4NH3 +3O2 → 2N2 + 6H2O;
– 4NH3 + 5O2 → 4NO + 6H2O
2NH3 + 3Br2 → N2 + 6HBr
Гидроксид аммония или нашатырный спирт
– 2NH3 + H2SO4 → (NH4)2SO4
Замещает металл, образуя новую соль
2NH3 + CuSO4 → (NH4)2SO4 + Cu
С оксидами металлов
Восстанавливает металл, образуется азот
2NH3 + 3CuO → 3Cu + N2 + 3H2O
Рис. 3. Горение аммиака.
Что мы узнали?
Выяснили, какими свойствами обладает аммиак. Аммиак – бесцветный лёгкий газ с резким запахом. Сжижается при низкой температуре. Раствор аммиака – хороший растворитель. Способен отдавать атомы водорода, присоединяя углеводородный радикал и образуя амины. Аммиак за счёт оставшейся электронной пары азота реагирует с простыми и сложными веществами – галогенами, кислородом, водой, кислотами, солями, оксидами.
Аммиак
2. Реакции присоединения. Аммиак активно соединяется как с водой, так и с кислотами.

При взаимодействии аммиака с соляной кислотой происходит реакция присоединения:
Аммиак взаимодействует и с другими кислотами.
Продуктами взаимодействия аммиака с кислотами являются соли аммония.
Проблема. За счет чего аммиак может вступать в реакции присоединения, если все валентные электроны использованы на образование связи, а атомы азота и водорода в его молекуле имеют устойчивые электронные конфигурации?
Откуда они взялись в растворе? По всей вероятности, вследствие отнятия от молекул воды ионов водорода Н + молекулами аммиака.

Вспомните механизм образования иона гидроксония при растворении хлороводорода в воде (см. § 5). За счет неподеленной пары электронов атома азота молекулы аммиака устанавливают прочную ковалентную связь с ионом водорода молекулы воды по донорно-акцепторному механизму с образованием катиона аммония
В водном растворе ион аммония играет роль катиона, а гидроксид-ион воды создает щелочную среду.
Реакции аммиака с кислотами идут по такому же механизму, как и с Н2O.
Задание. Напишите уравнения реакций аммиака с азотной и серной кислотами. Назовите продукты этих реакций.
Соли аммония. С многоосновными кислотами аммиак образует соли двух видов: кислые, например NH4HSO4 (гидросульфат аммония), и средние, например (NH4)2SO4 (сульфат аммония).
Свойства солей аммония сходны со свойствами солей щелочных металлов, особенно солей калия и рубидия. Это белые кристаллические вещества, хорошо растворимые в воде (см. таблицу растворимости). Они сильные электролиты.
Твердые соли термически неустойчивы и при нагревании разлагаются. Если соль аммония образована летучей кислотой, то при нагревании выделяются кислота и аммиак, способные при охлаждении вновь образовать соль:

В остальном соли аммония проявляют общие свойства класса солей.
Качественной реакцией для иона аммония 


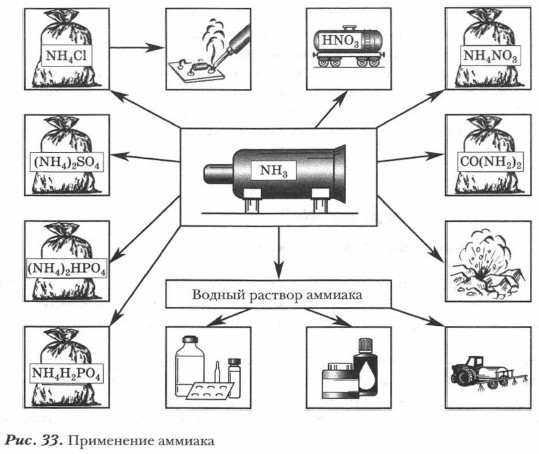
Применение аммиака и солей аммония. Большая часть аммиака используется для производства азотной кислоты и ее солей, соды, минеральных удобрений, содержащих азот. Жидкий аммиак применяют в холодильных установках. Нашатырный спирт применяют в медицине, а также в быту для выведения пятен в составе пятновыводящих смесей. Водные растворы аммиака применяют в химических лабораториях (рис. 33).
Широкое практическое применение находят и соли аммония. Нитрат аммония в смеси с сульфатом аммония используется как азотсодержащее удобрение. Нитрат аммония является компонентом при производстве взрывчатых веществ — аммоналов. Хлорид аммония (нашатырь 1 ) применяют при пайке металлов для очистки их поверхности (за счет хлороводорода, выделяющегося при разложении нашатыря), при их сварке, а кроме того — в сухих элементах (электрических батареях) в качестве электролита.
1 Нашатырь — техническое название хлорида аммония. Не путайте с нашатырным спиртом.
Способы получения аммиака • Свойства аммиака • Соли аммония • Катион аммония и механизм его образования • Качественная реакция на ион аммония




Напишите уравнения этих реакций и укажите их условия.





Сформировать систему знаний об аммиаке как водородном соединении азота, выявить практическое значение
Рассмотреть строение молекулы аммиака.
Изучить физические и химические свойства.
Создать условия для развития умений учащихся анализировать, обобщать, делать выводы, сравнивать.
Способствовать развитию навыков коммуникативного общения учащихся .
Оборудование: схемы-конспекты, реактивы для получения аммиака, соли аммония
– это те, кто на самом
I .Актуализация знаний, полученных на предыдущем уроке.
1.фронтальная беседа по прошлому уроку
а). Существует ли азот в природе как простое вещество?
б). Входит ли азот в состав сложных веществ? Приведите примеры.
в). Каково содержание азота в Земной коре как простого вещества? В составе органических веществ?
г).Каково биологическое значение азота?
д). В состав каких органических веществ входит азот и какова их роль в организме?
Какое соединение образует азот с водородом?
II . Изучение нового материала
1.Вводное слово учителя
Сегодня мы будем знакомиться с очень интересным веществом. Но прежде я приведу вам некоторые высказывания ученых :
Можно не любить химию,но прожить без нее сегодня и завтра нельзя.
Я думаю, что химики – это те, кто на самом деле понимают мир. Этот огромный мир – удел химиков.
Как вы думаете? Ученые правы, не преувеличили ли они значение химии?
Мы попробуем разобраться в этом, изучив это загадочное вещество. Вы сегодня поработаете и с опорным конспектом, и с учебником, будете заполнять таблицу, используя еще и мой рассказ и презентацию.
И так тема урока: Аммиак. Соли аммония
Прослушайте стихотворение и в конце изучения темы объясните, какие факты позволили детскому поэту написать такие строчки :
Добрый старый аммиак,
Он богач и он бедняк,
Но только, вот беда, ему
В растворе скучно одному.
Он погулять готов всегда:
Там кислота, а тут вода…
Потом, обобранный до нитки,
Он плачет: «Где мои пожитки?
Какое это беззаконие:
Стал катионом я аммония!»
История произошла во время I мировой войны. Английский крейсер вел преследование поврежденного в бою немецкого эсминца. Цель была почти достигнута, как вдруг между кораблями появилось плотное белое облако дыма. Экипаж крейсера почувствовал удушливый запах, раздражающий горло и легкие. Крейсер был вынужден дать задний ход и выйти из дымового облака. Уже после обнаружили, что пострадали не только люди, но и металлические части корабля. В последствии выяснилось: этот газ- аммиак.
В чистом виде аммиак был собран в конце XVIII века Джозефом Пристли. Он описал его свойства, но состав не определил. Определил состав аммиака Карл Бертолле. Он разложил аммиак электрическим током и получил точные данные о качественном составе.
3. особенности строения
Учащиеся работают с учебником § 23 стр., слушают рассказ учителя, просматривают презентацию и заполняют краткий конспект или опорную таблицу:
Химические св-ва, свяханные со строением
Распространение в природе
Получение в лаборатории и промышленности
Применение в быту и народном хозяйстве
Молекула аммиака имеет тетраэдрическое строение. Угол 107,3ᴼ.Связь ковалентная полярная, решетка молекулярная. Атом азота связан с атомами водорода ковалентной полярной связью. Общие электронные пары частично смещены к атому азота, поэтому молекула аммиака полярная. При этом у атома азота остаётся неподеленная электронная пара, которая принадлежит только ему. В пространстве молекула аммиака имеет форму пирамиды.
Аммиак — бесцветный газ с резким запахом, хорошо растворим в воде (нашатырный спирт),
5. химические свойства
1.5 Растворяется в воде(при 20 градусах 1 объем воды поглощает до 700 объемов аммиака):
Растворение аммиака в воде и в кислотах – процесс химический, в основе которого лежит способность молекул аммиака связывать ионы водорода. Причина этого – наличие у атома азота свободной электронной пары, которая «перетягивает» протон водорода из молекул воды и кислоты.
NH3 + HNO3 = NH4 NO3↓ нитрат аммония
Аммиак взаимодействует со всеми растворимыми в воде кислотами с образованием солей аммония
3.5. В чистом кислороде сгорает, окисляясь до азота. Аммиак загорается и горит желтовато- зеленым пламенем
Аммиак на воздухе не горит! Аммиак не горит на воздухе, но в чистом кислороде или в присутствии катализатора аммиак хорошо окисляется, проявляя свойства восстановителя.
4.5. Каталитически окисляется:
5.5. Восстанавливает сложные вещества:
6. Получение. Лаборатоный опыт
Аммиак можно получить нагреванием смеси соли хлорида аммония и гидроксида кальция. При нагревании смеси происходит реакция образования соли, аммиака и воды.
Тщательно разотрем ступкой смесь соли и основания и нагреем смесь.
Чтоб продукты не пропали
Аммиак совсем не враг.
Если обморок случился –
Может в чувство привести,
Вывести из опьяненья,
Глянец окнам навести.
III . Подведение итогов урока
1.Контроль по теме «Аммиак».Что узнали?
1)Аммиак ____________ растворяется в воде.
2)Раствор аммиака в воде называют ___________ водой или ___________ спиртом.
3)Под действием аммиака влажная фенолфталеиновая бумажка меняет свою окраску на ________________.
4)При взаимодействии аммиака с концентрированной соляной кислотой образуется вещество в виде клубов белого дыма, называемого _______________.
5)Аммиак в реакциях проявляет ______________ свойства…
6) На каких свойствах аммиака основаны методы борьбы с его утечкой?
7) На каких свойствах аммиака основано его применение в медицине, в холодильных установках?
Контроль по теме «Аммиак». Что узнали?
2)Раствор аммиака в воде называют аммиачной водой или нашатырным спиртом спиртом.
3)Под действием аммиака влажная фенолфталеиновая бумажка меняет свою окраску на малиновую .
4)При взаимодействии аммиака с концентрированной соляной кислотой образуется вещество в виде клубов белого дыма, называемого нашатырь.
5)Аммиак в реакциях проявляет основные свойства…
6) Раствор имеет щелочную реакцию, на этом основан весьма простой способ обнаружения утечки из системы хладоагрегата газообразного аммиака: посинение смоченной водой лакмусовой бумажки в парах, содержащих аммиак . взаимодействие с водой и кислотами .
7) В медицине 10% раствор аммиака, чаще называемый нашатырным спиртом.
Физиологическое действие нашатырного спирта обусловлено резким запахом аммиака, который раздражает специфические рецепторы слизистой оболочки носа и способствует возбуждению дыхательного и сосудодвигательного центров мозга, вызывая учащение дыхания и повышение артериального давления.
1)Молекула аммиака имеет неподелённую электронную пару:
А. Одну Б. Две В. Три Г. Пять
2) Какое вещество является восстановителем в реакции
А. Аммиак Б. Кислород В. Азот Г. Вода
А. Серной кислотой Б. Соляной кислотой В. Гидроксидом натрия Г. Водой
4) Установите соответствие:
Свойства азота Химические уравнения реакций
5) Составить уравнение химической реакции аммиака с азотной кислотой HNO 3.
6) Почему окрашенная в аммиаке фенолфталеиновая бумажка со временем обесцвечивается? Составьте соответствующие уравнения реакций.
1)Молекула аммиака имеет неподелённую электронную пару:
2) Какое вещество является восстановителем в реакции
В. Гидроксидом натрия
4) Установите соответствие:
Свойства азота Химические уравнения реакций
2. Реакции, связанные с образованием
5) Составить уравнение химической реакции аммиака с азотной кислотой HNO 3.