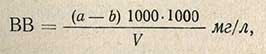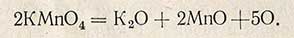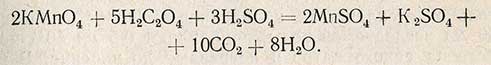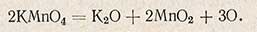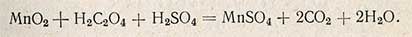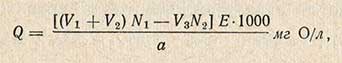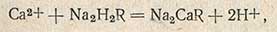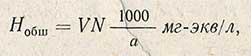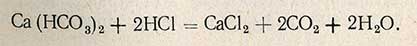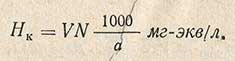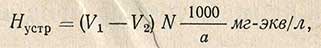пробу воды для определения окисляемости и аммиака консервируют
Отбор проб воды и их консервация
Отбор проб – операция, от правильного выполнения которой во многом зависит точность получаемых результатов.
Пробы из рек и водных потоков отбирают для определения качества воды в бассейне реки, пригодности воды для пищевого использования, орошения, для водопоя скота, рыборазведения, купания и водного спорта, установления источников загрязнения.
Для определения влияния места сброса сточных вод и вод притоков, пробы отбирают выше по течению и в точке, где произошло полное смешение вод. Пробоотборники помещают вниз по течению потока, располагая на нужной глубине.
Пробы из природных и искусственных озер (прудов) отбирают с теми же целями, что и пробы воды из рек. Однако, учитывая длительность существования озер, на первый план выступает мониторинг качества воды в течение длительного периода времени – нескольких лет (в том числе в местах, предполагаемых к использованию человеком), а также установление последствий антропогенных загрязнений воды (мониторинг ее состава и свойств). Отбор проб из озер должен быть тщательно спланирован для получения информации, к которой можно было бы применять статистическую оценку. Качество воды в озерах часто сильно различается по глубине из-за термальной стратификации, причиной которой могут быть фотосинтез в поверхностной зоне, подогрев воды, воздействие донных отложений и др. В больших глубоких водоемах может появляться также внутренняя циркуляция.
Следует отметить, что качество воды в водоемах (как озерах, так и реках) носит циклический характер, причем наблюдается суточная и сезонная цикличность. По этой причине ежедневные пробы следует отбирать в одно и то же время суток (например, в 12 часов), а продолжительность сезонных исследований должна быть не менее 1 года, включая исследования серий проб, отобранных в течение каждого времени года. Это особенно важно для определения качества воды в реках, имеющих резко отличающиеся режимы – межень и паводок.
Пробы влажных осадков (дождя и снега) чрезвычайно чувствительны к загрязнениям, поэтому пробы влажных осадков не следует отбирать вблизи источников значительных загрязнений атмосферы – например, котельных или ТЭЦ, открытых складов материалов и удобрений, транспортных узлов и др.
Пробы грунтовых вод отбирают для определения пригодности грунтовых вод в качестве источника питьевой воды, а также для технических или сельскохозяйственных целей; для определения влияния на качество грунтовых вод потенциально опасных хозяйственных объектов; при проведении мониторинга загрязнителей грунтовых вод.
Грунтовые воды изучают, отбирая пробы из артезианских скважин, колодцев, родников. Следует иметь в виду, что качество воды в различных водоносных горизонтах может значительно различаться, поэтому при отборе пробы грунтовых вод следует оценить доступными способами глубину горизонта, из которого отобрана проба, возможные градиенты подземных потоков, информацию о составе подземных пород, через которые пролегает горизонт. Поскольку в точке отбора пробы могут создаться концентрации различных примесей, отличные от их концентраций в водоносном слое, необходимо откачивать из скважины (или из родника, делая в нем углубление) воду в количестве, достаточном для обновления воды в скважине, водопроводе, углублении и т.п.
Пробы воды из водопроводных сетей отбирают в целях определения общего уровня качества водопроводной воды, поиска причин загрязнения распределительной системы, контроля степени возможного загрязнения питьевой воды продуктами коррозии и др.
Для получения репрезентативных проб при отборе воды из водопроводных сетей соблюдают следующие правила:
– отбор проб проводят после спуска воды в течение 10–15 мин – времени, обычно достаточного для обновления воды с накопившимися загрязнителями;
– для отбора не используют концевые участки водопроводных сетей, а также участки с трубами малого диаметра (менее 1,2 см);
– для отбора используют, по возможности, участки с турбулентным потоком – краны вблизи клапанов, изгибов;
– при отборе проб вода должна медленно течь в пробоотборную емкость до ее переполнения.
Отбор проб с целью определения состава воды (но не качества!) проводится также при изучении сточных вод, вод и пара котельных установок и др. Подобные работы имеют, как правило, технологические цели, требуют от персонала специальной подготовки и соблюдения дополнительных правил безопасности.
При отборе проб следует обращать внимание (и фиксировать в протоколе) на сопровождавшие отбор проб гидрологические и климатические условия, такие, как осадки и их обилие, паводки, межень и застойность водоема и др.
Пробы воды для анализа могут отбираться как непосредственно перед анализом, так и заблаговременно. Для отбора проб специалисты используют стандартные батометры либо бутыли вместимостью не менее 1 л, открывающиеся и наполняющиеся на требуемой глубине. В связи с тем, что для анализа полевыми методами по какому-либо одному показателю (за исключением растворенного кислорода и БПК) обычно достаточно 30–50 мл воды, отбор проб непосредственно перед анализом может быть выполнен в колбу вместимостью 250–500 мл (например, из состава комплекта-лаборатории, измерительного комплекта и т.п.).
Понятно, что посуда для отбора проб должна быть чистой. Чистота посуды обеспечивается предварительным мытьем ее горячей мыльной водой (стиральные порошки и хромовую смесь не использовать!), многократным споласкиванием чистой теплой водой. В дальнейшем для отбора проб желательно использовать одну и ту же посуду. Сосуды, предназначенные для отбора проб, предварительно тщательно моют, ополаскивают не менее трех раз отбираемой водой и закупоривают стеклянными или пластмассовыми пробками, прокипяченными в дистиллированной воде. Между пробкой и отобранной пробой в сосуде оставляют воздух объемом 5–10 мл. В общую посуду отбирают пробу на анализ только тех компонентов, которые имеют одинаковые условия консервации и хранения.
Для получения достоверных результатов анализ воды следует выполнять, по возможности, скорее. В воде протекают процессы окисления-восстановления, сорбции, седиментации, биохимические процессы, вызванные жизнедеятельностью микроорганизмов и др. В результате некоторые компоненты могут окисляться или восстанавливаться. Соответственно могут изменяться и органолептические свойства воды – запах, привкус, цвет, мутность. Биохимические процессы можно замедлить, охладив воду до температуры 4–5°С (в холодильнике).
Однако, даже владея полевыми методами анализа, не всегда можно выполнить анализ сразу же после отбора пробы. В зависимости от предполагаемой продолжительности хранения отобранных проб может возникнуть необходимость в их консервации. Универсального консервирующего средства не существует, поэтому пробы для анализа отбирают в несколько бутылей. В каждой из них воду консервируют, добавляя соответствующие химикаты в зависимости от определяемых компонентов.
В табл. 1 приведены способы консервации, а также особенности отбора и хранения проб. При анализе воды на некоторые показатели (например, растворенный кислород, фенолы, нефтепродукты) к отбору проб предъявляются особые требования. Так, при определении растворенного кислорода и сероводорода важно исключить контакт пробы с атмосферным воздухом, поэтому бутыли необходимо заполнять при помощи сифона – резиновой трубки, опущенной до дна склянки, обеспечивая переливание воды через край при переполнении склянки. Подробно особые условия при отборе проб (если они существуют) приводятся при описании соответствующих анализов.
| Анализируемый показатель | Способ консервации и количество консерванта на 1 л воды | Максимальное время хранения пробы | Особенности отбора и хранения проб |
|---|---|---|---|
| Активный хлор | Не консервируют | Несколько минут | — |
| Аммиак и ионы аммония | Не консервируют | 2 часа | — |
| Не консервируют | 1 сутки | Хранить при 4°С | |
| 2-4 мл хлороформа или 1 мл концентрированной серной кислоты | 1-2 суток | — | |
| Водородный показатель (pH) | Не консервируют | При отборе пробы | — |
| Не консервируют | 6 часов | В бутыли не оставлять пузырьков воздуха, предохранять от нагревания | |
| Железо общее | Не консервируют | 4 часа | — |
| 3 мл концентрированной соляной кислоты (до pH 2) | 2 суток | — | |
| Жесткость общая | Не консервируют | 2 суток | — |
| Запах(без нагревания) | Не консервируют | 2 часа | Отбирать только в стеклянные бутыли |
| Кальций | Не консервируют | 2 суток | — |
| Карбонаты | Не консервируют | 2 суток | — |
| Металлы тяжелые (медь, свинец, цинк) | Не консервируют | В день отбора | — |
| 3 мл азотной кислоты(до pH 2) | 3 суток | — | |
| То же | 1 месяц | Хранить при 4°С | |
| Мутность | Не консервируют | 2 часа | Перед анализом взболтать |
| Нефтепродукты | Не консервируют | В день отбора | Отбирать в стеклянные бутыли, для анализа используют весь объем пробы |
| 2-4 мл хлороформа | 5 суток | — | |
| Экстракция на месте отбора | 1 месяц | — | |
| Нитраты | Не консервируют | 2 часа | — |
| 2-4 мл хлороформа | 3 суток | Хранить при 4°С | |
| Нитриты | Не консервируют | 2 часа | — |
| 2-4 мл хлороформа | 3 суток | Хранить при 4°С | |
| Окисляемость бихроматная (ХПК) | Не консервируют | 4 часа | — |
| 10 мл серной кислоты | 1 сутки | Хранить при 4°С | |
| Окисляемость перманганатная | Не консервируют | 4 часа | — |
| 50 мл раствора серной кислоты (1:3) | 1 сутки | Хранить при 4°С, при определении учитывать количество прибавленной кислоты | |
| Растворенный кислород | Не консервируют | 1 сутки | Отбирать в кислородные склянки и фиксировать на месте отбора |
| Сероводород (сульфиды) | Не консервируют | 1 сутки | Отбирать в отдельные склянки и фиксировать на месте отбора |
| Сульфаты | Не консервируют | 7 суток | — |
| Сухой остаток | Не консервируют | В день отбора | — |
| 2 мл хлороформа | 1-2 суток | — | |
| Фториды | Не консервируют | 7 суток | Отбирать в полиэтиленовую посуду |
| Хлориды | Не консервируют | 7 суток | — |
| Цветность | Не консервируют | В день отбора пробы | — |
| 2-4 мл хлороформа | 1-2 суток | — |
Следует иметь в виду, что ни консервация, ни фиксация не обеспечивают постоянства состава воды неограниченно долго. Они лишь сохраняют на определенное время соответствующий компонент в воде, что позволяет доставить пробы к месту анализа – например, в полевой лагерь, а при необходимости – и в специализированную лабораторию. В протоколах отбора и анализа проб обязательно указываются даты отбора и анализа проб.
Сырье бродильных производств. Вода
Отбор средней пробы
Среднюю пробу воды из источников водоснабжения отбирают следующим образом. Пробы воды берут в стеклянные бутылки, тщательно вымытые, ополоснутые дистиллированной водой и плотно закрытые пробками. При взятии пробы бутылки несколько раз ополаскивают той водой, которую берут для исследования, затем заполняют ею и закупоривают.
При взятии проб из открытых водоемов привязывают к шесту небольшую бутылку с узким горлышком и погружают ее в воду для наполнения. Содержимое нескольких таких флаконов, взятое из разных мест и с разных глубин, составляет среднюю пробу.
При взятии пробы из водопровода надо в течение 10 мин спустить воду, чтобы в пробу не попала вода, застоявшаяся в трубах; затем, ополоснув бутылки, наполняют их исследуемой водой. Для проведения химического анализа необходимо не менее 3 л воды.
Исправленную воду отбирают после водоочистительной установки через кран после спуска воды в течение 2-3 мин.
Определение физических свойств воды
Температура воды измеряется в момент отбора пробы.
Прозрачность. Ориентировочное определение прозрачности проводят в пробирке, в которую налито 10 мл исследуемой воды. Воду в зависимости от степени прозрачности условно подразделяют на прозрачную, слабоопалесцирующую, опалесцирующую, слегка мутную, мутную и сильно мутную.
Цветность. Определение цветности проводят в прозрачной воде. Если вода непрозрачна, ее фильтруют. Пробирку наполняют исследуемой водой почти доверху, ставят на белую бумагу и, глядя сверху, определяют цветность. Цветность воды характеризуют следующим образом: бесцветная, зеленоватая, желтая, бурая и т.п.
Запах. Запах определяют при 18-20° С органолептически. Исследуемую воду наливают в колбу емкостью 200-250 мл с широким горлом примерно на 2/3 ее объема. Накрывают колбу часовым стеклом, встряхивают вращательными движениями в закрытом состоянии, открывают, быстро втягивают носом воздух из колбы и отмечают запах: без запаха, сероводородный, болотный, гнилостный, плесневой и т.д. Интенсивность запаха оценивают по шкале: нет, очень слабый, слабый, заметный, отчетливый, очень сильный.
Вкус. Определение вкуса проводят при температуре 18-20° С. Набирают в рот примерно 15 мл воды и держат во рту несколько секунд; проглатывать воду не следует. Различают соленый, горький, сладкий и кислый вкус. Остальные вкусовые ощущения называют привкусами. Интенсивность вкуса оценивают по такой же шкале, что и запах. Явно недоброкачественную воду на вкус пробовать не следует.
Определение содержания взвешенных веществ
В бюкс помещают фильтр и высушивают 2,5-3 ч в сушильном шкафу при температуре 105-110° С до постоянной массы. После взвешивания фильтр осторожно вынимают, вставляют в воронку и слегка увлажняют несколькими каплями дистиллированной воды.
Пробу исследуемой воды хорошо взбалтывают, быстро отбирают из нее мерным цилиндром 500-1000 мл и фильтруют через приготовленный фильтр, перенося при этом на фильтр все взвешенные в воде частицы. Затем цилиндр промывают 2-3 раза дистиллированной водой, также пропуская ее через фильтр (промывные воды отделяют, не смешивая с профильтрованной исследуемой водой). Осадок взвешенных частиц вместе с фильтром переносят в тот же бюкс, в котором высушивали фильтр, и высушивают при 105-110° С до постоянной массы. Содержание взвешенных веществ (ВВ) вычисляют по формуле
Ниже излагаются определения плотного остатка, окисляемости, жесткости воды, которые проводят в фильтрованной воде. Качественные и количественные определения катионов и анионов в воде из-за недостатка места опущены. Их можно найти в учебниках по аналитической химии и в специальных руководствах по анализу воды, в том числе: М. А. Ананьевская, Л. Г. Щекатурина. Руководство по химическому анализу воды. Новочеркасский политехнический институт. Новочеркасск, 1960; А. А. Резников, Е. П. Муликовская, И. Ю. Соколов. Методы анализа природных вод. Госгеолтехиздат, 1963.
Определение плотного (сухого) остатка
250 мл профильтрованной исследуемой воды (после определения взвешенных веществ) выпаривают на водяной бане в прокаленной и взвешенной платиновой или фарфоровой чашке, наполняя ее по мере испарения воды не более чем на половину объема. После испарения воды чашку с осадком высушивают (2,5-3 ч) в сушильном шкафу при 105-110° С до постоянной массы. Массу осадка в миллиграммах умножают на 4 (взято 250 мл воды) и находят содержание сухого остатка в мг в 1 л воды.
Определение окисляемости воды
Окисляемостью воды называют способность веществ, содержащихся в воде, реагировать с окислителями. Величину окисляемости выражают числом миллиграммов кислорода, необходимым для окисления веществ, содержащихся в 1 л исследуемой воды. Окисляемость характеризует степень загрязненности воды органическими веществами. Наиболее распространенным методом определения окисляемости воды является перманганатный метод, основанный на окислении органических веществ перманганатом калия при нагревании.
Избыток введенного перманганата калия титруют раствором щавелевой кислоты. Реакция протекает по уравнению
Значительное содержание хлор-иона оказывает влияние на реакцию окисления в кислой среде:
В этом случае окисление необходимо вести в щелочной среде; реакция протекает по уравнению
Избыток введенного перманганата калия в этом случае также оттитровывают щавелевой кислотой в кислой среде. Выпавшая двуокись марганца при этом восстанавливается щавелевой кислотой по уравнению
Ход определения в кислой среде
В коническую колбу емкостью 250 мл опускают несколько стеклянных капилляров, вносят пипеткой 100 мл исследуемой воды, прибавляют 5 мл разбавленной серной кислоты (1:3) и 10-15 мл 0,01 н. раствора перманганата калия; при этом должна появиться интенсивная розовая окраска. Колбу закрывают часовым стеклом, нагревают до кипения и кипятят точно 10 мин, наблюдая все время за окраской.
Если окраска жидкости во время кипячения сильно ослабевает, то прибавляют еще несколько миллилитров 0,01 н. раствора перманганата калия и снова кипятят. После кипячения колбу снимают с нагревательного прибора, вносят в нее 10 мл 0,01 н. раствора щавелевой кислоты и сразу титруют обесцвечивающийся горячий раствор 0,01 н. раствором перманганата калия, прибавляя его по каплям до появления слабо-розовой окраски, не исчезающей в течение 1 мин.
Ход определения в щелочной среде
В коническую колбу емкостью 250 мл опускают несколько стеклянных капилляров, вносят пипеткой 100 мл исследуемой воды, прибавляют 0,5 мл 50%-ного раствора едкого натра и нагревают до кипения. В начале кипения прибавляют 10-15 мл 0,01 н. раствора перманганата калия и кипятят точно 10 мин, закрыв колбу часовым стеклом. После кипячения колбу снимают с нагревательного прибора, охлаждают до 50-60° С, прибавляют 5 мл раствора серной кислоты (1:3) и 10 мл 0,01 н. раствора щавелевой кислоты. Раствор после обесцвечивания титруют 0,01 н. раствором перманганата калия до появления слабо-розовой окраски, не исчезающей течение 1 мин.
Расчет окисляемости воды
Окисляемость воды рассчитывают по формуле
Определение жесткости воды
Различают жесткость воды общую, временную (устранимую), постоянную (неустранимую), карбонатную и некарбонатную. Общая жесткость воды обусловлена общим содержанием в ней ионов кальция и магния. Временной жесткостью называют жесткость, которая обусловлена присутствием в воде гидрокарбонатов кальция и магния; при кипячении гидрокарбонаты кальция и магния превращаются в карбонаты и выпадают в осадок. Постоянная жесткость обусловлена присутствием главным образом хлоридов и сульфатов кальция и магния. Общая жесткость равна сумме временной и постоянной жесткости. Карбонатная жесткость обусловлена наличием в воде гидрокарбонатов не только кальция и магния, но и натрия, калия, железа, алюминия, а также карбонатов этих же катионов. Карбонатную жесткость выражают в миллиграмм-эквивалентах гидрокарбонат- и карбонат-ионов (HCO3- + СО32-) в 1 л воды. Когда число миллиграмм-эквивалентов НСО3- и СО32- в воде больше суммы миллиграмм-эквивалентов кальция и магния, то карбонатную жесткость считают равной общей жесткости.
Из приведенного уравнения видно, что при титровании трилоном Б ионы кальция выводятся из раствора и появляются ионы водорода. Для их связывания необходимо поддерживать pH 8-10, что достигается прибавлением аммиачного буферного раствора. Если в раствор, содержащий ионы кальция или магния, ввести индикатор, дающий цветные соединения с этими ионами, то при добавлении трилона Б к такому окрашенному раствору произойдет изменение окраски в эквивалентной точке. В качестве индикаторов используют: хромоген черный специальный ЕТ-00 (эриохром черный Т) и кислотный хром темно-синий. Цвета растворов этих индикаторов в щелочкой среде следующие:
При определении жесткости конденсатов и умягченной воды в качестве индикатора пользуются кислотным хромом темно-синим, так как хромоген черный ЕТ-00 обладает недостаточной чувствительностью. Используемые для данного определения индикаторы являются чувствительными реактивами на многие тяжелые металлы, вследствие чего присутствие последних мешает определению кальция и магния.
Для устранения искажающего влияния ионов меди и цинка следует перед определением жесткости перевести их в сульфиды добавлением 1 мл 2%-ного раствора сульфида натрия. Влияние марганца устраняют добавлением пяти капель 1%-ного раствора солянокислого гидроксиламина. Если содержание железа или алюминия во взятом для титрования количестве исследуемой воды превышает 1 мг, то исследуемой воды следует взять соответственно меньше и разбавить ее дистиллированной водой.
При определении жесткости воды трилонометрическим методом содержание ионов кальция и магния в объеме исследуемой воды не должно превышать 0,5 мг-экв. Поэтому рекомендуют следующие объемы проб исследуемой воды в зависимости от предполагаемой жесткости воды.
Определение общей жесткости
В коническую колбу емкостью 250 мл пипеткой отмеряют необходимое количество исследуемой воды в зависимости от предполагаемой жесткости воды. Затем, если нужно, добавляют дистиллированную воду до объема 50 мл, прибавляют 5 мл аммиачного буферного раствора, 10 капель индикатора и медленно титруют 0,01 н. раствором трнлона Б, все время энергично перемешивая содержимое колбы встряхиванием до изменения окраски. Свидетелем может служить перетитрованная проба, так как при прибавлении избытка раствора трилона Б окраска больше не изменяется.
Величину общей жесткости (Hобщ) рассчитывают по формуле
Определение постоянной жесткости
В коническую колбу на 250 мл отмеряют пипеткой необходимое количество воды в зависимости от предполагаемой постоянной жесткости, отмечают уровень ее в колбе карандашом по стеклу, закрывают воронкой и кипятят в течение часа, подливая время от времени дистиллированную воду до карандашной метки. По окончании кипячения и охлаждении объем воды доводят до метки дистиллированной водой, фильтруют в сухую колбу через сухой фильтр, промывают его 2-3 раза дистиллированной водой. Промывные воды собирают в одну колбу с фильтратом и титруют 0,01 н. раствором трилона Б, как указано при определении общей жесткости. Величину постоянной жесткости рассчитывают по той же формуле, что и общую жесткость.
Определение карбонатной жесткости
Определение карбонатной жесткости основано на свойстве гидрокарбонатов кальция и магния, а также гидрокарбонатов и карбонатов натрия, калия, железа и алюминия вступать в реакцию с кислотой:
Определение карбонатной жесткости проводят титрованием 0,1 н. раствором соляной кислоты в присутствии метилоранжевого. В коническую колбу емкостью 250 мл, закрывающуюся резиновой пробкой, отмеряют пипеткой 100 мл исследуемой воды, прибавляют 2-3 капли метилоранжевого и титруют 0,1 н. раствором соляной кислоты до появления слабо-оранжевой окраски. Величину карбонатной жесткости Hк рассчитывают по формуле.
Определение устранимой жесткости
Определение устранимой жесткости основано на определении карбонатной жесткости в сырой воде и в прокипяченной. При определении карбонатной жесткости в сырой воде в реакцию с соляной кислотой вступают гидрокарбонаты и карбонаты щелочных металлов (натрия, калия) и гидрокарбонаты щелочноземельных металлов (кальция и магния). При том же определении в прокипяченной воде в реакцию с соляной кислотой вступают только карбонаты щелочных металлов вследствие разрушения гидрокарбонатов и выделения в осадок карбонатов кальция и магния. Разность между этими двумя определениями дает величину устранимой жесткости.
Ход определения следующий. В коническую колбу отмеряют пипеткой 100 мл исследуемой воды, прибавляют две капли метилоранжевого и титруют 0,1 н. раствором соляной кислоты до перехода желтой окраски в оранжевую. Другую порцию воды в 100 мл также отмеряют пипеткой в коническую колбу. Колбу закрывают воронкой, отмечают уровень воды карандашом по стеклу и кипятят в течение часа, подливая время от времени дистиллированную воду до карандашной метки. После кипячения воду охлаждают, доводят объем ее до метки дистиллированной водой и фильтруют в сухую колбу через сухой фильтр. Фильтр промывают 2-3 раза дистиллированной водой. Промывные воды собирают вместе с фильтратом и титруют 0,1 н. раствором в присутствии метилоранжевого до изменения окраски.
Величину устранимой жесткости Hустр рассчитывают по формуле