в каком случае нейтральный атом превращается в положительный ион
Урок 6. Простые ионы
В уроке 6 «Простые ионы» из курса «Химия для чайников» познакомимся с простыми ионами и выясним, чему равен его заряд; также рассмотрим как образуется ионная химическая связь; научимся определять степень окисления и валентность элементов. Данный урок очень важный, и чтобы его лучше понять, обязательно просмотрите прошлые уроки, особое внимание уделяя уроку 1 «Схема строения атомов», а также уроку 3 «Схема образования молекул».
Ионная химическая связь
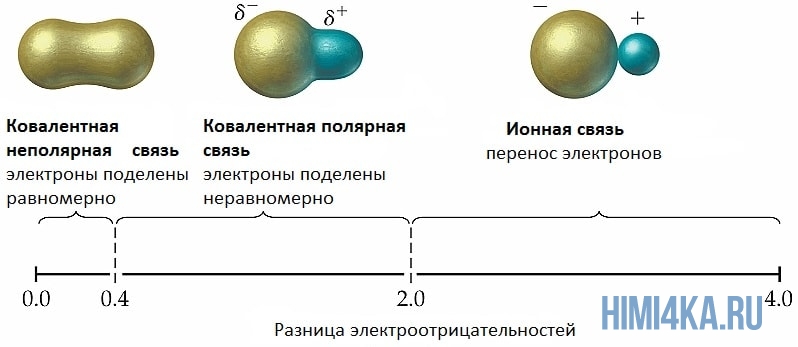
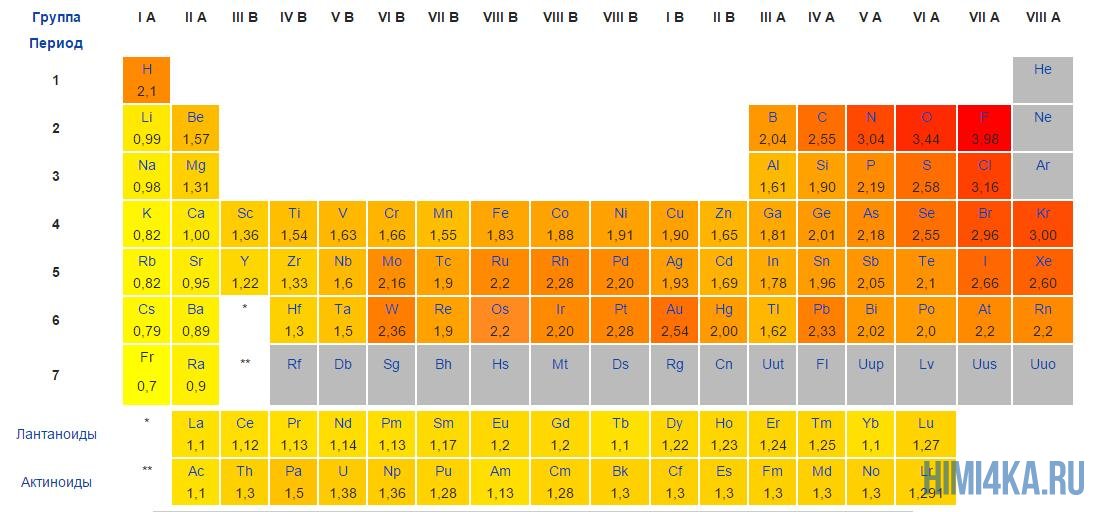
Мы уже кратко рассматривали ковалентную полярную химическую связь, в которой из-за незначительного различия в электроотрицательности атомов (0.4-2.0) электронная пара распределяется между ними не равномерно. Для тех, кто забыл, напоминаю, что электроотрицательность — это способность атомов притягивать к себе электроны.
Однако, если электроотрицательность атомов различается больше чем на 2 по таблице электроотрицательности, то электронная пара полностью переходит к более электроотрицательному атому, и в результате образуется ионная химическая связь. Ионная химическая связь образуется только между атомами типичных металлов (т.к. они легко теряют внешние электроны) и неметаллов (т.к. они обладают большой электроотрицательностью).
Положительные и отрицательные ионы
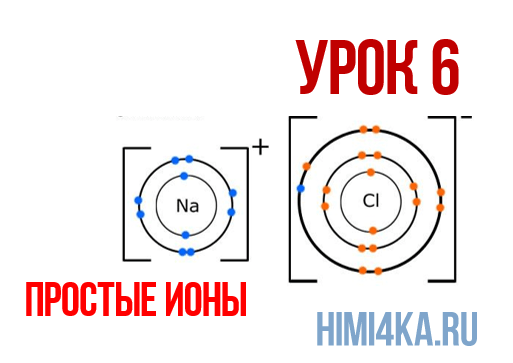
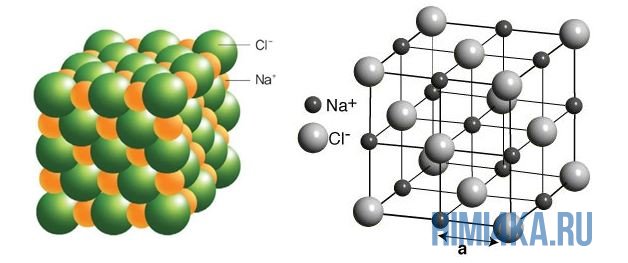
Наглядным примером ионной химической связи может служить обычная поваренная соль NaCl, которая присутствует на каждой кухне. Атомы натрия (и вообще всех металлов) слабо удерживают внешние электроны, тогда как атомы хлора напротив, обладают очень большой способностью притягивать к себе электроны, т.е обладают большой электроотрицательностью.
Записать ½Cl2 пришлось потому, что газообразный хлор в природе состоит из двухатомных молекул, а не из свободных одиночных атомов хлора.
Положительно заряженные ионы называются катионами. К ним в основном относятся металлы, так как они легко отдают от одного до трех электронов. Ниже приведены примеры катионов:
Анионами являются неметаллы, поскольку с радостью присоединяют к себе электроны, превращаясь в отрицательно заряженные ионы. Примеры анионов:
Степень окисления веществ
Процесс присоединения электронов к атому или просто их смещение в сторону данного атома называется реакцией восстановления, а оттягивание электронов от атома или их полное удаление называется реакцией окисления. Вот вам отличная шпаргалка со степенями окисления простых ионов:
Валентность химических элементов
Валентностью называют число химических связей, которые данный атом образует с другими атомами в молекуле. Однако, если говорить простыми словами, то под валентностью понимается все та же степень окисления, но в отличии от нее валентность не имеет знака и не равна нулю.
Название ионов
Ионы металлов, которые имеют различные (переменные) степени окисления, записываются следующим образом:
Пример 2: Окисление или восстановление происходит при превращении иона трехвалентного железа в ион двухвалентного? Запишите уравнение этого процесса.
Надеюсь урок 6 «Простые ионы» оказался для вас понятным и полезным. Если у вас возникли вопросы, пишите их в комментарии.
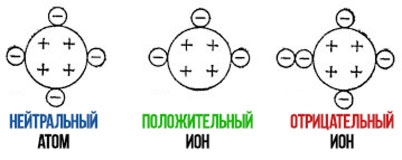
Что такое нейтральный атом? (С примерами)
нейтральный атом это то, что испытывает недостаток в электрическом заряде из-за компенсации между числом его протонов и электронов. Оба являются электрически заряженными субатомными частицами.
Протоны агломерированы рядом с нейтронами и составляют ядро; в то время как электроны рассеиваются путем определения электронного облака. Когда число протонов в атоме, равное его атомному номеру (Z), равно числу электронов, говорят, что между электрическими зарядами внутри атома есть компенсация.
Например, есть атом водорода (верхнее изображение), в котором есть протон и электрон. Протон расположен в центре атома как его ядро, в то время как электрон вращается вокруг окружающего пространства, оставляя области с меньшей электронной плотностью по мере удаления от ядра..
Нейтральный атом против иона
На примере нейтрального атома H было установлено, что число протонов равно числу электронов (1p = 1e); ситуация, которая не происходит с ионами, полученными потеря или усиление электрона.
Ионы образуются в результате изменения числа электронов, потому что атом выигрывает их (-) или теряет их (+).
В атоме катиона Н + Валентный заряд одиночного протона преобладает перед полным отсутствием электрона (1p> 0e). Это верно для всех других более тяжелых атомов (np> ne) периодической таблицы.
Хотя наличие положительного заряда может показаться незначительным, оно по диагонали меняет характеристики рассматриваемого элемента.
На против На +
Более известным примером является металлический натрий. Его нейтральный атом Na с Z = 11 имеет 11 протонов; следовательно, должно быть 11 электронов для компенсации положительных зарядов (11p = 11e).
Металлический натрий ядовит и разъедает, в то время как его катион присутствует даже внутри клеток. Это показывает, как свойства элемента могут резко меняться, когда он получает или теряет электроны.
примеров
кислород
Катион Cu + имеет на один электрон меньше (29р 2+ потерял два электрона (29p