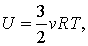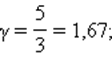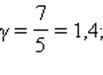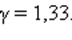в каком случае при передаче газу теплоты остается неизменной внутренняя энергия
Первый закон термодинамики
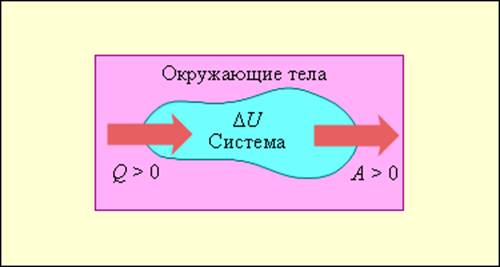
На рис. 3.9.1 условно изображены энергетические потоки между выделенной термодинамической системой и окружающими телами. Величина Q > 0, если тепловой поток направлен в сторону термодинамической системы. Величина A > 0, если система совершает положительную работу над окружающими телами.
Обмен энергией между термодинамической системой и окружающими телами в результате теплообмена и совершаемой работы
Если система обменивается теплом с окружающими телами и совершает работу (положительную или отрицательную), то изменяется состояние системы, т. е. изменяются ее макроскопические параметры (температура, давление, объем). Так как внутренняя энергия U однозначно определяется макроскопическими параметрами, характеризующими состояние системы, то отсюда следует, что процессы теплообмена и совершения работы сопровождаются изменением ΔU внутренней энергии системы.
Первый закон термодинамики является обобщением закона сохранения и превращения энергии для термодинамической системы. Он формулируется следующим образом:
Изменение ΔU внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q, переданной системе, и работой A, совершенной системой над внешними телами.
Соотношение, выражающее первый закон термодинамики, часто записывают в другой форме:
Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами.
Первый закон термодинамики является обобщением опытных фактов. Согласно этому закону, энергия не может быть создана или уничтожена; она передается от одной системы к другой и превращается из одной формы в другую. Важным следствием первого закона термодинамики является утверждение о невозможности создания машины, способной совершать полезную работу без потребления энергии извне и без каких-либо изменений внутри самой машины. Такая гипотетическая машина получила название вечного двигателя (perpetuum mobile) первого рода. Многочисленные попытки создать такую машину неизменно заканчивались провалом. Любая машина может совершать положительную работу A над внешними телами только за счет получения некоторого количества теплоты Q от окружающих тел или уменьшения ΔU своей внутренней энергии.
Применим первый закон термодинамики к изопроцессам в газах.
1. В изохорном процессе (V = const) газ работы не совершает, A = 0. Следовательно,
Здесь U (T1) и U (T2) – внутренние энергии газа в начальном и конечном состояниях. Внутренняя энергия идеального газа зависит только от температуры (закон Джоуля). При изохорном нагревании тепло поглощается газом (Q > 0), и его внутренняя энергия увеличивается. При охлаждении тепло отдается внешним телам (Q 0 – тепло поглощается газом, и газ совершает положительную работу. При изобарном сжатии Q 0); поэтому его внутренняя энергия уменьшается (ΔU γ = const.
Это соотношение называют уравнением Пуассона. Здесь γ = Cp / CV – показатель адиабаты, Cp и CV – теплоемкости газа в процессах с постоянным давлением и с постоянным объемом. Для одноатомного газа
Работа газа в адиабатическом процессе просто выражается через температуры T1 и T2 начального и конечного состояний:
Адиабатический процесс также можно отнести к изопроцессам. В термодинамике важную роль играет физическая величина, которая называется энтропией. Изменение энтропии в каком-либо квазистатическом процессе равно приведенному теплу ΔQ / T, полученному системой. Поскольку на любом участке адиабатического процесса ΔQ = 0, энтропия в этом процессе остается неизменной.
Адиабатический процесс (так же, как и другие изопроцессы) является процессом квазистатическим. Все промежуточные состояния газа в этом процессе близки к состояниям термодинамического равновесия. Любая точка на адиабате описывает равновесное состояние.
Не всякий процесс, проведенный в адиабатической оболочке, т. е. без теплообмена с окружающими телами, удовлетворяет этому условию. Примером не квазистатического процесса, в котором промежуточные состояния неравновесны, может служить расширение газа в пустоту. На рис. 3.9.3 изображена жесткая адиабатическая оболочка, состоящая из двух сообщающихся сосудов, разделенных вентилем K. В первоначальном состоянии газ заполняет один из сосудов, а в другом сосуде – вакуум. После открытия вентиля газ расширяется, заполняет оба сосуда, и устанавливается новое равновесное состояние. В этом процессе Q = 0, т.к. нет теплообмена с окружающими телами, и A = 0, т.к. оболочка недеформируема. Из первого закона термодинамики следует: ΔU = 0, т. е. внутренняя энергия газа осталась неизменной. Так как внутренняя энергия идеального газа зависит только от температуры, температура газа в начальном и конечном состояниях одинакова – точки на плоскости (p, V), изображающие эти состояния, лежат на одной изотерме. Все промежуточные состояния газа неравновесны и их нельзя изобразить на диаграмме.
Расширение газа в пустоту – пример необратимого процесса. Его нельзя провести в противоположном направлении.
Первый закон термодинамики.
Первое начало (первый закон) термодинамики — это закон сохранения и превращения энергии для термодинамической системы.
Согласно первому началу термодинамики, работа может совершаться только за счет теплоты или какой-либо другой формы энергии. Следовательно, работу и количество теплоты измеряют в одних единицах — джоулях (как и энергию).
Первое начало термодинамики было сформулировано немецким ученым Ю. Л. Манером в 1842 г. и подтверждено экспериментально английским ученым Дж. Джоулем в 1843 г.
Первый закон термодинамики формулируется так:
Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе:
где ΔU — изменение внутренней энергии, A — работа внешних сил, Q — количество теплоты, переданной системе.
При любых процессах, происходящих в изолированной системе, ее внутренняя энергия остается постоянной.
Если работу совершает система, а не внешние силы, то уравнение (ΔU = A + Q) записывается в виде:

Количество теплоты, переданное системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами.
Первое начало термодинамики может быть сформулировано как невозможность существования вечного двигателя первого рода, который совершал бы работу, не черпая энергию из какого-либо источника (т. е. только за счет внутренней энергии).
Следует помнить, что как работа, так и количество теплоты, являются характеристиками процесса изменения внутренней энергии, поэтому нельзя говорить, что в системе содержится определенное количество теплоты или работы. Система в любом состоянии обладает лишь определенной внутренней энергией.
Рассмотрим применение первого закона термодинамики к различным термодинамическим процессам.
Изохорный процесс.
Зависимость р(Т) на термодинамической диаграмме изображается изохорой.
Изохорный (изохорический) процесс — термодинамический процесс, происходящий в системе при постоянном объеме.
Изохорный процесс можно осуществить в газах и жидкостях, заключенных в сосуд с постоянным объемом.
При изохорном процессе объем газа не меняется (ΔV= 0), и, согласно первому началу термодинамики 
т. е. изменение внутренней энергии равно количеству переданного тепла, т. к. работа (А = рΔV=0) газом не совершается.
Если газ нагревается, то Q > 0 и ΔU > 0, его внутренняя энергия увеличивается. При охлаждении газа Q 0) он совершает положительную работу (A’ > 0). Если газ отдает тепло окружающей среде Q < 0 и A’ < 0. В этом случае над газом совершается работа внешними силами. Для внешних сил работа положительна. Геометрически работа при изотермическом процессе определяется площадью под кривой p(V).
Изобарный процесс.
Изобарный процесс на термодинамической диаграмме изображается изобарой.
Изобарный (изобарический) процесс — термодинамический процесс, происходящий в системе с постоянным давлением р.
Примером изобарного процесса является расширение газа в цилиндре со свободно ходящим нагруженным поршнем.
При изобарном процессе, согласно формуле 
Работа идеального газа определяется по графику зависимости p(V) для изобарного процесса (A’ = pΔV).
Для идеального газа при изобарном процессе объем пропорционален температуре, в реальных газах часть теплоты расходуется на изменение средней энергии взаимодействия частиц.
Адиабатический процесс (адиабатный процесс) — это термодинамический процесс, происходящий в системе без теплообмена с окружающей средой (Q = 0).
Адиабатическая изоляция системы приближенно достигается в сосудах Дьюара, в так называемых адиабатных оболочках. На адиабатически изолированную систему не оказывает влияния изменение температуры окружающих тел. Ее внутренняя энергия U может меняться только за счет работы, совершаемой внешними телами над системой, или самой системой.
Согласно первому началу термодинамики (ΔU = А + Q), в адиабатной системе
где A — работа внешних сил.
При адиабатном расширении газа А < 0. Следовательно,

что означает уменьшение температуры при адиабатном расширении. Оно приводит к тому, что давление газа уменьшается более резко, чем при изотермическом процессе. На рисунке ниже адиабата 1-2, проходящая между двумя изотермами, наглядно иллюстрирует сказанное. Площадь под адиабатой численно равна работе, совершаемой газом при его адиабатическом расширении от объема V1, до V2.
Адиабатное сжатие приводит к повышению температуры газа, т. к. в результате упругих соударений молекул газа с поршнем их средняя кинетическая энергия возрастает, в отличие от расширения, когда она уменьшается (в первом случае скорости молекул газа увеличиваются, во втором — уменьшаются).
Резкое нагревание воздуха при адиабатическом сжатии используется в двигателях Дизеля.
В замкнутой (изолированной от внешних тел) термодинамической системе изменение внутренней энергии какого-либо тела системы ΔU1 не может приводить к изменению внутренней энергии всей системы. Следовательно,
Если внутри системы не совершается работа никакими телами, то, согласно первому закону термодинамики, изменение внутренней энергии любого тела происходит только за счет обмена теплом с другими телами этой системы: ΔUi = Qi. Учитывая 

Уравнение теплового баланса является математическим выражением закона сохранения энергии при теплообмене.
Первый закон термодинамики.
Первое начало (первый закон) термодинамики — это закон сохранения и превращения энергии для термодинамической системы.
Согласно первому началу термодинамики, работа может совершаться только за счет теплоты или какой-либо другой формы энергии. Следовательно, работу и количество теплоты измеряют в одних единицах — джоулях (как и энергию).
Первое начало термодинамики было сформулировано немецким ученым Ю. Л. Манером в 1842 г. и подтверждено экспериментально английским ученым Дж. Джоулем в 1843 г.
Первый закон термодинамики формулируется так:
Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе:
где ΔU — изменение внутренней энергии, A — работа внешних сил, Q — количество теплоты, переданной системе.
При любых процессах, происходящих в изолированной системе, ее внутренняя энергия остается постоянной.
Если работу совершает система, а не внешние силы, то уравнение (ΔU = A + Q) записывается в виде:

Количество теплоты, переданное системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами.
Первое начало термодинамики может быть сформулировано как невозможность существования вечного двигателя первого рода, который совершал бы работу, не черпая энергию из какого-либо источника (т. е. только за счет внутренней энергии).
Следует помнить, что как работа, так и количество теплоты, являются характеристиками процесса изменения внутренней энергии, поэтому нельзя говорить, что в системе содержится определенное количество теплоты или работы. Система в любом состоянии обладает лишь определенной внутренней энергией.
Рассмотрим применение первого закона термодинамики к различным термодинамическим процессам.
Изохорный процесс.
Зависимость р(Т) на термодинамической диаграмме изображается изохорой.
Изохорный (изохорический) процесс — термодинамический процесс, происходящий в системе при постоянном объеме.
Изохорный процесс можно осуществить в газах и жидкостях, заключенных в сосуд с постоянным объемом.
При изохорном процессе объем газа не меняется (ΔV= 0), и, согласно первому началу термодинамики 
т. е. изменение внутренней энергии равно количеству переданного тепла, т. к. работа (А = рΔV=0) газом не совершается.
§ 78. Первый закон термодинамики
Как формулируется закон сохранения полной механической энергии?
При каких условиях внутренняя энергия сохраняется?
Первый закон термодинамики — это частный случай закона сохранения энергии, главного закона природы. Он показывает, от каких причин зависит изменение внутренней энергии.
Закон сохранения энергии. К середине XIX в. многочисленные опыты доказали, что
Важно
механическая энергия никогда не пропадает бесследно.
Падает, например, молот на кусок свинца, и свинец нагревается. Силы трения тормозят тела, которые при этом разогреваются.
На основании множества подобных наблюдений и обобщения опытных фактов был сформулирован закон сохранения энергии.
Закон сохранения энергии
Энергия в природе не возникает из ничего и не исчезает: количество энергии неизменно, она только переходит из одной формы в другую!
Закон сохранения энергии управляет всеми явлениями природы и связывает их воедино. Он всегда выполняется абсолютно точно, неизвестно ни одного случая, когда бы этот великий закон не выполнялся. Этот закон был открыт в середине XIX в. немецким учёным, врачом по образованию Р. Майером (1814—1878), английским учёным Дж. Джоулем (1818—1889) и получил наиболее точную формулировку в трудах немецкого учёного Г. Гельмгольца (1821 —1894).

Первый закон термодинамики. Закон сохранения и превращения энергии, распространённый на тепловые явления, носит название первого закона термодинамики. В термодинамике рассматриваются тела, положение центра тяжести которых практически не меняется, т. е. тела, изменение механической энергии которых много меньше изменения их внутренней энергии. Механическая энергия таких тел остаётся постоянной, изменяться может лишь внутренняя энергия каждого тела.
До сих пор мы рассматривали процессы, в которых внутренняя энергия системы изменялась либо за счёт совершения работы, либо за счёт теплообмена с окружающими телами.
В общем случае при переходе системы из одного состояния в другое внутренняя энергия изменяется одновременно как за счёт совершения работы, так и за счёт передачи теплоты. Первый закон термодинамики формулируется именно для таких общих случаев.
Первый закон термодинамики
Изменение внутренней энергии системы при переходе её из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданной системе:

Если система является изолированной, то работа внешних сил равна нулю (А = 0) и система не обменивается теплотой с окружающими телами (Q = 0).
В этом случае согласно первому закону термодинамики
Важно
Внутренняя энергия изолированной системы остаётся неизменной (сохраняется).
Количество теплоты, переданной системе, идёт на изменение её внутренней энергии и на совершение системой работы над внешними телами.
Невозможность создания вечного двигателя. Из первого закона термодинамики следует невозможность создания вечного двигателя первого рода, т. е. устройства, способного совершать неограниченную работу без затрат топлива или каких-либо других материалов. Если к системе не поступает тепло (Q = 0), то работа А’ согласно уравнению (13.12) может быть совершена только за счёт убыли внутренней энергии:
После того как запас энергии окажется исчерпанным, двигатель перестанет работать.
Работа и количество теплоты — характеристики процесса изменения внутренней энергии. В данном состоянии система всегда обладает определённой внутренней энергией.
Но нельзя говорить, что в системе содержится определённое количество теплоты или работы. Как работа, так и количество теплоты являются величинами, характеризующими изменение внутренней энергии системы в результате того или иного процесса.
Внутренняя энергия системы может измениться на одно и то же значение как за счёт совершения системой работы, так и за счёт передачи окружающим телам какого-либо количества теплоты. Например, нагретый газ в цилиндре может уменьшить свою энергию остывая, без совершения работы (рис. 13.7). Но он может потерять точно такое же количество энергии, поднимая поршень, без отдачи теплоты окружающим телам. Для этого стенки цилиндра и поршень должны быть теплонепроницаемыми (рис. 13.8).
Ключевые слова для поиска информации по теме параграфа.
Изменение внутренней энергии. Первый закон термодинамики
Вопросы к параграфу
1. Как формулируется первый закон термодинамики?
2. В каком случае изменение внутренней энергии отрицательно?
3. Почему можно говорить, что система обладает внутренней энергией, но нельзя сказать, что она обладает запасом определённого количества теплоты или работы?
4. Можно ли считать систему изолированной, если её температура остаётся постоянной?
5. Известно, что при изотермическом процессе идеальный газ совершил работу 2000 Дж. Чему равно количество теплоты, сообщённой системе?
Образцы заданий ЕГЭ
А1. Идеальный газ получил количество теплоты, равное 300 Дж, и совершил работу, равную 100 Дж. Как изменилась при этом внутренняя энергия газа?
1) увеличилась на 400 Дж 3) уменьшилась на 400 Дж
2) увеличилась на 200 Дж 4) уменьшилась на 200 Дж
А2. Идеальный газ совершил работу, равную 300 Дж. При этом его внутренняя энергия увеличилась на 300 Дж. В этом процессе газ
1) отдал 600 Дж 3) получил 600 Дж
2) отдал 300 Дж 4) получил 300 Дж
А3. В процессе эксперимента внутренняя энергия газа уменьшилась на 60 кДж, и он совершил работу 45 кДж. Следовательно, в результате теплообмена газ отдал окружающей среде количество теплоты, равное
1) 15 кДж 2) 45 кДж 3) 60 кДж 4) 105 кДж
А4. В процессе эксперимента газ получил от нагревателя количество теплоты, равное 3 кДж. При этом внутренняя энергия газа уменьшилась на 13 кДж. Следовательно, газ расширился, совершив работу
1) 3 кДж 2) 10 кДж 3) 13 кДж 4) 16 кДж
А5. Идеальный газ получил количество теплоты 100 Дж, и при этом внутренняя энергия газа уменьшилась на 100 Дж. Чему равна работа, совершённая внешними силами над газом?
Первый закон термодинамики. Как рассказать просто о сложном?
Термодинамика — раздел физики, в котором изучаются процессы изменения и превращения внутренней энергии тел, а также способы использования внутренней энергии тел в двигателях.
1. Определение первого закона термодинамики
Термодинамика — раздел физики, в котором изучаются процессы изменения и превращения внутренней энергии тел, а также способы использования внутренней энергии тел в двигателях. Собственно, именно с анализа принципов первых тепловых машин, паровых двигателей и их эффективности и зародилась термодинамика. Можно сказать, что этот раздел физики начинается с небольшой, но очень важно работы молодого французского физика Николя Сади Карно.
Самым важным законом, лежащим в основе термодинамики является первый закон или первое начало термодинамики. Чтобы понять суть этого закона, для начала, вспомним что называется внутренней энергией. ВНУТРЕННЯЯ ЭНЕРГИЯ тела — это энергия движения и взаимодействия частиц, из которых оно состоит. Нам хорошо известно, что внутреннюю энергию тела можно изменить, изменив температуру тела. А изменять температуру тела можно двумя способами:
Нам, также известно, что работа, совершаемая газом, обозначается Аг, а количество переданной или полученной внутренней энергии при теплообмене называется количеством теплоты и обозначается Q. Внутреннюю энергию газа или любого тела принято обозначать буквой U, а её изменение, как и изменение любой физической величины, обозначается с дополнительным знаком Δ, то есть ΔU.
Сформулируем ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ для газа. Но, прежде всего, отметим, что когда газ получает некоторое количество теплоты от какого-либо тела, то его внутренняя энергия увеличивается, а когда газ совершает некоторую работу, то его внутренняя энергия уменьшается. Именно поэтому первый закон термодинамики имеет вид:
Так как работа газа и работа внешних сил над газом равны по модулю и противоположны по знаку, то первый закон термодинамики можно записать в виде:
Понять суть этого закона довольно просто, ведь изменить внутреннюю энергию газа можно двумя способами: либо заставить его совершить работу или совершить над ним работу, либо передать ему некоторое количество теплоты или отвести от него некоторое количество теплоты.
2. Первый закон термодинамики в процессах
Применительно к изопроцессам первый закон термодинамики может быть записан несколько иначе, учитывая особенности этих процессов. Рассмотрим три основных изопроцесса и покажем, как будет выглядеть формула первого закона термодинамики в каждом из них.
3. Применение
Первое начало термодинамики (первый закон) имеет огромное значение в этой науке. Вообще понятие внутренней энергии вывело теоретическую физику 19 века на принципиально новый уровень. Появились такие понятия как термодинамическая система, термодинамическое равновесие, энтропия, энтальпия. Кроме того, появилась возможность количественного определения внутренней энергии и её изменения, что в итоге привело учёных к пониманию самой природы теплоты, как формы энергии.
Ну, а если говорить о применении первого закона термодинамики в каких-либо задачах, то для этого необходимо знать два важных факта. Во-первых, внутренняя энергия идеального одноатомного газа равна: