в каком случае реакция термодинамически возможна
В каком случае реакция термодинамически возможна
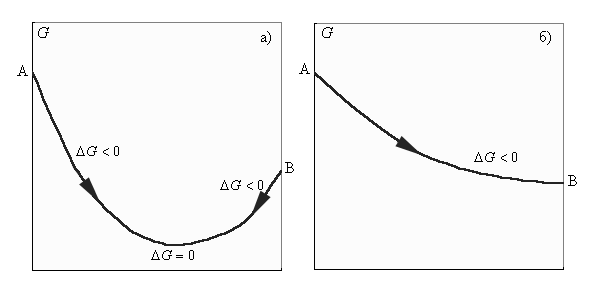
При ΔG 0 указывает на то, что процесс термодинамически запрещен.
Изменение энергии Гиббса: а – обратимый процесс; б – необратимый процесс.
Записав уравнение (1) в виде ΔH = ΔG + TΔS, получим, что энтальпия реакции включает свободную энергию Гиббса и «несвободную» энергию ΔS · T. Энергия Гиббса, представляющая собой убыль изобарного (P = const) потенциала, равна максимальной полезной работе. Уменьшаясь с течением химического процесса, ΔG достигает минимума в момент равновесия (ΔG = 0). Второе слагаемое ΔS · T (энтропийный фактор) представляет ту часть энергии системы, которая при данной температуре не может быть превращена в работу. Эта связанная энергия способна лишь рассеиваться в окружающую среду в виде тепла (рост хаотичности системы).
Итак, в химических процессах одновременно изменяются энергетический запас системы (энтальпийный фактор) и степень ее беспорядка (энтропийный фактор, не совершающая работу энергия).
Анализ уравнения (1) позволяет установить, какой из факторов, составляющих энергию Гиббса, ответственен за направление протекания химической реакции, энтальпийный (ΔH) или энтропийный (ΔS · T).
· Если ΔH 0, то всегда ΔG 0 и ΔS 0, и реакция с поглощением теплоты и уменьшением энтропии невозможна ни при каких условиях.
· В остальных случаях (ΔH 0, ΔS > 0) знак ΔG зависит от соотношения ΔH и TΔS. Реакция возможна, если она сопровождается уменьшением изобарного потенциала; при комнатной температуре, когда значение T невелико, значение TΔS также невелико, и обычно изменение энтальпии больше TΔS. Поэтому большинство реакций, протекающих при комнатной температуре, экзотермичны. Чем выше температура, тем больше TΔS, и даже эндотермические реакции становятся осуществляемыми.
Проиллюстрируем эти четыре случая соответствующими реакциями:
Определение энергии Гибсса и константы реакции при заданной ткмпературе
1. Расчет энтальпии реакции получим:
2. Расчет энтропии реакции получим:
Переведем температуру из шкалы Цельсия в шкалу Кельвина: Т = 273 + 200 = 473 К. Для расчета ΔG o 473 воспользуемся уравнением:
ΔG o 473 = ΔH o – TΔS o
ΔG o 473 = –153,6 – 473·(–0,01718) = –145,47 кДж.
Таким образом, ΔG o 473 o С возможно.
Ответ: ΔG o 473 = –145,47 кДж; возможно.
1. Расчет энтропии реакции получим:
2. Расчет энтропии реакции получим:
3. Теперь рассчитаем изменение энергии Гиббса при Т = 298 К для реакции, получим:
Как свидетельствуют результаты расчетов,ΔG 0 х.р. > 0 и, значит, этот процесс самопроизвольно протекать не будет.
Задача 72.
Возможно ли протекание реакции: CaCO3(к) = CaO(к) + CO2(г) при 25 и 1800°C? Найдите приближённое значение температуры, при которой ΔG 0 Т = 0. Зависимостями ΔH 0 и ΔS 0 от температуры пренебречь. Рассчитайте константу равновесия реакции для трёх указанных температур.
Решение.
ΔH 0 CaO(к) = −635,1 кДж/моль;
ΔH 0 CO2(г) = −393,5 кДж/моль;
ΔH 0 CaCO3(к) = −1206,8 кДж/моль;
ΔS 0 CaO(к) = 38,1 Дж/(моль . K);
ΔS0CO2(г) = 213,7 Дж/(моль . K);
ΔS 0 CaCO3(к) = 91,7 Дж/(моль . K).
ΔG 0 T реакции можно определить по формуле:
Вычислим ΔH 0 298 и ΔS 0 298 по формулам:
Так как ΔG 0 298 > 0, то протекание реакции при 25 °C невозможно.
Рассчитаем энергию Гиббса реакции при температуре 1800 °C, получим:
По условию задачи можно считать, что ΔH 0 298 = ΔH 0 2073 и ΔS 0 298 = ΔS 0 2073.
Температуру, при которой ΔGT = 0, находим по формуле:
Константу равновесия реакции для этих трёх температур найдём на основании формулы:
Таким образом, чем меньше значение ΔG 0 Т, тем более полно протекает реакция и тем больше константа равновесия.
В каком случае реакция термодинамически возможна
Итак, в химических процессах одновременно изменяются энергетический запас системы (энтальпийный фактор) и степень ее беспорядка (энтропийный фактор, не совершающая работу энергия).
Анализ уравнения (4.2) позволяет установить, какой из факторов, составляющих энергию Гиббса, ответственен за направление протекания химической реакции, энтальпийный () или энтропийный ().
Проиллюстрируем эти четыре случая соответствующими реакциями:
Для оценки знака реакции важно знать величины и наиболее типичных процессов. образования сложных веществ и реакции лежат в пределах 80–800 кДж∙






Учебник. Энергия Гиббса
Самопроизвольное протекание изобарно-изотермического процесса определяется двумя факторами: энтальпийным, связанным с уменьшением энтальпии системы (ΔH), и энтропийным T ΔS, обусловленным увеличением беспорядка в системе вследствие роста ее энтропии. Разность этих термодинамических факторов является функцией состояния системы, называемой изобарно-изотермическим потенциалом или свободной энергией Гиббса (G, кДж): ΔG = ΔH – T ΔS
При ΔG 0 указывает на то, что процесс термодинамически запрещен (рис. 4.4).

Записав уравнение (4.2) в виде ΔH = ΔG + T ΔS, получим, что энтальпия реакции включает свободную энергию Гиббса и «несвободную» энергию ΔS ċ T. Энергия Гиббса, представляющая собой убыль изобарного (P = const) потенциала, равна максимальной полезной работе. Уменьшаясь с течением химического процесса, ΔG достигает минимума в момент равновесия (ΔG = 0). Второе слагаемое ΔS ċ T (энтропийный фактор) представляет ту часть энергии системы, которая при данной температуре не может быть превращена в работу. Эта связанная энергия способна лишь рассеиваться в окружающую среду в виде тепла (рост хаотичности системы).
Итак, в химических процессах одновременно изменяются энергетический запас системы (энтальпийный фактор) и степень ее беспорядка (энтропийный фактор, не совершающая работу энергия).
Анализ уравнения (4.2) позволяет установить, какой из факторов, составляющих энергию Гиббса, ответственен за направление протекания химической реакции, энтальпийный (ΔH) или энтропийный (ΔS ċ T).
Если ΔH 0, то всегда ΔG 0 и ΔS 0, и реакция с поглощением теплоты и уменьшением энтропии невозможна ни при каких условиях.
В остальных случаях (ΔH 0, ΔS > 0) знак ΔG зависит от соотношения ΔH и TΔS. Реакция возможна, если она сопровождается уменьшением изобарного потенциала; при комнатной температуре, когда значение T невелико, значение TΔS также невелико, и обычно изменение энтальпии больше TΔS. Поэтому большинство реакций, протекающих при комнатной температуре, экзотермичны. Чем выше температура, тем больше TΔS, и даже эндотермические реакции становятся осуществляемыми.
Проиллюстрируем эти четыре случая соответствующими реакциями:
Термодинамическая возможность протекания химической реакции. Протекание самопроизвольного процесса в закрытой системе
Страницы работы
Фрагмент текста работы
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
Государственное образовательное учреждение высшего профессионального образования
Национальный исследовательский университет ресурсоэффективных технологий «ТПУ» (НИУ РЭТ ТПУ).
Химико-технологический факультет. Кафедра ТООС и ВМС
Направление-24000 «Химия и биотехнология».
Лекционный курс-«Химия и технология органических веществ»
Термодинамическая возможность протекания химической реакции
Для закрытых систем, находящихся в изобарно-изотермических либо изохорно-изотермических условиях свободная энергия принимает вид изобарно-изотермического либо изохорно-изотермического потенциалов (т.н. свободная энергия Гиббса (ΔG) и Гельмгольца (ΔF) соответственно). Данные функции называют иногда просто термодинамическими потенциалами, что не вполне строго, поскольку термодинамическими потенциалами являются также внутренняя энергия (изохорно-изэнтропный) и энтальпия (изобарно-изэнтропный потенциал).
Протекание самопроизвольного процесса в закрытой системе сопровождается уменьшением свободной энергии системы (dG о 298
Следовательно, в указанных условиях может образоваться 1,2-дибромэтан.
Пример 2. Определить, возможна ли реакция крекинга гексадекана при 298° К
н-пентан изобутан пропилен
Решение. В приложении 1 находим необходимые термодинамические данные: