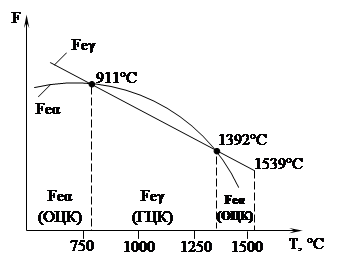в каком состоянии находятся атомы в металле
Учебные материалы
Из всех элементов Периодической системы Д.И. Менделеева 76 составляют металлы. Все металлы имеют общие характерные свойства, отличающие их от других веществ. Это обусловлено особенностями их внутриатомного строения.
Согласно современной теории строения атомов, каждый атом представляет сложную систему, которую схематично можно представить состоящей из положительно заряженного ядра, вокруг которого на разном расстоянии от него движутся отрицательно заряженные электроны.
Притягивающее действие ядра на внешние (валентные) электроны в металлах в значительной степени скомпенсировано электронами внутренних оболочек. Поэтому валентные электроны легко отрываются и свободно перемещаются между образовавшимися положительно заряженными ионами.
Слабая связь отдельных электронов с остальной частью атома и является характерной особенностью атомов металлических веществ, обусловливающей их химические, физические и механические свойства. Общее число не связанных с определенным атомом электронов в различных металлах неодинаково. Этим объясняется довольно значительное различие в степени ”металличности” отдельных металлов. Наличием электронного газа объясняют и особый тип межатомной связи, присущей металлам.
Металлический тип связи характеризуется тем, что между решеткой из положительно заряженных ионов и окружающими их свободными валентными электронами возникает электростатическое притяжение.
Наличие в металлах металлической связи придает им ряд характерных свойств: высокую тепло- и электропроводность; повышенную способность к пластической деформации; термоэлектронную эмиссию, т. е. способность испускать электроны при нагреве; хорошую отражательную способность, т.е. обладают металлическим блеском и непрозрачны; положительный температурный коэффициент электросопротивления, т.е. с повышением температуры электросопротивление металлов увеличивается.
Последнее свойство присуще только металлам, поэтому:
Металл это вещество, имеющее металлический тип связи и положительный температурный коэффициент электросопротивления.
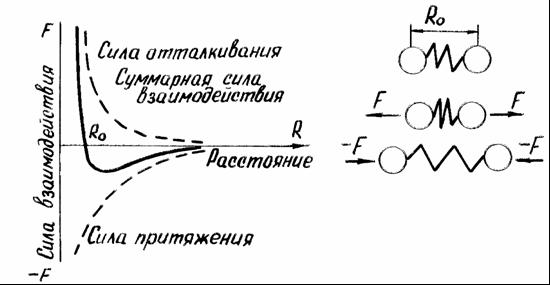
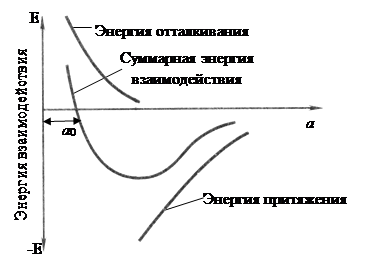
Сила связи в металлах определяется соотношением между силами отталкивания и притяжения между ионами и электронами. Атомы (ионы) располагаются на таком расстоянии один от другого, чтобы энергия взаимодействия была минимальной (рис. 1). Сближение атомов (ионов) на расстояние меньше R0 или удаление их на расстояние больше R0 осуществимо лишь при совершении определенной работы против сил отталкивания или притяжения.
В качестве модели такого взаимодействия (рисунок 1, б) можно принять два шара (ионы), между которыми находится пружина (сила взаимодействия). В состоянии равновесия расстояние между шарами R0. Если расстояние уменьшить и сжать пружину, то между шарами появится сила отталкивания (F), которая будет стремиться вернуть их в равновесное состояние. При увеличении расстояния появится сила притяжения (-F).
Рисунок 1 — Силы взаимодействия двух атомов в кристаллической решетке (а) и модель такого взаимодействия (б)
В связи с этим атомы в металлах располагаются закономерно на определенном расстоянии друг от друга, образуя правильную кристаллическую решетку.
Ее следует представлять как мысленно проведенные в пространстве в направлении трех осей координат прямые линии, соединяющие ближайшие атомы и проходящие через их центры, около которых они совершают колебательные движения. Проведенные линии образуют объемные фигуры правильной геометрической формы.
Наименьший объем кристалла, дающий представление об атомной структуре металла во всем объеме называется элементарной кристаллической ячейкой.
Половину наименьшего расстояния между центрами атомов называют атомным радиусом.
Плотность кристаллической решетки, объем занятого атомами, характеризуется координационным числом.
Число атомов, находящихся на равном и наименьшем расстоянии от данного атома, называется координационным числом.
Чем выше координационное число, тем больше плотность упаковки атомов. Для кубической ячейки координационное число обозначается буквой ”К”, а гексагональной — ”Г“.
Число атомов, приходящихся на одну элементарную ячейку, называется базисом.
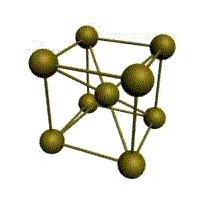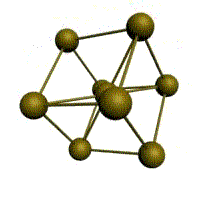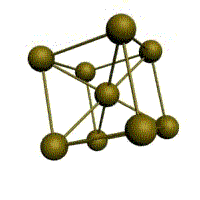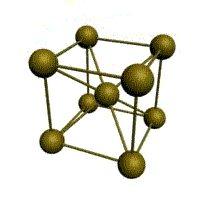
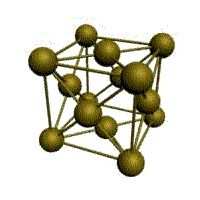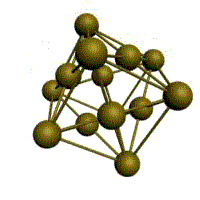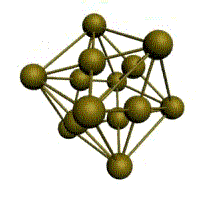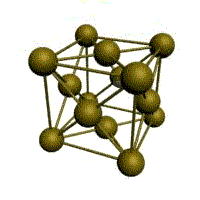
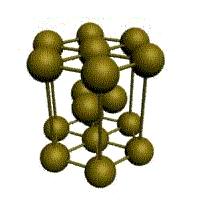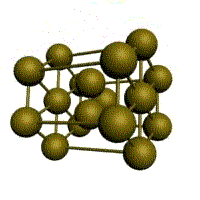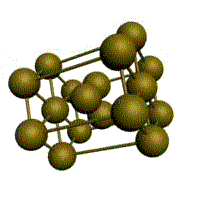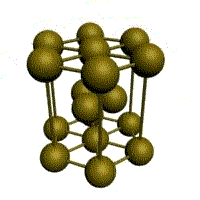
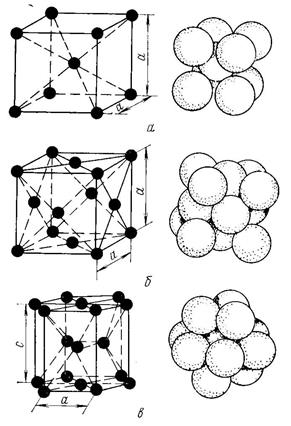
Базис решетки обозначается буквой ”n“. Основными видами ячеек (рисунок 2), которые имеют металлы, являются: кубическая объемноцентрированная (ОЦК), кубическая гранецентрированная (ГЦК) и гексагональная плотноупакованная (ГПУ).
На одну элементарную ячейку ОЦК приходятся два атома (n=2): один в центре куба, а другой вносят атомы, располагающиеся в вершинах куба. Каждый атом в вершине куба одновременно принадлежит восьми сопряженным элементарным ячейкам, и на данную ячейку приходится лишь 1/8 часть, а на всю ячейку (1/8)х8=1 атом. Координационное число считается для центрального атома и соответствует К8.
На одну элементарную ячейку ГЦК приходится четыре атома (n=4): из них один вносят атомы в вершинах куба, а три суммарно вносят атомы, находящиеся на середине грани, так как каждый из таких атомов принадлежит одновременно двум ячейкам: (1/2)х6=3. Координационное число считается для атома, расположенного в центре грани, и соответствует К12.
На одну элементарную ячейку ГПУ приходится шесть атомов (n=6): из них три находятся внутри ячейки. Два атома в центре граней дают один атом: (1/2)х2=1, а двенадцать вершинных атомов — два атома: (1/6)х12=2. Координационное число считается для атома, расположенного внутри ячейки, и соответствует Г12.
В каком состоянии находятся атомы в металле

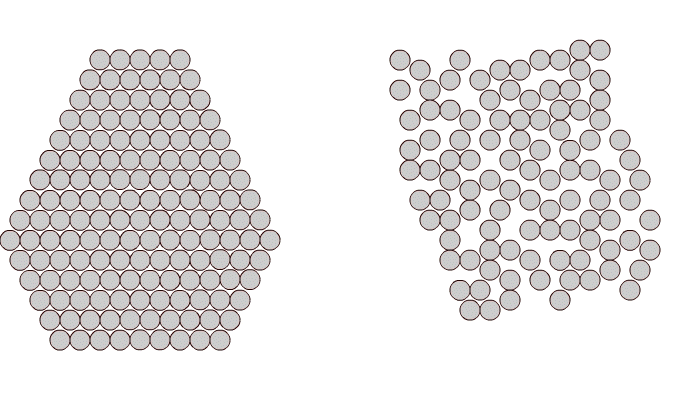
1.1. Аморфные и кристаллические тела
В твердых телах атомы могут размещаться в пространстве двумя способами:
Аморфные вещества обладают формальными признаками твердых тел, т.е. они способны сохранять постоянный объем и форму. Однако они не имеют определенной температуры плавления или кристаллизации.
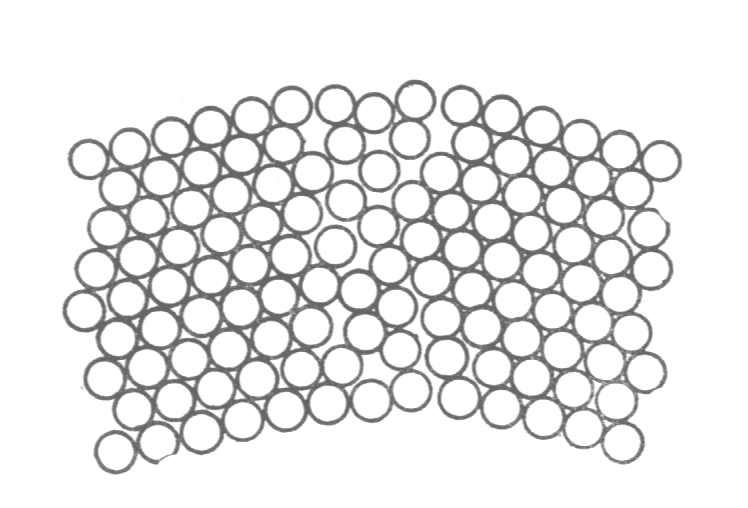
Внешние электронные орбиты атомов соприкасаются, так что плотность упаковки атомов в кристаллической решетке весьма велика.
В кристаллитах соблюдаются ближний и дальний порядки. Это означает наличие упорядоченного расположения и стабильности как окружающих данный атом ближайших его соседей (ближний порядок), так и атомов, находящихся от него на значительных расстояниях вплоть до границ зерен (дальний порядок ).
Рис. 1.1. Расположение атомов в кристаллическом (а) и аморфном (б) веществе
Вследствие диффузии отдельные атомы могут покидать свои места в узлах кристаллической решетки, однако при этом упорядоченность кристаллического строения в целом не нарушается.
1.2. Основные типы кристаллических решеток
Все металлы являются кристаллическими телами, имеющими определенный тип кристаллической решетки, состоящей из малоподвижных положительно заряженных ионов, между которыми движутся свободные электроны (так называемый электронный газ). Такой тип структуры называется металлической связью.
Тип решетки определяется формой элементарного геометрического тела, многократное повторение которого по трем пространственным осям образует решетку данного кристаллического тела.
объемно-центрированная кубическая (ОЦК)
гранецентрированная кубическая (ГЦК)
гексагональная плотноупакованная (ГП)
(6 атомов на ячейку)
Рис. 1.2. Основные типы кристаллических решеток металлов
Основу ОЦК-решетки составляет элементарная кубическая ячейка (рис. 1.2,б), в которой положительно заряженные ионы металла находятся в вершинах куба, и еще один атом в центре его объема, т. е. на пересечении его диагоналей. Такой тип решетки в определенных диапазонах температур имеют железо, хром, ванадий, вольфрам, молибден и др. металлы.
У ГЦК-решетки (рис. 1.2, в) элементарной ячейкой служит куб с центрированными гранями. Подобную решетку имеют железо, алюминий, медь, никель, свинец и др. металлы.
Третьей распространенной разновидностью плотноупакованных решеток является гексагональная плотноупакованная (ГПУ, рис. 1.2, г). ГПУ-ячейка состоит из отстоящих друг от друга на параметр с параллельных центрированных гексагональных оснований. Три иона (атома) находятся на средней плоскости между основаниями.
У гексагональных решеток отношение параметра с/ а всегда больше единицы. Такую решетку имеют магний, цинк, кадмий, берилий, титан и др.
Компактность кристаллической решетки или степень заполненности ее объема атомами является важной характеристикой. Она определяется такими показателями как параметр решетки, число атомов в каждой элементарной ячейке, координационное число и плотность упаковки.
Параметры а кубических решеток металлов находятся в пределах от 0,286 до 0,607 нм. Для металлов с гексагональной решеткой а лежит в пределах 0,228-0,398 нм, а с в пределах 0,357- 0,652 нм.
Параметры кристаллических решеток металлов могут быть измерены с помощью рентгеноструктурного анализа.
При подсчете числа атомов в каждой элементарной ячейке следует иметь в виду, что каждый атом входит одновременно в несколько ячеек. Например, для ГЦК-решетки, каждый атом, находящийся в вершине куба, принадлежит 8 ячейкам, а атом, центрирующий грань, двум. И лишь атом, находящийся в центре куба, полностью принадлежит данной ячейке.
Таким образом, ОЦК- и ГЦК-ячейки содержат соответственно 2 и 4 атома.
Под координационным числом понимается количество ближайших соседей данного атома.
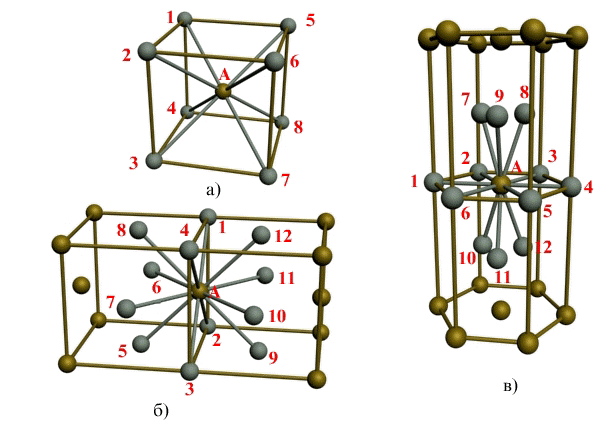
Рис. 1.3. Координационное число в различных кристаллических решетках для атома А:
В ОЦК решетке (рис. 1.3, а) атом А (в центре) находится на наиболее близком равном расстоянии от восьми атомов, расположенных в вершинах куба, т. е. координационное число этой решетки равно 8 (К8).
В ГЦК решетке (рис. 1.3, б) атом А (на грани куба) находится на наиболее близком равном расстоянии от четырех атомов /, 2, 3, 4, расположенных в вершинах куба, от четырех атомов 5, 6, 7, 8, расположенных на гранях куба, и, кроме того, от четырех атомов 9, 10, 11, 12, принадлежащих расположенной рядом кристаллической ячейке. Атомы 9, 10, 11, 12 симметричны атомам 5, 6, 7, 8. Таким образом, ГЦК решетки координационное число равно 12 (К12).
В ГПУ решетке при с/а = 1,633 (рис. 1.3, в) атом А в центре шестигранного основания призмы находится на наиболее близком равном расстоянии от шести атомов /, 2, 3, 4, 5, 6, размещенных в вершинах шестигранника, и от трех атомов 7, 8, 9, расположенных в средней плоскости призмы. Кроме того, атом А оказывается на таком же расстоянии еще от трех атомов 10, 11, 12, принадлежащих кристаллической ячейке, лежащей ниже основания. Атомы 10, 11, 12 симметричны атомам 7, 8, 9.
Следовательно, для ГПУ решетки координационное число равно 12 (Г12).
Плотность упаковки представляет собой отношение суммарного объема, занимаемого собственно атомами в кристаллической решетке, к ее полному объему. Различные типы кристаллических решеток имеют разную плотность упаковки атомов. В ГЦК решетке атомы занимают 74 % всего объема кристаллической решетки, а межатомные промежутки («поры») 26 %. В ОЦК решетке атомы занимают 68 % всего объема, а «поры» 32 %. Компактность решетки зависит от особенностей электронной структуры металлов и характера связи между их атомами.
От типа кристаллической решетки сильно зависят свойства металла.
1.3. Кристаллографические направления и плоскости
Упорядоченность кристаллического строения в пространственной решетке позволяет выделить отдельные кристаллографические направления и плоскости.
Кристаллографическими плоскостями являются, например, плоскости граней кубов (рис. 1.4, б), а также их различные диагональные плоскости вместе с находящимися на них атомами (рис. 1.4, в, г). Для ГПУ-решеток кристаллографическими плоскостями могут быть плоскости оснований (рис. 1.2, г).
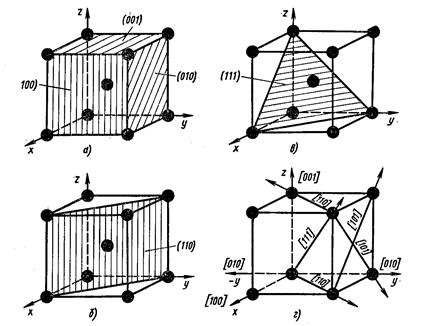
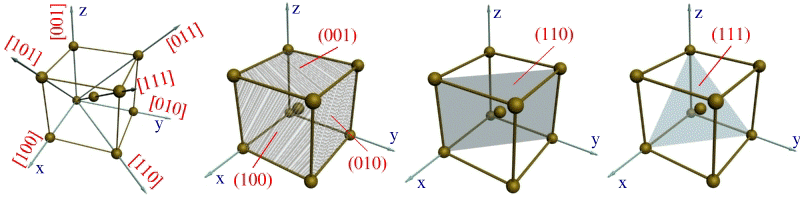
Для определения индекса какого-либо направления необходимо найти индекс ближайшего к данной точке отсчета атома, находящегося на данном направлении. Например, индекс ближайшего атома вдоль оси ОХ обозначается цифрами 100 (рис. 1.4,а). Эт и цифры представляют собой координаты упомянутого атома относительно точки О, выраженные через количество параметров вдоль осей OX, OY и OZ соответственно.
Индексы направления ОХ и параллельных ему направлений обозначаются [100]. Соответственно направления OY и OZ обозначаются [010] и [001]. Кристаллографические направления вдоль диагоналей граней XOZ, XOY и YOZ обозначают [101], [110] и [011]. Пользуясь указанной методикой, можно определить индекс любого направления. Например, индекс направления вдоль диагонали куба выразится так: [111].
Индексами плоскостей, параллельных плоскостям XOZ и YOZ, окажутся выражения (010) и (100) (рис. 1.4, б). Индекс вертикальной диагональной плоскости куба выразится через (110), (рис. 1.2, в), а индекс наклонной плоскости, пересекающейся со всеми тремя осями координат на удалении одного параметра, примет вид (111) (см. рис. 1.4, г).
1.4. Анизотропия в кристаллах
Под анизотропией понимается неодинаковость механических и других свойств в кристаллических телах вдоль различных кристаллографических направлений. Она является естественным следствием кристаллического строения, так как на различных кристаллографических плоскостях и вдоль различных направлений плотность атомов различна.
Например, в кубических решетках (см. рис. 1.2, б, в) по направлениям вдоль ребер насчитывается меньше атомов, чем вдоль диагоналей куба в ОЦК-решетке или диагоналей граней в ГЦК-решетке. На плоскостях, проходящих через грани ОЦК- и ГЦК-решеток, находится меньше атомов, чем на диагональных плоскостях.
Поскольку механические, физические и химические свойства вдоль различных направлений зависят от плотности находящихся на них атомов, то перечисленные свойства вдоль различных направлений в кристаллических телах должны быть неодинаковыми.
Анизотропия проявляется только в пределах одного монокристалла или зерна-кристаллита. В поликристаллических телах она не наблюдается из-за усреднения свойств по каждому направлению для огромного количества произвольно ориентированных друг относительно друга зерен. Поэтому реальные металлы являются квазиизотропными телами, т. е. псевдоизотропными.
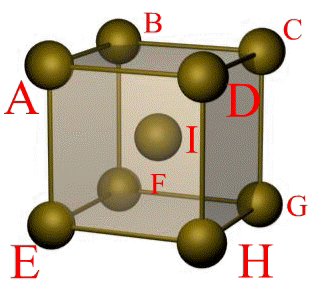
Рис. 1.5. Элементарная ячейка решетки ОЦК
Сдвиг в кристалле происходит наиболее легко вдоль атомных плоскостей с наиболее плотной упаковкой атомов. Рассмотрим объемно-центрическую кубическую решетку (ОЦК) (рис. 1.5):
Рис. 1.6. Плоскости решетки ОЦК
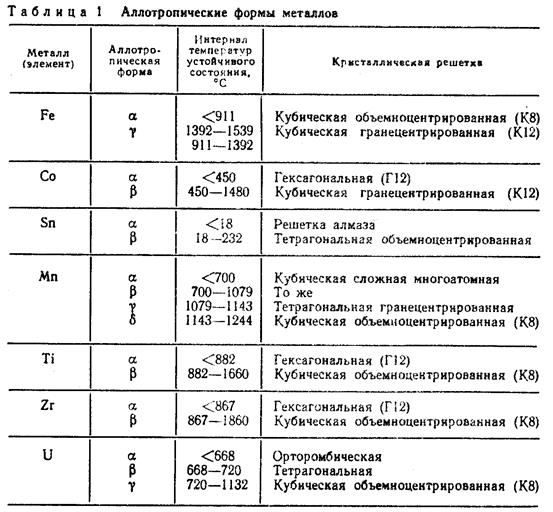
1.5. Аллотропия металлов
Некоторые металлы, например, железо, титан, олово и др. способны по достижении определенных температур изменять кристаллическое строение, т. е. изменять тип элементарной ячейки своей кристаллической решетки. Это явление получило название аллотропии или полиморфизма, а сами переходы от одного кристаллического строения к другому называются аллотропическими или полиморфными.
На рис. 1.7 показано изменение свободной энергии F от температуры t для двух вариантов кристаллического строения железа: ОЦК (кривая 1 ) и ГЦК (кривая 2).
В интервале температур 911-1392 о C железо имеет решетку ГЦК, так как при этом его свободная энергия меньше. При t 1392°С, у него должна быть решетка ОЦК, обладающая меньшей свободной энергией.
1.6. Дефекты кристаллической решетки металла
Кристаллическая решетка, в которой отсутствуют нарушения сплошности и все узлы заполнены однородными атомами называется идеальной кристаллической решеткой металла.
В решетке реального металла могут находиться различные дефекты.
Все дефекты кристаллической решетки принято делить на точечные, линейные, поверхностные и объемные.
Точечные дефекты соизмеримы с размерами атомов. К ним относятся вакансии, т. е. незаполненные узлы решетки, межузельные атомы данного металла (рис 1.8), примесные атомы замещения, т. е. атомы, по диаметру соизмеримые с атомами данного металла и примесные атомы внедрения, имеющие очень малые размеры и поэтому находящиеся в междоузлиях (рис 1.9). Влияние этих дефектов на прочность металла может быть различным в зависимости от их количества в единице объема и характера.
Рис. 1.8. Схема образования пары вакансия-внедренный атом
Рис. 1.9. Примесные атомы внедрения и замещения
Линейные дефекты имеют длину, значительно превышающую их поперечные размеры. К ним относятся дислокации, т. е. дефекты, образующиеся в решетке в результате смещений кристаллографических плоскостей.
Дислокации бывают двух видов.
Наиболее характерной является краевая дислокация (рис. 1.10). Она образуется в результате возникновения в решетке так называемой полуплоскости или экстраплоскости.
Рис. 1.10. Схема краевой дислокации в идеальном кристалле
Нижний ряд экстраплоскости собственно и принято называть дислокацией.
Другим типом дислокации является винтовая дислокация, которая представляет собой некоторую условную ось внутри кристалла, вокруг которой закручены атомные плоскости (рис.1.11).
Рис. 1.11. Схема винтовой дислокация
В винтовой дислокации, так же как в краевой, существенные искажения кристаллической решетки наблюдаются только вблизи оси, поэтому такой дефект может быть отнесен к линейным.
Дислокации обладают высокой подвижностью, поэтому существенно уменьшают прочность металла, так как облегчают образование сдвигов в зернах-кристаллитах под действием приложенных напряжений.
Дислокационный механизм сдвиговой пластической деформации внутри кристаллов может привести к разрушению изделия. Таким образом, дислокации непосредственно влияют на прочностные характеристики металла.
На рис. 1.12 в виде кривой ABC схематически показана зависимость прочности металла от плотности дислокаций. Точка А соответствует теоретической прочности металла, обусловленной необходимостью одновременного разрыва всех межатомных связей, проходящих через плоскость сдвига, в случае отсутствия дислокаций.
При увеличении количества дислокаций (см. участок АВ) прочность резко снижается, так как на несколько порядков уменьшаются усилия, необходимые для осуществления сдвигов в зернах металла при его деформировании и разрушении.
Рис. 1.12. Зависимость предела прочности кристалла от плотности линейных дефектов(дислокаций). Кривая Одинга
При плотности дислокаций 10 6- 10 7 см-2 (точка В на кривой), прочности минимальна, и на участке ВС происходит ее рост. Это объясняется тем, что с ростом плотности дислокаций их передвижение происходит не только по параллельным, но и по пересекающимся плоскостям, что существенно затрудняет процесс деформирования зерен.
Поэтому начиная с точки В прочность металла возрастает.
Поверхностные дефекты включают в себя главным образом границы зерен (рис.1.13). На границах кристаллическая решетка сильно искажена. В них скапливаются перемещающиеся изнутри зерен дислокации.
Из практики известно, что мелкозернистый металл прочнее крупнозернистого. Так как у последнего меньше суммарная протяженность (площадь) границ. То можно сделать вывод, что поверхностные дефекты способствуют повышению прочности металла. Поэтому создано несколько технологических способов получения мелкозернистых сплавов.
Рис.1.13. Структура границы двух соседних кристаллических зерен
Объемные дефекты кристаллической решетки включают трещины и поры. Наличие данных дефектов, уменьшая плотность металла, снижает его прочность.
Кроме того, трещины являются сильными концентраторами напряжений, в десятки и более раз повышающими напряжения создаваемые в металле рабочими нагрузками. Последнее обстоятельство наиболее существенно влияет на прочность металла.
Контрольные вопросы по лекции №1
В чем состоит существенная разница между строением аморфных и кристаллических тел? Что такое кристаллическая решетка?
Перечислите основные типы ячеек кристаллических решеток металлов. Что такое параметры решеток?
Что понимается под кристаллографическими направлениями и плоскостями и как они обозначаются?
Что такое анизотропия свойств в кристаллах, чем она обусловлена? Привести пример.
Почему поликристаллические тела являются изотропными? Что такое квазиизотропия (псевдоизотропия)?
Что такое аллотропия (полиморфизм) металлов и каково ее практическое значение?
Что представляют собой краевые дислокации, какова их роль в протекании пластической деформации металла и как они влияют на его прочность?
Что такое плотность дислокаций и как она влияет на характер изменения прочности металла?






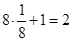 ;
; ;
; .
.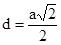 , К12.
, К12.