в каком состоянии железо встречается в природе назовите важнейшие природные соединения железа
Конспект урока по теме Железо и его соединения
Ищем педагогов в команду «Инфоурок»
Вопросы к семинару по теме
«ЖЕЛЕЗО И ЕГО СОЕДИНЕНИЯ»
В каком состоянии железо встречается в природе? Назовите
важнейшие природные соединения железа.
Каковы физические свойства железа?
С какими простыми веществами реагирует железо? Напишите
уравнения реакций и назовите полученные вещества. Что такое ржавчина и как она образуется?
С какими сложными веществами реагирует железо? Напишите уравнения реакций и назовите их продукты.
Какие гидроксиды образует железо? Укажите их кислотно-основный характер. Напишите уравнения реакций, характерных для гидроксидов железа (+2) и (+3).
Почему гидроксид железа (II) со временем становится бурым?
Какие вы знаете качественные реакции на ионы железа +2 и +3? Напишите уравнения реакций в молекулярной и ионной форме.
Биологическая роль железа и его соединений.
Вопросы к семинару по теме
«ЖЕЛЕЗО И ЕГО СОЕДИНЕНИЯ»
В каком состоянии железо встречается в природе? Назовите
важнейшие природные соединения железа.
Каковы физические свойства железа?
С какими простыми веществами реагирует железо? Напишите
уравнения реакций и назовите полученные вещества. Что такое ржавчина и как она образуется?
С какими сложными веществами реагирует железо? Напишите уравнения реакций и назовите их продукты.
Какие гидроксиды образует железо? Укажите их кислотно-основный характер. Напишите уравнения реакций, характерных для гидроксидов железа (+2) и (+3).
Почему гидроксид железа (II) со временем становится бурым?
Какие вы знаете качественные реакции на ионы железа +2 и +3? Напишите уравнения реакций в молекулярной и ионной форме.
Биологическая роль железа и его соединений.
обеспечить в ходе урока повторение, закрепление и контроль знаний о железе и его соединениях.
Сформировать (продолжить формирование, закрепить, проверить усвоение) следующих специальных понятий по данному предмету:
Умение характеризовать строение атома;
Записывать уравнения, характеризующие химические свойства железа и его соединений;
Составлять электронный баланс, указывая окислитель и восстановитель;
Записывать уравнения, соответствующие цепочке превращений;
Сформировать (продолжить формирование, закрепить, проверить усвоение) следующие общеучебные умения и навыки:
Умение устно и письменно отвечать на известные вопросы
Умение монологически высказываться
Умение действовать по инструкции, алгоритму
развивать у школьников следующие интеллектуальные умения и приемы умственной деятельности (анализ, синтез, сравнение);
развивать самостоятельность и волю школьников, используя для этого самостоятельные тестовые задания по изучаемой теме;
развивать познавательный интерес школьников, используя для этого данные о биологическом значении соединений железа;
развивать познавательный интерес школьников, используя демонстрационный эксперимент.
содействовать в ходе урока формированию идеи материальности и познаваемости мира;
Задачи для учащихся:
Проверить знание основных теоретических вопросов темы “Железо и его соединения”;
Развивать умения составлять электронный баланс и уравнения, соответствующие цепочке превращений;
Закрепить теоретические знания практическим путем.
Провести контроль усвоения основных теоретических понятий.
Оборудование и реактивы: кодоскоп;
для демонстрационных опытов: растворы FеSO4, FеС12, FеС13, NаОН, НСl, К3[Fе (СN)6], К4[Fе(СN)6], КСNS, пробирки.
Подготовка к семинару: учащимся заранее выдаются вопросы к семинару
1. Организационный момент.
2. Актуализация опорных зун.
Работа по вопросам семинара.
1 вопрос: Напишите электронно-графическую формулу атома железа. Укажите валентные электроны. Какие степени окисления проявляет железо в соединениях? Какие оксиды и гидроксиды соответствуют этим степеням окисления?
Валентные электроны 4S и 3d ( внешнего и предвнешнего уровня)
Степени окисления +2 и +3
2 вопрос: В каком состоянии железо встречается в природе? Назовите важнейшие природные соединения железа.
В основном в виде соединений: оксидов, сульфидов, карбонатов.
Магнитный железняк Fе3О4 (Урал)
Гидрокарбонат железа (II) Fе (НСОз)2 (Железноводск)
В свободном виде встречается только в метеоритах.
3 вопрос: Каковы физические свойства железа?
Ответ: серебристо-серый металл, ковкий, пластичный, плотность 7,87г/см 3 ; tпл.=1539°С; tкип.=2740°С; хорошо проводит тепло и электричество, обладает магнитными свойствами.
4 вопрос: С какими простыми веществами реагирует железо? Напишите
уравнения реакций и назовите полученные вещества. Что такое ржавчина и как она образуется?
Образование ржавчины: 4Fе + 3О2 + 6Н2О = 4Fе(ОН)з
5 вопрос: С какими сложными веществами реагирует железо? Напишите уравнения реакций и назовите их продукты.
1) с водой при нагревании 3Fе + 4Н2О = Fе3О4 + 4Н2
2) с растворами кислот Fе + 2НС1 = FеС12 + Н2
Fе + 4HNOз (разб.) = Fе(NOз)з + NО 
3) c концентрированными кислотами HNOз и H2SО4 при обычной температуре железо пассивируется;
при нагревании: 2Fе + 6H2SО4(конц.) = Fе2(SО4)3 + 3SО2 
Fе + 6HNOз (конц.) = Fе(NOз)з + 3NО2 
4) с растворами солей менее активных металлов
Fе + СuSО4 = FеSО4 + Сu (сульфат железа (II), медь)
6 вопрос: Какие гидроксиды образует железо? Укажите их кислотно-основный характер. Напишите уравнения реакций, характерных для гидроксидов железа (+2) и (+3).
Fе (ОН)2 + NаОН
7 вопрос: Почему гидроксид железа (II) со временем становится бурым?
Ответ: Соединения Fе +2 нестойки и со временем на воздухе окисляются до Fе +3 :
8 вопрос: Какие вы знаете качественные реакции на ионы железа +2 и +3? Напишите уравнения реакций в молекулярной и ионной форме.
Ответ (сопровождается демонстрационными опытами).
9 вопрос : Какова биологическая роль железа и его соединений?
Много железа содержится в коровьем и козьем молоке, яичном желтке.
У растений железо в порфиринах, которые отвечают за синтез хлорофилла. При недостатке железа растения не образуют хлорофилла (что разрушает процесс фотосинтеза), теряют возможность ассимилировать углекислый газ и выделять кислород, у животных и человека развивается анемия (малокровие).
Где встречается железо в природе
Железо — самый распространенный после алюминия металл на земном шаре; оно составляет около 5% земной коры. Встречается железо в виде различных соединений: оксидов, сульфидов, силикатов. В свободном виде железо находят в метеоритах, изредка встречается самородное железо (феррит) в земной коре как продукт застывания магмы.
Железо входит в состав многих минералов, из которых слагаются месторождения железных руд.
Основные рудные минералы железа:
Гематит (железный блеск, красный железняк) — Fe2O3 (до 70% Fe);
Магнетит (магнитный железняк) — Fe3O4 (до 72,4% Fe);
Гидрогетит — FeOOH*nH2O (лимонит) — (около 62% Fe);
Месторождения железных руд образуются в различных геологических условиях; с этим связано разнообразие состава руд и условий их залегания. Железные руды разделяются на следующие промышленные типы:
Бурые железняки — руды водной окиси железа (главный минерал — гидрогетит), 30-55% железа.
Красные железняки, или гематитовые руды (главный минерал — гематит, иногда с магнетитом), 51-66% железа.
Магнитные железняки (главный минерал — магнетит), 50-65% железа.
Сидеритовые или карбонатные осадочные руды, 30-35% железа.
Силикатные осадочные железные руды, 25-40% железа.
Большие запасы железных руд находятся на Урале, где целые горы (например Магнитная, Качканар, Высокая и др.) образованы магнитным железняком. Большие залежи железных руд имеются вблизи Курска, на Кольском полуострове, в Западной и Восточной Сибири, на дальнем Востоке. Богатые залежи имеются на Украине.
Железо является также одним из наиболее распространенных элементов в природных водах, где среднее содержание его колеблется в интервале 0,01-26 мг/л.
Железо в природе (4,7% в Земной коре)

Чаще всего железо находят в богатых металлом рудах, которые можно относительно легко добывать и перерабатывать. В чистом виде железо находили только в метеоритах, а в соединениях оно присутствует в сульфидах, силикатах и оксидах.
Характеристика железа
Физические свойства
Железо – это серебристо-белый металл с сероватым оттенком. В чистом виде пластичен, но непрочен. При добавлении в него различных добавок (например, углерода) твердость и хрупкость сплава повышается. Железо хорошо проводит электричество, тепло и обладает мощными магнитными свойствами, то есть под действием магнитного поля оно намагничивается и потом само становится магнитом.
Железо особенно важно для живых организмов. Оно способствует дыхательным процессам и входит в состав гемоглобина крови (477 мг/л). Это значит, что железо участвует в процессе доставки кислорода от органов дыхания к тканям.
Находясь в воде и на влажном воздухе железо меркнет и ржавеет, а при температуре 1539°С легко плавится и поддается ковке. При высоких температурах железо реагирует с паром воды.
Железо образует 300 разнообразных минералов (карбонаты, сульфиды и т.д.) и энергично мигрирует в земной коре. Его называют металлом земных недр, так как он копится в кристаллизации магмы.
Химические свойства
Железо — металл со средней степенью химической активности. На воздухе, на нем образуется защитная пленка, которая препятствует коррозии и ржавлению. Если воздух влажный, железо окисляется и покрывается ржавчиной.
Растворяется в разведенной соляной или серной кислотах, с выделением водорода. Вытесняет из растворов солей металлы. Во время нагревания взаимодействует с неметаллами.
Соединения и нахождение железа в природе
В естественных водах, среднее содержание железа (в интервале 0,01-26 мг/л). Кроме того, животные особи, бактерии и растения содержат его в своих организмах. Даже в тканях и внутренних органах людей есть железо, поступающее в организм вместе с едой. Потребность в нем для взрослого человека составляет 11-30мг. Избыток железа приводит к гемохроматозу и серьезным нарушениям внутренних органов.
Так как месторождения железных руд возникают в разных геологических условиях, то и состав руд и условия их расположения разнообразны.
Железо содержится во многих рудах:
• гематит (железный блеск, красный железняк),
• пирит (серный колчедан) и гетит,
• магнетит (магнитный железняк),
• сидерит и гидрогенит.
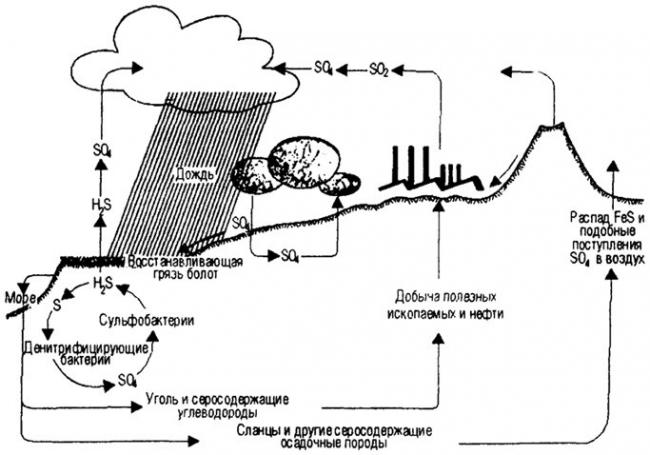
Круговорот железа в природе
(На примере круговорота серы и других соединений в природе)
За счет жизнедеятельности железобактерий (нитевидные бактерии и одиночные железобактерии) происходит круговорот железа в природе. Они окисляют железо до гидроксида железа, а углерод получают из углекислоты. Таким образом, железобактерии получают энергию для своей жизнедеятельности, а после смерти осаждаются в почве в виде болотной руды.
Области применения железа
В чистом виде железо непрочно, поэтому практически не применяется. Его используют для выработки электромагнитов, как катализатор химических реакций и др.
Основное применение этот металл находит в виде сплавов. На их долю приходится 95% всей металлопродукции. Железо основной компонент стали и чугуна. В стали меньше углерода, чем в чугуне, и поэтому она более пластична и устойчива к резким ударным нагрузкам железа.
Так же железо входит в состав никелевых и других сплавов, использующихся в электротехнике, железо-воздушных аккумуляторах и железо — никелевых аккумуляторах.
На основе железа производятся материалы, которые могут выдерживать действие низкой и повышенной температуры, агрессивной среды, ядерных излучений, вакуума и высоких давлений и т. п.
Железо относится к группе тех металлов, которые очень широко применяются во всех областях народного и бытового хозяйства. Чугун и сталь стали основой современной техники. С их участием произошло развитие тяжелой промышленности, разнообразного наземного транспорта и др.
Большие запасы железа в России, Австралии, Канаде, Казахстане, Индии, Франции, США, Венесуэле и ЮАР.
Где встречается железо в природе
Железо – химический элемент
1. Положение железа в периодической таблице химических элементов и строение его атома
Железо — это d- элемент VIII группы; порядковый номер – 26; атомная масса Ar ( Fe ) = 56; состав атома: 26-протонов; 30 – нейтронов; 26 – электронов.
Схема строения атома:
Электронная формула: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2
Металл средней активности, восстановитель:
Основные степени окисления: +2, +3
2. Распространённость железа
Железные руды довольно широко распространены на Земле. Названия гор на Урале говорят сами за себя: Высокая, Магнитная, Железная. Агрохимики в почвах находят соединения железа.
Железо входит в состав большинства горных пород. Для получения железа используют железные руды с содержанием железа 30-70% и более.
Основными железными рудами являются :
магнетит (магнитный железняк) – Fe3O4 содержит 72% железа, месторождения встречаются на Южном Урале, Курской магнитной аномалии:
гематит (железный блеск, кровавик)– Fe2O3 содержит до 65% железа, такие месторождения встречаются в Криворожском районе:
лимонит (бурый железняк) – Fe2O3*nH2O содержит до 60% железа, месторождения встречаются в Крыму:
пирит (серный колчедан, железный колчедан, кошачье золото) – FeS2 содержит примерно 47% железа, месторождения встречаются на Урале.
3. Роль железа в жизни человека и растений
Биохимики открыли важную роль железа в жизни растений, животных и человека. Входя в состав чрезвычайно сложно построенного органического соединения, называемого гемоглобином, железо обусловливает красную окраску этого вещества, от которого в свою очередь, зависит цвет крови человека и животных. В организме взрослого человека содержится 3 г чистого железа, 75% которого входит в состав гемоглобина. Основная роль гемоглобина – перенос кислорода из легких к тканям, а в обратном направлении – CO2.
Железо необходимо и растениям. Оно входит в состав цитоплазмы, участвует в процессе фотосинтеза. Растения, выращенные на субстрате, не содержащем железа, имеют белые листья. Маленькая добавка железа к субстрату – и они приобретают зеленый цвет. Больше того, стоит белый лист смазать раствором соли, содержащей железо, и вскоре смазанное место зеленеет.
Так от одной и той же причины – наличия железа в соках и тканях – весело зеленеют листья растений и ярко румянятся щеки человека.
4. Физические свойства железа.
Железо – это серебристо-белый металл с температурой плавления 1539 о С. Очень пластичный, поэтому легко обрабатывается, куется, прокатывается, штампуется. Железо обладает способностью намагничиваться и размагничиваться, поэтому применяется в качестве сердечников электромагнитов в различных электрических машинах и аппаратах. Ему можно придать большую прочность и твердость методами термического и механического воздействия, например, с помощью закалки и прокатки.
Восстановлением из оксидов углём или оксидом углерода (II), а также водородом:
6. Химические свойства железа
Как элемент побочной подгруппы железо может проявлять несколько степеней окисления. Мы рассмотрим только соединения, в которых железо проявляет степени окисления +2 и +3. Таким образом, можно говорить, что у железа имеется два ряда соединений, в которых оно двух- и трехвалентно.
1) На воздухе железо легко окисляется в присутствии влаги (ржавление):
2) Накалённая железная проволока горит в кислороде, образуя окалину — оксид железа (II,III) — вещество чёрного цвета:
3) При высокой температуре (700–900°C) железо реагирует с парами воды:
4) Железо реагирует с неметаллами при нагревании:
5) Железо легко растворяется в соляной и разбавленной серной кислотах при обычных условиях:
6) В концентрированных кислотах – окислителях железо растворяется только при нагревании
На холоде концентрированные азотная и серная кислоты пассивируют железо!
7) Железо вытесняет металлы, стоящие правее его в ряду напряжений из растворов их солей.
8) Качественные реакции на
Основная часть получаемого в мире железа используется для получения чугуна и стали — сплавов железа с углеродом и другими металлами. Чугуны содержат около 4% углерода. Стали содержат углерода менее 1,4%.
Чугуны необходимы для производства различных отливок — станин тяжелых машин и т.п.
Задания для закрепления
Железо в природе
Железо (Ferrum); ат. вес 55,85 — самый распространенный после алюминия металл на земном шаре, составляющий 4,2% веса земной коры. Встречается железо исключительно в виде различных соединений: окислов, сернистых соединений, силикатов. В свободном состоянии железо находят только в падающих на землю метеоритах.
Важнейшими железными рудами являются: магнитный железняк Fe3О4, красный железняк Fe2О3, бурый железняк 2Fe2О3• 3Н2О и шпатовый железняк FeCО3. Встречающийся в больших количествах железный колчедан FeS2 редко применяется в металлургии, так как железо из него получается очень низкого качества, из-за большого содержания серы. Не представляя интереса для металлургии, железный колчедан имеет тем не менее значительное применение — он служит исходным сырьем для получения серной кислоты.
В пределах СНГ месторождения железных руд находятся на Урале, где целые горы (например, Магнитная, Качканар, Высокая и др.) образованы магнитным железняком превосходного качества. Не менее богатые залежи находятся в Криворожском районе и на Керченском полуострове. Криворожские руды, которыми питается украинская металлургическая промышленность, состоят из красного железняка, керченские — из бурого железняка. Большие залежи железных руд имеются близ Курска, в области так называемой Курской магнитной аномалии. Огромные запасы железной руды обнаружены также в недрах Кольского полуострова, в Западной и Восточной Сибири и на Дальнем Востоке. Общее количество железных руд в СНГ составляет больше половины мировых запасов.
Из всех металлов, добываемых человеком, железо имеет наибольшее значение в нашей жизни. Вся современная техника связана с применением железа и его сплавов. Насколько важную роль играет железо, видно уже из того, что количество добываемого железа приблизительно в 20 раз превосходит добычу всех остальных металлов, вместе взятых.
Добыча железа особенно быстро росла в прошлом столетии. Еще в начале XIX в. мировая выплавка чугуна равнялась всего 0,8 млн. т в год, а к концу XIX в. она составляла уже 66 млн. т в год. В 1929 г. выплавка стали в капиталистических странах достигла 110,0 млн. т, после чего резко упала в годы кризиса (до 44,8 млн. т. в 1932 г.), затем снова повысилась и в 1937 г. составляла 112,8 млн. т. В 1957 г. в капиталистических странах было выплавлено 155 млн. т чугуна и 218 млн. т стали.
Вы читаете, статья на тему Железо в природе
Двойкам нет
Железо. Распространенность железа в природе. Биологическая роль железа
Второй важный химический элемент после кислорода, свойства которого будут изучаться, — это Ферум. Железо является металлическим элементом, который образует простое вещество — железо. Железо входит в состав восьмой группы побочной подгруппы периодической системы. Согласно номеру группы максимальная валентность железа должна составлять восемь, однако в соединениях Ферум чаще проявляет валентность два и три, а также известные соединения с валентностью железа шесть. Относительная атомная масса железа равно пятьдесят шесть.
По распространенной в составе земной коры Ферум занимает среди металлических элементов второе место после алюминия. Массовая доля железа в земной коре составляет почти пять процентов. В самородном состоянии железо встречается очень редко, обычно лишь в виде метеоритов. Именно в этом виде наши предки и смогли впервые познакомиться с железом и оценить его как очень хороший материал для изготовления орудий труда. Считается, что железо является главной составляющей ядра земного шара. Чаще Ферум встречается в природе в составе руд. Важнейшими из них являются: магнитный железняк (магнетит) Fe3O4, красный железняк (гематит) Fe2O3, бурый железняк (лимонит) Fe2O3 · nH2O, железный колчедан (пирит) FeS2, шпатовый железняк (сидерит) FeСO3, гетит FeO (OH). В водах многих минеральных источников содержится Fe (НСO3) 2 и некоторые другие соли железа.
Железо является жизненно важным элементом. В организме человека, как и животных, феррум присутствует во всех тканях, однако наибольшая его часть (примерно три грамма) сосредоточена в кровяных шариках. Атомы железа занимают центральное положение в молекулах гемоглобина, им гемоглобин обязан своей окраской и способностью присоединять отщеплять кислород. Железо участвует в процессе переноса кислорода от легких к тканям организма. Суточная потребность организма в Ферум составляет 15-20 мг. Общая его количество попадает в организм человека с растительной пищей и мясом. При потере крови потребность в Ферум превышает количество, которое человек получает с пищей. Недостаток железа в организме может привести к состоянию, которое характеризуется уменьшением количества эритроцитов и гемоглобина крови. Медицинские препараты железа следует принимать только по назначению врача.