в какую сторону увеличивается радиус атома
Периодический закон
Периодический закон был открыт Д.И. Менделеевым в 1868 году. Его современная формулировка: свойства химических элементов и образуемых ими соединений (простых и сложных) находятся в периодической зависимости от величины заряда атомного ядра.
Периодический закон лежит в основе современного учения о строении вещества. Периодическая система Д.И. Менделеева является наглядным отражением периодического закона.
Группой называют вертикальный ряд химических элементов в периодической таблице. Элементы собраны в группы на основе степени окисления в высшем оксиде. Каждая из восьми групп состоит из главной подгруппы (а) и побочной подгруппы (б).
Периодическая таблица Д.И. Менделеева содержит колоссальное число ответов на самые разные вопросы. При умелом ее использовании вы сможете предполагать строение и свойства веществ, успешно писать химические реакции и решать задачи.
Радиус атома
Радиусом атома называют расстояние между атомным ядром и самой дальней электронной орбиталью. Это не четкая, а условная граница, которая говорит о наиболее вероятном месте нахождения электрона.
В периоде радиус атома уменьшается с увеличением порядкового номера элементов («→» слева направо). Это связано с тем, что с увеличением номера группы увеличивается число электронов на внешнем уровне. Запомните, что для элементов главных подгрупп номер группы равен числу электронов на внешнем уровне.
С увеличением числа электронов они становятся более скученными, так как притягиваются друг к другу сильнее: это и есть причина маленького радиуса атома.
Чем меньше электронов, тем больше у них свободы и больше радиус атома, поэтому радиус увеличивается в периоде «←» справа налево.
Период, группа и электронная конфигурация
Правило составления электронной конфигурации, которое вы только что увидели, универсально. Если вы имеете дело с элементом главной подгруппы, то увидев номер группы вы знаете, сколько электронов у него на внешнем уровне. Посмотрев на период, знаете номер его внешнего уровня.
Длина связи
Убедимся в этом на наглядном примере, сравнив длину связей в четырех веществах: HF, HCl, HBr, HI.
Чем больше радиусы атомов, которые образуют химическую связь, тем больше между ними и длина связи. Радиус атома водорода неизменен во всех трех веществах, а в ряду F → Cl → Br → I происходит увеличение радиуса атома. Наибольшим радиусом обладает йод, поэтому самая длинная связь в молекуле HI.
Металлические и неметаллические свойства
Сравним металлические и неметаллические свойства Rb, Na, Al, S. Натрий, алюминий и сера находятся в одном периоде. Металлические свойства возрастают S → Al → Na. Натрий и рубидий находятся в одной группе, металлические свойства возрастают Na → Rb.
Основные и кислотные свойства
Замечу, что здесь есть одно важное исключение. Как и в общем случае: исключения только подтверждают правила. В ряду галогенводородных кислот HF → HCl → HBr → HI происходит усиление кислотных свойств (а не ослабление, как должно быть по логике нашего правила).
Восстановительные и окислительные свойства
Электроотрицательность (ЭО), энергия связи, ионизации и сродства к электрону
Для примера сравним ЭО-ость атомов Te, In, Al, P. Индий расположен в одной группе с алюминием, ЭО-ость In → Al возрастает (снизу вверх). Алюминий расположен в одном периоде с серой, ЭО-ость возрастает Al → S (слева направо). Сравнивая серу и теллур, мы видим, что сера расположена в группе выше теллура, значит и ее электроотрицательность тоже выше.
Энергия связи (а также ее прочность) возрастают с увеличением электроотрицательности атомов, образующих данную связь. Чем сильнее атом тянет на себя электроны (чем больше он ЭО-ый), тем прочнее получается связь, которую он образует.
Продемонстрирую на примере. Сравним энергию связи в трех молекулах: H2O, H2S, H2Se.
Высшие оксиды и летучие водородные соединения (ЛВС)
В периодической таблице Д.И. Менделеева ниже 7 периода находится строка, в которой для каждой группы указаны соответствующие высшие оксиды, ниже строка с летучими водородными соединениями.
Для элементов главных подгрупп начиная с IV группы (в большинстве случае) максимальная степень окисления (СО) определяется по номеру группы. К примеру, для серы (в VI группе) максимальная СО = +6, которую она проявляет в соединениях: H2SO4, SO3.
На экзамене строка с готовыми «высшими» оксидами, как в таблице наверху, может отсутствовать. Считаю важным подготовить вас к этому. Предположим, что эта строчка внезапно исчезла из таблицы, и вам нужно записать высшие оксиды для фосфора и углерода.
С летучими водородными соединениями (ЛВС) ситуация аналогичная: их может не быть в периодической таблице Д.И. Менделеева, которая попадется на экзамене. Я расскажу вам, как легко их запомнить.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Атомный радиус, как он измеряется, как он изменяется в периодической таблице, примеры
атомный радиус это важный параметр для периодических свойств элементов таблицы Менделеева. Это напрямую связано с размером атомов, поскольку на большем радиусе они больше или громоздче. Кроме того, это связано с электронными характеристиками того же.
Пока атом имеет больше электронов, тем больше его размер и атомный радиус. Оба определяются электронами валентной оболочки, потому что на расстояниях за пределами их орбит вероятность обнаружения электрона приближается к нулю. В окрестности ядра происходит обратное: увеличивается вероятность нахождения электрона.
Верхнее изображение представляет собой упаковку ватных шариков. Обратите внимание, что каждый из них окружен шестью соседями, не считая другого возможного верхнего или нижнего ряда. Способ уплотнения ватных шариков будет определять их размеры и, следовательно, их радиусы; как это происходит с атомами.
Элементы в соответствии с их химической природой так или иначе взаимодействуют со своими собственными атомами. Следовательно, величина атомного радиуса варьируется в зависимости от типа присутствующей связи и твердой упаковки ее атомов..
Как измеряется атомный радиус?
На основном изображении можно легко измерить диаметр ватных шариков, а затем разделить его на два. Однако сфера атома не полностью определена. Почему? Потому что электроны циркулируют и диффундируют в определенных областях пространства: орбитали.
Поэтому атом можно рассматривать как сферу с неощутимыми краями, о которых невозможно точно сказать, в какой степени они заканчиваются. Например, на верхнем изображении центральная область около ядра выглядит более интенсивной, а ее края размыты.
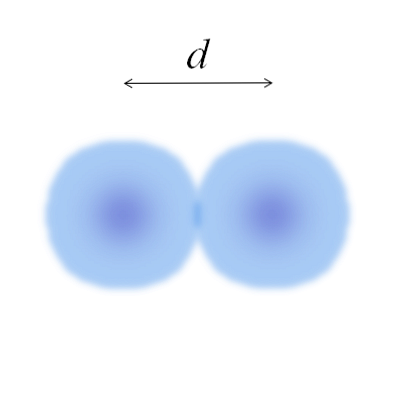
Изображение представляет двухатомную молекулу E2 (как Cl2, H2, О2, и т.д.). Предполагая, что атомы являются сферическими телами, если расстояние было определено d что разделяет оба ядра в ковалентной связи, то было бы достаточно разделить его на две половины (d/ 2) получить атомный радиус; точнее, ковалентный радиус E для E2.
А если Е не образует с собой ковалентных связей, но это металлический элемент? то d это будет указано числом соседей, которые окружают Е в его металлической структуре; то есть по координационному числу (N.C) атома в упаковке (помните ватные шарики основного изображения).
Определение межъядерного расстояния
Определить d, это межъядерное расстояние для двух атомов в молекуле или упаковке, это требует методов физического анализа.
Одной из наиболее часто используемых является дифракция рентгеновских лучей, в которой пучок света облучается через кристалл, и изучается дифракционная картина, возникающая в результате взаимодействия электронов с электромагнитным излучением. В зависимости от упаковки могут быть получены различные дифракционные картины и, следовательно, другие значения d.
Если атомы «плотно» в кристаллической решетке, они будут представлять разные значения d по сравнению с тем, что они имели бы, если бы они были «удобными». Кроме того, эти межъядерные расстояния могут колебаться в значениях, поэтому атомный радиус фактически состоит из среднего значения таких измерений.
Как связаны атомный радиус и координационное число? В. Гольдшмидт установил взаимосвязь между ними, в которой для N.C. из 12 относительное значение равно 1; от 0,97 для упаковки, где атом имеет N.C, равный 8; 0,96 для N.C, равного 6; и 0,88 для N.C. из 4.
единицы
Из значений для N.C, равных 12, было построено много таблиц, сравнивающих атомные радиусы всех элементов периодической таблицы..
Поскольку не все элементы образуют такие компактные структуры (N.C меньше 12), соотношение В. Гольдшмидта используется для расчета их атомных радиусов и выражения для одной и той же упаковки. Таким образом, измерения атомных радиусов стандартизированы.
Как это меняется в периодической таблице?
На протяжении периода
Слева направо в тот же период, ядро добавляет протоны и электроны, но последние ограничены тем же уровнем энергии (главное квантовое число). Как следствие, ядро оказывает увеличивающийся эффективный заряд ядра на валентные электроны, который сжимает атомный радиус..
Таким образом, неметаллические элементы в тот же период имеют тенденцию иметь атомные (ковалентные) радиусы меньше, чем металлы (металлические радиусы).
По убыванию группой
При спуске по группе включаются новые уровни энергии, которые позволяют электронам иметь больше места. Таким образом, электронное облако преодолевает большие расстояния, его размытая периферия все больше отдаляется от ядра, и, следовательно, радиус атома расширяется.
Сокращение лантаноидов
Электроны внутреннего слоя помогают экранировать эффективный заряд ядра на валентных электронах. Когда орбитали, составляющие внутренние слои, имеют много «дырок» (узлов), как и в случае f-орбиталей, ядро сильно сжимает атомный радиус из-за плохого экранирующего эффекта орбиталей..
Этот факт подтверждается сокращением лантаноидов в период 6 периодической таблицы. От La до Hf происходит значительное сжатие атомного радиуса, создаваемого орбиталями f, которые «заполняются» при прохождении через блок f: у лантаноидов и актиноидов.
Аналогичный эффект можно наблюдать и с элементами блока p периода 4. На этот раз произведение слабого экранирующего эффекта орбиталей d, которые заполняются при пересечении периодов переходных металлов..
примеров
Для периода 2 периодической таблицы атомные радиусы ее элементов:
Обратите внимание, что металлический литий имеет наибольший атомный радиус (257 мкм), в то время как фтор, расположенный в крайней правой части периода, является наименьшим из них (64 мкм). Атомный радиус уменьшается слева направо за тот же период, и перечисленные значения показывают его.
Литий, образуя металлические связи, его радиус металлический; и фтор, поскольку он образует ковалентные связи (F-F), его радиус является ковалентным.
А если вы хотите выразить атомные радиостанции в единицах ангстрема? Просто разделите их на 100: (257/100) = 2,57Å. И так далее с остальными ценностями.
В какую сторону увеличивается радиус атома
В формулировке периодического закона не говорится о том, какие именно свойства периодически зависят от заряда ядра. Дело в том, что химическое описание элемента и его соединений включает множество свойств и характеристик, поэтому перечислить их все довольно трудно. Рассмотрим некоторые из них, наиболее важные, ограничиваясь при этом элементами A-групп.
Атомный радиус r — это величина, характеризующая размер атома. Чем больше атомный радиус, тем дальше от ядра простирается его электронное облако. Большинство атомов имеют радиусы в пределах 0.05 — 0.2 нанометра (нм); самым маленьким является атом гелия (r 0.23 нм).
Интересно знать! Электронное облако атома не имеет чётких границ, а значит, и точных размеров, поэтому величина атомного радиуса является условной и зависит от метода определения. Например, можно рассмотреть сферу с центром в атомном ядре и рассчитать, какая часть электронного облака свободного атома окажется внутри сферы в зависимости от радиуса этой сферы. Последняя точка перегиба на графике этой зависимости будет соответствовать орбитальному радиусу атома. С другой стороны, можно подобрать такие значения радиусов, чтобы расстояние между соседними атомными ядрами в молекулах соответствовало сумме этих радиусов; так получаются ковалентные радиусы атомов (именно они указаны на рисунке). Есть и другие способы определения атомных радиусов, но важно понимать, что для сравнения атомных радиусов друг с другом нужно брать значения, определённые одним и тем же методом.
Электроотрицательность χ — это условная величина, характеризующая способность атома уплотнять своё электронное облако при взаимодействии с другими атомами. Когда атомы связываются друг с другом, их электронные облака перекрываются и деформируются так, чтобы взаимодействие с ядрами было наиболее выгодным, то есть происходит перераспределение электронной плотности. При этом оказывается, что какие-то атомы «тянут» сильнее, скапливая вокруг себя избыточный отрицательный заряд, — отсюда и название величины. Впервые численные оценки этой величины предложил известный химик Лайнус Карл Полинг, и с тех пор электроотрицательность оценивают в баллах по шкале Полинга. Самый «сильный» по электроотрицательности элемент — фтор, самый «слабый» — цезий:
Интересно знать! У атомов благородных газов уже достигнуто наиболее выгодное состояние внешнего слоя, поэтому для них понятие электроотрицательности не имеет чёткого смысла. Именно по этой причине благородные газы отсутствуют в приведённом выше эмпирическом ряду. Также оттуда исключены элементы седьмого периода, большая часть которых малоизучена. Кроме того, заряд ядра в атомах элементов 7 периода настолько велик, что возникают отклонения от закономерностей, наблюдающихся в предыдущих периодах (например, у франция атомный радиус меньше, а электроотрицательность выше, чем у цезия). Причинами этих отклонений являются спин-орбитальное расщепление и релятивистские эффекты, которые изучаются в университетском курсе квантовой химии.
Интересно знать! Металличность можно противопоставить электроотрицательности в том смысле, что металличность характеризует способность «отдавать» электроны, а электроотрицательность — способность их «забирать». Но эти понятия не являются противоположными друг другу. Например, у благородных газов металличность вообще не выражена, но принимать электроны они не способны. Другой пример: полоний является металлом (из-за большого атомного радиуса), но его электроотрицательность заметно выше, чем у неметалла кремния (до выгодного состояния внешнего слоя полонию не хватает всего двух электронов).
Таким образом, вдоль таблицы Менделеева:
Радиус атома
Из Википедии — свободной энциклопедии
Электроны не имеют четко определённых орбит или границ. Скорее, их положения могут быть описаны как распределения вероятностей, которые постепенно сужаются по мере удаления от ядра без резкого сокращения. Кроме того, в конденсированном веществе и молекулах электронные облака атомов обычно в некоторой степени перекрываются, и некоторые из электронов могут перемещаться в области, охватывающей два или более атомов («принадлежать» нескольким атомам одновременно).
Во многих случаях форма атома может быть аппроксимирована сферой. Это лишь грубое приближение, но оно может дать количественные представления и выступить в качестве базовой модели для описания для многих явлений, таких как плотность жидкостей и твердых веществ, диффузия жидкостей через молекулярные сита, расположение атомов и ионов в кристаллах, а также размер и форма молекул.
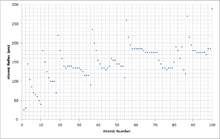
Радиусы атомов изменяются, подчиняясь определённым закономерностям периодической таблицы химических элементов. Например, радиусы атомов обычно уменьшаются при перемещении слева направо вдоль каждого периода (строки) таблицы, от щелочных металлов до благородных газов, и возрастают по мере продвижения сверху вниз в каждой группе (столбце). Радиусы атомов резко возрастают при переходе между благородным газом в конце каждого периода и щелочным металлом в начале следующего периода. Эти тенденции изменения радиусов атомов (наряду с другими химическими и физическими свойствами элементов) могут быть объяснены с точки зрения теории электронной оболочки атома, а также представляют доказательства подтверждения квантовой теории. Радиусы атомов уменьшаются в периодической таблице, потому что с увеличением атомного номера увеличивается число протонов в атоме, а дополнительные электроны добавляются в одну и ту же квантовую оболочку. Следовательно, эффективный заряд атомного ядра по отношению к внешним электронам увеличивается, притягивая внешние электроны. В результате электронное облако сжимается и атомный радиус уменьшается.
Электроны не имеют определенных орбит или четко определенных диапазонов. Скорее их положения должны быть описаны как распределения вероятностей, которые постепенно сужаются по мере удаления от ядра без резкого ограничения; их называют атомными орбиталями или электронными облаками. Более того, в конденсированных средах и молекулах электронные облака атомов обычно до некоторой степени перекрываются, и некоторые электроны могут перемещаться по большой области, охватывающей два или более атомов.
СОДЕРЖАНИЕ
История
Определения
Широко используемые определения атомного радиуса включают:
Эмпирически измеренный атомный радиус
| Группа (столбец) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |
| Период (строка) | |||||||||||||||||||
| 1 | H 25 | Он | |||||||||||||||||
| 2 | Ли 145 | Быть 105 | В 85 | С 70 | № 65 | O 60 | П 50 | Ne | |||||||||||
| 3 | Na 180 | Мг 150 | Al 125 | Si 110 | P 100 | S 100 | Cl 100 | Ar | |||||||||||
| 4 | К 220 | Около 180 | Сбн 160 | Ti 140 | V 135 | Кр 140 | Пн 140 | Fe 140 | Co 135 | Ni 135 | Cu 135 | Zn 135 | Ga 130 | Ge 125 | Как 115 | Пн 115 | Br 115 | Kr | |
| 5 | 235 руб. | Sr 200 | Y 180 | Zr 155 | Nb 145 | Пн 145 | Tc 135 | Ru 130 | Rh 135 | Pd 140 | Ag 160 | CD 155 | В 155 г. | Sn 145 | Сб 145 | Te 140 | Я 140 | Xe | |
| 6 | CS 260 | Ba 215 | * | Lu 175 | Hf 155 | Ta 145 | W 135 | Re 135 | Os 130 | Ir 135 | Пт 135 | Au 135 | Hg 150 | Tl 190 | Pb 180 | Би 160 | Po 190 | В | Rn |
| 7 | Пт | Ra 215 | ** | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Ур. | Ц | Og |
| * | La 195 | CE 185 | Pr 185 | Nd 185 | PM 185 | См 185 | Eu 185 | Gd 180 | ТБ 175 | Dy 175 | Ho 175 | Er 175 | ТМ 175 | Yb 175 | |||||
| ** | Ac 195 | Чт 180 | Па 180 | U 175 | Np 175 | Pu 175 | Am 175 | См | Bk | Cf | Es | FM | Мкр | Нет |
Объяснение общих тенденций
То, как атомный радиус изменяется с увеличением атомного номера, можно объяснить расположением электронов в оболочках фиксированной емкости. Оболочки обычно заполняются в порядке увеличения радиуса, поскольку отрицательно заряженные электроны притягиваются положительно заряженными протонами в ядре. По мере увеличения атомного номера вдоль каждой строки периодической таблицы дополнительные электроны переходят в ту же самую внешнюю оболочку; радиус которого постепенно сужается из-за увеличения заряда ядра. В благородном газе самая внешняя оболочка полностью заполнена; следовательно, дополнительный электрон следующего щелочного металла перейдет в следующую внешнюю оболочку, учитывая внезапное увеличение атомного радиуса.
Возрастающий заряд ядра частично уравновешивается увеличением количества электронов, явление, известное как экранирование ; что объясняет, почему размер атомов обычно увеличивается вниз по каждому столбцу. Однако есть одно примечательное исключение, известное как сжатие лантаноидов : 5d-блок элементов намного меньше, чем можно было бы ожидать, из-за слабого экранирования 4f-электронов.
По сути, атомный радиус уменьшается через периоды из-за увеличения количества протонов. Следовательно, существует большее притяжение между протонами и электронами, потому что противоположные заряды притягиваются, и большее количество протонов создает более сильный заряд. Более сильное притяжение притягивает электроны ближе к протонам, уменьшая размер частицы. Следовательно, атомный радиус уменьшается. Вниз по группам атомный радиус увеличивается. Это потому, что существует больше уровней энергии и, следовательно, большее расстояние между протонами и электронами. Кроме того, электронная защита снижает притяжение, поэтому оставшиеся электроны могут уходить дальше от положительно заряженного ядра. Следовательно, размер или атомный радиус увеличивается.
В следующей таблице приведены основные явления, влияющие на атомный радиус элемента:
Сокращение лантаноидов
Из-за сокращения лантаноидов можно сделать 5 следующих наблюдений:
сокращение d-блока
Расчетные атомные радиусы
В следующей таблице показаны атомные радиусы, рассчитанные на основе теоретических моделей, опубликованных Энрико Клементи и другими в 1967 году. Значения даны в пикометрах (пм).