в митохондриях клеток какого органа главным образом происходит кетогенез
Параграф 47. 1. Кетоновые тела
Автор текста – Анисимова Елена Сергеевна.
Авторские права защищены. Продавать текст нельзя.
Курсив не зубрить.
Замечания можно присылать по почте: exam_bch@mail.ru
https://vk.com/bch_5
Параграф учебника по биохимии 47.1.
Кетоновые тела:
определение, обмен, синтез, использование, роль, значении при патологии, регуляция обмена.
Содержание параграфа:
47.1.1. Синтез кетоновых тел.
47.2.2. Окисление кетоновых тел.
47.1.3. Кетозы
Определение.
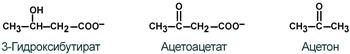
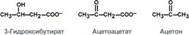
Кетоновые тела – это группа веществ:
ацетон, ;-кетобутират и ;-гидроксибутират.
(Но не у всех из них есть кетогруппы – только у кетобутирата).
Обмен кетоновых тел (КТ).
Обмен конкретного вещества – это
процессы образования (синтеза) и использования вещества.
КТ могут использоваться большинством тканей
для выработки энергии (АТФ)
и тем самым поддерживать жизнь тканей.
Нервная ткань использует кетоновые тела для миелинизации.
(В этом польза КТ).
Но избыток КТ приводит к ацидозу.
(В этом их патогенность).
Синтез КТ называется кетогенезом.
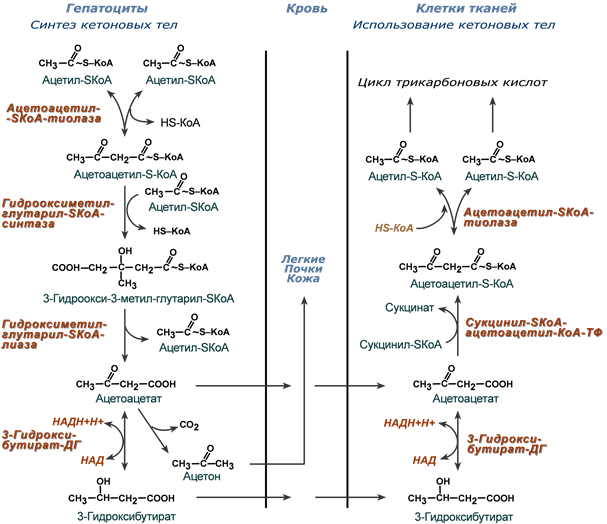
47.1.1. Синтез кетоновых тел (кетогенез).
Кетогенез происходит в печени
(в митохондриях гепатоцитов)
при накоплении в гепатоцитах ацетилКоА,
который образуется в основном из жирных кислот
при ;-окислении
(жирные кислоты поступают из крови,
в которую поступают из белой жировой ткани
или из липопротеинов
при распаде жира – липолизе, п.44.1).
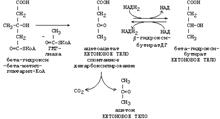
1-я реакция кетогенеза:
из двух молекул ацетилКоА образуется ацето/ацетилКоА.
2-я реакция кетогенеза:
ацето/ацетилКоА вступает в реакцию с третьей молекулой ацетилКоА,
превращаясь в ГМГ-КоА
(;-Гидрокси/;-Метил/ГлутарилКоА:
это тиоэфир глутаровой кислоты
с группой ОН и метильной группами в ; положении)
под действием фермента ГМГ-КоА-синтазы.
3-я реакция: ГМГ-КоА расщепляется
на ацетилКоА и ацетоацетат
(синоним – ;-кето/бутират)
под действием фермента ГМГ-КоА/лиазы.
Ацетоацетат – это первое кетоновое тело.
4-я реакция кетогенеза:
бОльшая часть ацетоацетата вступает в обратимую реакцию в НАДН,
превращаясь в ;-ОН-бутират
(под действием фермента ;-ОН-бутират/дегидрогеназы),
поэтому основное кетоновое тело в крови – это ;-ОН-бутират.
После кетозенеза продукты кетошенеза
;-ОН-бутират и ;-кетобутираты поступают в кровь
и кровотоком доставляются в ткани.
Часть ацетоацетата без участия фермента превращается в ацетон
при отщеплении карбоксильной группы в виде СО2 (при декарбоксилировании).
Тут надо добавить таблицу с формулами
«Р е а к ц и и кетогенеза (синтеза кетоновых тел) в МХ гепатоцитов».
Но пока она в отдельном файле.
47.1.2. Окисление кетоновых тел.
Что происходит с КТ в тканях.
В тканях КТ (бутираты) превращаются в ацетилКоА,
который поступает в ЦТК для выработки АТФ.
Этот путь использования КТ тканями называется окислением КТ
и нужен для получения АТФ в клетках
(окисление ;-кето-бутирата дает 19 молекул АТФ,
а окисление ;-ОН-бутирата дает 21,5 АТФ).
Выработка ацетилКоА из КТ
снижает потребность головного мозга в глюкозе
как субстрате для выработки АТФ,
которая является основным источником ацетилКоА;
но глюкоза должна поступать в нейроны для получения из нее оксалоацетата,
иначе без него ацетилКоА не сможет использоваться в ЦТК.
Второй путь использования кетоновых тел в тканях:
в нервной ткани ацетилКоА,
полученный из кетоновых тел,
используется для синтеза жирных кислот (п.46)
для синтеза липидов миелиновых оболочек (мембран шванновских клеток),
то есть для миелинизации.
Как КТ превращаются в ацетилКоА.
;-ОН бутират превращается в ;-кетобутират
при отщеплении водорода под действием фермента ;-ОН/бутират/дегидрогеназы:
см. п.22 и 21
отщепленные атомы водорода переносятся на НАД+,
превращая его в НАДН, Н+;
использование НАДН, Н+ в ДЦ
дает 2,5 АТФ
(поэтому окисление ;-ОН/бутирата дает на 2,5 АТФ больше,
чем окисление ;-кето/бутирата).
;-кетобутират превращается в ;-кето/бутирил/КоА (=ацетоацетилКоА) одним из двух способов:
— либо вступая в реакцию с КоA
(при этом тратится 1 АТФ,
поэтому этот способ активации менее выгоден, чем следующий; см. 2а),
— либо вступая в реакцию с сукцинилКоА:
;-кетобутират + сукцинилКоА ;
;-кетобутирилКоА + сукцинат; см. 2б.
;-кето/бутирилКоА расщепляется на 2 молекулы ацетилКоА (см. 3),
поступление которых в ЦТК дает 20 молекул АТФ
(по 10 АТФ от каждого ацетилКоА – см. п.21).
Тут надо добавить таблицу с формулами превращений кетоновых тел в ацетилКоА
«Р е а к ц и и окисления кетоновых тел в тканях»
Но пока она в отдельном файле.
– это состояния, при которых повышена концентрация кетоновых тел в крови
(это повышение называется гипер/кетон/емией)
и присутствуют кетоновые тела в моче
(это называется кетонурией).
Из-за того, что 2 из 3 кетоновых тел (бутираты, но не ацетон) являются кислотами,
их избыток (кетоз) приводит к ацидозу:
чем больше в крови кетоновых тел,
тем сильнее ацидоз
(кислоты при рН около 7 диссоциируют на анион и протон Н+,
ацидозом является накопление именно протонов).
При умеренном ацидозе возникает тошнота,
а сильный ацидоз угрожает жизни
(см. о кетоацидотической коме при СД в п.103).
Кетозы являются результатом повышенного образования кетоновых тел
(результатом усиления кетогенеза).
Причиной усиления кетогенеза является:
увеличение концентрации ацетилКоА в гепатоцитах
из-за активации липолиза в жировой ткани и ГНГ в печени,
что бывает при:
1) при нарушении питания,
при котором употребляется много жиров
при недостаточном употреблении углеводов
(сало без хлеба, жирная колбаса без каши, масло без ничего и т.п.),
так как при этом образуется много ацетилКоА из жира,
но не хватает оксалоацетата из-за дефицита углеводов,
2) при недостатке инсулина при сахарном диабете,
поскольку инсулин мог бы затормозить липолиз и ГНГ),
3) при избытке таких гормонов, как:
1 – катехоламины
(избыток КА бывает у здоровых людей при стрессе
или у больных с гиперфункцией мозгового вещества надпочечников),
2 – глюкагон
(у здоровых при голоде),
3 – йодтиронины
(при гиперфункции ЩВЖ, при тиреотоксикозе),
4 – СТГ
(при гиперфункции гипофиза при акромегалии и при гигантизме).
Таким образом, кетозы бывают и у больных, и у здоровых,
но у здоровых кетозы менее сильные и менее опасны для жизни.
У здоровых кетозы бывают (физиологические кетозы) при:
1) избытке жиров в пище при недостатке углеводов,
2) при стрессе и голоде,
3) при беременности.
Хотя сильный кетоз при беременности является патологией, может быть опасен и т.д.
Патологические кетозы
бывают при лихорадках
и при эндокринных заболеваниях:
— сахарном диабете (см. п. 103),
— акромегалии,
— тиреотоксикозе.
При сильном кетозе бывает появление запаха ацетона,
но отсутствие запаха ацетона не гарантирует отсутствие кетоза:
нужно определять [кетоновых тел] в крови (кетонемию)
и присутствие кетоновых тел в моче (кетонурию).
Строение кетоновых тел
В обычных условиях синтез кетоновых тел также идет, хотя в гораздо меньшем количестве. Для этого используются как жирные кислоты, так и безазотистые остатки кетогенных и смешанных аминокислот.
Для детей раннего возраста характерна неустойчивость жирового обмена, связанная с недостаточностью регуляторного влияния ЦНС и эндокринной системы. Поэтому кетонемия и кетонурия у грудных детей наблюдается чаще, чем у взрослых.
Уровень ацетоацетата быстро нарастает между 12 и 24 часами жизни и сохраняется высоким первую неделю жизни, что свидетельствует об активной мобилизации жира из депо, высокой утилизации свободных жирных кислот в печени и малом использовании кетоновых тел в тканях.
У детей до 7 лет под влиянием различных стимулов (краткое голодание, инфекции, эмоциональное возбуждение) ускоряется синтез кетоновых тел и может легко возникать кетоацидоз, сопровождающийся неукротимой рвотой («ацетонемическая рвота«). Причиной этого служит неустойчивость углеводного обмена и малые запасы гликогена у детей, что усиливает липолиз в адипоцитах, накопление жирных кислот в крови и, следовательно, кетогенез в печени.
Синтез кетоновых тел (кетогенез)
Реакции синтеза и утилизации кетоновых тел
Используются кетоновые тела клетками всех тканей, кроме печени и эритроцитов. Особенно активно, даже в норме, они потребляются миокардом и корковым слоем надпочечников.
В тканях реакции утилизации кетоновых тел в целом совпадают с обратным направлением реакций синтеза. В цитозоле клеток 3-гидроксибутират окисляется, образующийся ацетоацетат проникает в митохондрии, активируется за счет сукцинил-SКоА и превращается в ацетил-SКоА, который сгорает в ЦТК.
При сахарном диабете 1 типа (инсулинзависимом) в гепатоците глюкозы может быть много, т.к. глюкоза проникает в него через ГлюТ-2 без участия инсулина. Однако, точно также как при голодании, соотношение инсулин/глюкагон низкое, и оксалоацетат очень активно уходит на синтез глюкозы, что тормозит ЦТК и отправляет ацетил-SKoA на образование кетоновых тел.
При сахарном диабете 2 типа (инсулиннезависимом) инсулина достаточно и соотношение инсулин/глюкагон велико, поэтому глюконеогенез не активен и оксалоацетата хватает для поддержания ЦТК. Образуемый здесь ацетил-SKoA либо сгорает в ЦТК, либо используется для реакций синтеза холестерина и синтеза жирных кислот (которые стимулируются инсулином). К тому же при наличии инсулина попадающие в печень жирные кислоты будут не окисляться, а вовлекаться в синтез триацилглицеролов и ЛПОНП.
Кетоновые тела не обязательно образуются из жирных кислот; скорее, значительное их количество синтезируется только в ситуации углеводной и белковой недостаточности, когда только жирные кислоты легко доступны в качестве топлива для их производства.
СОДЕРЖАНИЕ
Производство
Кетоновые тела
Три кетоновых тела, каждое из которых синтезируется из молекул ацетил-КоА, представляют собой:
Регулирование
Кетогенез может происходить, а может и не происходить, в зависимости от уровней доступных углеводов в клетке или организме. Это тесно связано с путями ацетил-КоА:
Патология
Кетогенез может быть неэффективным у людей с дефектами бета-окисления.
У людей с сахарным диабетом может наблюдаться перепроизводство кетоновых тел из-за недостатка инсулина. Без инсулина, который помогает извлекать глюкозу из крови, в тканях снижается уровень малонил-КоА, и жирным кислотам становится легче переноситься в митохондрии, вызывая накопление избытка ацетил-КоА. Накопление ацетил-КоА, в свою очередь, приводит к образованию избыточных кетоновых тел в результате кетогенеза. В результате скорость производства кетонов выше, чем скорость утилизации кетонов, и снижается pH крови.
Есть некоторые преимущества для здоровья кетоновых тел и кетогенеза. Было высказано предположение, что кетогенная диета с низким содержанием углеводов и высоким содержанием жиров может использоваться для лечения эпилепсии у детей. Кроме того, кетоновые тела могут оказывать противовоспалительное действие. Некоторые виды раковых клеток не могут использовать кетоновые тела, поскольку в них нет ферментов, необходимых для кетолиза. Было высказано предположение, что активное участие в поведении, которое способствует кетогенезу, может помочь справиться с последствиями некоторых видов рака.
Кетогенез, типы кетоновых тел, синтез и деградация
cetogénesis это процесс, с помощью которого получают ацетоацетат, β-гидроксибутират и ацетон, которые вместе называют кетоновыми телами. Этот сложный и тонко регулируемый механизм осуществляется в митохондриях, от катаболизма жирных кислот.
Получение кетоновых тел происходит, когда организм подвергается истощающим периодам голодания. Хотя эти метаболиты синтезируются в основном в клетках печени, они обнаруживаются в качестве важного источника энергии в различных тканях, таких как скелетные мышцы и ткани сердца и головного мозга..
Hydro-гидроксибутират и ацетоацетат являются метаболитами, используемыми в качестве субстратов в сердечной мышце и коре почек. В мозгу кетоновые тела становятся важными источниками энергии, когда организм исчерпал свой запас глюкозы.
Общие характеристики
Кетогенез считается очень важной физиологической функцией или метаболическим путем. Как правило, этот механизм осуществляется в печени, хотя было показано, что он может осуществляться в других тканях, способных метаболизировать жирные кислоты..
Образование кетоновых тел является основным метаболическим производным ацетил-КоА. Этот метаболит получают из метаболического пути, известного как β-окисление, которое является разложением жирных кислот.
Наличие глюкозы в тканях, где происходит β-окисление, определяет метаболическую судьбу ацетил-КоА. В особых ситуациях окисленные жирные кислоты почти полностью направляются на синтез кетоновых тел..
Типы и свойства кетоновых тел
Основным кетоновым телом является ацетоацетат или ацетоуксусная кислота, которая синтезируется главным образом в клетках печени. Другие молекулы, которые составляют кетоновые тела, происходят из ацетоацетата.
Восстановление ацетоуксусной кислоты приводит к образованию D-β-гидроксибутирата, второго кетонового тела. Ацетон представляет собой соединение, которое трудно разлагать, и он образуется в результате спонтанной реакции декарбоксилирования ацетоацетата (поэтому он не требует вмешательства какого-либо фермента), когда он присутствует в высоких концентрациях в крови.
Обозначение кетоновых тел было принято условно, поскольку, строго говоря, β-гидроксибутират не имеет кетонной функции. Эти три молекулы растворимы в воде, что облегчает их транспорт в крови. Его основная функция заключается в обеспечении энергией определенных тканей, таких как скелетные и сердечные мышцы..
Ферменты, участвующие в образовании кетоновых тел, в основном находятся в клетках печени и почек, что объясняет, почему эти два места являются основными продуцентами этих метаболитов. Его синтез происходит только и исключительно в митохондриальном матриксе клеток..
Как только эти молекулы синтезируются, они попадают в кровоток и попадают в ткани, которые в них нуждаются, где они разлагаются до ацетил-КоА..
Синтез кетоновых тел
Условия для кетогенеза
Метаболическая судьба ацетил-КоА от β-окисления зависит от метаболических потребностей организма. Это окисляется до СО2 и H2Или через цикл лимонной кислоты или синтез жирных кислот, если метаболизм липидов и углеводов в организме стабилен.
Когда организму требуется образование углеводов, оксалоацетат используется для производства глюкозы (глюконеогенез) вместо запуска цикла лимонной кислоты. Это происходит, как уже упоминалось, когда организм имеет некоторую неспособность получить глюкозу в таких случаях, как длительное голодание или наличие диабета..
В связи с этим ацетил-КоА, полученный в результате окисления жирных кислот, используется для производства кетоновых тел..
механизм
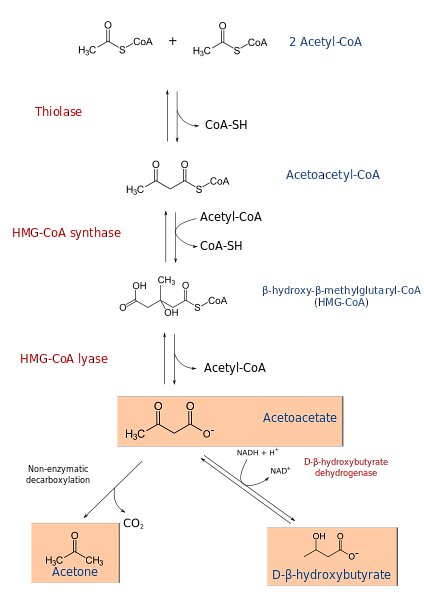
Процесс кетогенеза начинается с продуктов β-окисления: ацетацетил-КоА или ацетил-КоА. Когда субстратом является ацетил-КоА, на первом этапе происходит конденсация двух молекул, реакция, катализируемая ацетил-КоА-трансферазой, с образованием ацетацетил-КоА.
Ацетацетил-КоА конденсируется с третьим ацетил-КоА под действием синтазы ГМГ-КоА с образованием ГМГ-КоА (β-гидрокси-β-метилглутарил-КоА). HMG-CoA разлагается до ацетоацетата и ацетил-КоА под действием лиазы HMG-CoA. Таким образом получается первое кетоновое тело..
Ацетоацетат восстанавливается до β-гидроксибутирата путем вмешательства β-гидроксибутиратдегидрогеназы. Эта реакция зависит от НАДН.
Основным ацетоацетатным кетоновым телом является β-кетокислота, которая подвергается неферментативному декарбоксилированию. Этот процесс прост и производит ацетон и СО2.
Таким образом, эта серия реакций приводит к образованию кетоновых тел. Они, будучи растворимыми в воде, могут легко транспортироваться через кровоток без необходимости прикрепления к структуре альбумина, как в случае жирных кислот, которые нерастворимы в водной среде..
Β-окисление и кетогенез связаны между собой
Метаболизм жирных кислот производит субстраты для кетогенеза, поэтому эти два пути функционально связаны.
Ацетоацетил-КоА является ингибитором метаболизма жирных кислот, поскольку он останавливает активность ацил-КоА-дегидрогеназы, которая является первым ферментом β-окисления. Кроме того, он также оказывает ингибирование на ацетил-КоА-трансферазу и синтазу HMG-КоА..
Фермент синтаза HMG-CoA, подчиненный СРТ-I (фермент, участвующий в производстве ацилкарнитина при β-окислении), представляет важную регуляторную роль в образовании жирных кислот.
Регуляция β-окисления и его влияние на кетогенез
Питание организмов регулирует сложный набор гормональных сигналов. Углеводы, аминокислоты и липиды, потребляемые в рационе, откладываются в форме триацилглицеринов в жировой ткани. Инсулин, анаболический гормон, участвует в синтезе липидов и образовании триацилглицеринов.
На уровне митохондрий β-окисление контролируется поступлением и участием некоторых субстратов в митохондриях. Фермент CPT I синтезирует ацилкарнитин из цитозольного ацил-КоА.
Когда организм питается, активируется ацетил-КоА-карбоксилаза, и цитрат повышает уровень СРТ I, а его фосфорилирование уменьшается (циклическая АМФ-зависимая реакция).
Это вызывает накопление малонил-КоА, который стимулирует синтез жирных кислот и блокирует их окисление, предотвращая образование бесполезного цикла..
В случае голодания активность карбоксилазы очень низка, так как уровни фермента СРТ I были снижены, и он был фосфорилирован, активируя и стимулируя окисление липидов, что впоследствии позволит образованию кетоновых тел через ацетил-КоА.
деградация
Кетоновые тела диффундируют из клеток, где они синтезируются и транспортируются кровью в периферические ткани. В этих тканях они могут окисляться через цикл трикарбоновых кислот.
В периферических тканях β-гидроксибутират окисляется до ацетоацетата. Впоследствии настоящий ацетоацетат активируется ферментом 3-кетоацил-КоА-трансферазой.
Сукцинил-КоА действует как донор КоА, становясь сукцинатом. Активация ацетоацетата происходит, чтобы предотвратить превращение сукцинил-КоА в сукцинат в цикле лимонной кислоты при сопряженном синтезе ГТФ под действием сукцинил-КоА-синтазы..
Полученный ацетоацетил-КоА подвергается тиолитическому расщеплению с образованием двух молекул ацетил-КоА, которые включаются в цикл трикарбоновых кислот, более известный как цикл Кребса..
В клетках печени отсутствует 3-кетоацил-КоА-трансфераза, предотвращающая активацию этого метаболита в этих клетках. Таким образом, гарантируется, что кетоновые тела не окисляются в клетках, где они были произведены, но что они могут переноситься в ткани, где требуется их активность..
Медицинская значимость кетоновых тел
В организме человека высокие концентрации кетоновых тел в крови могут вызывать особые состояния, называемые ацидозом и кетонемией..
Производство этих метаболитов соответствует катаболизму жирных кислот и углеводов. Одной из наиболее распространенных причин патологического состояния кетогенеза является высокая концентрация фрагментов дикарбоната уксусной кислоты, которые не разлагаются путем окисления трикарбоновых кислот..
Вследствие этого наблюдается повышение уровня кетоновых тел в крови выше 2-4 мг / 100 Н и их присутствие в моче. Это приводит к нарушению промежуточного метаболизма указанных метаболитов..
Определенные дефекты нейрогландулярных факторов гипофиза, которые регулируют деградацию и синтез кетоновых тел, наряду с нарушениями метаболизма углеводородов, являются причиной состояния гиперцетонемии..
Сахарный диабет и накопление кетоновых тел
Сахарный диабет (тип 1) является эндокринным заболеванием, вызывающим увеличение выработки кетоновых тел. Недостаточное производство инсулина препятствует транспорту глюкозы в мышцы, печень и жировую ткань, накапливаясь в крови.
Клетки в отсутствие глюкозы начинают процесс глюконеогенеза и распада жиров и белков для восстановления их метаболизма. Как следствие, концентрация оксалоацетата снижается, а окисление липидов увеличивается..
Затем происходит накопление ацетил-КоА, которое в отсутствие оксалоацетата не может следовать по пути лимонной кислоты, вызывая высокую выработку кетоновых тел, характерных для этого заболевания..
Накопление ацетона определяется его присутствием в моче и дыхании людей, которые имеют это состояние, и на самом деле является одним из симптомов, которые указывают на проявление этого заболевания.
Синтез кетоновых тел (кетогенез)
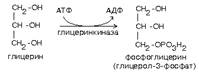
Формула активной формы глицерина.
Глицерин в активной форме — глицерол-3-фосфат (фосфоглицерин). Преимущественно глицерол-3-фосфат получают путем активации глицерина с помощью глицеринкиназы:
3. Реакции образования кетоновых тел. Где осуществляется кетогенез и какие условия способствует его усилению? Автономная саморегуляции кетогенеза.
К кетоновым телам относят три соединения близкой структуры – ацетоацетат, β-гидроксибутират и ацетон.
Синтез кетоновых тел (кетогенез)
Синтез ацетоацетата происходит только в митохондриях печени, и далее он либо восстанавливается до β-гидроксибутирата, либо спонтанно декарбоксилируется до ацетона. Далее все три соединения поступают в кровь и разносятся по тканям. Ацетон не используется в организме и как летучее вещество, легко удаляется с выдыхаемым воздухом и потом. Все кетоновые тела могут выделяться с мочой. В норме концентрация ацетона в крови мала и обычными реакциями не определяется. Наличие кетоновых тел в моче всегда свидетельствует о какой-либо патологии.
Регуляция:кетогенез происходит в митохондриях (кроме клеток печени).
Однако при общем или при углеводном голодании может нарушаться баланс между образованием и утилизацией кетоновых тел. Это связано с тем, что скорость образования кетоновых тел зависит от скорости b-окисления жирных кислот в печени, а процесс b-окисления ускоряется при усилении липолиза (распада жира) в жировой ткани ( такое может происходить при голодании или физической нагрузке в связи с действием адреналина). Регулирует процесс кетогенеза такой гормон как инсулин. Инсулин способствует не только поступлению, но и окислению глюкозы в клетках печени и других тканей (стимулирует гликолиз). В мышечной ткани и печени регулирует накопление гликогена и тормозит гликогенолиз, а в жировой ткани и печени ускоряет синтез липидов и блокирует липолиз и кетогенез. Недостаток инсулина способствует повышенному липолизу и кетогенезу, патологический процесс прогрессирует и приводит к развитию клинически выраженного кетоацидоза.