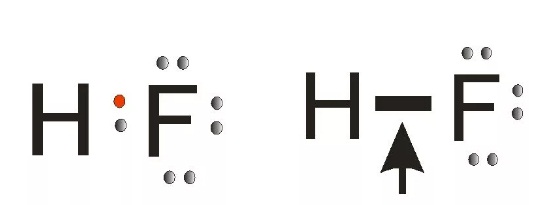в молекуле hbr химическая связь какая
Химические связи
Различают несколько типов химических связей: ковалентная, ионная, металлическая, водородная.
Ковалентная связь возникает между двумя атомами по обменному механизму (обобществление пары электронов) или донорно-акцепторному механизму (электронов донора и свободной орбитали акцептора).
Ковалентной связью соединены атомы в молекулах простых веществ (Cl2, Br2, O2), органических веществ (C2H2), а также, в общем случае, между атомами неметалла и другого неметалла (NH3, H2O, HBr).
Существует донорно-акцепторный механизм образования ковалентной связи, при котором один атом выступает в качестве донора неподеленной электронной пары. Другой атом не тратит свои электроны, а только лишь предоставляет орбиталь (ячейку) для этой электронной пары.
Ионная связь
В наиболее частом случае ионная связь образуется между типичным металлом и типичным неметаллом. Примеры:
Большой подсказкой служит таблица растворимости, ведь все соли имеют ионные связи: CaSO4, Na3PO4. Даже ион аммония не исключение, между катионом аммония и различными анионами образуются ионные связи, например в соединениях: NH4I, NH4NO3, (NH4)2SO4.
Часто в химии встречаются несколько связей внутри одной молекулы. Рассмотрим, например, фосфат аммония, обозначив тип каждой связи внутри этой молекулы.
Металлическая связь
«Облако» электронов в металлах способно приходить в движение под различным воздействием. Именно оно является причиной электропроводности металлов.
Водородная связь
Водородные связи возникают между атомом водорода и другим более электроотрицательным атомом (O, S, N, C).
Отчасти за счет водородных связей наблюдается то самое исключение, связанное с усилением кислотных свойств в ряду галогеноводородных кислот: HF → HCl → HBr → HI. Фтор является самым ЭО-ым элементов, сильно притягивает к себе атом водорода другой молекулы, что снижает способность кислоты отщеплять водород и снижает ее силу.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
В молекуле hbr химическая связь какая




3. Химическая связь
4. Степ. окисл. Валентн.
5. Строение вещества
7. Простые вещества
12. Строение орг. в-в
17. Азотсодерж. соед.
19. Классиф. реакций
20. Скорость реакции
21. Электр. дисс. РИО
22. Хим. лаборатория
25. Термохим. расчеты
26. Расч. по уравнен.
33. Качествен. реакции
38. Органич. цепочки
39. Раствор и реакции
Виртуальная химическая школа
Тестовый практикум по ЕГЭ
Ковалентная химическая связь, её разновидности и механизмы образования. Характеристика ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь.
1. В аммиаке и хлориде бария химическая связь соответственно
1) ионная и ковалентная полярная
2) ковалентная полярная и ионная
3) ковалентная неполярная и металлическая
4) ковалентная неполярная и ионная
2. Вещества только с ионной связью приведены в ряду:
3. Соединение с ионной связью образуется при взаимодействии
4. В каком ряду все вещества имеют ковалентную полярную связь?
5. В каком ряду записаны формулы веществ только с ковалентной полярной
связью?
7. Веществом с ковалентной полярной связью является
8. Веществом с ковалентной связью является
1) СаС1 2 2) MgS 3) H 2 S 4) NaBr
9. Вещество с ковалентной неполярной связью имеет формулу
10. Веществами с неполярной ковалентной связью являются
11. Между атомами с одинаковой относительной электроотрицательностью образуется химическая связь
2) ковалентная полярная
3) ковалентная неполярная
12. Ковалентная полярная связь характерна для
1) KC1 2) НВг 3) Р 4 4) СаС l 2
13. Химический элемент, в атоме которого электроны по слоям распределены так: 2, 8, 8, 2 образует с водородом химическую связь
2) ковалентную неполярную
14. В молекуле какого вещества длина связи между атомами углерода наибольшая?
1> ацетилена 2) этана 3) этена 4) бензола
15. Тремя общими электронными парами образована ковалентная связь в молекуле
16. Водородные связи образуются между молекулами
1) диметилового эфира
17. Полярность связи наиболее выражена в молекуле
1) HI 2) НС1 3) HF 4) НВг
18. Веществами с неполярной ковалентной связью являются
19. Водородная связь не характерна для вещества
20. Ковалентная полярная связь характерна для каждого из двух веществ, формулы которых
21. Наименее прочная химическая связь в молекуле
1) фтора 2) хлора 3> брома 4> иода
22. В молекуле какого вещества длина химической связи наибольшая?
1) фтора 2) хлора 3) брома 4) иода
23. Ковалентные связи имеет каждое из веществ, указанных в ряду:
24. Ковалентную связь имеет каждое из веществ, указанных в ряду:
25. Ковалентную связь имеет каждое из веществ, указанных в ряду:
26. Ковалентные связи имеет каждое из веществ, указанных в ряду:
27. Полярность связи наиболее выражена в молекулах
28. В молекуле какого вещества химические связи наиболее прочные?
Примеры решения задач. Пример 1. Объясните механизм образования ковалентной химической связи в молекуле HBr и оцените степень ее полярности
Пример 1. Объясните механизм образования ковалентной химической связи в молекуле HBr и оцените степень ее полярности.
Р е ш е н и е. 1) Для объяснения механизма образования ковалентной химической связи необходимо определить, какие электроны участвуют в образовании этой связи. Запишем электронные конфигурации атомов и электронные схемы строения их валентных уровней; изобразим форму АО, участвующих в образовании связи.
Br 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 5
Для образования ковалентной связи атомы водорода и брома предоставляют по одному неспаренному электрону с антипараллельными спинами: атом Н – электрон, находящийся на s – АО (форма АО – сфера), а атом Br – электрон с
p – АО (форма АО – гантель).
2) Покажем механизм образования ковалентной связи в молекуле HBr.
В молекуле HBr связь создается за счет перекрывания двух атомных орбиталей: s – АО и p – АО с образованием между ядрами атомов H и Br зоны повышенной электронной плотности:
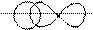
3) Для определения степени полярности связи рассчитаем разность электроотрицательностей атомов, образующих молекулу: ЭОН = 2,2; ЭОBr = 2,8; т.е. ЭОH − Br = 0,6, поэтому связь в молекуле HBr ковалентная полярная.
4) Определим вид химической связи в зависимости от способа перекрывания АО взаимодействующих атомов. В молекулах с одинарной химической связью (а именно таковой является молекула HBr) всегда образуется σ – связь как более прочная. В случае σ – связи область перекрывания АО расположена на линии, соединяющей ядра двух атомов.
Пример 2. Определите химические свойства, валентность и возможные степени окисления атома углерода в основном и возбужденном состояниях.
Р е ш е н и е. 1) Рассмотрим основное состояние атома углерода. Так как химические свойства атома определяются его электронным строением, составим электронную конфигурацию атома С и выделим строениевалентного уровня:
2) Составим электронную схему валентного уровня и определим химические свойства атома С, его валентность и степень окисления.
Валентность атома определяется числом неспаренных электронов валентного уровня. Из данной схемы видно, что атом углерода имеет два неспаренных валентных электрона, значит в основном состоянии валентность атома углерода равна двум (В=II), т.е. атом углерода может образовывать две химические связи. Вступая во взаимодействие с другими атомами, атом С стремится завершить свой внешний уровень. Поэтому он может отдать эти два неспаренных электрона, проявляя при этом восстановительные свойства и превращаясь в положительно заряженный ион со степенью окисления +2: С 0 − 2 ē = С +2
2s 2 2p 2 2s 2 (типа He)
Но атом углерода, как неметалл, может принимать недостающие до завершения внешнего уровня четыре электрона, проявляя окислительные свойства и превращаясь в отрицательно заряженный ион со степенью окисления – 4:
2s 2 2p 2 2s 2 2p 6 (типа Ne)
С 0 …2s 2 2p 2 → С* … 2s 1 2p 3
Основное состояние Возбужденное состояние
При возбуждении число неспаренных электронов увеличивается до четырех. Значит в возбужденном состоянии атом углерода проявляет валентность В=IV и образует четыре химические связи. В возбужденном состоянии атом С может только отдать на связь свои 4ē, проявляя восстановительные свойства и превращаясь в положительно заряженный ион со степенью окисления +4:
2s 2 2p 2 1s 2 (типа He)
Пример 3. Определите, какая связь C−N или C−H является более полярной. Укажите, к ядру какого атома происходит смещение общей электронной пары.
Р е ш е н и е. Для определения полярности связи необходимо найти разность электроотрицательностей атомов (∆ЭО), образующих эти связи. Из табл.1 выписываем значения ЭО этих атомов и находим ∆ЭО:
ЭОС =2,5; ЭОN = 3,0; ЭОH = 2,1; ∆ЭОC−N =3,0 – 2,5 = 0,5; ∆ЭОC−H = 2,5 – 2,1 = 0,4.
Известно, что чем больше ∆ЭО атомов, образующих связь, тем выше полярность связи. Поэтому более полярной является связь C–N. При образовании ковалентной связи общая электронная пара смещается к ядру атома с большей ЭО. В химической связи C−N общая электронная пара смещена к атому N, а в химической связи C−H – к атому С.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Ковалентная связь. Разбираем задачи, закрепляем тему
История
С момента открытия атомов и молекул исследователи долгое время задумывались над вопросом, какие силы объединяют микрочастицы в молекуле.
В 1897 году Джозеф Джон Томсон выдвинул теорию, что атомы удерживаются рядом благодаря переносу электронов от одного атома к другому и образованию электронных связей. И был прав. Вклад Томсона в науку был отмечен Нобелевской премией в 1906 году за «изучение прохождения электрического тока через газы».
Исследования продолжились, и в 1916 году американский физико-химик Гильберт Ньютон Льюис объяснил это явление, предложив теорию электронной химической связи. В своих опытах ученый заметил, что наиболее устойчивы при взаимодействии электронные оболочки атомов благородных газов. А атомы других веществ стремятся сделать свою энергетическую оболочку похожей на оболочку благородного газа, расположенного в том же периоде. И для этого присоединяют или отдают электроны. Познакомиться с биографией ученого можно в учебнике Химия 8 класс под редакцией В.В. Еремина на странице 218.
Исследователь предложил графическую модель структуры молекулы, в которой электроны обозначены точками, а связи черточками.
Правило октета
Льюис сформулировал принцип «октета». Согласно этому правилу, при создании молекулы атомы стараются достигнуть восьмиэлектронной валентной оболочки, попарно объединяя электроны, находящиеся на внешней орбитали. По важности это открытие сопоставимо с открытием периодического закона Д.И. Менделеевым.
Заглянем в Периодическую таблицу. В первом периоде находятся водород и гелий. Общее у этих двух газов — одна орбиталь. А вот количество электронов различно: у водорода один, у гелия два. Как мы помним, на первой орбитали у любого элемента могут поместиться всего лишь два электрона. И поскольку орбиталь гелия максимально заполнена — это инертный газ, который не вступает в химические реакции. А вот водород ищет себе пару и объединяется в двухатомные молекулы H2 или образует соединения с другими элементами. В остальных периодах на внешней орбитали могут разместиться восемь электронов.
Механизмы образования связи
Взаимодействие, возникающее при образовании общих электронных пар, называется ковалентная химическая связь. При образовании химической связи выделяется энергия в количестве, необходимом для разъединения атомов на расстояние, при котором взаимодействие стало бы невозможным. Такой тип связи характерен для большинства соединений.
Взаимодействие между атомами различных веществ может происходить двумя способами.
От электроотрицательности атомов и их способности притягивать электроны зависит, какая ковалентная связь образуется в молекуле.
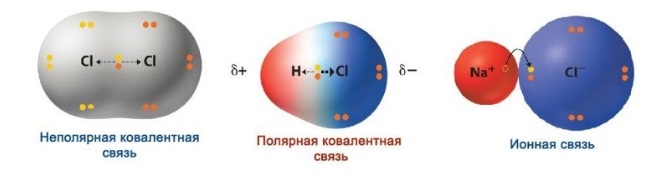
В месте перекрывания электронных облаков создается зона повышенной электронной плотности. Если электроотрицательность элементов равна, электронное облако находится на одинаковом расстоянии от центров атомов, входящих в электронную пару, и образуется ковалентная неполярная связь.
Если электроотрицательность различна, происходит сдвиг электронного облака в сторону центра с большей электроотрицательностью, то есть образуются молекула с двумя полюсами (диполь). Самый простой пример диполя — молекула воды. Данный тип связи и есть ковалентная полярная связь.
Ионная связь — вариант крайне полярной ковалентной связи.
Помимо полярности, ковалентная связь соединения характеризуется и другими параметрами:
Задачи на тему «Химическая связь»
1. Чем объяснить, что такие вещества, как кислород, водород, углекислый газ, имеют низкие температуры кипения и плавления?
Молекулы О2, Н2 имеют ковалентную неполярную связь, а СО2 – ковалентную полярную (хотя, на самом деле, молекула О=С=О в целом неполярная, т. к. она линейная и дипольные моменты С=О компенсируют друг друга). Таким образом, они слабо поляризуются, а значит между атомами одной молекулы связь значительно сильнее чем между отдельными молекулами. Поэтому, для образования жидкости или кристалла молекулы вещества нужно очень сильно замедлить.
2. Приведите по два примера соединений с полярной и неполярной ковалентной связью.
Неполярная ковалентная связь образуется одинаковыми атомами – Н2, N2;
Полярная ковалентная связь образуется разными атомами – Н2О, NН3;
3. Приведите примеры неполярных молекул с ковалентными полярными связями.
BeF2, CO2, C2H4 – неполярные молекулы, т. к. дипольные моменты малополярных связей Be=F, C=O и C-H соответственно компенсируют друг друга.
4. Напишите формулы двух соединений, имеющих одновременно ионную и ковалентную связи.
5. Объясните, почему водородное соединение фосфора менее прочное, чем водородное соединение азота.
Водородные соединения фосфора – РН3, азота – NH3. Азот более электроотрицательный элемент по сравнению с фосфором, поэтому образует с водородом более прочную связь.
6. Напишите структурные формулы иона аммония и молекулы пероксида водорода.
7. Напишите структурные формулы следующих соединений: перхлорат калия, хлорат калия, хлорит калия, гипохлорит калия, хлорид калия.
8. Напишите структурную и электронную формулы оксида углерода (II) и оксида углерода (IV).
Оксида углерода (II) – CO, оксида углерода (IV) – СО2.
9. Напишите структурные формулы фосфата, гидрофосфата и дигидрофосфата кальция.
Фосфат кальция – Ca3(PO4)2, гидрофосфат кальция – CaHPО4, дигидрофосфат кальция – Ca[H2PO4]2.
10. В чем заключается сущность донорно-акцепторного механизма образования химической связи? Приведите не менее трех примеров соединений, связь в которых образована по этому механизму.
Сущность заключается в том, что ковалентная связь образуется в результате перехода уже существующей электронной пары донора (поставщика электронов) в общее пользование донора и другого атома – акцептора, предоставляющего для этой пары свободную орбиталь.
11. Дайте характеристику водородной связи. В каких случаях возможно ее образование? Приведите примеры.
Водородная связь – связь между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом другой молекулы. Водородная связь имеет частично электростатическую, частично донорно-акцепторную природу.
Водородные связи могут образовываться в тех случаях, когда атом водорода связан с электроотрицательным атомом, который смещает на себя электронной облако, создавая тем самым на водороде положительный заряд δ+.
Примеры: Н2О, HF, HCl, HBr, HI.
12. Сопоставьте разности электроотрицательностей элементов в гидридах щелочных металлов от лития к цезию. Как изменяется природа связи в гидридах?
Щелочны́е мета́ллы — элементы 1-й группы периодической таблицы химических элементов (по устаревшей классификации — элементы главной подгруппы I группы): литий Li, натрий Na, калий K, рубидий Rb, цезий Cs, франций Fr, унуненний Uue.
Химические формулы для сравнения: LiH, NaH, KH, RbH, CsH.
Электроотрицательности элементов по Полингу: H – 2.1, Li – 1.0, Na – 0.9, K – 0.8, Rb – 0.8, Cs – 0.8.
ΔX (LiH) = 2.1 – 1.0 = 1.1
ΔX (NaH) = 2.1 – 0.9 = 1.2
ΔX (RbH) = 2.1 – 0.8 = 1.3
ΔX (CsH) = 2.1 – 0.8 = 1.3
От лития к цезию разность электроотрицательностей возрастает. Природа связи от лития к цезию движется от ковалентной полярной в сторону ионной. При разности электроотрицательностей элементов 1.7 и выше связь считается ионной. Прочность связи от лития к цезию падает.
13. Как изменяется полярность в ряду молекул: а) HF; HCl, HBr, HI; б) NH3, PH3, AsH3?
а) Электроотрицательности элементов по Полингу: H – 2.1, F – 4.0, Cl – 3.2, Br – 3.0, I – 2.7.
Поскольку в ряде (а) электроотрицательность элементов справа (F, Cl, Br, I, т. е. тех, что перетягивают на себя электронное облако) падает, стало быть и общие пары электронов все больше смещаются к водороду, связь при этом становится прочнее.
б) Электроотрицательности элементов по Полингу: H – 2.1, N – 3.0, P – 2.2, As – 2.0.
В данном случае полярность направлена к водороду. Общие пары электронов по ходу ряда все больше смещаются к водороду.
14. У какого соединения температура плавления ниже: Br2 или I2, NaF или KF, LiCl или CCl4, C4H9OH или C5H10?
1) Оба элемента имеют ковалентную неполярную связь и молекулярную кристаллическую решетку. Йод подвергается возгонке (переход из твердого состояния сразу в газообразное).Температура плавления ниже у брома.
2) Оба элемента имеют ионную связь и ионную кристаллическую решетку. У KF температура плавления ниже, т. к. Na более электроотрицателен, а значит и разность электроотрицательностей с фтором ниже, связь крепче, температура плавления выше.
3) CCl4 имеет молекулярную кристаллическую решетку, а LiCl – ионную, ионная прочнее, значит у CCl4 температура плавления ниже.
4) У C4H9OH температура плавления ниже, т. к. присутствуют водородные связи.
15. Приведите примеры молекул (не менее 5), в которых степени окисления атомов и их валентности не совпадают.
1) Угарный газ СО (С≡О) – с.о. углерода +2, валентность углерода – III.
2) Циановодород HCN (H–C≡N) – с.о. углерода +2, валентность углерода – IV.
4) Кислород О2 (О=О) – с.о. кислорода 0, валентность кислорода – II.
5) Водород H2 (Н-Н) – с.о. водорода 0, валентность водорода – I.
16. Почему для атомов фосфора, серы и хлора максимальная валентность совпадает с номером группы, а для атомов азота, кислорода и фтора она меньше номера группы?
Валентность определяется числом неспаренных электронов атома в основном или возбужденном состоянии, участвующих в образовании общих электронных пар с электронами других атомов.
Таким образом, в атомах P, S и Cl в возбужденном состоянии спаренные электроны на внешнем уровне могут разделяться (т. к. для них есть свободные орбитали), тогда их валентности будут равны 5, 6 и 7 соответственно.
Для атомов N, O и F характерны валентности 3, 2 и 1 соответственно.