в растворах каких солей среда кислая сульфат алюминия хлорид кальция
В растворах каких солей среда кислая сульфат алюминия хлорид кальция
Установите соответствие между формулой соли и её отношением к гидролизу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ОТНОШЕНИЕ К ГИДРОЛИЗУ
A)
Б)
B)
Г)
1) гидролизуется по катиону
2) гидролизуется по аниону
3) не гидролизуется
4) гидролизуется как по катиону, так и по аниону
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Eсли растворимая соль образована сильной кислотой и слабым основанием, то она гидролизуется по катиону (части слабого основания). Например,
В результате раствор имеет кислую среду (избыток ионов водорода).
Eсли растворимая соль образована слабой кислотой и сильным основанием, то она гидролизуется по аниону (части слабой кислоты). Например,
В результате раствор имеет щелочную среду (избыток гидроксид-ионов).
Соль, образованная сильной кислотой и сильным основанием, не гидролизуется, среда нейтральная.
Растворимая соль, образованная слабой кислотой и слабым основанием, гидролизуется и по катиону, и по аниону.
Нерастворимые соли гидролизу не подвергаются.
А) Перхлорат калия — образован сильным основанием и сильной кислотой — гидролиза нет (3).
Б) Сульфид меди (II) — нерастворимая соль — гидролиза нет (3).
В) Ацетат аммония — образован слабой кислотой и слабым основанием — гидролизуется и по катиону, и по аниону (4).
г) Карбонат натрия — образован слабой кислотой и сильным основанием — гидролиз по аниону (2).
1.4.7. Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная.
Для того, чтобы понять, что такое гидролиз солей, вспомним для начала, как диссоциируют кислоты и щелочи.
Общим между всеми кислотами является то, что при их диссоциации обязательно образуются катионы водорода (Н + ), при диссоциации же всех щелочей всегда образуются гидроксид-ионы (ОН − ).
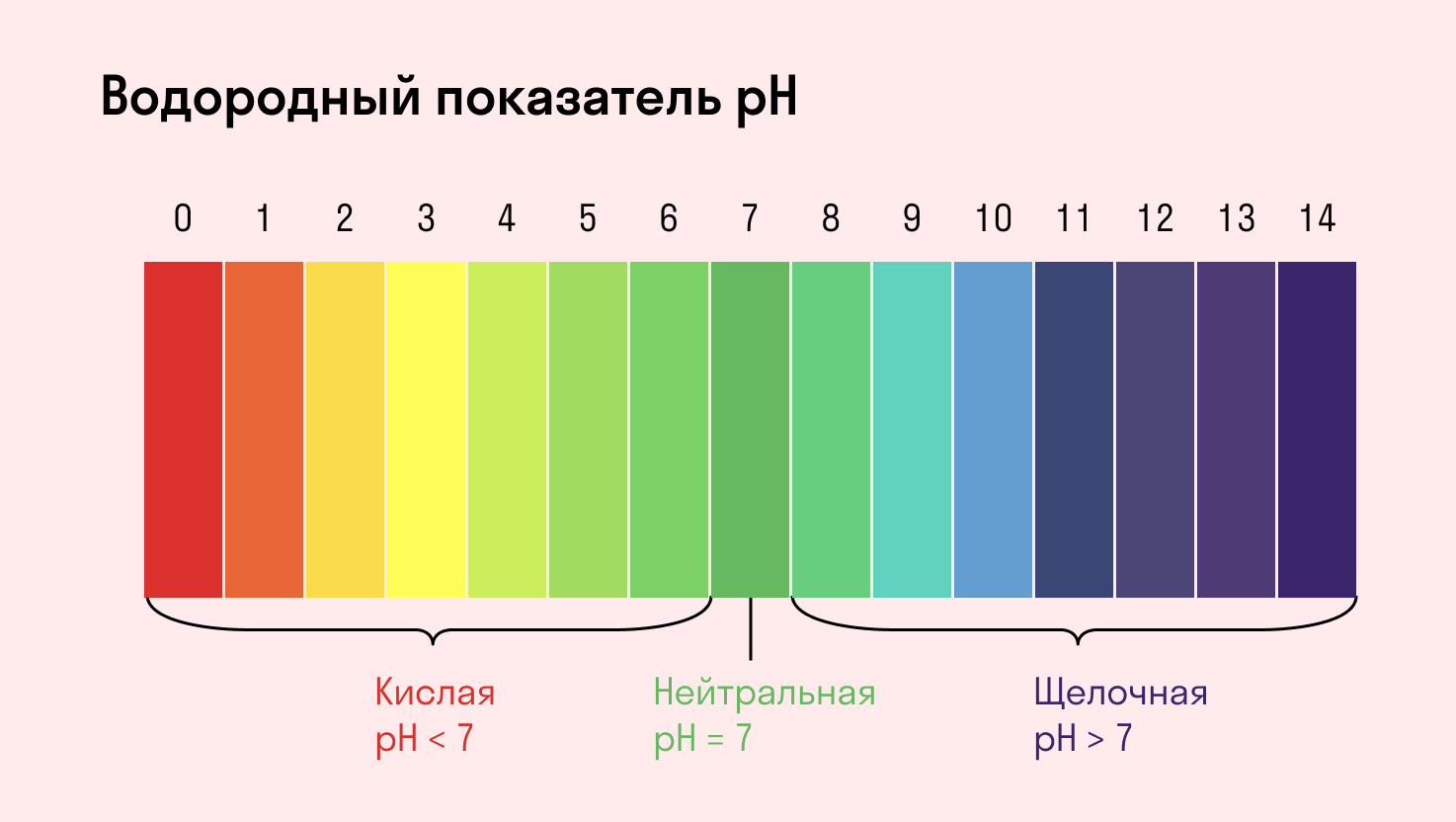
В связи с этим, если в растворе, по тем или иным причинам, больше ионов Н + говорят, что раствор имеет кислую реакцию среды, если ОН − — щелочную реакцию среды.
Если с кислотами и щелочами все понятно, то какая же реакция среды будет в растворах солей?
На первый взгляд, она всегда должна быть нейтральной. И правда же, откуда, например, в растворе сульфида натрия взяться избытку катионов водорода или гидроксид-ионов. Сам сульфид натрия при диссоциации не образует ионов ни одного, ни другого типа:
Тем не менее, если бы перед вами оказались, к примеру, водные растворы сульфида натрия, хлорида натрия, нитрата цинка и электронный pH-метр (цифровой прибор для определения кислотности среды) вы бы обнаружили необычное явление. Прибор показал бы вам, что рН раствора сульфида натрия больше 7, т.е. в нем явный избыток гидроксид-ионов. Среда раствора хлорида натрия оказалась бы нейтральной (pH = 7), а раствора Zn(NO3)2 кислой.
Единственное, что соответствует нашим ожиданиям – это среда раствора хлорида натрия. Она оказалась нейтральной, как и предполагалось.
Но откуда же взялся избыток гидроксид-ионов в растворе сульфида натрия, и катионов-водорода в растворе нитрата цинка?
Попробуем разобраться. Для этого нам нужно усвоить следующие теоретические моменты.
Любую соль можно представить как продукт взаимодействия кислоты и основания. Кислоты и основания делятся на сильные и слабые. Напомним, что сильными называют те кислоты, и основания, степень диссоциации, которых близка к 100%.
примечание: сернистую (H2SO3) и фосфорную (H3PO4) чаще относят к кислотам средней силы, но при рассмотрении заданий по гидролизу нужно относить их к слабым.
Как можно видеть, в результате такого взаимодействия образуется избыток гидроксид-ионов, отвечающий за щелочную реакцию среды. То есть кислотные остатки слабых кислот увеличивают щелочность среды. В случае растворов солей содержащих такие кислотные остатки говорят, что для них наблюдается гидролиз по аниону.
Кислотные остатки сильных кислот, в отличие от слабых, с водой не взаимодействуют. То есть они не оказывают влияния на pH водного раствора. Например, хлорид-ион, являясь кислотным остатком сильной соляной кислоты, с водой не реагирует:
То есть, хлорид-ионы, не влияют на pН раствора.
Zn 2+ + H2O ↔ Zn(OH) + + H +
Zn(OH) + + H2O ↔ Zn(OH) + + H +
Как можно видеть из уравнений выше, в результате взаимодействия катионов цинка с водой, в растворе накапливаются катионы водорода, повышающие кислотность среды, то есть понижающие pH. Если в состав соли, входят катионы, которым соответствуют слабые основания, в этом случае говорят что соль гидролизуется по катиону.
Катионы металлов, которым соответствуют сильные основания, с водой не взаимодействуют. Например, катиону Na + соответствует сильное основание – гидроксид натрия. Поэтому ионы натрия с водой не реагируют и никак не влияют на pH раствора.
Таким образом, исходя из вышесказанного соли можно разделить на 4 типа, а именно, образованные:
1) сильным основанием и сильной кислотой,
Такие соли не содержат ни кислотных остатков, ни катионов металлов, взаимодействующих с водой, т.е. способных повлиять на pH водного раствора. Растворы таких солей имеют нейтральную реакцию среды. Про такие соли говорят, что они не подвергаются гидролизу.
2) сильным основанием и слабой кислотой
В растворах таких солей, с водой реагируют только кислотные остатки. Среда водных растворов таких солей щелочная, в отношении солей такого типа говорят, что они гидролизуются по аниону
Примеры: NaF, K2CO3, Li2S и т.д.
3) слабым основанием и сильной кислотой
У таких солей с водой реагируют катионы, а кислотные остатки не реагируют – гидролиз соли по катиону, среда кислая.
4) слабым основанием и слабой кислотой.
С водой реагируют как катионы, так и анионы кислотных остатков. Гидролиз солей такого рода идет и по катиону, и по аниону. Нередко такие соли подвергаются необратимому гидролизу.
Что же значит то, что они необратимо гидролизуются?
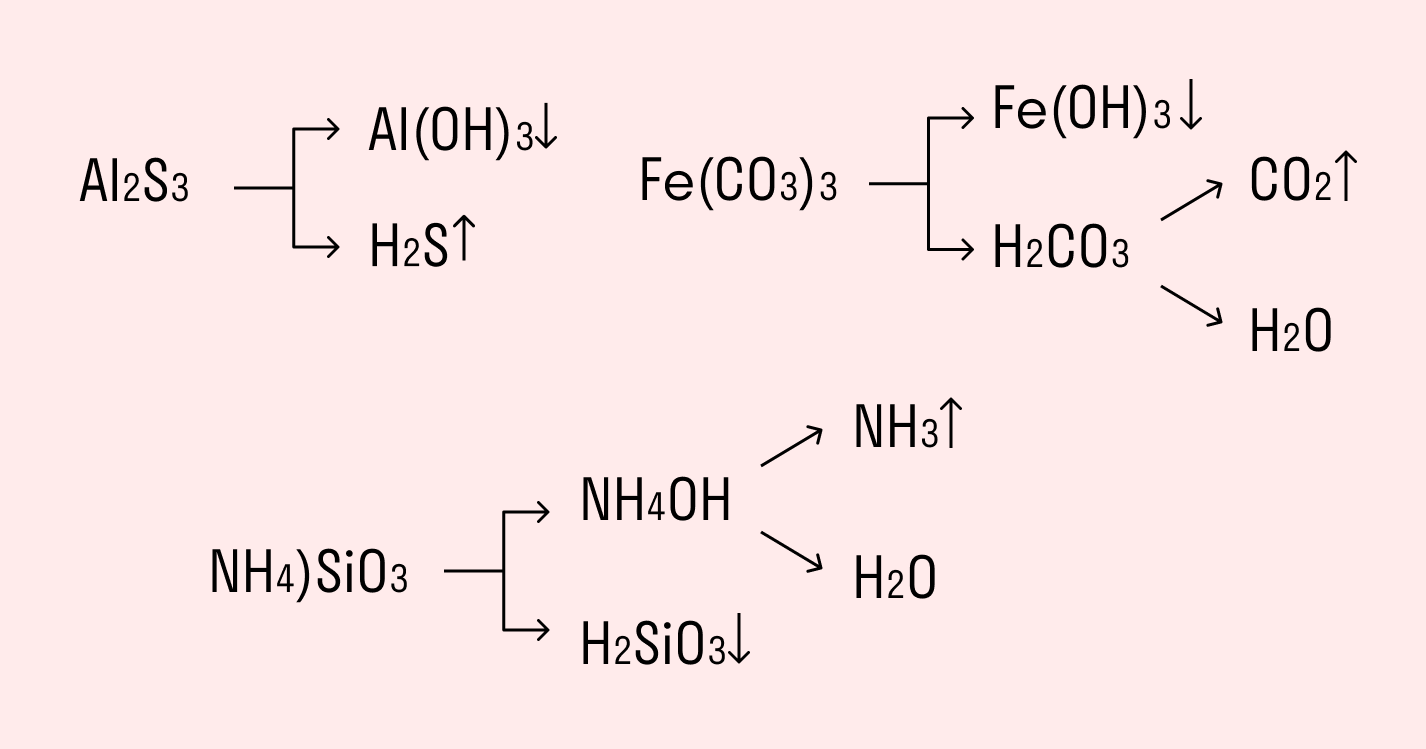
Это, в свою очередь, приводит к тому, что соли образованные кислотными остатками слабых оснований и слабых кислот не могут быть получены обменными реакциями, а только твердофазным синтезом, либо и вовсе не могут быть получены. Например, при смешении раствора нитрата алюминия с раствором сульфида натрия, вместо ожидаемой реакции:
Наблюдается следующая реакция:
Тем не менее, сульфид алюминия без проблем может быть получен сплавлением порошка алюминия с серой:
При внесении сульфида алюминия в воду, он также как и при попытке его получения в водном растворе, подвергается необратимому гидролизу.
Гидролиз
Определение гидролиза
| Гидролиз — это процесс взаимодействия сложного химического вещества с водой, итогом которого становится разложение молекул этого вещества. Сам термин происходит от двух греческих слов: hydor, что значит «вода», и lysis, то есть «распад». |
Гидролизации подвержены как органические, так и неорганические вещества: углеводы, белки, оксиды, карбиды, соли и т. д. Например, гидролиз органических соединений напрямую связан с пищеварением — с его помощью происходит распад и усвоение клетками организма жиров, белков, углеводов. Но сейчас мы займемся неорганической химией и рассмотрим гидролизацию на примере солей.
| Гидролиз солей — это реакция взаимодействия ионов соли с Н + и ОН − ионами воды, которая ведет к распаду исходного соединения. В результате такого ионного обмена образуется слабый электролит — кислотный, щелочной или нейтральный. |
Условия гидролиза
Далеко не все соединения распадаются, вступая в реакцию с молекулами воды. Сейчас мы на примере солей рассмотрим, какие вещества подвергаются гидролизу, а какие нет, и от чего это зависит.
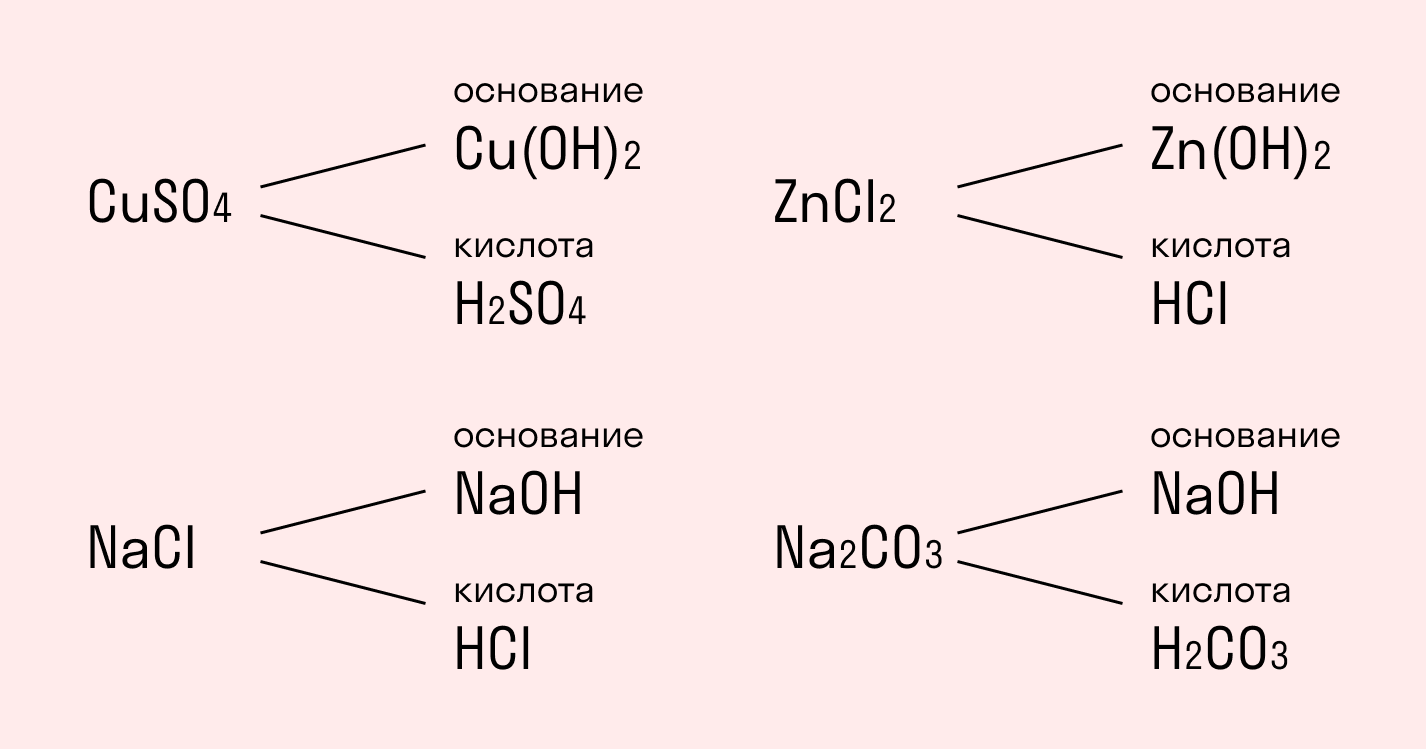
Начнем с того, что любая соль включает основание — амфотерный гидроксид, и кислотный остаток.
сульфат меди CuSO4состоит из основания Cu(ОН)2и кислоты H2SO4;
хлорид натрия NaCl состоит из основания NaOH и кислоты HCl;
хлорид цинка ZnCl2состоит из основания Zn(ОН)2 и кислоты HCI;
карбонат натрия Na2CO3состоит из основания NaOH и кислоты H2CO3.
В зависимости от того, какие соли подвергаются гидролизу — со слабым основанием или слабой кислотой, в итоге может получиться кислая, щелочная или нейтральная среда водного раствора.
А что происходит, если соль состоит из сильного основания и сильного кислотного остатка? Ничего. 🙂 В этом случае ее сильные катионы и анионы не взаимодействуют с ионами воды. Такая соль не распадается, то есть не подвержена гидролизу.
Схема химической реакции гидролиза выглядит так:
XY + HOH ↔ XH + HOY
XH — кислотный остаток;
Индикаторы среды раствора
Для определения среды раствора за считанные секунды используются специальные индикаторы. Самый распространенный из них — лакмусовая бумага, но также популярны фенолфталеин и метиловый оранжевый. В нейтральной среде они не меняют свой цвет, а в кислотной или щелочной — приобретают другую окраску.
Изменение цвета индикатора однозначно говорит о том, что произошла гидролизация. Однако если цвет остался тем же — это не всегда означает отсутствие гидролиза. Среда будет почти нейтральной и в том случае, когда гидролизу подвергается соль со слабым основанием и слабой кислотой. Но об этом поговорим дальше, а пока посмотрите таблицу.
Виды гидролиза
Мы выяснили, что в составе соли может быть слабый ион, который и отвечает за гидролизацию. Он находится в основании, в кислотном остатке или в обоих компонентах, и от этого зависит тип гидролиза.
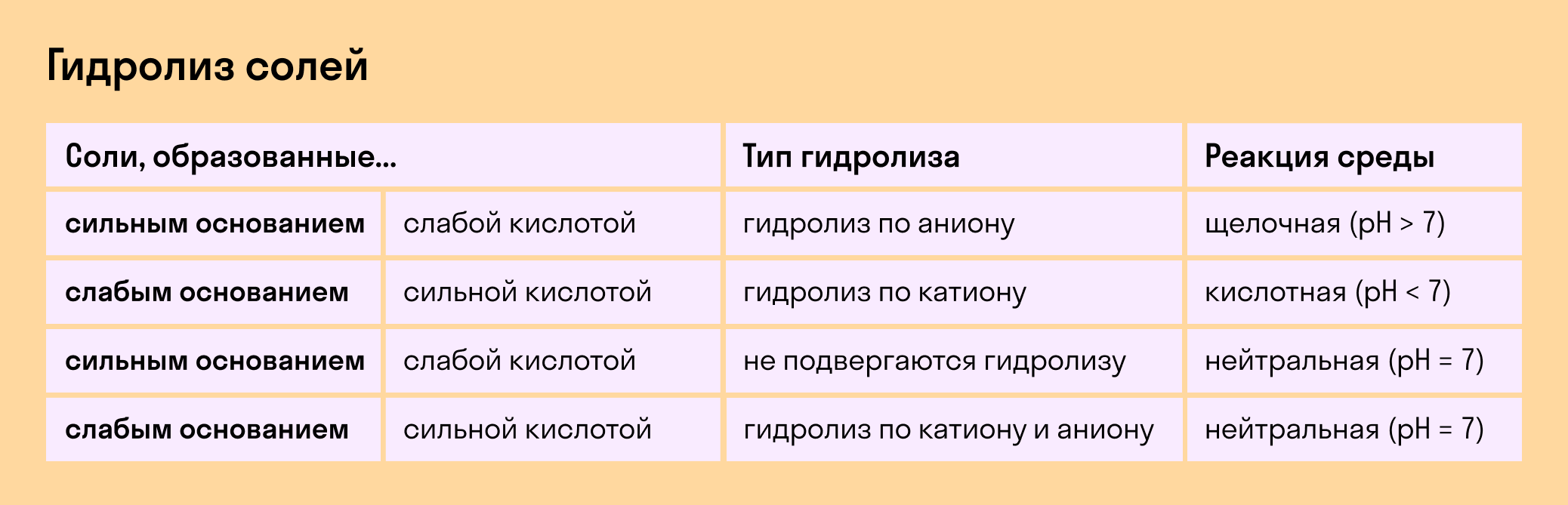
Соль с сильным основанием и сильной кислотой
Гидролиз отсутствует. Как вы уже знаете, при наличии сильного основания и сильного кислотного остатка соль не распадается при взаимодействии с водой. Так, например, невозможен гидролиз хлорида натрия (NaCl), поскольку в составе этого вещества нет слабых ионов. К таким же не подверженным гидролизации солям относят KClO4, Ba(NO3)2 и т. д.
Среда водного раствора — нейтральная, т. е. pH = 7.
Реакция индикаторов: не меняют свой цвет (лакмус остается фиолетовым, а фенолфталеин — бесцветным).
Соль со слабым основанием и сильной кислотой
Среда водного раствора — кислая, pH меньше 7.
Реакция индикаторов: фенолфталеин остается бесцветным, лакмус и метиловый оранжевый — краснеют.
Соль с сильным основанием и слабой кислотой
Среда водного раствора — щелочная, pH больше 7.
Реакция индикаторов: фенолфталеин становится малиновым, лакмус — синим, а метиловый оранжевый желтеет.
Молекулярное уравнение: KNO2 + H2O ↔ HNO2 + KOH
Ионное уравнение: K + + NO2 − + HOH ↔ HNO2 + K + + OH −
Гидролиз по катиону и аниону. Если у соли оба компонента — слабые, при взаимодействии с водой в реакцию вступает и анион, и катион. При этом катион основания связывает ионы воды OH − а анион кислоты связывает ионы H +
Среда водного раствора: нейтральная, слабокислая или слабощелочная.
Реакция индикаторов: могут не изменить свой цвет.
Цианид аммония NH4CN включает слабое основание NH4OH и слабую кислоту HCN.
Молекулярное уравнение: NH4CN + H2O ↔ NH4OH + HCN
Ионное уравнение: NH4 + + CN − + HOH ↔ NH4OH + HCN
Среда в данном случае будет слабощелочной.
Обобщим все эти сведения в таблице гидролиза солей.
Ступенчатый гидролиз
Любой из видов гидролиза может проходить ступенчато. Так бывает в тех случаях, когда с водой взаимодействует соль с многозарядными катионами и анионами. Сколько ступеней будет включать процесс — зависит от числового заряда иона, отвечающего за гидролиз.
Как определить количество ступеней:
если соль содержит слабую многоосновную кислоту — число ступеней равняется основности этой кислоты;
если соль содержит слабое многокислотное основание — число ступеней определяют по кислотности основания.
Для примера рассмотрим гидролиз карбоната калия K2CO3. У нас есть двухосновная слабая кислота H2CO3, а значит, гидролизация пройдет по аниону в две ступени.
I ступень: K2CO3+HOH ↔ KOH+KHCO3, итогом которой стало получение гидроксида калия (KOH) и кислой соли (KHCO3).
II ступень: K2HCO3+HOH ↔ KOH+H2CO3, в итоге получился тот же гидроксид калия (KOH) и слабая угольная кислота (H2CO3).
Для приблизительных расчетов обычно принимают в учет только результаты первой ступени.
Обратимый и необратимый гидролиз
Химические вещества могут гидролизоваться обратимо или необратимо. В первом случае распадается лишь некоторое количество частиц, а во втором — практически все. Если соль полностью разлагается водой, это необратимый процесс, и его называют полным гидролизом.
Необратимо гидролизуются соли, в составе которых есть слабые нерастворимые основания и слабые и/или летучие кислоты. Такие соединения могут существовать лишь в сухом виде, их не получить путем смешивания водных растворов других солей.
Например, полному гидролизу подвергается сульфид алюминия:
Как видите, в результате гидролизации образуется гидроксид алюминия и сероводород.
Необратимые реакции при взаимодействии с водой имеют место и в органической химии. В качестве примера рассмотрим полный гидролиз органического вещества — карбида кальция, в результате которого образуется ацетилен:
Степень гидролиза
Взаимодействие соли или другого химического соединения с водой может усиливаться или ослабляться в зависимости от нескольких факторов. Если нужно получить количественное выражение гидролиза, говорят о его степени, которая указывается в процентах.
h — степень гидролиза,
nгидр. — количество гидролизованного вещества,
nобщ. — общее количество растворенного в воде вещества.
На степень гидролизации может повлиять:
температура, при которой происходит процесс;
концентрация водного раствора;
состав участвующих в гидролизе веществ.
Можно усилить гидролиз с помощью воды (просто разбавить полученный раствор) или стимулировать процесс повышением температуры. Более сложным способом будет добавление в раствор такого вещества, которое могло бы связать один из продуктов гидролиза. К соли со слабой кислотой и сильным основанием нужно добавить соль со слабым основанием и сильной кислотой.
Для ослабления гидролиза раствор охлаждают и/или делают более концентрированным. Также можно изменить его состав: если гидролизация идет по катиону — добавляют кислоту, а если по аниону — щелочь.
Итак, мы разобрались, что такое гидролиз солей и каким он бывает. Пора проверить свои знания и ответить на вопросы по материалу.
Вопросы для самопроверки:
Назовите необходимое условие для гидролиза.
Какие типы гидролиза вы знаете?
В каком случае в результате гидролиза может образоваться слабощелочная или слабокислая среда?
По какому типу гидролизуется соль с сильным основанием и слабым кислотным остатком?
При гидролизе соли с сильным основанием и слабой кислотой для ослабления процесса нужно добавить в раствор кислоту или щелочь?
Как воздействует на гидролиз разбавление раствора водой?
Как определяется количество ступеней гидролиза?
Какая среда раствора образуется при гидролизации солей NaF, KCl, FeBr2, Na2PO4? Ответов может быть несколько.
Какие из солей гидролизуются по катиону: Csl, FeSO4, RbNO3, CuSO4, Mn(NO3)2? Ответов может быть несколько.
Какая из солей не подвергается гидролизу: K2HPO4, KNO3, KCN, Ni(NO3)2?
В растворах каких солей среда кислая сульфат алюминия хлорид кальция
Установите соответствие между названием соли и средой водного раствора этой соли: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.