в развитии каких заболеваний активную роль могут играть бактерии h pylori
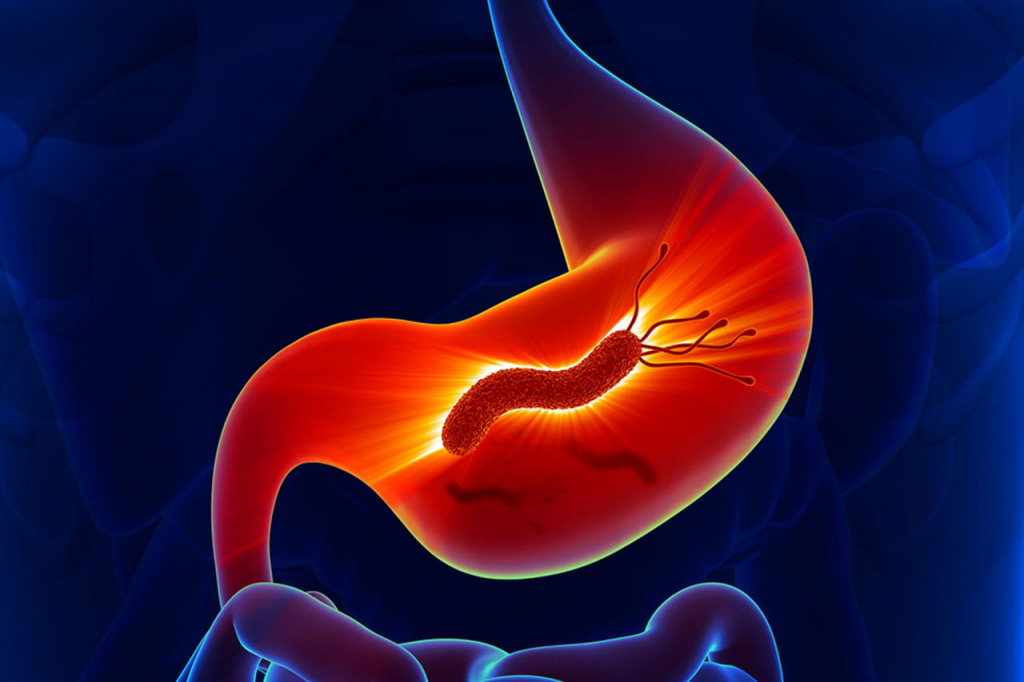
Хеликобактер пилори
Хеликобактер пилори – это бактерия, которая находится в желудке, и для своего роста требует присутствия кислорода в атмосфере или питательной среде. Название происходит от выделенного рода схожих бактерий Helicobacter, а слово pylōri в названии является формой родительного падежа от «pylōrus» (привратник желудка, циркулярный жом, перекрывающий проход из желудка в двенадцатиперстную кишку), которое, в свою очередь, происходит от др.-греч. πυλωρός, означающего буквально «привратник».
История
Впервые об этих микроорганизмах упоминается еще в 1875 году в Германии. Затем в Польше, Италии и России ученые независимо друг от друга пытались работать и исследовать этот новый тип микроорганизма, живущий в слизистой желудка.
Хеликобактер был выявлен, выделен и культивирован в начале 1980-х годов двумя австралийскими учеными – Робином Уорреном, который затем провёл дальнейшие исследования её вместе с Барри Маршаллом.
Чем опасен для человека хеликобактер пилори?
В многочисленных работах было показано, что хеликобактер присутствует у пациентов с хроническим гастритом и язвенной болезнью желудка – заболевания, которые ранее не считались инфекционного происхождения. Он также связан с развитием язв двенадцатиперстной кишки и раком желудка.
Вреден или полезен хеликобактер пилори?
Однако, у более чем 80% из носителей хеликобактер ( Helicobacter pylori) не вызывает симптомы болезней. Это родило предположение, что бактерия может играть важную роль в естественной экологии желудка. Некоторые специалисты считают, что его присутствие в организме необходимость для полноценного функционирования нашего организма. И только в момент снижения нашего иммунитета происходит активация хеликобактера, как патогенного микроорганизма. Включаются механизмы, которые приводят к болезням желудка. Неспроста ранее считалось, что язва желудка и гастрит обостряются сезонно – в осенне-весенний период. Осенью люди часто простывают, весной – часто развивается нехватка витаминов. Вот вам и сезонное снижение иммунитета, которое и приводило к «обострениям» заболеваний желудка.
Распространенность
Хеликобактер пилори является наиболее распространенной бактериальной инфекцией во всем мире, при этом более половины населения мира являются носителями этой бактерии в верхних отделах желудочно-кишечного тракта. В то время как заболеваемость снижается в западных странах (например, в США 20% населения заражено хеликобактером), инфекция Helicobacter pylori широко распространена в развивающихся странах (по разным оценкам в России до 80% населения являются носителями хеликобактера). При отсутствии целенаправленной антимикробной терапии колонизация обычно длится десятилетиями.
По материалам Landes Bioscience (Austin, TX USA)
Бактерия хеликобактер пилори
7 февраля 2018
Многие желают узнать, как передается и лечится хеликобактер пилори – опасная бактерия, живущая в желудке, виновница хронического гастрита, эрозий, язв и даже рака желудка.
Что это за бактерия?
Как же воздействует хеликобактер на желудок? Уничтожает париетальные (пристеночные) клетки слизистой (внутренней) оболочки желудка, выбрасывая ядовитые продукты – токсины. Защитные клетки крови – нейтрофилы, лимфоциты и другие, преследуют вредителя, пытаясь уничтожить и его, и измененные париетальные клетки – возникает воспаление. Количество защитной слизи на участке пребывания бактерии заметно снижается, на измененный участок стремительно воздействует соляная кислота, усугубляя неизменное воспаление слизистой. Это проявляется болью в желудке «под ложечкой», изжогой, отрыжкой, налетом на языке, неприятным запахом изо рта, постоянной тошнотой, то есть симптомами хронического гастрита. Хроническое длительное воспаление слизистой оболочки желудка приводит к изменению ее клеток, вплоть до развития рака желудка.
Так что же теперь и в кафе со своей посудой ходить? К счастью, хеликобактер не устойчивая бактерия и обработки посуды в посудомоечной машине достаточно, чтобы ее уничтожить. Хорошие рестораны и кафе конечно оборудованы такими машинами, и посещать их можно без риска заражения.
Как узнать, есть ли у меня инфекция хеликобактер пилори?
У меня выявлен хеликобактер пилори – что делать?
При выявлении положительного анализа на хеликобактер пилори нужно обратиться за консультацией к гастроэнтерологу или терапевту. В лечении инфекции используются антибиотики, и назначает их только врач.
Можно ли вылечить хеликобактер приемом препарата де-нол, как показывают в рекламе, или народными средствами? Полностью избавиться от инфекции хеликобактер пилори можно только определенными антибиотиками.
Нужно ли мне травить себя антибиотиками, если меня ничего не беспокоит, а результат анализа на хеликобактер положительный? Инфекция может и не беспокоить, в 70% случаев так и происходит, гастрит годами протекает «молча», но через несколько лет вследствие вялотекущего воспаления возникает атрофия слизистой оболочки и нельзя исключить ее переход в рак желудка. В каждом конкретном случае решение о проведении лечения принимает лечащий врач.
Инфекция хеликобактер пилори очень распространена среди населения, есть ли смысл в лечении, если потом можно повторно заразиться? Да, повторное инфицирование возможно, но происходит не часто – примерно 6 человек из 100 пролеченных приобретают инфекцию вновь при несоблюдении правил профилактики. Они очень просты – мыть руки перед едой, не пробовать чужую еду, не есть в сомнительных забегаловках, где нет уверенности в правильной обработке посуды, не целовать не очень близких людей. Важно также при выявлении инфекции хеликобактер пилори проверить на нее всех членов семьи, начиная с подросткового возраста, и в идеале – пролечиться одновременно всем инфицированным. Детей, если ничего не беспокоит, лечат с подросткового возраста – с 12-13 лет. Если ребенок жалуется на боли в животе или тошноту, то обследование и лечение проводят по показаниям в более раннем возрасте.
Люди очень часто жалуются на обострение гастрита. А ведь во многих случаях его можно вылечить, избавившись от бактерии, которая вызвала воспаление желудка. Если инфекцию оставить без внимания, со временем, гастрит перейдет в атрофический. Тогда пациенту нужно будет минимум раз в год брать биопсию в 5-7 местах желудка, чтобы не пропустить рак.
Хеликобактер пилори: найти и обезвредить
Поделиться:
Эта бактерия — возбудитель одной из самых распространенных в мире хронических инфекций, поражающей примерно половину популяции.
Около 90% зараженных не испытывают никакого дискомфорта, существуя с ней в мире и согласии.
Однако остальные 10% в полной мере ощущают коварство хеликобактера и часто нуждаются в неотложном лечении связанных с ним заболеваний — гастрита, язвенной болезни или даже рака желудка.
Можно ли предупредить заражение и что же делать тем, у кого анализы выявили инфекцию?
От человека – человеку
Считается, что заражение хеликобактером может происходить тремя основными путями: фекально-оральным (к примеру, при несоблюдении правил гигиены, питье неочищенной воды), орально-оральным (со слюной) и при проведении медицинских манипуляций необработанными инструментами, такими как эндоскоп. Бактерии выделяют из различных сред организма —фекалий, желудочного сока, слюны.
Чаще всего инфицирование происходит в раннем детстве, преимущественно на первом-втором году жизни. Предполагается, что источником инфекции для малыша обычно становится зараженная мать.
Грудное вскармливание, по всей видимости, не только не защищает ребенка от хеликобактера, а, напротив, в какой-то мере предрасполагает.
Кормящая мама нередко не моет руки перед кормлением, что резко повышает риск инфицирования ребенка. Выходит, чем дольше малыша кормить грудью, тем выше вероятность заразить его опасной бактерией, разумеется, если мать является ее носителем.
Читайте также:
Язва желудка: как будем лечить?
В подавляющем большинстве случаев инфекция не имеет клинических признаков. Но настораживающая статистика связанных с ней рисков для здоровья не может оставлять равнодушными даже бессимптомных носителей.
Хеликобактер в фактах и цифрах
Helicobacter pylori признана одним из ключевых факторов развития множества желудочно-кишечных заболеваний. Ее выявляют у 90-100% больных язвенной болезнью двенадцатиперстной кишки и 60-100% пациентов с язвой желудка. Успешное лечение инфекции в таких случаях обеспечивает полное исцеление от язвы и снижает риск ее повторного появления до 10%.
Хеликобактер стала первым официально признанным бактериальным канцерогеном — она тесно связана с аденокарциномой и низкодифференицируемой лимфомой. До 90% случаев рака желудка развиваются вследствие инфекции Helicobacter pylori.
Риски еще более увеличиваются у тех, кто ест много соли и/или курит.
И наоборот: после успешного излечения от инфекции вероятность злокачественных заболеваний желудка снижается как минимум на 34%.
Кроме того, именно с хеликобактером связаны диагнозы хронического и атрофического гастрита. Поэтому при появлении проблем с желудком очень важно провести качественную диагностику.
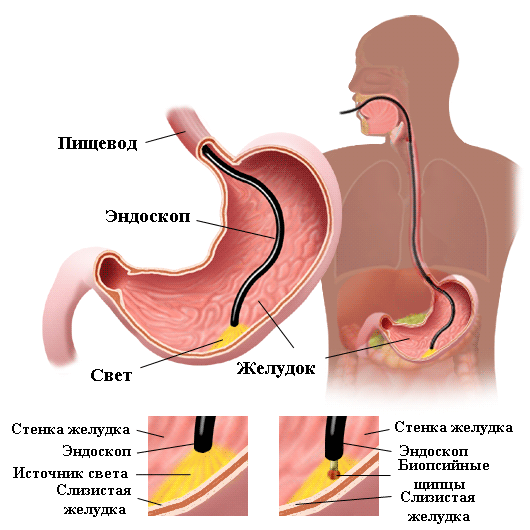
Тернии диагностики
Самый простой способ выявить инфекцию открывается перед теми, кто проходит гастроскопию. Во время процедуры врач может провести быстрый уреазный тест. Он очень простой и эффективный: его чувствительность достигает 40%, а результат можно получить уже через несколько минут.
Но если выявить инфекцию нужно, а гастроскопию делать необходимости нет, используют другие методы. К относятся ним исследование кала для определения антигена бактерии и дыхательный тест.
Все перечисленные методики могут дать неверный результат, если накануне их проведения принимать препараты, которые блокируют выработку соляной кислоты в желудке, — ингибиторы протонной помпы (например, омепразол, пантопрозол, рабепразол и так далее).
Исказить результаты исследования могут также антибиотики и препараты, содержащие соли висмута (висмута трикалия дицитрат).
Чтобы выявить бактерию наверняка, следует не менее чем за 4 недели отменить антибиотики и препараты висмута, а за 2 недели до анализов перестать пить ингибиторы протонной помпы.
А вот при проведении исследования крови принимаемые накануне лекарства не оказывают влияния на результат, позволяя выявить инфекцию или проследить эффективность терапии.
Лечить или не лечить?
С одной стороны, если есть инфекция в организме, ее нужно лечить. Тем более такую коварную, как хеликобактерная.
Но с другой стороны, для 9 из 10 инфицированных бактерия не представляет опасности. К тому же она настолько распространена, что каждый пятый успешно пролеченный заболевает вновь.
В то же время лечение довольно сложное, и должно проводиться только по показаниям, чтобы избежать развития устойчивости бактерии к антибиотикам. Поэтому назначают его, как правило, в следующих случаях:
• Выявленное поражение желудка и/или двенадцатиперстной кишки — гастрит, язвенная болезнь и так далее.
• Нарушение пищеварения, которое не сопровождается изменениями в состоянии органов ЖКТ (функциональная диспепсия), — боль в животе, отрыжка, метеоризм, вздутие и другие.
• Семейная история рака желудка, например, в случаях, когда это заболевание было выявлено у родителей, братьев или сестер.
Бессимптомно протекающую инфекцию, не подпадающую под эти три категории, обычно не лечат. Впрочем, если сам зараженный очень хочет избавиться от близкого «соседства» с хеликобактером, доктор может-таки назначить эрадикационную терапию.
Возможности профилактики
Конечно, любую инфекцию легче предупредить, чем лечить, хотя в случае с хеликобактером это очень проблематично.
Поскольку большинство инфицированных заражается в раннем детстве, профилактика должна ложиться на плечи родителей. Ее основной принцип — соблюдение правил гигиены: не пользоваться одной посудой с малышом, не облизывать пустышки и не дегустировать детское питание. Достичь этого на самом деле сложно, и это легко подтвердит любая мама.
Поэтому профилактика хеликобактера — понятие скорее гипотетическое, чем практическое. В отличие от диагностики и лечения, эффективность которых приближается к 100%, вселяя надежду и внушая оптимизм.
Точка зрения автора может не совпадать с точкой зрения редакции
Хеликобактер пилори: особенности, патогенность, что купить для лечения
Один из самых загадочных микробов, о существовании которого ничего не было известно до конца 20 века. Лишь в 1994 году была признан «вклад» бактерии Helicobacter pylori в различие воспалительных заболеваний желудка и тонкого кишечника. Тогда же протоколы лечения гастритов и язв были принципиально изменены.
Что такое Helicobacter pylori
Биологически микроб представляет бактерию из ада грамотрицательных, способных развиваться при мизерном содержании кислорода в окружающей среде. Обитает в складках полости желудка и 12-перстной кишки. Спиралевидная форма и органеллы движения — несколько пар жгутиков обеспечивают бактерии возможность быстро передвигаться и прочно цепляться к стенкам слизистых оболочек.
Уникальное свойство патогена — нечувствительность к желудочному соку, насыщенному агрессивной для микробов соляной кислотой. Данные, полученные при изучении микроба, позволяют считать его провокатором самых распространенных болезней:
гастритов, в том числе атрофических и с повышенной кислотностью;
Выяснено, что Хеликобактер способна действовать как канцероген, поддерживая механизм злокачественного перерождения клеток.
Пути заражения Хеликобактер пилори
Микроб проникает в ЖКТ орально-оральным и орально-фекальным каналами:
при использовании обсемененных предметов личной гигиены: зубных щеток, ложек, вилок;
с загрязненных рук;
Учитывая легкость, с которой распространяется и приживается внутри организма бактерия, можно предположить зараженность ей большую часть населения всего мира. Практически это — часть условно-патогенной микрофлоры, которая активируется и наносит вред здоровью при снижении защитных сил.
Как действует бактерия в желудке
Проникая внутрь желудка микроб свободно циркулирует в гелеобразной жидкости, покрывающей его стенки и укрывается в толще эпителия слизистой. Белки и полисахариды Хеликобактер продуцируют фермент уреазу, который производит защищающую от кислоты пленку и аммиак. В результате их активности естественная кислотность желудочной среды снижается, а протективный слизистый слой на поверхности стенок постепенно истончается и растворяется.
Чтобы выровнять кислотный баланс железы продуцируют больше гастрина, пепсина и соляной кислоты. Запускается разрушающий процесс:
агрессивные соединения повреждают желудочные стенки, они воспаляются, отекают;
формируется и прогрессирует гастрит;
в тяжелых случаях возникают глубокие эрозированные очаги и изъязвления.
Нездоровый образ жизни, избыток вредной пищи, жареных и острых продуктов ускоряют развитие болезней.
Изредка активность Helicobacter pylori приводит к кожным проявлениям: папулезной розоватой сыпи на щеках, подбородке. Это следствие иммунной реакции организма на чужеродный микроб.
Устойчивость Хеликобактер к воздействию желудочного сока повышает способность принимать шаровидную форму, пряча жгутики под покрытое защитной пленкой тело.
Симптомы Helicobacter pylori
Колонии бактерий могут ничем не выдавать своего присутствия в желудке всю жизнь. Но у части носителей они вызывают хронические заболевания, которые с трудом поддаются терапии. Явные признаки заражения неспецифичны, связаны с нарушением функций желудка:
неприятный привкус во рту;
режущие боли в эпигастрии;
вздутие живота после еды.
Применение прогрессирования симптомы нарастают. При запущенных формах язвенной болезни повышается риск перфорации стенок и развития внутренних кровотечений.
Диагностика
Заподозрить активность патогенов врач может при жалобах пациента на характерные боли в области желудка, тошноту, отрыжку и другие симптомы гастрита. Специфическая диагностика Helicobacter pylori проводится несколькими методами:
Определение титра антител к бактерии в лабораторных условиях: исследуются пробы крови и кала.
Дыхательные тесты: больному предлагают выпить раствор мочевины, который провоцирует патогены вырабатывать аммиачные соединения. Их фиксируют в выдыхаемом воздухе специальными газоанализаторами.
Гистологический анализ биоптата. Инвазивный и самый информативный метод, выявляет колонии бактерий в организме с точностью до 100%. Небольшие фрагменты слизистой из полости желудка забирают во время гастроскопии под местной анестезией. Обследование выявляет также присутствующие онкомаркеры.
Факт наличия в желудке Хеликобактер пилори не означает, что носитель обязательно заболеет гастритом или язвой. Она — лишь один из факторов пищеварительных патологий. Диагностика помогает подобрать адекватную этиотропную терапию при начавшемся воспалительном процессе, предотвратить обострение при развившемся хроническом заболевании.
Как лечат патологии, вызванные Helicobacter pylori
Применение антацидных препаратов, нейтрализующих соляную кислоту желудочного сока, при гастрите и язве считается устаревшим методом. Такие средства ненадолго устраняют изжогу, не влияя на причины болезни.
Современный подход к терапии — комплексное применение антибактериальных средств и ингибиторов протонной помпы.
Эффективно подавляют патогены медикаменты из группы цефалоспоринов, фторхинолоны, Азитромицин, Метронидазол, Левофлоксацин. Так как Хеликобактер быстро адаптируется к лекарствам, важно не прерывать лечение на полпути.
Для ускорения регенерации назначают трикалия дицитрат. В аптеках его можно купить под торговым названием Де-Нол. Препарат подавляет активность патогена и защищает слизистую от разрушения.
Ингибиторы протонной помпы влияют на синтез соляной кислоты до выделения ее в полость желудка. Применяют Омепразол, Контролок, Нольпазу, Рабепразол.
Для эффективного подавления бактерии требуется купить и принимать не менее двух медикаментов из разных фармацевтических групп. Какие именно, врач рекомендует по изучении лабораторных анализов и результатов гастроскопии. Благодаря адекватной терапии удается избегать рецидивирующих обострений заболеваний в течение многих лет.
Все представленные на сайте материалы предназначены исключительно для образовательных целей и не предназначены для медицинских консультаций, диагностики или лечения. Администрация сайта, редакторы и авторы статей не несут ответственности за любые последствия и убытки, которые могут возникнуть при использовании материалов сайта.
Критический анализ концепции о ведущей роли Helicobacter pylori инфекции в развитии гастродуоденальных заболеваний
В статье представлены основные факты, установленные при изучении бактерии Helicobacter pylori, и дана детальная, основанная на научных фактах и аргументах доказательная критика концепции о ведущей роли этой бактерии в развитии хронического гастрита, язвенной болезни и рака желудка. Кроме того, проанализированы итоги использования рекомендаций “Маастрихтского консенсуса” за более, чем 20-летний период их применения во врачебной практике, и представлен перечень просчетов, допущенных в этих рекомендациях, которые привели к негативным результатам.
Человек является «хозяином» мириад микроорганизмов, число которых в 10 раз превышает количество клеток в организме человека. Основную массу бактерий, колонизирующих человеческий организм, составляет популяция комменсалов (commensal – франц. – «сотрапезник») – бактерий, использующих хозяина для своей жизнедеятельности, но не причиняющих ему вреда. Для их взаимоотношений с человеком характерны коэволюция, коадаптация и взаимозависимость [1]. Значительно распространены и симбионтные бактерии, полезные для жизнедеятельности человека. Симбионтные бактерии, населяющие организм человека, участвуют в образовании энергии из пищи, образуют факторы роста, стимулируют функции врожденного и приобретенного иммунитета, противодействуют инвазии патогенных бактерий. Патогенных бактерий известно несколько сотен. Великий французский микробиолог Луи Пастер (1822–1895 гг.) утверждал: «Жизнь без бактерий была бы невозможна».
В 1983 г. австралийские ученые J.R. War ren и B.J. Marshall обнаружили в желудке человека ранее неизвестную бактерию, первоначально названную Campylobacter pyloridis, но затем переименованную в Helicobacter pylori (Hp). Сам факт обнаружения неизвестной ранее бактерии не является каким-то чрезвычайным событием в микробиологии, поскольку помимо огромного количества известных бактерий, существуют и пока еще неизвестные, которые ждут своего «открытия».
Первоначальный скепсис ученых в отношении вновь открытой бактерии (Нр) вскоре сменился всеобщим ажиотажем, своеобразным «геликобактерным бумом». Стали утвер ждать, что Нр является главной причиной развития хронического гастрита (ХГ) и язвенной болезни (ЯБ), а затем – рака желудка (РЖ) и MALT-лимфомы (мальтомы) желудка низкой степени злокачественности. Но и этим дело не ограничилось – присутствие Нр в желудке связывали с развитием многих внежелудочных заболеваний, в том числе сердечно-сосудистых, неврологических, болезней печени и желчных путей, кишечника, системы крови и др. И это при том, что, как было достоверно установлено, Нр – это неинвазивная бактерия, жизнедеятельность которой ограничена желудком – надэпителиальной желудочной слизью, наружной поверхностью однослойного желудочного эпителия (между ворсинками) и (частично) межклеточным пространством. Ни в под эпителиальном пространстве желудка, ни в эпителии желудочных желез Нр, как правило, не обнаруживают. Не могут они существовать и на эпителии соседних с желудком органов – на многослойном плоском эпителии пищевода и на цилиндрическом эпителии кишечника, включая двенадцатиперстную кишку, за исключением очагов желудочной метаплазии. Каким образом Нр могут стать причиной развития столь разных заболеваний, остается нерешенной загадкой, вызывающей недоумение.
С момента «открытия» Нр и появления концепции о ведущей роли микроба в развитии основных гастродуоденальных заболеваний (ХГ, ЯБ, РЖ) мы высказали сомнение в ее достоверности, а по мере накопления научных фактов и аргументов, опровергающих эту концепцию, выступили с ее обоснованной критикой и отрицанием ее постулатов [2–7]. Даже присуждение «первооткрывателям» микроорганизма J.R. Warren и B.J. Marshall Нобелевской премии по медицине (2005 г.) не поколебало нашего негативного отношения к концепции о ведущей роли этой бактерии в развитии гастродуоденальной патологии, поскольку, как справедливо отметил великий российский физиолог И.П. Павлов: «Факты в тысячу раз важнее слов».
Установленные за последние 35 лет после «открытия» Нр факты о Нр-инфекции и ее свойствах
1. Нр – это неинвазивная бактерия (микроаэрофил спиралевидной формы), имеющая 4–5 униполярно расположенных жгутиков, позволяющих ей перемещаться в надэпителиальной желудочной слизи в поисках оптимальных условий для жизнедеятельности (рН, осмолярность и др.).
2. Нр сумели адаптироваться в резко кислой среде желудка благодаря небольшому размеру генома и способности к быстрым мутациям в неблагоприятных условиях для их существования, заняв свою экологическую «нишу».
3. В последнее время было установлено, что Нр – сравнительно молодая бактерия, «возраст» которой не превышает 50 тысяч лет.
4. Нр-инфекция широко распространена среди людей в мире. Так, в развитых странах Западной Европы и в Северной Америке она встречается у 35–50% населения, а в развивающихся странах Азии, Африки и Латинской Америки – у 90% и более, в среднем у 60% населения земного шара.
5. Полагают, что до широкого внедрения антибактериальной терапии (АБТ) – в 50-х годах XX столетия – распространенность Нр-инфекции достигала 80%, но в последующие годы снизилась до 60%. В России распространенность Нр составляет у детей в возрасте 5–10 лет 29%, в возрасте 11–14 лет – 50%, а у взрослых – 70–92% [8].
6. В неблагоприятных условиях для существования Нр трансформируются из спиралевидной формы (helical-like) в кокковидную (coccoid-like), в которой резко снижен обмен веществ и утрачена репродуктивная способность, но повышена устойчивость к неблагоприятным факторам окружающей среды. Попав в благоприятные условия, кокковидные формы бактерий вновь превращаются в спиралевидные формы, подвергаясь реверсии.
7. На поздних стадиях эволюции часть Нр приобрела «островок патогенности» (pathogenecity associated island – PAI), расположенный на участке хромосомной ДНК. Полагают, что его появление связано с горизонтальной передачей «островка» от какого-то другого микроба [9,10].
8. При изучении «островка патогенности» были установлены «гены цитотоксичности»: cagA (cytotoxin-associated gene A), vacA (vacuolating-associated cytotoxin A), iceA (induced by contact with epithelium) и babA (blood-group associated adhesion). Основным маркером «островка патогенности» служит иммунодоминантный цитотоксин (белок) CagA, кодируемый геном cagA.
9. Предпринимавшиеся неоднократно попытки ус та новить связь цитотоксических штаммов Нр с кон кретными гастродуоденальными заболеваниями, ассоциированными с Нр, не увенчались успехом: «ульцерогенных», «канцерогенных» и т.п. штаммов Нр в природе не существует. Более того, цитотоксические штаммы Нр были обнаружены не только у больных ХГ и ЯБ, но и при синдроме функциональной (гастродуоденальной) дисперсии, не связанной с Нр-инфекцией (в 46%), и даже у здоровых бактерионосителей (в 27%), не причиняя им никакого вреда [7,9].
10. Были установлены «детерминанты вирулентности» Нр: уреаза (ген ureA1), фактор адгезии (ген hpaA), супероксиддисмутаза (ген sodA), вакуолизирующий цитотоксин (ген vacA) и каталаза (ген catA) [12]. Уреаза действует как токсин, разрушая мочевину, входящую в состав пищи. При этом образуется аммиак, повреждающий эпителиоциты желудка.
11. Утверждают, будто у Нр в желудке нет конкурентов, – только Нр благодаря их уникальной способности к рекомбинантным мутациям сумели приспособиться к существованию в резко кислой среде желудка. В случае обнаружения другой микрофлоры ее считают транзиторной, неспособной колонизировать желудок.
12. Главным резервуаром Нр-инфекции является человек, а основным путем инфицирования – фекально-оральный. В окружающей среде (почве, воде) обнаружить Нр пока не удалось.
13. Нр отличаются особой склонностью к изменчивости – генетическому полиморфизму, в связи с чем их часто именуют «хамелеоном».
14. В 1989 году H. Bower выяснил, что геном Нр имеет циркулярную структуру и состоит из 1 667 867 генов; им была предпринята попытка установить последовательность генов в геноме Нр [11].
Представим научные факты и аргументы, опровергающие ведущую роль Нр-инфекции в развитии основных гастродуоденальных заболеваний.
1. Среди инфицированных Нр людей различные заболевания развиваются менее, чем у 1%, а 70% людей, у которых обнаруживают Нр, – это здоровые бактерионосители [9]. Известный микробиолог С.В. Сидоренко утверждает: «Широкое распространение Нр-инфекции среди лиц без признаков патологии – это весомый аргумент, опровергающий ведущую роль Нр в развитии гастродуоденальных заболеваний» [10].
2. Мы провели исследование микрофлоры, колонизирующей желудок, чтобы выяснить, действительно ли у Нр в желудке нет конкурентов, или это суждение ошибочно. Мы изучили микробный пейзаж желудка современными методами микробиологического исследования (в соавторстве с микробиологом – доктором медицинских наук Ю.А. Захаровой). Было обследовано 2 группы больных, в том числе с острым и хроническим гастритом или язвенной болезнью желудка и двенадцатиперстной кишки. Первую группу составили 62 пациента, среди которых было 54,1% женщин и 45,9% мужчин в возрасте 46,2±3,6 лет. Прицельную биопсию (3 образца) осуществляли из антрума желудка стерильными щипцами гастрофиброскопа после предварительной обработки ротовой полости антисептиком. Исходный микробиологический посев полученного материала производили на специальные питательные среды, в том числе на две чашки Петри геликобактерного агара с биодобавками (BioMerieux). Один образец биоптата помещали в полужидкую питательную среду СКС с целью визуализации роста микрофлоры, включая трудно культивируемые формы. Осуществляли качественное определение аэробной, факультативноаэробной и анаэробной микрофлоры и грибов рода Candida.
Все бактерии, колонизирующие желудок у больных ХГ и ЯБ, обладали адгезивностью, а значительная часть из них – инвазивностью (в отличие от Нр) и патогенными свойствами. Это дает основание отнести их не к транзиторной, а к мукозной микрофлоре (М-микрофлоре), способной вызвать развитие воспалительноэрозивно-язвенных поражений желудка наряду с Нр и независимо от них.
Таким образом, у больных ХГ и ЯБ определяется не геликобактериоз, а дисбактериоз. Аналогичные или близкие результаты были получены в последнее время и у нас в стране [14], и за рубежом [15,16]. Авторами было установлено, что основной микрофлорой, колонизирующей желудок при его заболеваниях, являются стрептококки, превателла, фузобактерии. Эти данные были получены при изучении бактериального состава желудка методами глубокого секвенирования амплифицированной 16SpRNA (клонирование). В общей сложности было выявлено 127 филотипов и 5 доминирующих родов (Streptococcus, Prevatella, Fusobacterium, Rothia, Veilonella).
Вместе с тем, в Киотском консенсусе по-прежнему основной причиной ХГ называют Нр. В этом для нас нет ничего удивительного, поскольку в состав его соавторов входят P. Malfertheiner (Германия) и D.Y. Graham (США) – наиболее ортодоксальные адепты концепции о ведущей роли Нр-инфекции в развитии гастродуоденальных заболеваний.
Нр-инфекция и язвенная болезнь
Со времени первого описания язвенной болезни Ж. Крювелье (J. Cruveilhier, Франция) в 1830–1842 гг. остро стоял вопрос о ее этиологии. Ж. Крювелье писал: «Причины образования «круглой язвы желудка» покрыты мраком неизвестности». В 1949 г. один из наиболее известных учеников В.П. Образцова – М.М. Губергриц, выступая с докладом на Всесоюзном съезде терапевтов, назвал ЯБ «таинственной незнакомкой», имея в виду загадочную незнакомку из знаменитого одноименного стихотворения А.А. Блока [19]. Спустя 20 лет (1969 г.), О.С. Радбиль, продолжая тот же образный ряд, писал: «Мы приподняли вуаль, но еще не заглянули незнакомке в лицо» [20].
После «открытия» Нр появилась концепция об инфекционной этиологии ЯБ, которая, к сожалению, доминирует до сих пор, хотя не имеет убедительного научного обоснования.
1. Как известно, для признания микроорганизма (бактерии) этиологическим фактором заболевания (в данном случае ЯБ) необходимо его соответствие трем требованиям («триаде») Р. Коха: (1) микроб-возбудитель болезни должен быть всегда обнаружен в организме больного, страдающего ЯБ; (2) микроб-возбудитель может быть взят у больного и культивироваться вне его; (3) микроб, полученный от больного и выделенный в чистой культуре, при введении его в организм восприимчивого индивидуума должен вызывать у него соответствующее заболевание (ЯБ). Как было установлено, Нр, как предполагаемый этиологический фактор ЯБ, не соответствует двум из трех обозначенных требований – первому и третьему.
2. В последние 15–20 лет было доказано, что помимо ЯБ, ассоциированной с Нр-инфекцией, со значительной частотой встречается Нр-негативная ЯБ, при которой использование даже нескольких диагностических методов идентификации Нр не выявляет их присутствия. Нр-негативные формы ЯБ выявляют с частотой 38% среди дуоденальных язв и 56% – желудочных. В США Нр-негативные формы ЯБ встречались в диапазоне от 39% до 52% случаев, в Австралии – в 45% [9]. Клини чес кая характеристика Нр-негативных и Нрпозитивных форм ЯБ отличается незначительно, а исходы достоверно хуже после эрадикации Нр, особенно после использования схем эрадикации с антибиотиками [19,20]. В связи с установлением возможности развития ЯБ без всякого участия Нр известный постулат D.Y. Graham «Нет Нр – нет ЯБ» [21] был признан ошибочным, и его заменили на более корректный: «Нет Нр – нет Нр-ассоциированной ЯБ», признающий существование Нр-негативных форм заболевания [22].
3. Один из «первооткрывателей» Нр B.J. Marshall, чтобы доказать этиологическую роль Нр при ЯБ, ввел себе в желудок концентрированную суспензию чистой культуры Нр (109 микробных тел). Через 7–10 дней у него развилась типичная клиническая картина острого гастрита (а не ЯБ), которая вскоре исчезла без всяких последствий. Другие добровольцы, повторившие эксперимент с самозаражением культурой Нр, получили аналогичный результат [23]. Выдающийся российский патолог И.В. Давыдовский (1887–1968 гг.) утверждал: «Причина, которая не действует, не есть вовсе причина» [24].
4. Инфекционной концепции происхождения ЯБ противоречит и тот факт, что без всякого лечения язва самопроизвольно рубцуется в течение 4–5 недель, несмотря на присутствие в желудке Нр. В.Х. Василенко отметил, что «язвы заживают при лечении, без лечения и даже «вопреки» лечению» [25].
Не находит объяснения с точки зрения инфекционной концепции этиологии ЯБ (Нр) то, что при рецидиве болезни образуется, как правило, одиночная язва, а не множественные эрозивно-язвенные поражения, а течение ЯБ характеризуется спонтанной цикличностью со сменой рецидивов и ремиссий [4,7].
5. Опровергает этиологическую роль Нр при ЯБ и такой важнейший факт, как отсутствие положительных сдвигов в ее распространении в большинстве стран мира, несмотря на эрадикацию Нр. Даже такой убежденный сторонник ведущей этиологической роли Нр при ЯБ, как И.В. Маев, в статье, посвященной современным тенденциям в изучении заболеваний желудка и двенадцатиперстной кишки, вынужден был признать: «Несмотря на уже многолетнюю активную борьбу с … Нр-инфекцией, распространенность ЯБ в нашей стране и в большинстве стран мира не снижается; стабильно высокой (на уровне 10%) остается и частота ее грозных осложнений (кровотечение, пенетрация, перфорация)» [26]. Следовательно, проводившаяся на протяжении последних 20 с лишним лет активная антибактериальная терапия, направленная на уничтожение Нр и излечение ЯБ, оказалась безрезультатной! Так, в США состоит на учете более 4 млн больных ЯБ, протекающей с ежегодными рецидивами, и их число за последние годы не снижается, а растет [27]. Известный сторонник ведущей роли Нр в происхождении гастродуоденальных заболеваний В.А. Исаков (ведущий автор монографии «Хеликобактериоз», М., 2003) в своей докторской диссертации, посвященной ЯБ (Москва, 2000) подтверждает: «Доказать этиологическую роль Нр при ЯБ пока не удалось» [28].
Таким образом, приведенные бесспорные научные факты и аргументы дают достаточно оснований утверждать, что ЯБ – это не инфекционное (Нр), а идиопатическое (с неизвестной этиологией) гастроэнтерологическое заболевание. Еще Е.М. Тареев констатировал: «Инфекционная концепция является постоянно действующим «магнитом», который отвлекает врачей и крупных ученых от неинфекционного агента» [29].
6. Участвуют ли Нр в патогенезе ЯБ? Мы на протяжении нескольких десятилетий изучали патогенез ЯБ, еще в 1994 г. опубликовав нашу концепцию ее патогенеза и саногенеза [30], которая за прошедшие годы была дополнена лишь некоторыми деталями [27,31]. Мы рассматриваем ЯБ как общее заболевание, в развитии которого участвуют генетические факторы (отягощенная по ЯБ наследственность); психоэмоциональные и психосоциальные стрессовые воздействия; иммунодефицитное состояние; вегетативная дисфункция; оксидативный стресс и местные патогенетические воздействия. В то же время сторонники инфекционной концепции (Нр) считают ЯБ местным патологическим процессом, о чем свидетельствует еще один постулат D.Y. Graham: «ЯБ должна рассматриваться как местное проявление бактериальной инфекции – Нр».
Наследственное предрасположение к ЯБ передается аутосомно-рецессивным путем. По данным модельного анализа, развитие ЯБ связано с генетическими факторами в 39% случаев (в диапазоне от 32 до 47%). Среди маркеров наследственной отягощенности по ЯБ нами установлено значение гиперпепсиногенемии-1; увеличения массы обкладочных клеток желудочных желез; «несекреторный статус» (неспособность выделять со слюной агглютиногены крови системы АВН); особый фенотип крови по Lewis; особенности дерматоглифики и др. [32,33].
Значение психоэмоциональных и психосоциальных факторов в патогенезе ЯБ подтверждается резким учащением ЯБ и ее грозных осложнений (кровотечение, пенетрация, перфорация) во время войны, экономической депрессии и т.п. Такие психические переживания, как страх, тревога, отчаяние и другие стрессовые ситуации, также способствуют развитию ЯБ. Как показали наши исследования, у пациентов с ЯБ уже в детском возрасте отмечаются нарушения межличностных связей, эмоциональная депривация, что проявляется в зрелые годы негибкостью реагирования на предъявляемые к ним требования, отсутствием навыков конкурентной борьбы. В структуре личности больных ЯБ было отмечено превалирование циклоидных и эпилептоидных черт; реже встречались эмотивный и демонстративный (эмоционально неуравновешенный) типы [35]. В.Х. Василенко утверждал: «Одни люди «живут сердцем» и страдают стенокардией и инфарктом миокарда; другие «живут желудком» и являются кандидатами на ЯБ» [25,35].
При изучении иммунного статуса больных ЯБ нами были установлены нарушения, характерные для комбинированных форм вторичного иммунодефицита с преимущественным угнетением Т-клеточного звена иммунитета, а также неэффективность процессов дезинтеграции микробного антигена в фагоцитирующих клетках [36].
Еще одним фактором патогенеза ЯБ является активация процессов свободнорадикального окисления липидов (СРОЛ) – оксидативный стресс, сопровождающийся инактивацией сульфгидрильных групп (SH) ферментов, гормонов и клеточных рецепторов, а также высвобождением тучными клетками гистамина [37].
Известный гастроэнтеролог-морфолог Л.И. Аруин, будучи сторонником инфекционной концепции происхождения ЯБ, был вынужден признать: «Всякая попытка обнаружить какой-либо один этиологический или патогенетический фактор (решающее звено), ответственный за развитие ЯБ, обречена на неудачу» [38].
Выдающийся клиницист М.П. Кончаловский еще в 1922 году так высказался по поводу происхождения ЯБ: «Язва не есть местная болезнь слизистой оболочки, а есть болезнь всего организма», в связи с чем предложил именовать ее «язвенной болезнью» [39]. Это предложение нашло понимание и у зарубежных гастроэнтерологов, использующих термины «gastric and duodenal ulcer disease» (англ.) и «Ulkuskrankheit» (нем.).
По мнению В.Х. Василенко: «ЯБ является местным выражением каких-то общих нарушений», с чем трудно не согласиться [40]
Местными факторами патогенеза ЯБ являются: (1) нарушения регионарного кровотока в стенке желудка и двенадцатиперстной кишки, возникающие в результате повышения сосудистого тонуса, уменьшения притока артериальной крови и веностаза [37]; (2) повышенная ацидопептическая активность желудочного сока; (3) колонизация желудка патогенной мукозной микрофлорой, включая Нр. При этом необходимо отметить, что повышенная ацидопептическая активность желудочной секреции – это облигатный фактор патогенеза ЯБ ( «нет кислоты – нет язвы» ), а колонизация желудка Нр – факультативный, так как ЯБ может развиться и без всякого участия Нр (Нр-негативные формы ЯБ) [7,41].
Нр-инфекция и рак желудка
РЖ занимает одно из ведущих мест в структуре онкологических заболеваний, уступая лишь раку легких и колоректальному раку. РЖ ежегодно является причиной смерти 1 млн людей во всем мире.
Сторонники концепции о ведущей роли Нр в происхождении различных гастродуоденальных заболеваний связывают развитие РЖ с особым типом Нр-ассоциированного ХГ, который они именуют «ХГ ракового типа». Мы считаем выделение «ХГ ракового типа» неприемлемым, прежде всего из деонтологических соображений, а также в связи с редкостью развития РЖ при контаминации желудка Нр – не более 1% [42,43].
Согласно теории Р. Correa (США), РЖ – это многофакторный и многоступенчатый процесс, растянутый во времени. Этот процесс характеризуется определенной последовательностью событий: антральный неатрофический гастрит – тотальный атрофический гастрит – мультифокальный атрофический гастрит – кишечная метаплазия – эпителиальная дисплазия – РЖ [44,45], получивших наименование «каскада Correa».
По данным эпидемиологических исследований, у Нр-инфицированных людей РЖ развивается в 1,4–4,2 раза чаще, чем в общей популяции [43]. Эти данные стали основанием для признания в 1994 г. Нр канцерогеном 1-го класса Международным агентством по изучению рака (International Agency for Research on Cancer – IARC) при ВОЗ. Имеется ли для этого достаточно убедительных оснований?
Как известно, «после этого» не значит «вследствие этого». Как мы уже указали, РЖ при колонизации желудка Нр развивается только в 1% случаев, а среди населения Индии и Африки, где инфицированность населения Нр достигает 90–95%, РЖ диагностируют значительно реже, чем в Западной Европе и США, где распространенность Нр не превышает 35–50% [44].
Было установлено, что Нр непосредственно не участвуют в развитии РЖ, не вырабатывают мутагенных и канцерогенных веществ [46], поэтому нет оснований рассматривать бактерию в качестве истинного канцерогена. Возможно, она является коканцерогеном [9,43], но и это требует доказательств.
Важно подчеркнуть, что в исследованиях было установлено, что Нр-инфекция повышает риск развития только дистального (пилороантрального) РЖ, а проксимальный (кардиальный) РЖ не связан с Нр. Более того, колонизация Нр антрума желудка, особенно их cagAположительными штаммами, каким-то образом препятствует развитию кардиального РЖ и рака нижней трети пищевода, выполняя протективную функцию [47]. В связи с этим М.J. Blaser высказал мнение, что «Суще ствует некий баланс между отрицательным и положительным действием Нр на человека» [48]. РЖ может развиваться и при аутоиммунном ХГ (тип А), не связанном с Нр-инфекцией, который нередко сочетается с мегалобластной анемией (Аддисона–Бирмера).
При РЖ Нр в желудке обнаруживают редко. Преоб ладают, как правило, анаэробы, нарастает количество Streptococcus, Veilonella, Leptotrichia [16]. Описаны и другие более важные кофакторы РЖ. Так, РЖ непосредственно связан с мутацией или депрессией онкогенов, ответственных за развитие РЖ, в частности с канцерогеном метилнитронитрозогуанидином (MNNG) [49], даже малые дозы которого вызывают развитие РЖ.
Недавно была поколеблена справедливость «каскада Cоrrea», считающего развитие атрофического ХГ обязательной стадией канцерогенеза. В сообщении М.А. Leia и соавт. на рабочем совещании Европейской группы по изучению Нр-инфекции (Любляна, 2012 г.) было от мечено, что у большинства пациентов с РЖ определяются нормальные уровни пепсиногена-1 и пепсиногена-2, а, следовательно, у них отсутствует атрофический процесс в желудке. Эти данные нашли подтверждение и в докладе M. Verbanova и соавт., которые показали, что РЖ не коррелирует с выраженностью атрофии и кишечной метаплазии в желудке по системе OLGA [50].
Изучение данных о роли Нр в развитии РЖ послужило основанием для Th. Rokkas (Греция) высказать следующее суждение: «Взаимосвязь между инфекцией Нр и последующим развитием РЖ остается неясным эпидемиологическим парадоксом» [51].
Ведущие российские хирурги-гастроэнтерологи (А.Ф. Черноусов и др.) не признают значения Нр в развитии РЖ [52].
В связи с рекомендацией «группы Маастрихта» проводить эрадикацию Нр с целью профилактики РЖ французский гастроэнтеролог J. Personnet не без иронии заметил: «Этими исследованиями пытаются доказать, будто в эру расшифрованного генома человека можно излечить РЖ с помощью антимикробной терапии» [52]. Даже P. Correa задается вопросом: «Возможна ли профилактика РЖ?».
Прав был известный патолог В.В. Серов, упрекая рос сийских ученых: «Некоторые принципиальные положения отечественные ученые рассматривают «под гипнозом» зарубежных авторов».
«Маастрихтский консенсус» (МК) и клиническая оценка его рекомендаций
В 1997 г. в г. Маастрихт (Голландия) группа европейских гастроэнтерологов во главе с P. Malfertheiner (Германия) провела конференцию с участием 63 гастроэнтерологов из 19 стран Европы и отдельных представителей из Канады, США и Японии. Итогом ее работы стали рекомендации по диагностике и лечению Нр-ассоциированных заболеваний, а также показаниям к эрадикационной терапии, которые стали именовать «Маастрихтским консенсусом» – МК. В 2002 году состоялся «МК-2» с участием 76 гастроэнтерологов из 28 стран. Однако рекомендации были одобрены только 70% его участников, так что консенсуса достигнуто не было. В 2005 г. состоялся «МК-3» во Флоренции (Италия), в 2010 г. – «МК-4» и в 2015 г. – «МК-5», также проходившие во Флоренции [53,54]. Фактически руководящая группа «МК» монополизировала право определять показания, методы диагностики и лечения Нр-ассоциированных заболеваний.
Результаты использования в клинической практике рекомендаций «МК» за прошедшие 20 с лишним лет оказались, с нашей точки зрения, плачевными. Основными недостатками этих рекомендаций являются следующие:
1. Авторы «МК» произвольно, без научных обоснований, расширили показания для эрадикации Нр, включив в их перечень, помимо ХГ, ЯБ и РЖ, гастроэзофагеальную рефлюксную болезнь (ГЭРБ), синдром функциональной (гастродуоденальной) диспепсии и так называемую гастропатию, индуцированную дли тель ным приемом нестероидных противовоспалительных препаратов (НПВП), а также рекомендовали проводить эрадикацию Нр у здоровых бактерионосите лей («по желанию пациента»). При этом они проигнорировали многочисленные исследования, опровергающие целесообразность эрадикации Нр у больных ГЭРБ, синдромом функциональной диспепсии и т.н. НПВПгастропатией (НПВП-гастритом). Что касается рекомендации проводить эрадикацию Нр у здоровых бактерионосителей «по желанию пациента», то мы считаем, что возлагать решение вопроса о проведении эрадикационной терапии (Нр) на людей, не имеющих медицинского образования, недопустимо.
2. В основу стратегии и тактики анти-Нр-терапии был положен ошибочный постулат D.Y. Graham «Хоро ший Нр – мертвый Нр» и поставлена задача тотального уничтожения Нр (test and treat strategy: выявлять и ликвидировать). Пауль Эрлих утверждал: «Микробы непобедимы!»
3. Составители «МК» произвольно установили низкий рубеж эффективности эрадикационной терапии – 80%, допускающий выживание до 20% этих бактерий. Но совершенно очевидно, что эти 20% выживших после курса эрадикации – это бактерии, которые приобрели резистентность к действию используемых для их уничтожения антибактериальных средств, и после ликвидации чувствительных к ним штаммов Нр дадут потомство, не восприимчивое к проводимому лечению.
4. В течение 20 с лишним лет для эрадикации Нр рекомендуются в сущности одни и те же антибактериальные средства (кларитромицин, амоксициллин, метронидазол) в сочетании с ингибитором протонной помпы (ИПП). При этом игнорируется известная закономерность: чем чаще используют одно и то же антибактериальное средство, тем быстрее развивается к нему резистентность бактерии. И действительно, резистентность Нр к используемым для их эрадикации антибактериальным препаратам неуклонно растет и уже достигла критического уровня. Так, к кларитромицину резистентность Нр варьируется от 23,1 до 36,1%, к амоксициллину – от 26 до 36,3%, к метронидазолу – от 40,7 до 65% [54,55] и продолжает увеличиваться. При этом нарастает как первичная резистентность Нр, которая всегда является следствием предшествующего лечения конкретными антибактериальными препаратами, так и вторичная резистентность, обусловленная приобретенной мутацией бактерии (Нр), вызванной антибиотиком.
Только в «МК-4» (Флоренция, 2010 г.) ее авторы, под влиянием неопровержимых фактов, были вынуждены сделать важные признания [7,54]:
1. При синдроме функциональной диспепсии эрадикация Нр вызывает полное и длительное устранение симптомов у 1 (8,3%) из 12 пациентов, а по данным «Римских критериев», посвященных функциональным гастроэнтеральным расстройствам, использование плацебо при этом состоянии эффективно в 20–40% случаев и более!
2. «Нр не влияют на тяжесть, частоту симптомов и эффективность лечения при ГЭРБ, а эпидемиологические исследования демонстрируют отрицательную корреляцию между распространенностью Нр и ГЭРБ и аденокарциномой пищевода». Иначе говоря, после эрадикации Нр число больных ГЭРБ и аденокарциномой пищевода возрастает! По данным A.P. Weston и соавт. (2000 г.), после курса эрадикации Нр частота ГЭРБ и аденокарциномы пищевода увеличивается в 2 раза! [56].
3. Эрадикация Нр сама по себе не устраняет риска образования эрозивно-язвенных поражений желудка и двенадцатиперстной кишки, индуцированных приемом НПВП (в отличие от ИПП – Я.Ц.)
4. После эрадикации Нр улучшаются функциональные возможности тела желудка, но насколько это связано с регрессией атрофии, остается спорным. Убедительных доказательств, что эрадикация Нр ведет к регрессии кишечной метаплазии в желудке, пока не получено.
5. Диагностическая ценность антигенного стул-теста сопоставима с уреазным дыхательным тестом. Пос кольку, как было нами установлено, мукозная микрофлора желудка (помимо Нр) также обладает уреазной активностью, уреазные тесты идентификации Нр не могут считаться достоверными.
6. Пока недостаточно доказательств ассоциации Нр с другими внежелудочными заболеваниями, включая сердечно-сосудистые и неврологические [7,54].
Несмотря на эти вынужденные признания, никаких изменений в показаниях для эрадикационной терапии не последовало. Кроме того, для нас неприемлем тот факт, что авторы МК при всех заболеваниях, ассоциированных с Нр, рекомендуют стандартное лечение с использованием ИПП и комплекса антибактериальных средств, игнорируя необходимость индивидуализированного (персонализированного – прецизионного) лечения, воздействующего на различные механизмы развития заболевания. Г.А. Захарьин утверждал: «Глав ное правило при назначении лечения – соблюдение метода индивидуализирования» [55]. Мы, например, при лечении больных ЯБ в фазе рецидива используем (по показаниям) психотропные средства, в том числе антидепрессанты, иммуномодуляторы, антиоксиданты и др.
В последнее время было установлено, что бронхиальная астма, кожные аллергические реакции, ожирение учащаются после эрадикации Нр, особенно у детей [57,58].
M.J. Blaser считает, что «В зависимости от обстоятельств, Нр могут себя вести как комменсалы или даже как симбионты, являясь компонентом нормальной микрофлоры желудка, но в определенных условиях могут выступать и в качестве патогена» [59,60]. Выступая на гастронеделе в США (2014 г.), он красноречиво назвал свой доклад: «Нр: друг или враг?». В 1962 г. эколог T. Rosebury предложил термин «амфибиоз», отражающий взаимоотношения между человеком и микробом, которые могут быть как симбионтными, так и патогенными, в зависимости от конкретных обстоятельств, прежде всего от состояния иммунной системы организма (при наличии иммунодефицита) [62].
Мы полагаем, что консенсусы противоречат основным принципам медицины, основанной на доказательствах, поскольку не предусматривают использования таких важнейших элементов познания, как логика клинического мышления, анализ и синтез (обобщение) фактических данных. Врач становится не самостоятельно мыслящим исследователем, а простым техническим исполнителем предложенных рекомендаций, что в корне противоречит основным принципам врачебной деятельности [7,61].
 Читайте также:
Читайте также: