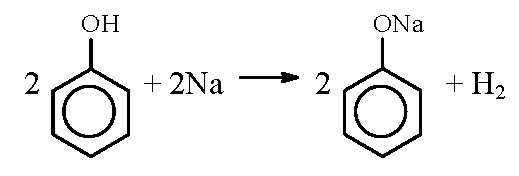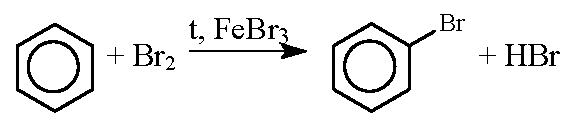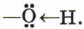в результате каких опытов можно убедиться что в молекуле фенола бензольное кольцо и гидроксильная
В результате каких опытов можно убедиться, что в молекуле фенола функциональные группы атомов взаимно влияют друг на друга?
В результате каких опытов можно убедиться, что в молекуле фенола функциональные группы атомов взаимно влияют друг на друга?
Напишите уравнения реакций.
1) Ароматическое кольцо оказывает влияние на гидроксильную группу, в результате чего атом водорода становится более подвижным, чем в спиртах (объяснение см.
В ответе на вопрос 2).
2) Гидроксильная группа также оказывает влияние на бензольное кольцо, в результате чего реакции замещения в фенолах протекают гораздо легче, чем в ароматических углеводородах.


Проделайте опыты, которые подтверждают их характерные химические свойства.
Напишите уравнения соответствующих реакций.
Как объяснить свойство атомов соединяться друг с другом?
Как объяснить свойство атомов соединяться друг с другом?
Какие силы удерживают их вместе в молекуле?
Изобретите строение молекулы глюкозы и потвердите уравнение химических реакций наличии в ней нескольких разных функциональных групп?
Изобретите строение молекулы глюкозы и потвердите уравнение химических реакций наличии в ней нескольких разных функциональных групп.
Какие функциональные группы имеются в молекуле глюкозы?
Какие функциональные группы имеются в молекуле глюкозы?
Напишите уравнение реакции.
Напишите уравнение реакции хлорирования фенола?
Напишите уравнение реакции хлорирования фенола.
Какие функциональные группы имеются в молекуле глюкозы?
Какие функциональные группы имеются в молекуле глюкозы?
1. Какие вещества относят к фенолам?
1. Какие вещества относят к фенолам?
2. Каковы особенности строения молекулы фенола?
Опишите взаимное влияние атомов в молекуле фенола.
3. Каменный уголь и основные продукты его переработки 4.
Физические свойства фенола 5.
Особенности химических свойств : влияние годроксогруппы на бензольное кольцо влияние бензольного кольца на гидроксогруппу 6.
Качественные реакции на фенол 7.
Реакция поликонденсации : определение, пример 8.
Напишите уравнение реакции фенола с металлическим натрием?
Напишите уравнение реакции фенола с металлическим натрием.
Ca + 2HCl = CaCl₂ + H₂ по уравнению реакции : V(H₂) / V₀ = m(Ca) / M(Ca) объем водорода : V(H₂) = V₀m(Ca) / M(Ca) V(H₂) = 22, 4л / моль * 4г / 40г / моль = 2, 24 л.
Ca(OH)2 + СО2 = СаСО3 + Н2ОСаСО3 + СО2 + Н2О = Са (НСО3)2.
Пусть количество смеси = 1 моль. N(NH3) = 0, 4 моль m(NH3) = 0, 4 * 17 = 6, 8 г w(NH3) = 6, 8 \ (6, 8 + 0, 6 * 32) = 0, 262 = 26, 2%.
S + O2(t°C) = SO2 SO2 + Ca(OH)2 = CaSO3 + H2O S + Fe(t°C) = FeS FeS + 2HCl = FeCl2 + H2S H2S + KOH = KHS + H2O.
Спирты и фенолы
Урок-обобщение
10 КЛАСС
Цель. Сформировать представление о том, что свойства гидроксигруппы в соединении могут меняться в зависимости от характера связанного с ней углеводородного радикала и что свойства самого радикала также меняются под влиянием функциональной группы –ОН.
Вещества. С6Н5ОН (раствор и расплав), Na, NaOH (р-р), FeCl3, Br2, C6H6, H2O, KMnO4 (р-р), фенолфталеин.
Девиз урока. Для описания свойств вещества достаточно знать его электронную структуру.
ХОД УРОКА
Тестирование. На доске записаны формулы веществ:
Определите, какое из перечисленных веществ:
1) пентанол; 2) гексанол; 3) двухатомный спирт; 4) трехатомный спирт; 5) винный спирт; 6) насыщенный алифатический спирт, R которого содержит 4 атома С; 7) взаимодействует со спиртами с образованием сложных эфиров; 8) дает качественную реакцию на многоатомные спирты.
(Ответы. 1 – г; 2 – е; 3 – в; 4 – д; 5 – б; 6 – л; 7 – м; 8 – п.)
Задание у доски. Составить структурные формулы гидроксильного производного бензола СН3С6Н4ОН и его изомеров. На какие две группы их можно разделить?
Объяснение нового материала
1. Фенолы и ароматические спирты.
Какое определение можно дать веществам, исходя из составленной схемы? К каким классам органических веществ они относятся и почему?
Разберем более подробно свойства фенола.
2. Физические свойства фенола.
С6Н5ОН – бесцветное кристаллическое вещество, tпл = 40,9 °С, плохо растворим в воде (8% при 20 °С).
Демонстрационный эксперимент Сравнение растворимости бензола и фенола в воде
Бензол практически нерастворим в воде, его растворимость при 20 °С равна 0,07%. Получается, что фенол в 100 раз более растворим в воде, чем бензол. В чем причина такого отличия?
Вывод. Растворимость фенола обусловлена наличием водородной связи между гидроксильной группой фенола и молекулой воды:
3. Химические свойства фенолов.
Сходен ли фенол с предельными одноатомными спиртами? Как это сходство повлияет на химические свойства фенола?
а) Рассмотрим реакции фенола по ОН-группе:
Кислотные свойства у фенола выражены сильнее, чем у спирта С2Н5ОН. Фенол – слабая кислота (карболовая).
б) Реакция фенола по бензольному кольцу:
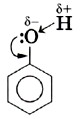
4. Взаимное влияние атомов в молекуле.
Сравним подвижность атомов водорода гидроксильных групп фенола С6Н5ОН и спирта ROH. В каком случае атом Н в гидроксигруппе более подвижен? Почему?
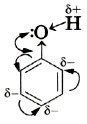
Бензольное кольцо в феноле обладает электроноакцепторными свойствами. Оно смещает электронную плотность атома кислорода в свою сторону. При этом увеличивается электронная плотность в бензольном ядре (особенно в орто- и параположениях). Электронная пара связи О–Н сильнее притягивается к атому кислорода. Поэтому связь О–Н становится менее прочной и легче происходит отщепление водорода в виде протона. Напротив, в спиртах алкильные группы R обладают электронодонорными свойствами, т. е. способностью отталкивать электронную плотность. В результате электронная плотность связи О–Н возрастает, связь упрочняется.
Вывод. Органические радикалы R соединений ROH следующим образом влияют на подвижность гидроксильного протона: алкильные группы C2H5 –, CH3 – в спиртах уменьшают подвижность протона О–Н, тогда как арильные группы в фенолах, например C6H5 –, такую подвижность увеличивают.
Мы рассмотрели смещение электронной плотности в молекулах фенола, разобрали его химические свойства.
Какой вывод о взаимном влиянии атомов в молекуле фенола можно сделать?
Фенильная группа C6H5 – и гидроксил –ОН взаимно влияют друг на друга.
Начиная с многоатомных спиртов мы с вами будем обращать внимание на качественные реакции. Качественной реакцией на фенол является взаимодействие с FeCl3:
Закрепление материала темы
1) Почему С6Н6 и С6Н5ОН обладают разной растворимостью в воде?
2) Как доказать, что С6Н5ОН является кислотой?
3) Как происходит смещение электронной плотности в молекуле С6Н5ОН?
4) Какое влияние оказывают радикалы спиртов на подвижность атома Н в ОН-группе?
5) Дать определение фенолов.
Упражнение. Являются ли гомологами следующие пары веществ:
Дайте обоснованный ответ в свете теории строения органических веществ.
Домашнее задание.
Учебник: Рудзитис Г.Е., Фельдман Ф.Г. Химия-10. М.: Просвещение, 1990. Глава VII, § 3, с. 90–94; задачи 1 и 3, с. 94.
№4. В результате каких опытов можно убедиться, что в молекуле фенола функциональные группы атомов взаимно влияют друг на друга? Напишите уравнения реакций
 Решебник по химии за 10 класс (Г. Е.Рудзитис, Ф. Г.Фельдман, 2000 год), №4 к главе «Глава VII. Спирты и фенолы. §3 Фенолы(стр. 94) Вопросы». Решебник по химии за 10 класс (Г. Е.Рудзитис, Ф. Г.Фельдман, 2000 год), №4 к главе «Глава VII. Спирты и фенолы. §3 Фенолы(стр. 94) Вопросы». |
Условие задачи: №4. В результате каких опытов можно убедиться, что в молекуле фенола функциональные группы атомов взаимно влияют друг на друга? Напишите уравнения реакций.
1) Ароматическое кольцо оказывает влияние на гидроксильную группу, в результате чего атом водорода становится более подвижным, чем в спиртах (объяснение см. в ответе на вопрос 2). Если спирты реагируют с выделением водорода с металлическим натрием, а с гидроксидом натрия не реагируют, то фенолы реагируют и с натрием, и с гидроксидом натрия:
Реакция с гидроксидом натрия — реакция нейтрализации, типичная для кислот. В результате образуется соль — фенолят натрия — и вода.
2) Гидроксильная группа также оказывает влияние на бензольное кольцо, в результате чего реакции замещения в фенолах протекают гораздо легче, чем в ароматических углеводородах. Например, при действии на бензол брома реакция замещения протекает только в присутствии катализатора — бромида железа — и замещается только один атом водорода, образуется бромбензол:
В феноле замещение водорода на бром протекает и без катализатора, и замещаются сразу три атома водорода, образуется 2,4,6-трибромфенол:
§ 18. Фенолы
Строение фенолов
Гидроксильная группа в молекулах органических соединений может быть связана с ароматическим ядром непосредственно, а может быть отделена от него одним или несколькими атомами углерода. В зависимости от этого свойства вещества, вероятно, будут существенно отличаться друг от друга из-за взаимного влияния групп атомов (вспомните одно из положений теории А. М. Бутлерова). И действительно, органические соединения, содержащие ароматический радикал фенил С6Н5—, непосредственно связанный с гидроксильной группой, проявляют особые свойства, отличные от свойств спиртов. Такие соединения называют фенолами.
Так же как и спирты, фенолы классифицируют по атомности, т. е. по количеству гидроксильных групп.
Одноатомные фенолы содержат в молекуле одну гидроксильную группу.
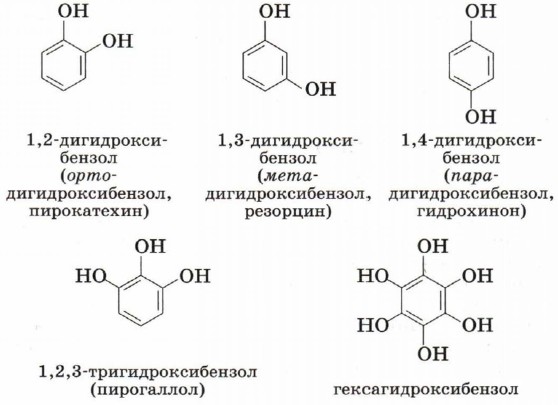
Многоатомные фенолы содержат в молекулах более одной гидроксильной группы.
Существуют и другие многоатомные фенолы, содержащие три и более гидроксильные группы в бензольном кольце.
Познакомимся подробнее со строением и свойствами простейшего представителя этого класса — фенолом С6Н5ОН (рис. 42). Название этого вещества и легло в основу названия всего класса — фенолы.
Физические свойства фенолов
Твёрдое бесцветное кристаллическое вещество с резким характерным запахом, tпл = 43 °С, tкип = 181 °С. Ядовит. Фенол при комнатной температуре незначительно растворяется в воде. Тривиальное название фенола — карболовая кислота. При попадании на кожу он вызывает ожоги, поэтому с фенолом необходимо обращаться осторожно.
Строение молекулы фенола
В молекуле фенола гидроксил непосредственно связан с атомом углерода бензольного ароматического ядра.
Вспомним строение групп атомов, образующих молекулу фенола.
Ковалентная связь между атомами кислорода и водорода гидроксильного радикала сильно полярна. Общее электронное облако связи О—H смещено в сторону атома кислорода. В результате на атоме кислорода возникает частичный отрицательный заряд, а на атоме водорода — частичный положительный заряд. Кроме того, атом кислорода в гидроксильной группе имеет две неподелённые, принадлежащие только ему электронные пары:
Следовательно, водород гидроксильной группы в молекуле фенола имеет кислотный характер.
Сопряжение электронов бензольного кольца и гидроксильной группы сказывается не только на её свойствах, но и на реакционной способности бензольного кольца.
Локализация электронной плотности в орто- и пара-положениях делает их наиболее вероятными для атак электрофильных частиц при взаимодействии с другими веществами.
Следовательно, влияние радикалов, составляющих молекулу фенола, взаимно, и оно определяет его характерные свойства.
Фенол
Фенолы — номенклатура, получение, химические свойства
Фенолы — органические вещества,молекулы которых содержат радикал фенил,связанный с одной или несколькими гидроксогруппами. Так же как и спирты, фенолы классифицируют по атомности, т.е. по количеству гидроксильных групп.
Одноатомные фенолы содержат в молекуле одну гидроксильную группу:
Многоатомные фенолы содержат в молекулах более одной гидроксильной группы:
Существуют и многоатомные фенолы, содержащие три и более гидроксильных групп в бензольном кольце.
Физические свойства фенола
Фенол-твердое, бесцветное кристаллическое вещества, t°плавления=43°С, t°кипения=181°С, с резким характерным запахом.Ядовит.Фенол при комнатной температуре незначительно растворяется в воде. Водный раствор фенола называют карболовой кислотой.При попадании на кожу он вызывает ожоги,поэтому с фенолом нужно обращаться очень осторожно!
Химические свойства фенола
Фенолы в большинстве реакций по связи О–Н активнее спиртов, поскольку эта связь более полярна за счет смещения электронной плотности от атома кислорода в сторону бензольного кольца (участие неподеленной электронной пары атома кислорода в системе p-сопряжения). Кислотность фенолов значительно выше, чем спиртов. Для фенолов реакции разрыва связи С-О не характерны, поскольку атом кислорода прочно связан с атомом углерода бензольного кольца за счет участия своей неподеленной электронной пары в системе сопряжения. Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы, но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара-положениях (+М-эффект ОН-группы)
Кислотные свойства фенола
Атом водорода гидроксильной группы обладает кислотным характером. Т.к. кислотные свойства у фенола выражены сильнее, чем у воды и спиртов, то фенол реагирует не только с щелочными металлами, но и со щелочами с образованием фенолятов:
Кислотность фенолов зависит от природы заместителей (донор или акцептор электронной плотности), положения относительно ОН-группы и от количества заместителей. Наибольшее влияние на ОН-кислотность фенолов оказывают группы, расположенные в орто- и пара-положениях. Доноры увеличивают прочность связи О-Н (тем самым уменьшая подвижность водорода и кислотные свойства), акцепторы уменьшают прочность связи О-Н, при этом кислотность возрастает:
Однако кислотные свойства у фенола выражены слабее, чем у неорганический и карбоновых кислот. Так, например, кислотные свойства фенола примерно в 3000 раз меньше,чем у угольной кислоты. Поэтому, пропуская через водный раствор фенолята натрия углекислый газ, можно выделить свободный фенол.
Добавление к водному раствору фенолята натрия соляной или серной кислоты также приводит к образованию фенола:
Качественная реакция на фенол
Фенол реагирует с хлоридом железа (3) с образованием интенсивно окрашенного в фиолетовый цвет комплексного соединения.Эта реакция позволяет обнаруживать его даже в очень ограниченных количествах.Другие фенолы,содержащие одну или несколько гидроксильных групп в бензольном кольце, также дают яркое окрашивание сине-фиолетовых оттенков в реакции с хлоридом железа(3).
Реакции бензольного кольца фенола
Наличие гидроксильного заместителя значительно облегчает протекание реакций электрофильного замещения в бензольном кольце.
Так, при взаимодействии фенола с бромной водой образуется белый осадок 2,4,6-трибромфенола:
Эта реакция, так же как и реакция с хлоридом железа(3), служит для качественного обнаружения фенола.
2. Нитрирование фенола также происходит легче, чем нитрирование бензола. Реакция с разбавленной азотной кислотой идет при комнатной температуре. В результате образуется смесь орто- и пароизомеров нитрофенола:
При использовании концентрированной азотной кислоты образуется 2,4,6, тринитритфенол-пикриновая кислота, взрывчатое вещество:
3. Гидрирование ароматического ядра фенола в присутствии катализатора проходит легко:
4. Поликонденсация фенола с альдегидами, в частности, с формальдегидом происходит с образованием продуктов реакции — фенолформальдегидных смол и твердых полимеров.
Взаимодействие фенола с формальдегидом можно описать схемой:
В молекуле димера сохраняются «подвижные» атомы водорода, а значит,возможно дальнейшее продолжение реакции при достаточном количестве реагентов:
Реакция поликонденсаци, т.е. реакция получения полимера, протекающая с выделением побочного низкомолекулярного продукта(воды), может продолжаться и далее (до полного израсходования одного из реагентов) с образованием огромных макромолекул. Процесс можно описать суммарным уравнением:
Образование линейных молекул происходит при обычной температуре. Проведение этой же реакции при нагревании приводит к тому, что образующийся продукт имеет разветвленное строение, он твердый и нерастворим в воде.В результате нагревания фенолформальдегидной смолы линейного строения с избытком альдегида получаются твердые пластические массы с уникальными свойствами. Полимера на основе фенолформальдегидных смол применяют для изготовления лаков и красок, пластмассовых изделий, устойчивых к нагреванию, охлаждению,действию воды, щелочей, кислот.Они обладают высокими диэлектрическими свойствами. Из полимеров на основе фенолформальдегидных смол изготавливают наиболее ответственные и важные детали электроприборов, корпуса силовых агрегатов и детали машин,полимерную основу печатных плат для радиоприборов. Клеи на основе фенолформальдегидных смол способны надежно соединять детали самой различной природы,сохраняя высочайшую прочность соединения в очень широком диапазоне температур. Такой клей применяется для крепления металлического цоколя ламп освещения к стеклянной колбе.Таким образом, фенол и продукты на его основе находят широкое применение.
Получение фенола
Применение фенолов
Фенол — твердое вещество, с характерным запахом, вызывает ожоги при попадании на кожу. Ядовит. Растворяется в воде, его раствор называют карболовой кислотой (антисептик). Она была первым антисептиком введенным в хирургию. Широко используется для производства пластмасс, лекарственных средств (салициловая кислота и ее производные), красителей, взрывчатых веществ.
Фенол: что представляет вещество, его влияние на организм человека
Фенол – это химическое органическое вещество, углеводород. Другие названия – карболовая кислота, гидроксибензол. Он бывает природного и промышленного происхождения. Что такое фенол и каково его значение в жизни человека?
Происхождение вещества, химические и физические свойства
Химическая формула фенола – c6h5oh. По внешнему виду вещество напоминает кристаллы в виде иголок, прозрачные, с белым оттенком. На открытом воздухе при взаимодействии с кислородом окраска приобретает светло-розовый цвет. Для вещества характерен специфический запах. Фенол пахнет как краска гуашь.
Природные фенолы – это антиоксиданты, которые в разных количествах присутствуют во всех растениях. Они обуславливают цвет, аромат, защищают растения от вредных насекомых. Природный фенол полезен для организма человека. Он содержится в оливковом масле, зернах какао, фруктах, орехах. Но встречаются и ядовитые соединения, например, танин.
Химическая промышленность производит эти вещества путем синтеза. Они ядовиты и очень токсичны. Фенол опасен для человека, также промышленные масштабы его производства значительно загрязняют окружающую среду.
Как применяют фенолы
Более 40% веществ используют в химической промышленности для получения других органических соединений, в основном смол. Также из него искусственные волокна – капрон, нейлон. Вещество применяют в нефтепереpaбатывающей отрасли для очищения масел, которые применяют в буровых установках и других технологических объектах.
Фенол используют для производства лакокрасочной продукции, пластмасс, в составе химикатов и пестицидов. В ветеринарии веществом на фермах обpaбатывают животных сельскохозяйственного значения для профилактики инфекций.
Применение фенола в фармацевтической промышленности значительное. Он входит в состав многих лекарственных препаратов:
В генной инженерии фенол применяют для очистки ДНК и его выделения из клетки.
Токсическое действие фенола
Фенол – это яд. По своей токсичности соединение относится ко 2-му классу опасности. Это значит, что оно высокоопасное для окружающей среды. Степень воздействия на живые организмы высокая. Вещество способно нанести серьезный ущерб экологической системе. Минимальный период восстановления после действия фенола составляет минимум 30 лет, при условии полной ликвидации источника загрязнения.
Синтетический фенол влияние на организм человека оказывает негативное. Токсическое действие соединения на органы и системы:
Механизм токсичного действия фенолов заключается в изменении структуры клетки и, как следствие, ее функционирования. Наиболее восприимчивы к ядовитым веществам нейроны (нервные клетки).
Предельно допустимая концентрация (ПДК фенола):
Симптомы отравления фенолом
Вред фенола на живой организм давно доказан. При попадании на кожу или слизистые соединение быстро всасывается, преодолевает гематогенный барьер и с кровью разносится по всему телу.
Первым на воздействие яда реагирует головной мозг. Признаки отравления у человека:
Обстоятельства, при которых может произойти отравление – нарушение правил техники безопасности при работе с особо опасными веществами, передозировке лекарственными препаратами, бытовом отравлении моющими и чистящими средствами, в результате несчастного случая.
Если в доме находится мебель низкого качества, детские игрушки, не соответствующие международным стандартам безопасности, стены покрашены краской, не предназначенной для этих целей, то исходящие пары фенола человек вдыхает постоянно. В этом случае развивается хроническое отравление. Его основной признак – синдром хронической усталости.
Принципы оказания первой помощи
Первое, что необходимо сделать, это прервать контакт человека с отравляющим источником.
Пострадавшего вынести из помещения на свежий воздух, расстегнуть пуговицы, замки, молнии, чтобы лучше обеспечить доступ кислорода.
Если раствор фенола попал на одежду, ее немедленно снять. Пораженную кожу и слизистую глаз многократно и тщательно промыть проточной водой.
Категорически нельзя обpaбатывать кожные покровы маслами, мазями, спиртом, пищевым жиром.
При попадании фенола в ротовую полость ничего не проглатывать, а немедленно прополоскать рот в течение 10 минут. Если вещество успело попасть в желудок, можно выпить сорбент со стаканом воды:
Нельзя промывать желудок, так как эта процедypa усилит степень ожога и увеличит площадь поражения слизистой.
Антидот фенола – раствор глюконата кальция для внутривенного введения. При отравлении любой степени тяжесть пострадавший доставляется в больницу для наблюдения и лечения.
Вывести фенол из организма в условиях стационара при тяжелых отравлениях можно такими методами:
Фенол – это синтетическое отравляющее вещество, опасное для человека. Даже соединение природного происхождения может нанести вред здоровью. Чтобы избежать отравления, необходимо с ответственностью относится к работе на производстве, где есть риск контакта с ядом. При покупках интересоваться составом продукции. Неприятный запах пластмассовых изделий должен насторожить. При употрeблении лекарственных препаратов с содержанием фенола соблюдать предписанную дозировку.
Фено́л (гидроксибензол, устар. карболовая кислота) C6H5OH — простейший представитель класса фенолов. Бесцветные игольчатые кристаллы, розовеющие на воздухе из-за окисления, приводящего к образованию окрашенных веществ. Обладают специфическим запахом гуаши. Растворим в воде (6 г на 100 г воды), в растворах щелоче́й, в спирте, в бензоле, в ацетоне. 5 % раствор в воде — антисептик, широко применяемый в медицине.
Мировое производство фенола на 2006 год составляет 8,3 млн тонн/год. По объёму производств фенол занимает 33-е место среди всех выпускаемых химической промышленностью веществ и 17-е место среди органических веществ.
Содержание
На 2006 год производство фенола в промышленном масштабе осуществляется тремя способами:
Ведутся пилотные испытания установок получения фенола прямым окислением бензола закисью азота и кислотным разложением гидропероксида втор-бутилбензола.
Фенол также можно получить восстановлением хинона.
Химические свойства
C6H5OH + 3Br2(aqua) → C6H2(Br)3OH + 3HBr образуется твердое вещество белого цвета 2,4,6 трибромфенол
6C6H5OH + FeCl3 → [Fe(C6H5OH)6]CI3 образуется трихлоридфенолят железа (III)(фиолетовое окрашивание)
Биологическая роль
Протеиногенная аминокислота тирозин является структурным производным фенола и может быть рассмотрена как пара-замещённый фенол или α-замещённый пара-крезол. В природе распространены и другие фенольные соединения, в том числе полифенолы. В свободном виде фенол встречается у некоторых микроорганизмов и находится в равновесии с тирозином. Равновесие поддерживает энзим тирозин-фенол-лиаза (КФ 4.1.99.2).
Биологическое значение фенола обычно рассматривается в рамках его воздействия на окружающую среду. Фенол — один из промышленных загрязнителей. Фенол довольно токсичен для животных и человека. Фенол губителен для многих микроорганизмов, поэтому промышленные сточные воды с высоким содержанием фенола плохо поддаются биологической очистке.
Применение
По данным на 2006 год мировое потрeбление фенола имеет следующую структуру:
Фенол и его производные обуславливают консервирующие свойства коптильного дыма. Также фенол используют в качестве консерванта в вакцинах. Пример использования, в качестве антисептика — препарат «Орасепт».
Токсические свойства
Фенол ядовит. Вызывает нарушение функций нервной системы. Пыль, пары и раствор фенола раздражают слизистые оболочки глаз, дыхательных путей, кожу.
Попадая в организм, фенол очень быстро всасывается даже через неповрежденные участки кожи и уже через несколько минут начинает воздействовать на ткани головного мозга. Сначала возникает кратковременное возбуждение, а потом и паралич дыхательного центра. Даже при воздействии минимальных доз фенола наблюдается чихание, кашель, головная боль, головокружение, бледность, тошнота, упадок сил. Тяжелые случаи отравления характеризуются бессознательным состоянием, синюшностью, затруднением дыхания, нечувствительностью роговицы, скорым, едва ощутимым пульсом, холодным потом, нередко судорогами. Зачастую фенол является причиной онкозаболеваний.
Примечания
Смотреть что такое «Фенол» в других словарях:
ФЕНОЛ — в химии под этим общим названием известен ряд органических углеродистых соединений: карболовая кислота, сольвеол, лизол, резорцин, нафталин и др. Полный словарь иностранных слов, вошедших в употрeбление в русском языке. Попов М., 1907. ФЕНОЛОВАЯ… … Словарь иностранных слов русского языка
фенол — сущ. • карболовая кислота • карболка Словарь русских синонимов. Контекст 5.0 Информатик. 2012. фенол сущ., кол во синонимов: 15 • … Словарь синонимов
ФЕНОЛ — (карболовая кислота), C6H5OH, бесцветные, розовеющие на воздухе кристаллы, tпл 43шC. Выделяют из каменноугольной смолы или получают синтетически. Сырье в производстве синтетических смол (например, феноло формальдегидных), капролактама, красителей … Современная энциклопедия
ФЕНОЛ — ФЕНОЛ, фенола, муж. (от греч. phaino освещаю и лат. oleum масло) (хим.). Карболовая кислота. || чаще мн. Общее название группы веществ, представляющих собой производные бензола, как и карболовая кислота. Толковый словарь Ушакова. Д.Н. Ушаков.… … Толковый словарь Ушакова
ФЕНОЛ — ФЕНОЛ, а, муж. Карболовая кислота. | прил. феноловый, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
Фенол — – производные бензола с одной или несколькими гидроксильными группами. Применяется в производстве фенолформальдегидных пластмасс, синтетического волокна капрона, красителей, пестицидов, лекарственных препаратов (аспирин, салол) … Нефтегазовая микроэнциклопедия
ФЕНОЛ — (карболовая кислота C6H5OH) бесцветные (розовеют на воздухе) кристаллы с характерным запахом. Ф. ядовит. Получают из каменноугольной смолы. Применяют в производстве феноло формальдегидных смол, синтетического волокна, красителей, пестицидов,… … Российская энциклопедия по охране труда
феноліт — іменник чоловічого роду … Орфографічний словник української мови
Владельцы сайта
Урок №33. Строение, свойства и применение фенола
1. Фенолы — производные ароматических углеводородов, в молекулах которых гидроксильная группа (- ОН) непосредственно связана с атомами углерода в бензольном кольце.
2. Классификация фенолов
Различают одно-, двух-, трехатомные фенолы в зависимости от количества ОН-групп в молекуле:
В соответствии с количеством конденсированных ароматических циклов в молекуле различают сами фенолы (одно ароматическое ядро – производные бензола), нафтолы (2 конденсированных ядра – производные нафталина), антранолы (3 конденсированных ядра – производные антрацена) и фенантролы:
3. Изомерия и номенклатура фенолов
Возможны 2 типа изомерии:
4. Строение молекулы
Фенильная группа C6H5 – и гидроксил –ОН взаимно влияют друг на друга
5. Физические свойства
Большинство одноатомных фенолов при нормальных условиях представляют собой бесцветные кристаллические вещества с невысокой температурой плавления и характерным запахом. Фенолы малорастворимы в воде, хорошо растворяются в органических растворителях, токсичны, при хранении на воздухе постепенно темнеют в результате окисления.
Фенол C6H5OH (карболовая кислота) — бесцветное кристаллическое вещество на воздухе окисляется и становится розовым, при обычной температуре ограниченно растворим в воде, выше 66 °C смешивается с водой в любых соотношениях. Фенол — токсичное вещество, вызывает ожоги кожи, является антисептиком
6. Токсические свойства
Фенол ядовит. Вызывает нарушение функций нервной системы. Пыль, пары и раствор фенола раздражают слизистые оболочки глаз, дыхательных путей, кожу. Попадая в организм, Фенол очень быстро всасывается даже через неповрежденные участки кожи и уже через несколько минут начинает воздействовать на ткани головного мозга. Сначала возникает кратковременное возбуждение, а потом и паралич дыхательного центра. Даже при воздействии минимальных доз фенола наблюдается чихание, кашель, головная боль, головокружение, бледность, тошнота, упадок сил. Тяжелые случаи отравления характеризуются бессознательным состоянием, синюхой, затруднением дыхания, нечувствительностью роговицы, скорым, едва ощутимым пульсом, холодным потом, нередко судорогами. Зачастую фенол является причиной онкозаболеваний.
7. Применение фенолов
1. Производство синтетических смол, пластмасс, полиамидов
2. Лекарственных препаратов
4. Поверхностно-активных веществ
7. Взрывчатых веществ
8. Получение фенола в промышленности
1). Кумольный способ получения фенола (СССР, Сергеев П.Г., Удрис Р.Ю., Кружалов Б.Д., 1949 г.). Преимущества метода: безотходная технология (выход полезных продуктов > 99%) и экономичность. В настоящее время кумольный способ используется как основной в мировом производстве фенола.
2). Из каменноугольной смолы (как побочный продукт – выход мал):
(продукт обработки смолы едким натром)
4). Сплавлением солей ароматических сульфокислот с твёрдыми щелочами :
9. Химические свойства фенола (карболовой кислоты)
Кислотные свойства – выражены ярче, чем у предельных спиртов (окраску индикаторов не меняют):
! Феноляты – соли слабой карболовой кислоты, разлагаются угольной кислотой –
По кислотным свойствам фенол превосходит этанол в 10 6 раз. При этом во столько же раз уступает уксусной кислоте. В отличие от карбоновых кислот, фенол не может вытеснить угольную кислоту из её солей
C 6 H 5 — OH + NaHCO 3 = реакция не идёт – прекрасно растворяясь в водных растворах щелочей, он фактически не растворяется в водном растворе гидрокарбоната натрия.
Кислотные свойства фенола усиливаются под влиянием связанных с бензольным кольцом электроноакцепторных групп ( NO 2 — , Br — )
Фенолы. Свойства фенолов.
Фенолы – производные ароматических углеводородов, в состав которых могут входить одна или несколько гидроксильных групп, соединенных с бензольным кольцом.
Как называть фенолы?
По правилам ИЮПАК сохраняется название «фенол». Нумерация атомов идет от атома, который непосредственно связан с гидрокси-группой (если она – старшая) и нумеруют так, чтобы заместители получили наименьший номер.
Строение фенола.
У атома кислорода на внешнем уровне находится неподеленная электронная пара, которая «втягивается» в систему кольца (+М-эффект ОН-группы). В результате могут возникнуть 2 эффекта:
1) повышение электронной плотности бензольного кольца в положения орто- и пара-. В основном, такой эффект проявляется в реакциях электрофильного замещения.
2) уменьшается плотность на атоме кислорода, вследствие чего связь О-Н ослабляется и может рваться. Эффект связан с повышенной кислотности фенола по сравнению с предельными спиртами.
Монозамещенные производные фенола (крезол) могут быть в 3х структурных изомерах:
Физические свойства фенолов.
Фенолы – кристаллические вещества при комнатой температуре. Плохо растворимы в холодной воде, но хорошо – в горячей и в водных растворах щелочей. Обладают характерным запахом. Вследствие образования водородных связей, обладают высокой температурой кипения и плавления.
Получение фенолов.
1. Из галогенбензолов. При нагревании хлорбензола и гидроксида натрия под давлением получают фенолят натрия, который после взаимодействия с кислотой, превращается в фенол:
2. Промышленный способ: при каталитическом окислении кумола на воздухе получается фенол и ацетон:
3. Из ароматических сульфокислот с помощью сплавления с щелочами. Чаще проводят реакцию для получения многоатомных фенолов:
Химические свойства фенолов.
р-орбиталь атома кислорода образует с ароматическим кольцом единую систему. Поэтому электронная плотность на атоме кислороде уменьшается, в бензольном кольце – увеличивается. Полярность связи О-Н повышается, и водород гидроксильной группы становится более реакционоспособным и легко может быть замещен атомом металла даже при действии щелочей.
Кислотность фенолов выше, чем у спиртов, поэтому можно проводить реакции:
Но фенол – слабая кислота. Если через его соли пропускать углекислый или сернистый газ, то выделяется фенол, что доказывает, что угольная и сернистая кислота являются более сильными кислотами:
Кислотные свойства фенолов ослабляются при введении в кольцо заместителей I рода и усиливаются – при введении II.
2) Образование сложных эфиров. Процесс протекает при воздействие хлорангидридов:
3) Реакция электрофильного замещения. Т.к. ОН-группа является заместителем первого рода, то реакционная способность бензольного кольца в орто- и пара- положениях повышается. При действии на фенол бромной воды наблюдается выделение осадка – это качественная реакция на фенол:
4) Нитрование фенолов. Реакцию проводят нитрирующей смесью, в результате чего образуется пикриновая кислота:
5) Поликонденсация фенолов. Реакция протекает под воздействии катализаторов:
6) Окисление фенолов. Фенолы легко окисляются кислородом воздуха:
7) Качественной реакцией на фенол является воздействие раствора хлорида железа и образование комплекса фиолетового цвета.
Применение фенолов.
Фенолы используют при получении фенолформальдегидных смол, синтетических волокон, красителей и лекарственных средств, дезинфицирующих веществ. Пикриновая кислота используется в качестве взрывчатых веществ.